Revisar los hallazgos de imagen de las diferentes histiocitosis pulmonares. En concreto, además de la conocida histiocitosis de células de Langerhans relacionada con el tabaco y su posible aparición sin antecedentes de este, la enfermedad de Rosai-Dorfman y la enfermedad de Erdheim-Chester. También se revisa su etiopatogenia, histología, clínica y tratamiento.
ConclusiónLa histiocitosis de células de Langerhans, la enfermedad de Rosai-Dorfman y la enfermedad de Erdheim-Chester son un conjunto de patologías de causa idiopática en las que la proliferación e infiltración de histiocitos es el hallazgo anatomopatológico diagnóstico. La histiocitosis de células de Langerhans se manifiesta en forma de nódulos y quistes que respetan los ángulos costofrénicos, característicamente en pacientes fumadores. Aunque es poco frecuente, debe pensarse en esta entidad en pacientes no fumadores, en tratamiento quimio y radioterapéutico, con nódulos cavitados de nueva aparición e incluirse en el diagnóstico diferencial junto con la enfermedad metastásica y la infección oportunista. La enfermedad de Rosai-Dorfman y la enfermedad de Erdheim-Chester se presentan con hallazgos torácicos más inespecíficos, como adenopatías, engrosamiento intersticial y derrame pleural. En la enfermedad de Erdheim-Chester, las características manifestaciones extratorácicas suelen ser claves en el diagnóstico.
To review the imaging findings for the different types of pulmonary histiocytosis. In particular, in addition to the well-known pulmonary Langerhans cell histiocytosis related to smoking and its possible appearance in nonsmokers, we focus on non-Langerhans cell histiocytosis in Rosai-Dorfman disease and Erdheim-Chester disease. We also review the etiopathogenesis, histology, clinical presentation, and treatment of pulmonary histiocytosis.
ConclusionLangerhans cell histiocytosis, Rosai-Dorfman disease, and Erdheim-Chester disease are idiopathic diseases in which the proliferation and infiltration of histiocytes is the histologic finding that confirms the diagnosis. Langerhans cell histiocytosis manifests as nodules and cysts that spare the costophrenic angles; it typically appears in smokers. Although it is uncommon in nonsmokers, Langerhans cell histiocytosis should also be considered in nonsmokers treated with chemotherapy and radiotherapy in whom cavitated nodules appear and should be included in the differential diagnosis together with metastatic disease and opportunistic infections. Rosai-Dorfman disease and Erdheim-Chester disease present with less specific thoracic findings such as adenopathies, interstitial thickening, and pleural effusion. In Erdheim-Chester disease, the characteristic extrathoracic manifestations are usually key for the diagnosis.
Las histiocitosis son un grupo de enfermedades caracterizadas por proliferación anómala de histiocitos con infiltración de un determinado órgano. Este grupo de entidades derivan del sistema mononuclear fagocítico, que tiene como objetivo primario la fagocitosis de material extraño, procesamiento antigénico y presentación antigénica a los linfocitos. El sistema mononuclear fagocítico incluye macrófagos y células dendríticas. Los macrófagos están distribuidos de forma ubicua en el organismo, pero se encuentran principalmente en mucosas y otras potenciales puertas de entrada para microorganismos, donde funcionan como inmunidad innata y específica. En los pulmones, suelen estar presentes en los alvéolos. Las células dendríticas se localizan primariamente en la piel, mucosas, médula ósea, bazo, timo y ganglios linfáticos, y aunque tienen un papel menos importante en la fagocitosis, gozan de mayor importancia en el inicio de la respuesta T-dependiente1. Específicamente, las células de Langerhans (CL) derivan de las células dendríticas y se localizan en la capa epidérmica de la piel. La afectación más frecuente y conocida en la que participan estas células es la histiocitosis de células de Langerhans (HCL), asociada de forma característica con el tabaco y que se manifiesta con unos hallazgos radiológicos distintivos. Se ha descrito su asociación con determinadas neoplasias, como el linfoma de Hodgkin2–5 y tras tratamiento con quimioterapia y radioterapia6,7. La HCL no es la única histiocitosis que afecta al sistema respiratorio. Otras histiocitosis pulmonares menos conocidas son la enfermedad de Rosai-Dorfman (ERD) (derivada de los macrófagos) y la enfermedad de Erdheim-Chester (EEC) (derivada de células dendríticas no Langerhans). Las formas secundarias y malignas de histiocitosis no se discuten en este manuscrito, y nos centraremos en las histiocitotosis pulmonares primarias no neoplásicas en el adulto (tabla 1)8,9.
Resumen de los trastornos histiocíticos primarios de etiología no neoplásica (o desconocida) y aquellos con comportamiento maligno
| TRASTORNOS HISTIOCÍTICOS PRIMARIOS |
| No neoplásicos o de etiología incierta |
| Histiocitosis de células de Langerhans |
| • Forma adulta (compromiso pulmonar)a |
| • Forma pediátrica (compromiso multisistémico) Enfermedad de Letterer-Siwe Enfermedad de Hand-Schüller-Christian Síndrome de Hashimoto-Pritzker |
| Enfermedad de Rosai-Dorfmana |
| Enfermedad de Erdheim-Chestera |
| Neoplasias histiocíticas |
| Tumor folicular de células dendríticas Sarcoma histiocítico Sarcoma de células de Langerhans Sarcoma de células reticulares |
Trastornos primarios no neoplásicos que afectan al adulto y que son tratados en este manuscrito8,9.
El objetivo de nuestro trabajo es revisar los hallazgos de imagen de las distintas manifestaciones torácicas de las histiocitosis más frecuentes, dando las claves para su correcto diagnóstico. También se describe su etiopatogenia, histología, presentación clínica y tratamiento.
Histiocitosis de células de LangerhansEs la patología asociada a las células dendríticas más frecuente10. El comportamiento celular en la enfermedad varía con la edad: en adultos, las CL patológicas tienen un comportamiento reactivo, sin presentar un crecimiento neoplásico, y el órgano más frecuentemente afectado, y generalmente el único, es el pulmón. Por el contrario, en la edad pediátrica, la proliferación de CL patológicas se caracteriza por su comportamiento de neoplasia clonal8 y afectación multisistémica. Las enfermedades de Letterer-Siwe, Hand-Schüller-Christian y el síndrome de Hashimoto-Pritzker son HCL con afectación multisistémica, que característicamente se inician en la edad pediátrica. La afectación pulmonar es rara en estos casos y, cuando aparece, es parte del cuadro sistémico y no tiene relación con el tabaco.
En este trabajo nos centraremos en la HCL con afectación pulmonar en el adulto.
EtiopatogeniaAunque de etiología desconocida, se ha postulado una posible causa antigénica, mutaciones somáticas o etiología infecciosa11,12. La HCL aparece casi exclusivamente en fumadores o exfumadores, lo cual apoya la hipótesis antigénica. La influencia del tabaco en el desarrollo y progresión de la enfermedad se ve reforzado por el hecho de que progresa más rápidamente en los pacientes que mantienen el hábito tabáquico e involuciona en la mayoría de los que lo abandonan2,3,6,7,12.
Mucho menos frecuente y conocida es la aparición de esta enfermedad en pacientes no fumadores3. Se ha descrito su asociación a distintas neoplasias5 y procesos linfoproliferativos, en concreto al linfoma de Hodgkin2,4,6,13,14, particularmente tras quimioterapia y radioterapia6,7.
HistologíaEn etapas precoces, la enfermedad se caracteriza por la proliferación e infiltración del bronquiolo respiratorio y el intersticio adyacente por CL, eosinófilos y macrófagos, mientras que en las tardías predomina la fibrosis.
Las CL presentan características microscópicas y bioquímicas diferenciadoras: una morfología nuclear enrevesada, con la característica imagen de papel arrugado8 (figs. 1 y 2). Además, presentan gránulos de Birbeck e inclusiones intracitoplasmáticas pentalaminares que pueden ser observados en microscopía óptica8. La imagen de raqueta de tenis se corresponde en microscopía electrónica con la fusión de los gránulos de Birbeck con vesículas intracitoplasmáticas3,10. El estudio inmunohistoquímico revela positividad para S100, CD1a y antígeno langerina (fig. 2)8.
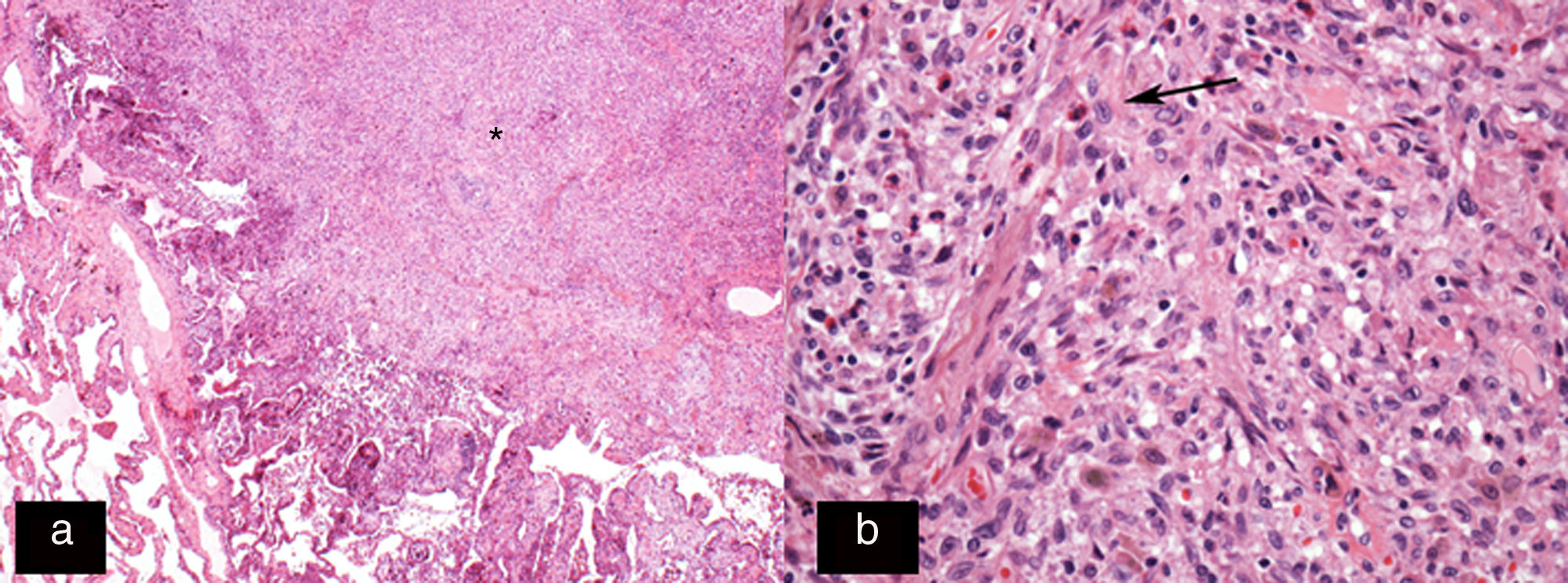
Imagen histológica teñida con hematoxilina-eosina (H-E 20x). A) Nódulo celular de morfología estrellada (asterisco). B) Imagen histológica a mayor aumento (H-E 200x) que muestra la composición de esta lesión predominantemente por células de Langerhans (flecha) en combinación con eosinófilos y otras células inflamatorias.
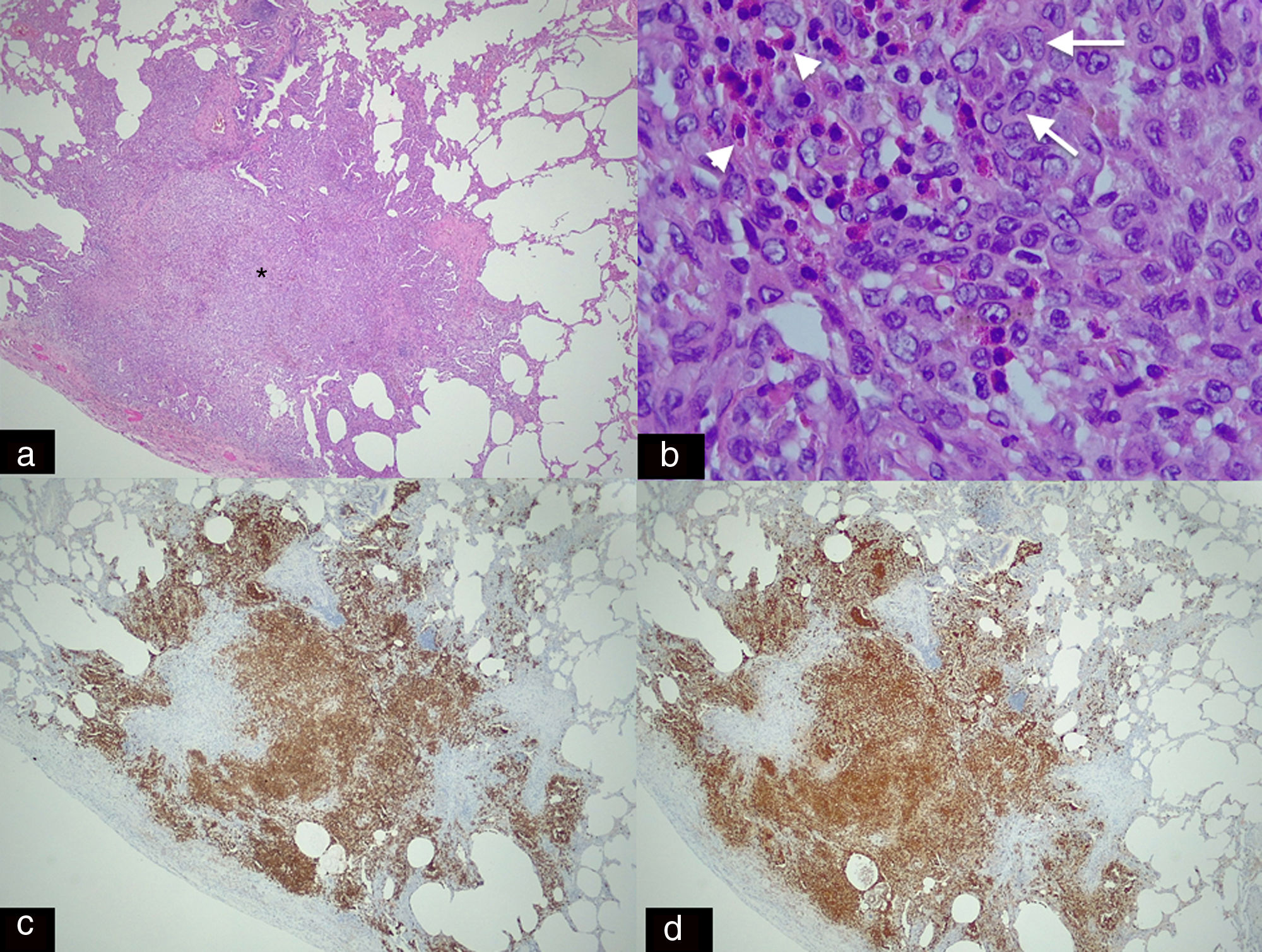
Imagen histológica panorámica teñida con hematoxilina-eosina (H-E 2,5x) A) Nódulo espiculado (asterisco) de límites irregulares adyacente a un bronquio. Este agregado celular denso está compuesto principalmente por células de Langerhans y algunos eosinófilos. B) Imagen histológica de mayor aumento (H-E 20x) que muestra los infiltrados de células de Langerhans (flechas), caracterizadas por su gran tamaño, morfología ovalada, núcleo reniforme e inclusiones granulares (gránulos de Birbeck) que se acompañan de infiltrado eosinofílico (cabezas de flecha). C) Tinción inmunohistoquímica para CD-1a (2,5x) y S-100 (2,5x). D) Imagen que muestra extensa e intensa positividad citoplasmática en las células de Langerhans, lo que confirma el diagnóstico de histiocitosis de células de Langerhans (mismo paciente que en la figura 5).
La HCL suele presentarse entre la tercera y cuarta décadas de la vida12, con sintomatología inespecífica como disnea, tos, fatiga y dolor torácico en caso de neumotórax; sin embargo, hasta una cuarta parte de los pacientes son asintomáticos15. La presencia de neumotórax recurrentes es una de las manifestaciones más específicas de esta enfermedad, aunque no la más frecuente (10-25%)8,15.
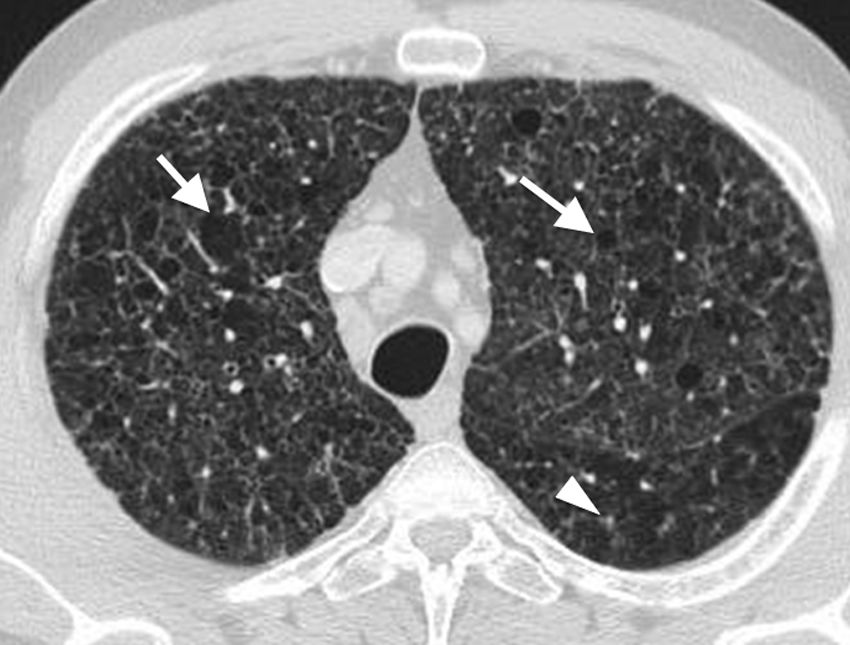
Hallazgos de imagenEn las etapas más tempranas, la enfermedad se caracteriza por la presencia de nódulos centrolobulillares bilaterales, con predominio en los campos pulmonares superiores y medios (figs. 3 y 4)12. Progresivamente, estos nódulos centrolobulillares inicialmente lisos adoptan una morfología más estrellada. La inflamación destruye las paredes del bronquiolo, dejando la pequeña vía aérea dilatada y aportando la característica radiolucencia central8. Esta progresiva dilatación de los bronquiolos es la responsable de la apariencia de nódulos cavitados, con pared progresivamente más fina (figs. 4 a 6), quistes aéreos de morfología irregular (figs. 3 y 4) y, finalmente, confluencia de esos quistes12. Los ángulos costofrénicos están característicamente respetados, así como las zonas anteriores del pulmón8 (fig. 3).
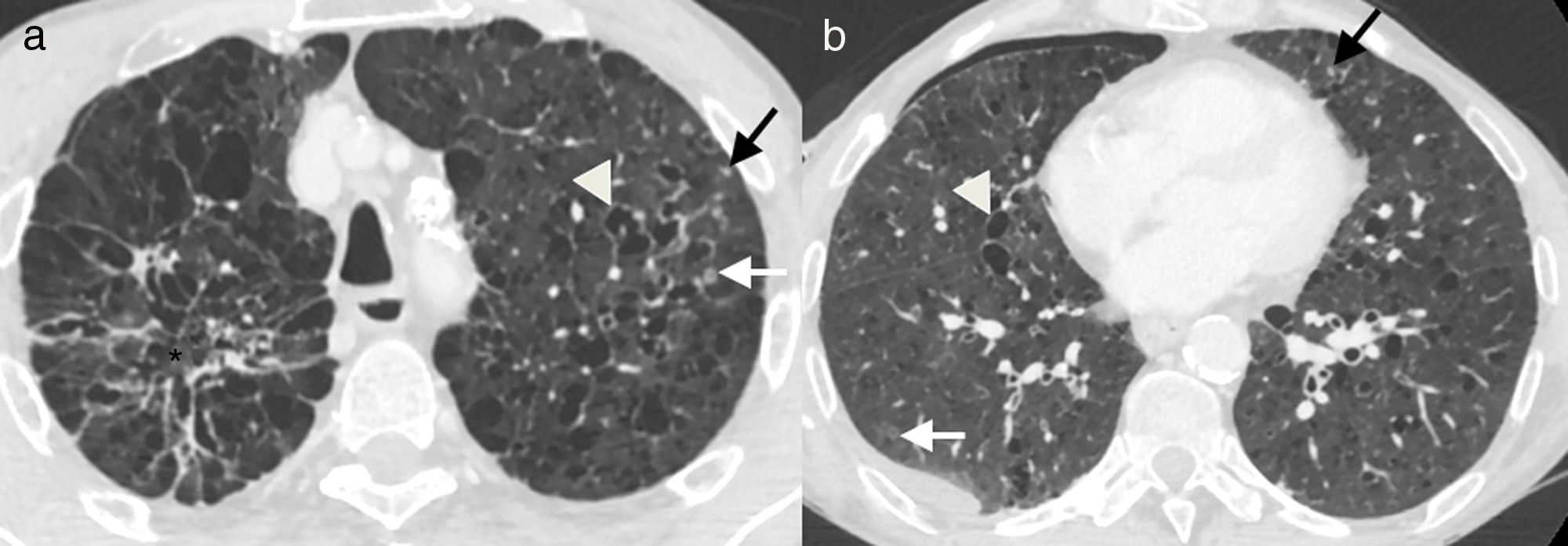
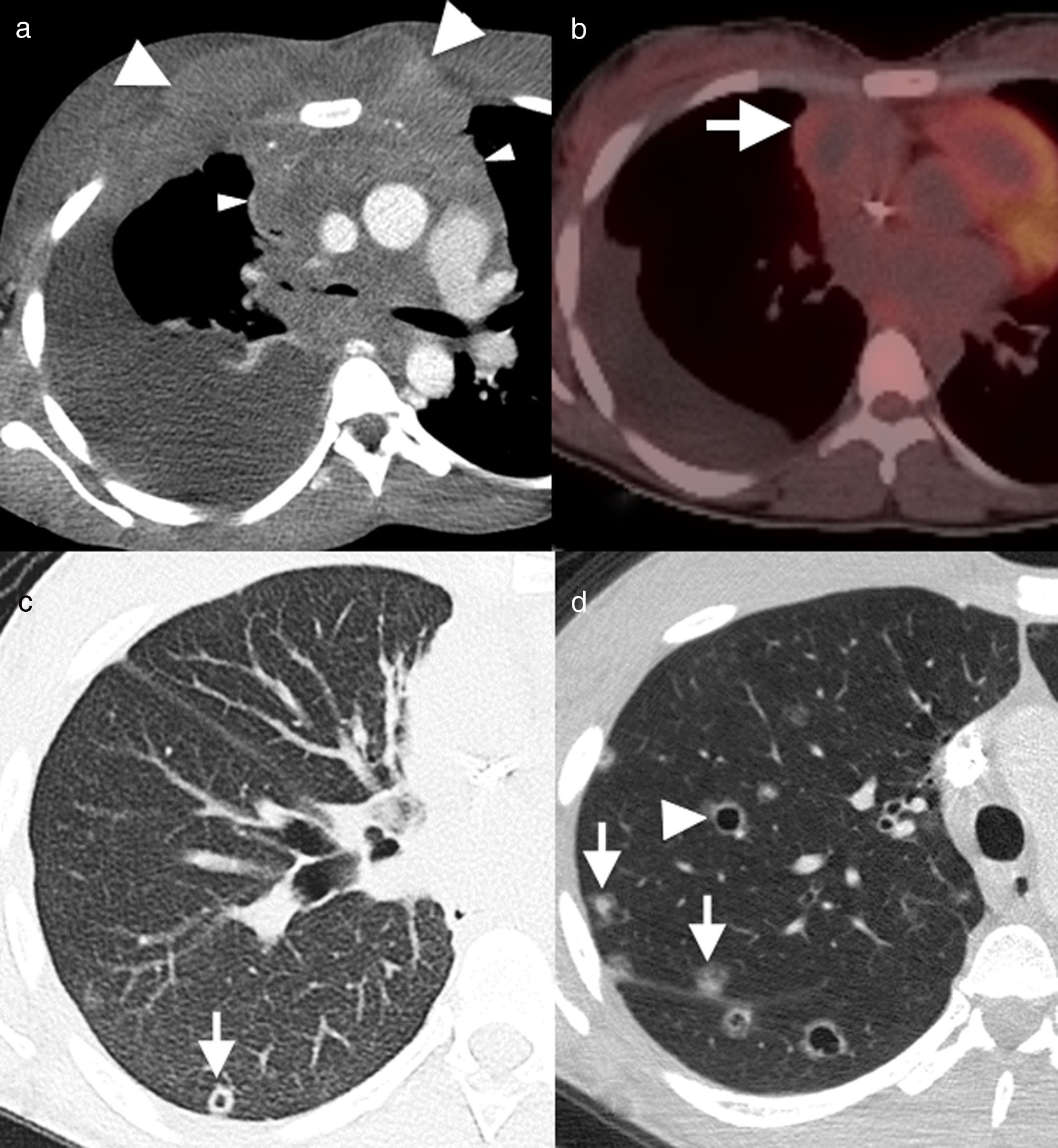
Varón de 55 años, fumador activo, con dolor torácico agudo. A y B) Imágenes axiales de tomografía computarizada de tórax. Pequeños nódulos sólidos (flechas negras), algunos de ellos cavitados (flechas blancas), y múltiples quistes de morfología y tamaño variables (cabezas de flecha), asociados a enfisema y áreas de fibrosis (asterisco). Existe un pequeño neumotórax derecho (B), el cual explica los síntomas clínicos.
Con frecuencia, los hallazgos descritos en las diferentes etapas se superponen en un mismo paciente. El “signo de Cheerio” ha sido acuñado para describir la apariencia de estas lesiones en su estadio de nódulos con radiolucencias centrales, por su semejanza con los cereales en forma de anillo, cuyo principal diagnóstico diferencial es la metástasis de adenocarcinoma (figs. 5 y 6D)16.
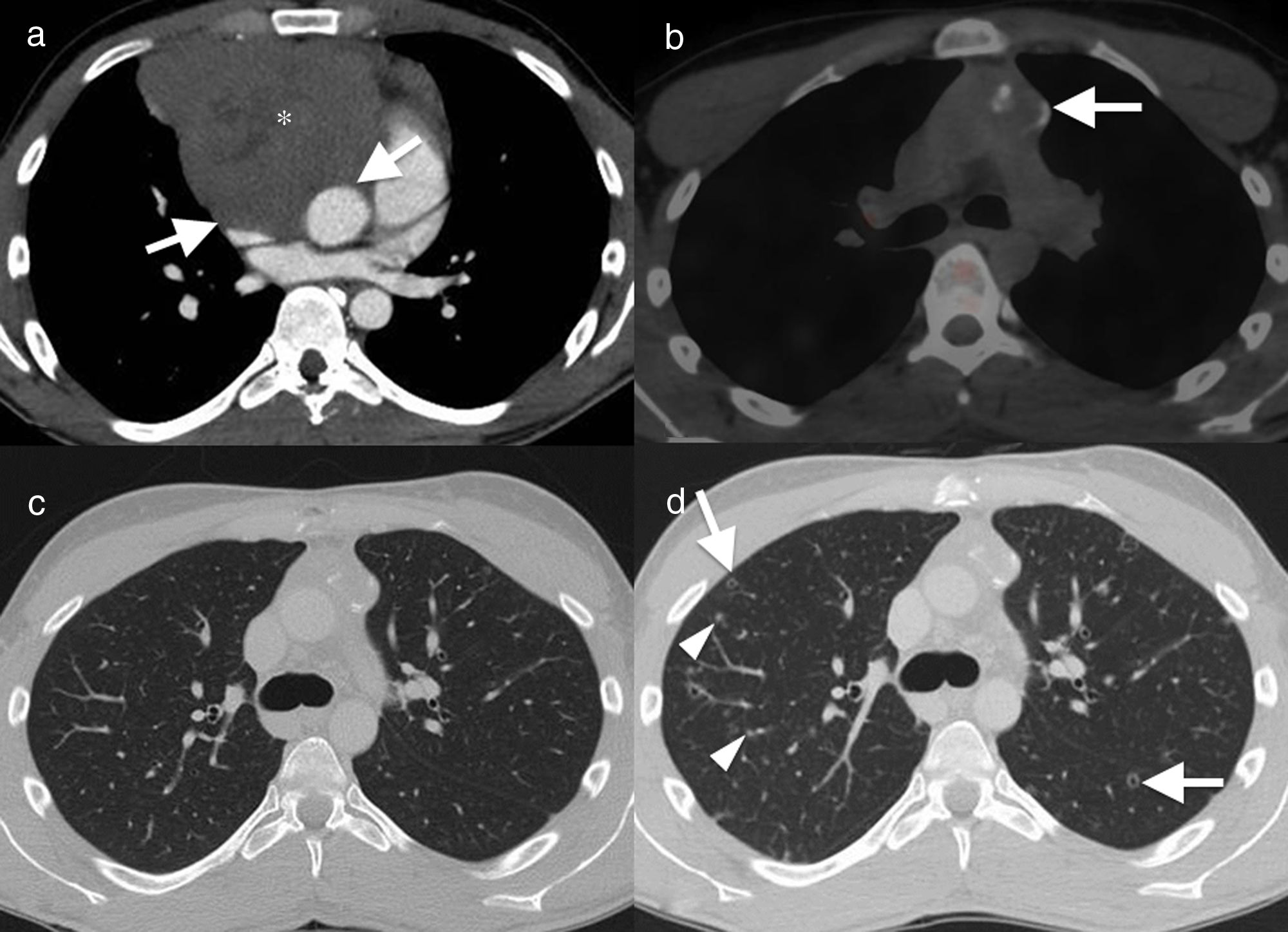
Varón de 22 años, no fumador, con antecedentes de seminoma con extenso compromiso mediastínico. Imagen axial de tomografía computarizada con contraste. A) Masa sólida en el mediastino anterior (asterisco), con pérdida de planos grasos de separación con las estructuras vasculares (flechas), que sugieren invasión vascular. El paciente presentó remisión de la enfermedad tras quimioterapia, como se evidencia en la imagen axial de tomografía por emisión de positrones-tomografía computarizada (PET-TC) (B). La masa ha disminuido de tamaño y muestra calcificación parcial, sin actividad metabólica residual (flecha). Imagen axial en ventana de pulmón (C) que muestra parénquima normal. TC de control, 12 meses después de finalizar la quimioterapia (D) que muestra múltiples nódulos pulmonares sólidos (cabezas de flecha) y cavitados (“signo de Cheerio”) (flechas). El diagnóstico histológico confirma agregados histiocíticos y células de Langerhans (fig. 2) en este paciente con histiocitosis de células de Langerhans.
Varón de 29 años, no fumador, con linfoma de Hodgkin. Imagen axial de tomografía computarizada (TC) de tórax, con contraste, en el estudio diagnóstico inicial (A) donde se aprecia una masa sólida (cabezas de flecha) con afectación de múltiples compartimientos mediastínicos e infiltración en la pared torácica anterior (flechas). B) Imagen axial de tomografía por emisión de positrones-TC, 12 meses tras el inicio de tratamiento, que muestra remisión de la enfermedad con presencia de una masa residual (flecha) sin actividad metabólica anormal. El componente infiltrativo en la pared torácica anterior se ha resuelto. La imagen de TC con ventana de pulmón (C) muestra uno de los múltiples nódulos pulmonares cavitados (flecha) presentes en el parénquima pulmonar. La posibilidad de infección oportunista y metástasis pulmonares se consideraron ante este hallazgo. En imágenes axiales de TC de tórax, 2 meses más tarde (D) se observan nuevos nódulos pulmonares sólidos múltiples (flechas) y cavitados (cabeza de flecha), bilaterales. El resultado histológico descarta la enfermedad metastásica y confirma histiocitosis de células de Langerhans pulmonar.
El volumen pulmonar está respetado o aumentado, al contrario que en otras enfermedades intersticiales. A veces se observa fibrosis adyacente a los quistes y la coexistencia con enfisema es frecuente16.
La hipertensión pulmonar, común en estos pacientes, se relaciona con un peor pronóstico. La tomografía computarizada (TC) puede mostrar aumento del tamaño de las arterias pulmonares y, en ocasiones, nódulos centrolobulillares en vidrio deslustrado. Como mencionamos previamente, algunos pacientes pueden presentarse con neumotórax (fig. 4)8,9.
El diagnóstico de HCL se dificulta especialmente en pacientes con historia previa de neoplasia, ya que, fundamentalmente en su forma nodular, los hallazgos radiológicos pueden confundirse con enfermedad metastásica o infección oportunista. Otras consideraciones diagnósticas que se han de tener en cuenta en cualquier paciente en su forma nodular son la tuberculosis miliar, la sarcoidosis y la silicosis10.
El diagnóstico diferencial de la enfermedad quística pulmonar incluye: linfangioleiomiomatosis, enfisema, neumonía intersticial linfoide, espacios aéreos agrandados con fibrosis de la pared que pueden aparecer en el contexto de una fibrosis intersticial relacionada con el tabaco y bronquiectasias10,12.
Debe recordarse que, aunque poco frecuente, debemos incluir la HCL dentro del diagnóstico diferencial de una enfermedad pulmonar nodular difusa en el contexto de un linfoma de Hodgkin1,8, especialmente si va asociado a quistes y afectación predominante de los lóbulos superiores y cuando no haya otros signos de progresión de enfermedad (figs. 5 y 6).
El curso de la enfermedad es variable e impredecible. En la mitad de los pacientes, el cese del consumo de tabaco es suficiente para que la enfermedad se estabilice. En una cuarta parte de los pacientes, la enfermedad remite de manera espontánea, independientemente del abandono del hábito tabáquico y, en los restantes, la enfermedad progresa a pesar de la restricción de su consumo8. En estos últimos casos son necesarias medidas adicionales como la administración de corticoterapia o quimioterapia10,17. La intervención precoz mejora el pronóstico de la enfermedad, aunque en pacientes con HCL avanzada el trasplante pulmonar se contempla como opción terapéutica12.
Enfermedad de Rosai-DorfmanLa ERD, también conocida como histiocitosis sinusal con adenopatías masivas, es una rara histiocitosis en la que no están implicadas las CL, sino que se trata de una proliferación benigna de macrófagos.
Aunque la afectación más característica es la que involucra a los ganglios linfáticos, a veces presenta afectación pulmonar.
EtiopatogeniaEl agente etiológico es desconocido y se postula una etiología multifactorial. El virus del herpes simple podría tener influencia en su etiología; también el factor estimulador de colonias de macrófagos, ejerciendo un papel en el desarrollo y progresión del proceso. Se ha descrito su relación con el virus de la inmunodeficiencia humana, la amiloidosis, el linfoma y otros procesos linfoproliferativos18, algunos autoanticuerpos, glomerulonefritis, síndrome de Wiskott-Aldrich y policitemia vera8.
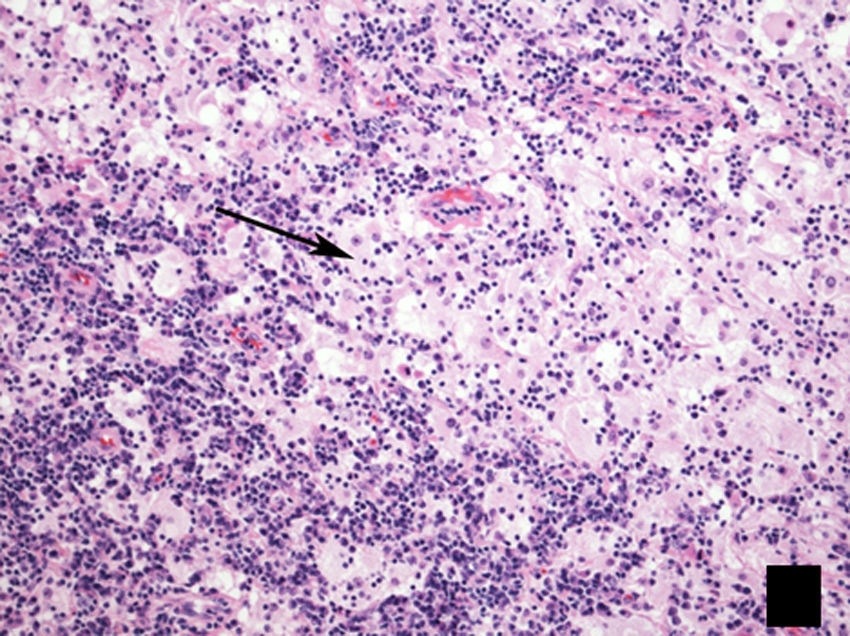
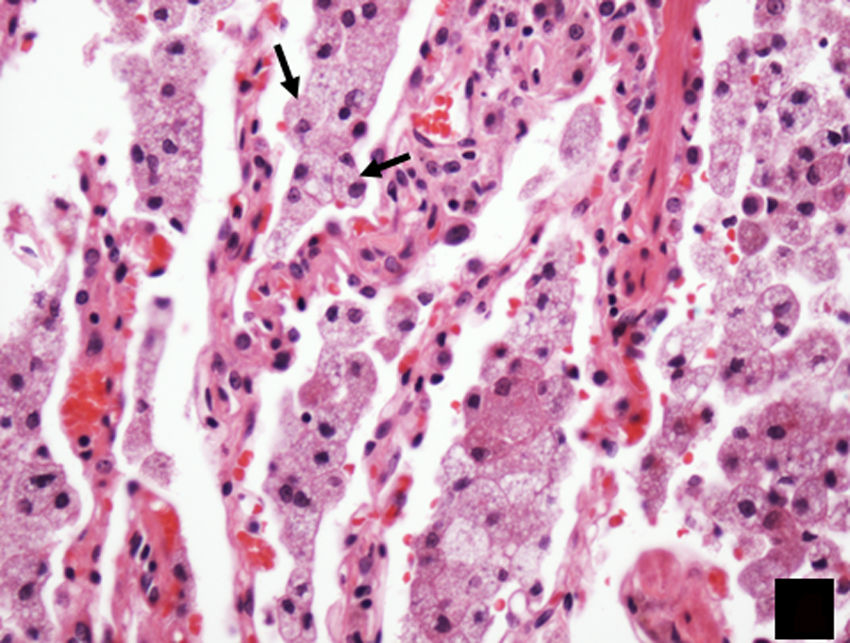
HistologíaEl estudio histopatológico revela un infiltrado de histiocitos, caracterizados por su citoplasma pálido eosinofílico, sobre un fondo de linfocitos dispersos y células plasmáticas. Es frecuente observar emperipolesis (fig. 7), que consiste en la fagocitosis de linfocitos por histiocitos19. La inmunohistoquímica revela la presencia de células S100 positivas, CD68 positivas, factor XIIIa negativas y CD1 negativas8.
Imagen histológica de biopsia ganglionar, teñida con hematoxilina-eosina (H-E 100x), que muestra la típica lesión presente en la enfermedad de Rosai-Dorfman, con una apariencia bifásica compuesta predominantemente por linfocitos (áreas oscuras) e histiocitos (áreas claras) que muestran emperipolesis (flecha).
Afecta típicamente a niños y adultos durante la primera o segunda décadas de la vida8,10,18–20, y tiene una ligera predilección por el sexo masculino10 en individuos con ascendencia africana10,18. Generalmente, se presenta con adenopatías cervicales bilaterales (83%) indoloras, fiebre y pérdida de peso20. Un 20-43% de los pacientes presentan enfermedad extranodal19: cutánea (11,5%), de la cavidad nasal (11,3%), del tracto aerodigestivo superior (11,3%), orbitaria (8,5%), del sistema nervioso central (4,9%), renal (2,3%), hepática y pancreática. La afectación torácica (2-3%) incluye adenopatías y lesión de la vía área; esta última da lugar a disnea y alteraciones espirométricas. La afectación pulmonar y pleural es rara21.
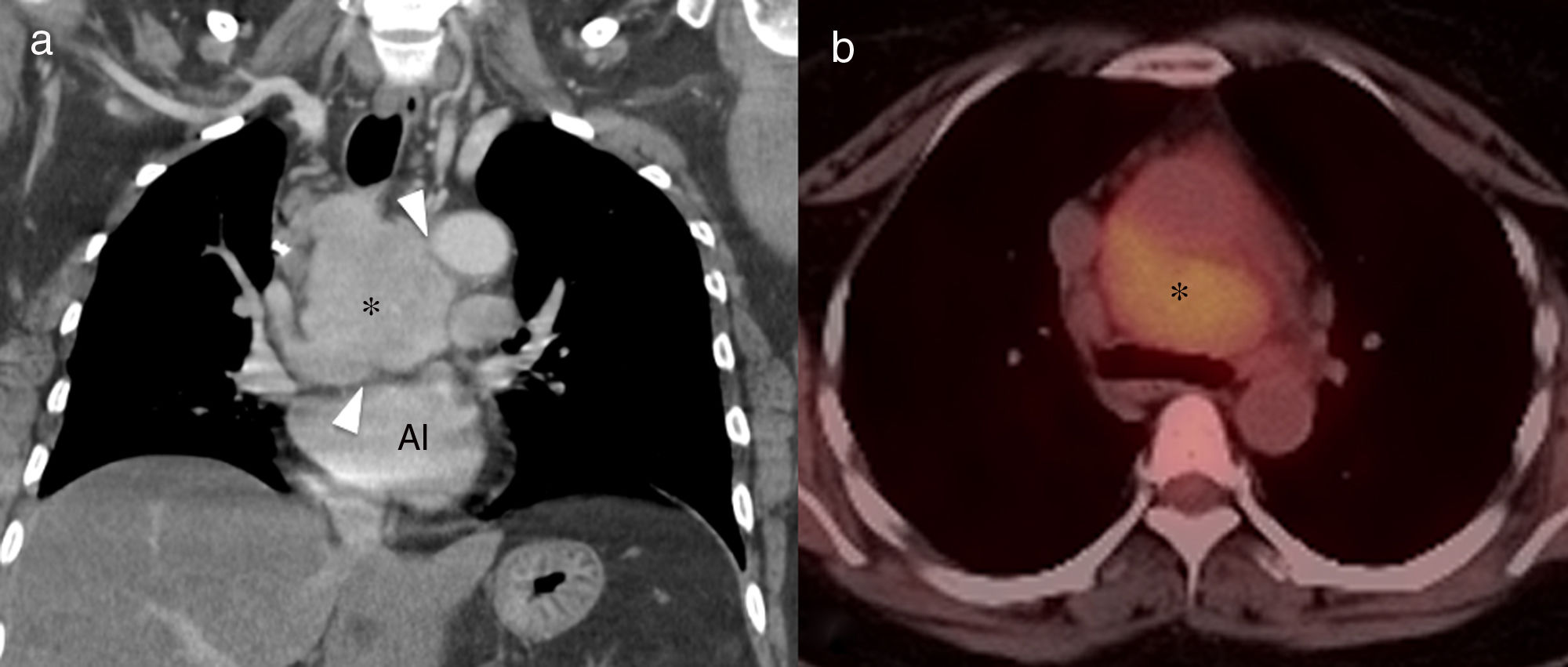
Hallazgos de imagenSe debe recordar que la afectación torácica en ERD suele consistir en adenopatías mediastínicas (fig. 8). La afectación de la tráquea y los bronquios se presenta en forma de masas nodulares únicas o múltiples, de densidad homogénea y con afectación de la grasa adyacente, que llevan a diferentes grados de obstrucción de la vía área20.
Mujer de 46 años, asintomática, con enfermedad de Rosai-Dorfman. Reconstrucción coronal de tomografía computarizada (TC) (A) que muestra una masa mediastínica sólida con realce homogéneo (asterisco). La lesión respeta los planos grasos de separación con los órganos adyacentes (cabezas de flecha), y es metabólicamente activa en tomografía por emisión de positrones-TC (B). AI: aurícula izquierda.
La afectación pulmonar se caracteriza por nódulos o masas pulmonares mal definidas e infiltración intersticial perilinfática, sin claro predominio por campos basales o apicales. Estas lesiones están generalmente asociadas a irregularidad de los bronquios adyacentes, por compresión de estos18. Es posible encontrar afectación pleural8,18,19. Las lesiones suelen ser metabólicamente activas en tomografía por emisión de positrones (PET) (fig. 8)18.
Cuando la enfermedad se manifiesta con adenopatías mediastínicas, el diagnóstico diferencial incluye infecciones por micobacterias, sarcoidosis, linfoma, metástasis, síndrome de reconstitución inmunitaria e infecciones fúngicas.
TratamientoLa mayoría de los pacientes se mantienen asintomáticos, con hallazgos radiológicos estables, o incluso tiene lugar la regresión espontánea sin necesidad de tratamiento. Cuando presentan síntomas persistentes, existe una buena respuesta a los corticoides. La quimioterapia no ha demostrado utilidad18.
Enfermedad de Erdheim-ChesterEs una rara histiocitosis, derivada de células dendríticas distintas de las CL. Se trata de una enfermedad sistémica con manifestaciones heterogéneas y únicamente varios cientos de casos descritos en la bibliografía.
EtiopatogeniaSu origen es desconocido. En más del 50% de los casos se asocia con mutaciones en BRAF V600E en precursores mielomonocíticos multipotentes o histiocitos tisulares22.
HistologíaSe caracteriza por infiltrados perilinfáticos xantogranulomatosos, con histiocitos espumosos rodeados de fibrosis8. La inmunocitoquímica es positiva para CD68 y negativa para CD1a. Al contrario que en la HCL, los histiocitos tienen un citoplasma pálido y no presentan eosinofilia citoplasmática ni gránulos de Birbeck (fig. 9).
ClínicaSuele presentarse en edades medias de la vida, y se inicia con dolor óseo secundario a la afectación metafisodiafisaria en los huesos largos (50%)23. La afectación extraesquelética puede ser: cardiaca, aórtica, pulmonar, renal, del SNC, orbitaria (manifestando exoftalmos) y cutánea (xantelasmas)24. En los pacientes con afectación pulmonar (20-55%) y pleural cursa con tos y disnea progresiva8. La afectación cardiaca puede llevar a la presencia de alteraciones de la conducción o infarto de miocardio por afectación coronaria23.
El curso de la enfermedad depende sobre todo de su extensión y distribución. La afectación cardiaca, pulmonar y neurológica son signos de mal pronóstico23. Las manifestaciones cardiovasculares son la principal causa de muerte23.
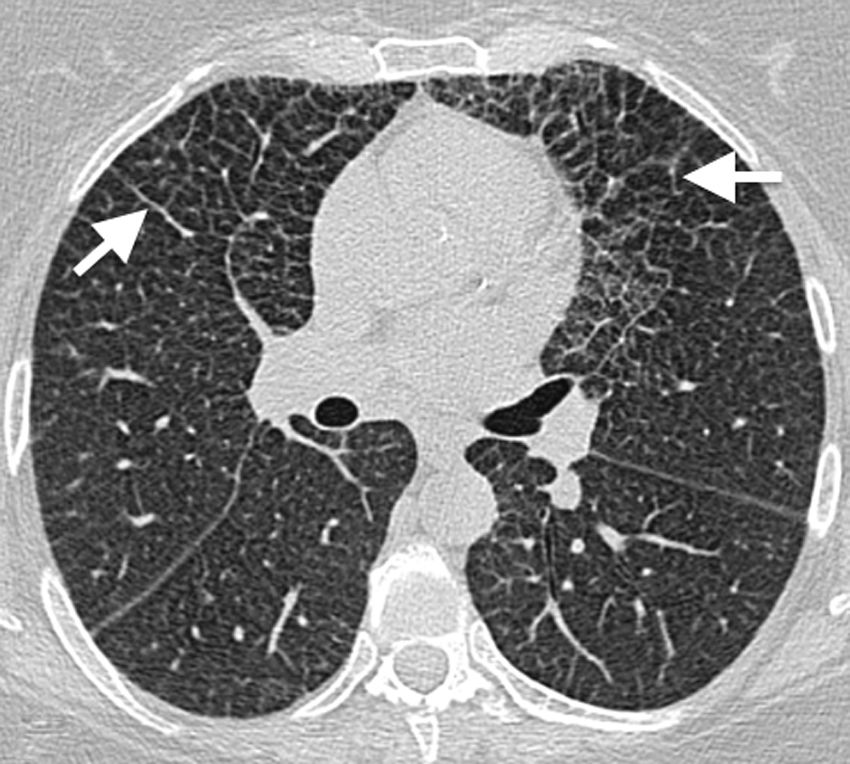
Hallazgos de imagenLa afectación pulmonar suele caracterizarse por su predominio perilinfático, y con frecuencia se observa en la TC un engrosamiento del intersticio septal interlobulillar, peribroncovascular (fig. 10) y de cisuras23. También pueden observarse opacidades en vidrio deslustrado23 y nódulos centrolobulillares8,23. La presencia de quistes aislados en algunos pacientes plantea su posible relación con la HCL; de hecho, se han descrito casos en los que ambas patologías coexisten en un mismo paciente (fig. 11)24,25.
Mujer de 50 años, asintomática, con historia de masas suprarrenales bilaterales y esplenomegalia. Imagen axial de tomografía computarizada (TC) de alta resolución de pulmón que muestra una extensa reticulación de predominio en campos anteriores, con engrosamiento de septos interlobulillares y del intersticio intralobular (flechas). Esta es una manifestación clásica del compromiso pulmonar en la enfermedad de Erdheim-Chester.
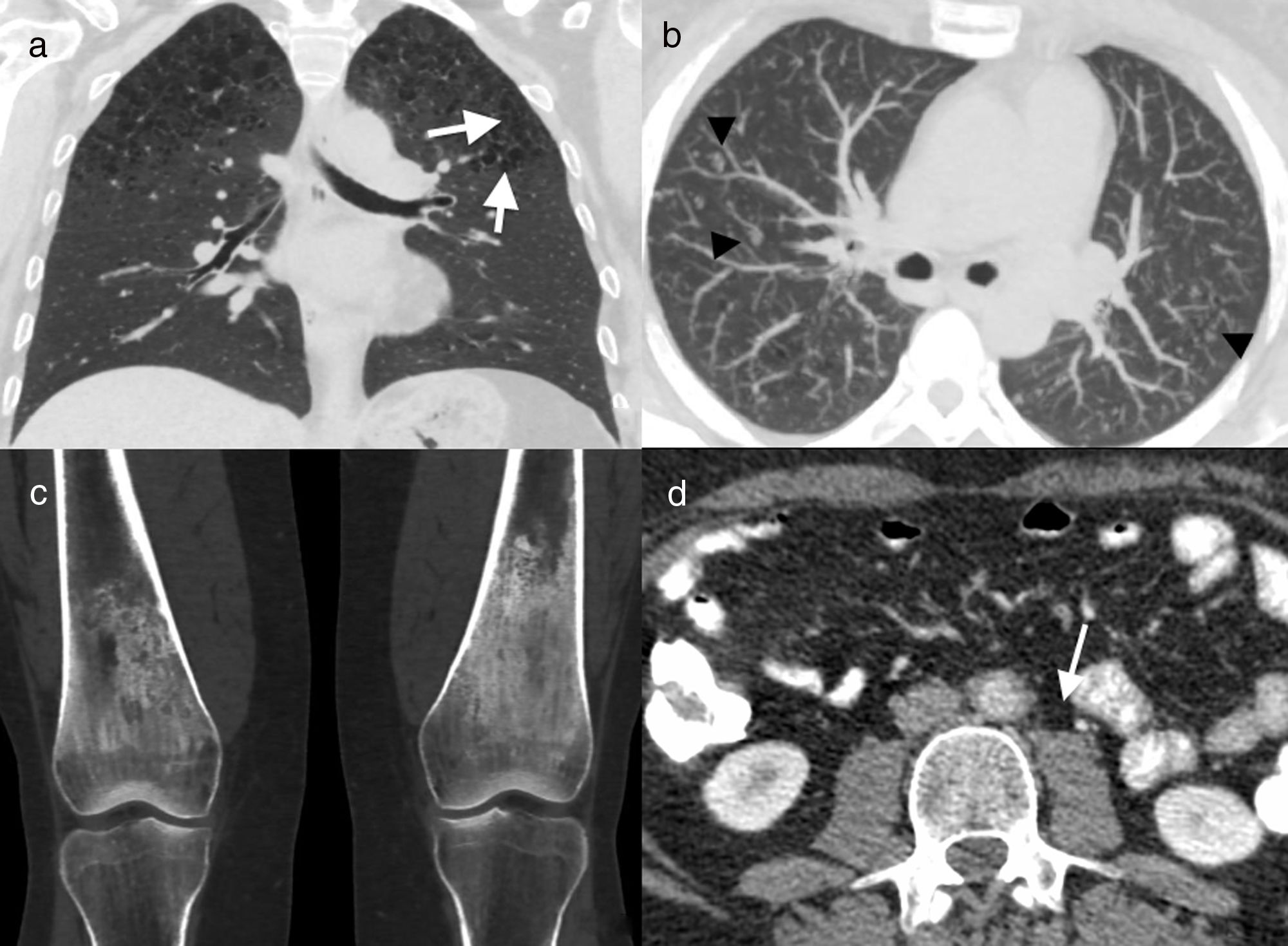
Varón de 41 años, exfumador, con enfermedad de Erdheim-Chester. Reconstrucción coronal (A) e imagen axial de tomografía computarizada (TC) con proyección de máxima intensidad (MIP) (B). Quistes (flechas) y múltiples nódulos centrolobulillares (cabezas de flecha) en ambos lóbulos superiores, junto a enfisema centroacinar. Reconstrucción coronal de TC de rodillas (C) que muestra esclerosis bilateral simétrica en las diáfisis y metáfisis de ambos fémures. Imagen axial de TC abdominal (D) en la que se observa engrosamiento concéntrico de la pared de la aorta abdominal (flecha). La biopsia de una lesión mandibular (no ilustrada) confirmó el diagnóstico de enfermedad de Erdheim-Chester.
Puede presentar engrosamiento y derrame pleural. El engrosamiento pleural suele localizarse en la zona basal paravertebral derecha y, en ocasiones, se continúa con infiltración del espacio retrocrural, creando una masa seudotumoral con densidad de partes blandas24.
La afectación cardiovascular es frecuente, generalmente afecta a la aorta descendente y abdominal, con una infiltración periadventicial de densidad de partes blandas (patrón de “aorta revestida”, del inglés “coated aorta”) que puede extenderse a los troncos supraaórticos, arterias intercostales o coronarias, simulando una vasculitis11,24. La enfermedad de Takayasu y la fibrosis retroperitoneal son los principales diagnósticos diferenciales.
También puede observarse infiltración de la pared de la aurícula derecha de aspecto seudotumoral24. Cuando la infiltración mediastínica es extensa y comprime las estructuras vasculares, el diagnóstico diferencial incluye: la enfermedad granulomatosa crónica, el linfoma, la mediastinitis fibrosante y la amiloidosis.
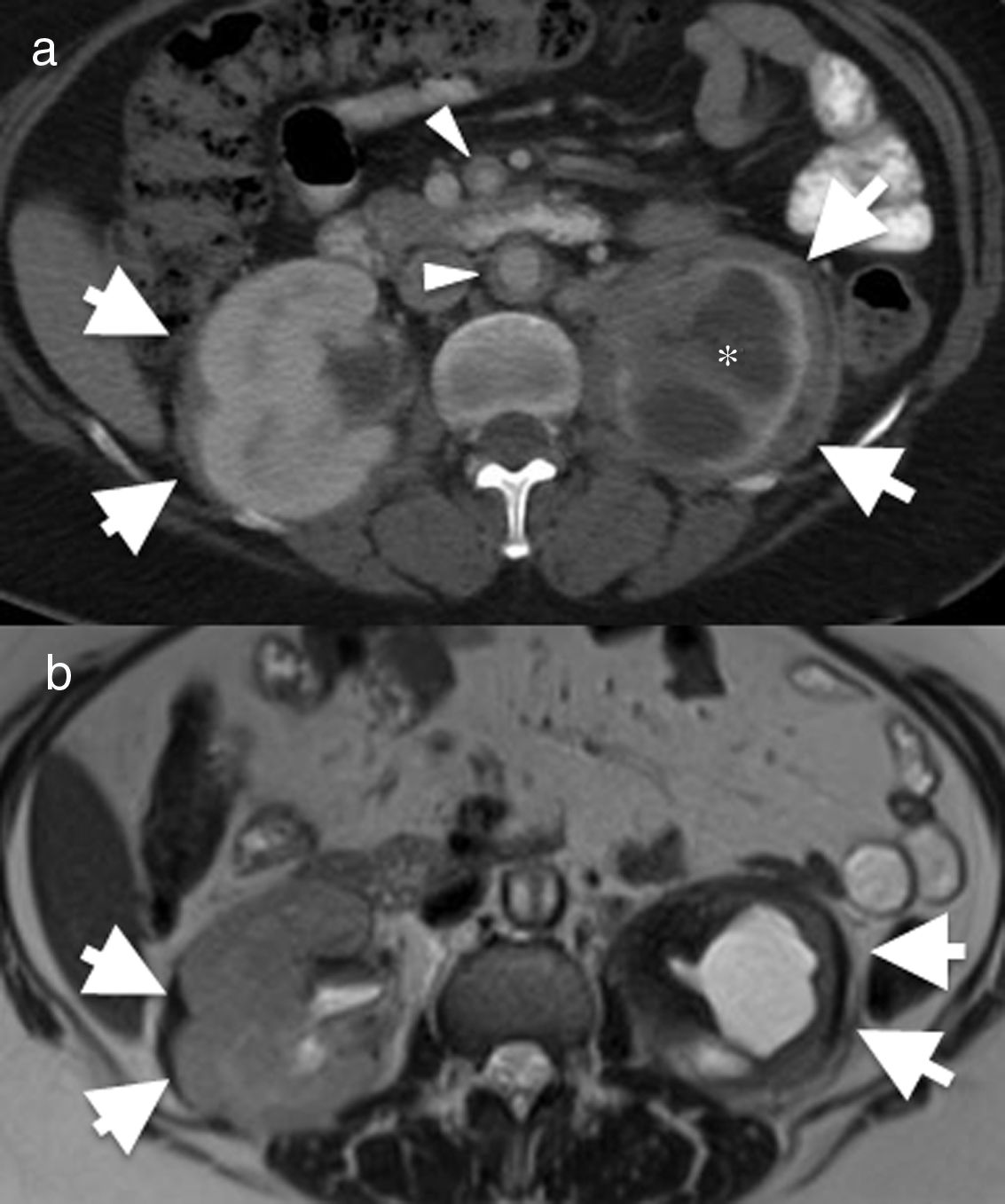
Debe recordarse que, debido al carácter inespecífico de la afectación pulmonar en la EEC, las manifestaciones extratorácicas suelen ser clave en el diagnóstico. La presencia de lesiones escleróticas en las metáfisis y diáfisis de huesos largos (fig. 12), así como la característica afectación renal “hairy kidney”(infiltración de la grasa perirrenal que capta contraste)22 (fig. 12) apoyan su diagnóstico.
Mujer de 55 años con enfermedad de Erdheim-Chester. Inicialmente, presenta cuadro de dolor abdominal en el cuadrante inferior izquierdo y náuseas. Imagen axial de tomografía computarizada (TC) de abdomen (A) que muestra infiltración perirrenal bilateral por tejido blando (flechas). Existe importante atrofia del riñón izquierdo e hidronefrosis grave (asterisco). También se observa engrosamiento mural de la aorta abdominal y de la arteria mesentérica superior (cabezas de flecha). B) Imagen axial de resonancia magnética (RM) potenciada en T2 eco de espín que muestra la baja intensidad de señal del tejido blando perirrenal (flechas) así como del infiltrado periaórtico (cabeza de flecha). El diagnóstico diferencial ante este hallazgo incluye enfermedad de Erdheim-Chester, fibrosis retroperitoneal, sarcoidosis y amiloidosis. El resultado de biopsia confirma enfermedad de Erdheim-Chester. Esta paciente carecía de afectación pulmonar por la enfermedad.
El descubrimiento reciente de las mutaciones activadoras en el gen BRAF ha dado pie al desarrollo de nuevas terapias centradas en la inactivación de este gen. Actualmente, se reservan para casos resistentes al tratamiento, cuando las terapias de primera línea (corticoides, inmunosupresores, quimioterápicos) no son efectivas, solas o en combinación con estas últimas. Entre ellas se encuentran: vemurafenib (un inhibidor de BRAFF), infliximab (un anticuerpo anti-TNF) y anakinra (un antagonista del receptor interleucina 1). Aun así, la supervivencia a los 5 años no supera el 70%22.
ConclusiónLa HCL, junto con la ERD y EEC son un conjunto de patologías, de causa idiopática, en las que la proliferación e infiltración de histiocitos en las muestras histológicas es el hallazgo anatomopatológico diagnóstico. Cuando afectan al pulmón, a excepción de la HCL, presentan hallazgos poco específicos y, en ocasiones, las manifestaciones extrapulmonares aportan la clave diagnóstica. Aunque muy poco frecuente, debe pensarse en HCL en pacientes no fumadores, en tratamiento quimio y radioterápico con nódulos cavitados de nueva aparición e incluirse en el diagnóstico diferencial junto con la enfermedad metastásica y la infección oportunista.
Autoría- 1.
Responsable de la integridad del estudio: CTG, JB, EC, EBS, NM y LF.
- 2.
Concepción del estudio: CTG, JB y LF.
- 3.
Diseño del estudio: CTG, JB, EC, EBS, NM y LF.
- 4.
Obtención de los datos: CTG, JB, EC, EBS, NM y LF.
- 5.
Análisis e interpretación de los datos: N.A.
- 6.
Tratamiento estadístico: N.A.
- 7.
Búsqueda bibliográfica: CTG, JB y LF.
- 8.
Redacción del trabajo CTG, JB y LF.
- 9.
Revisión crítica del manuscrito con aportaciones intelectuales relevantes: CTG, JB, EC, EBS, NM y LF.
- 10.
Aprobación de la versión final: CTG, JB, EC, EBS, NM y LF.
Los autores declaran no tener ningún conflicto de intereses.