De acuerdo con el conocimiento científico actual, los programas de diagnóstico precoz mediante mamografía y la calidad de los tratamientos han logrado disminuir la mortalidad por cáncer de mama. Aunque no está exento de riesgos, el cribado poblacional tiene claras ventajas sobre la detección oportunista. Siguiendo las «Recomendaciones del Consejo Europeo sobre el cribado del cáncer», en España existen programas de detección precoz en todas las Comunidades Autónomas que, en líneas generales, siguen unas directrices comunes. «La Guía Europea para la Garantía de Calidad en el cribado y diagnóstico de cáncer de mama» es un documento de referencia y proporciona una visión general de todos los aspectos del cribado. Para conseguir los objetivos previstos de reducción de morbilidad y mortalidad por cáncer de mama es necesario que los programas de cribado cumplan con unos criterios de calidad establecidos y que se garanticen a las pacientes las mejores opciones terapéuticas.
The currently available scientific evidence attests that mammographic screening and quality treatment have been able to reduce mortality attributable to breast cancer. Although screening is not without risks, population-based screening has clear advantages over opportunistic detection. Following the Council of the European Union's “Recommendations on cancer screening”, all the regional Autonomous Communities in Spain have screening programs that, in general, follow the same guidelines. The “European guidelines for quality assurance in breast cancer screening and diagnosis” serve as a reference that provides an overview of all aspects of screening. To achieve the foreseen objectives for the reduction of the morbidity and mortality attributable to breast cancer, screening programs must fulfill the established quality criteria and guarantee that patients have access to the best treatment options.
El cáncer de mama es el tumor más frecuente en las mujeres occidentales. Se estima que la probabilidad de desarrollarlo antes de los 75 años es del 8%1. En 2009 se registraron en España 6.130 fallecimientos, con una tasa ajustada de mortalidad de 26,35 por 100.000 mujeres2. En 2012 se calcula que se diagnosticarán 27.000 casos y producirán 6.231 muertes3. En los países industrializados constituye un problema de salud importante por su alta incidencia, mortalidad y repercusión personal y social4. En junio de 2003, el Parlamento Europeo instó a los países miembros a desarrollar estrategias efectivas dirigidas a mejorar el cribado, diagnóstico y tratamiento del cáncer de mama5,6.
El principal objetivo del cribado poblacional es disminuir la mortalidad detectando precozmente el cáncer de mama7. Su historia natural permite detectarlo pronto, ya que en la mayoría de tumores, existe una fase preclínica detectable de entre 1 y 3 o más años8. La mamografía sigue siendo la prueba de elección para el cribado9 y su efectividad está ampliamente probada10. Los resultados del metaanálisis de 8 ensayos clínicos aleatorizados iniciados entre 1963 y 1982, con 500.000 participantes en Europa, Estados Unidos y Canadá (HIP, Malmö, Two-Country, Edinburg, Stocklolm, NBSS-1, NBSS-2 y Gothenburg), han demostrado que el cribado mamográfico reduce la mortalidad por cáncer de mama en un 20-30%10,11.
Los programas de cribado poblacional se iniciaron en varios países europeos a finales de los 80 y, en España, a principios de los 908. Tras un aumento continuado de los casos de cáncer de mama entre las mujeres españolas durante los años 80 y 90, la disminución de la tasa de incidencia a partir del año 2001 (registrada para el período 2001-2004) entre las mujeres de 45 a 65 años, posiblemente sea consecuencia de la generalización del cribado mamográfico, el tratamiento de lesiones de alto riesgo y el menor uso de terapias hormonales sustitutivas12. Estudios recientes confirman que la tasa de mortalidad también está disminuyendo gracias a los programas de detección precoz y a los avances en el tratamiento sistémico de la enfermedad4,13,14.
Aunque el cribado del cáncer de mama está ampliamente aceptado, no está exento de controversia4 y periódicamente aparecen voces críticas con los programas, sus metodologías y sus resultados15. Después de 30 años desde el inicio de los primeros programas, todavía permanecen sin resolver algunos aspectos básicos (edad de la población diana, periodicidad del cribado, estandarización de sistemas de lectura, etc.).
Los objetivos de esta actualización son mostrar la situación actual del cribado, comentar las directrices radiográficas y radiológicas recogidas en la «Guía Europea para la garantía de calidad en el cribado y diagnóstico de cáncer de mama»7 y discutir los aspectos que suscitan mayor debate y controversia.
Principios del cribado de cáncer de mamaActualmente no es posible prevenir la aparición de un cáncer de mama, porque los principales factores de riesgo conocidos (sexo, edad, antecedentes familiares y personales, menarquia precoz, menopausia tardía, etc.) no son modificables. Por tanto, la prevención secundaria es la alternativa para interrumpir su historia natural16. El cáncer de mama cumple los criterios epidemiológicos requeridos para ser susceptible de cribado: elevada morbilidad y mortalidad, prevalencia alta del estado preclínico detectable, posibilidad de tratamiento efectivo y existencia de un test de cribado de alta sensibilidad y especificidad, bajo costo y escasos efectos secundarios17. El cribado se dirige a una población «asintomática», por ello debe cumplir requisitos más estrictos que los exigibles a pruebas diagnósticas empleadas en pacientes sintomáticas18,19.
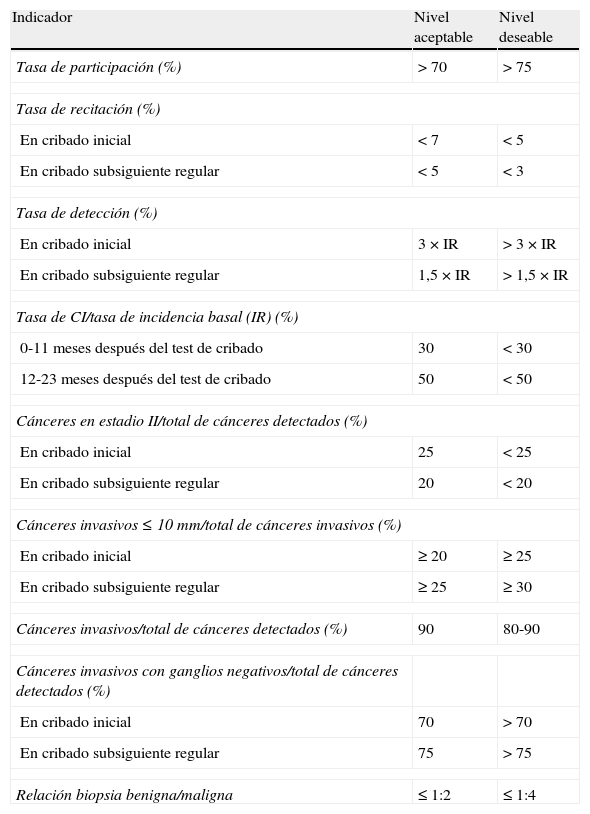
La Guía Europea, en su cuarta edición7, recoge los estándares de calidad recomendados y constituye un documento de referencia en todos los aspectos del cribado15. Contiene documentos sobre control técnico, directrices epidemiológicas, radiográficas y radiológicas, control de calidad en patología y cirugía e incluye un sumario con los indicadores utilizados para evaluar el proceso de cribado (tabla 1) y un glosario con la terminología empleada (tabla 2).
Indicadores de rendimiento que se utilizan para medir el impacto que tiene un programa de cribado en la disminución de la mortalidad por cáncer de mama
| Indicador | Nivel aceptable | Nivel deseable |
| Tasa de participación (%) | >70 | >75 |
| Tasa de recitación (%) | ||
| En cribado inicial | <7 | <5 |
| En cribado subsiguiente regular | <5 | <3 |
| Tasa de detección (%) | ||
| En cribado inicial | 3×IR | >3×IR |
| En cribado subsiguiente regular | 1,5×IR | >1,5×IR |
| Tasa de CI/tasa de incidencia basal (IR) (%) | ||
| 0-11 meses después del test de cribado | 30 | <30 |
| 12-23 meses después del test de cribado | 50 | <50 |
| Cánceres en estadio II/total de cánceres detectados (%) | ||
| En cribado inicial | 25 | <25 |
| En cribado subsiguiente regular | 20 | <20 |
| Cánceres invasivos ≤10mm/total de cánceres invasivos (%) | ||
| En cribado inicial | ≥20 | ≥25 |
| En cribado subsiguiente regular | ≥25 | ≥30 |
| Cánceres invasivos/total de cánceres detectados (%) | 90 | 80-90 |
| Cánceres invasivos con ganglios negativos/total de cánceres detectados (%) | ||
| En cribado inicial | 70 | >70 |
| En cribado subsiguiente regular | 75 | >75 |
| Relación biopsia benigna/maligna | ≤1:2 | ≤1:4 |
CI: carcinoma de intervalo; IR: incidencia de cáncer de mama en ausencia de cribado.
Glosario de términos utilizados en cribado de cáncer de mama
| Población diana | Mujeres a las que está dirigido el programa de cribado siguiendo unos criterios establecidos de edad y localización geográfica. Incluye grupos especiales como institucionalizadas y minorías |
| Intervalo de cribado | Intervalo fijo entre 2 cribados consecutivos. Se fija según la política particular de cada programa de cribado, habitualmente 2 años |
| Controles intermedios | Estudios indicados con una frecuencia inferior al intervalo de cribado (6 o 12 meses). Los cánceres diagnosticados en estos controles se consideran cánceres detectados |
| Cribado inicial | La primera exploración de cribado a la que se ve sometida cada mujer individual dentro del programa de cribado, con independencia de la ronda del programa en la que la mujer se examina |
| Cribados subsiguientes | Todos los cribados para una mujer individual que siguen al cribado inicial. Pueden ser regulares, si acude a todas las rondas de cribado o irregulares, si falta en alguna ronda |
| Tasa de participación | Proporción de mujeres que acuden al cribado entre las mujeres invitadas al mismo. Es un indicador clave que predice la capacidad global de un programa para reducir la mortalidad por cáncer de mama |
| Adherencia al cribado | Proporción de mujeres que acuden al cribado en la ronda actual con relación a las que acudieron en la ronda de cribado previa |
| Cribado oportunista | Cribado realizado fuera del marco de un programa de cribado poblacional |
| Tasa de incidencia (IR) | Número de casos nuevos diagnosticados en una población definida en un período determinado |
| Tasa de incidencia esperada | Tasa de incidencia que se esperaría en la población cribada, en ausencia de cribado |
| Tasa de recitación | Proporción de mujeres que son recitadas para valoración adicional de entre las mujeres sometidas al cribado |
| Tasa de detección | Proporción de cánceres detectados en una ronda de cribado por cada 1.000 mujeres cribadas. Esta tasa varía entre el cribado inicial y subsiguientes |
| Sensibilidad de la prueba de cribado | Proporción de mujeres verdaderamente enfermas que son identificadas como tales mediante el test de cribado (verdaderos positivos/verdaderos positivo+falsos negativos) |
| Especificidad de la prueba de cribado | Proporción de mujeres que verdaderamente no tienen cáncer, que son identificadas como tales mediante el test de cribado (verdaderos negativos/verdadero negativos+falsos positivos) |
| Valor predictivo positivo de la prueba de cribado | Proporción de cánceres detectados en las mujeres con una prueba de cribado positiva. En la práctica el denominador corresponde a las mujeres sometidas a valoración adicional |
| Valor predictivo positivo de las pruebas invasivas | Proporción de cánceres detectados en las mujeres a las que se les recomienda intervencionismo mamario como consecuencia del cribado. El intervencionismo incluye citología, biopsia percutánea (core-biopsia y biopsia asistida por vacío) y biopsia quirúrgica |
| Relación biopsia benigna/maligna | Relación entre lesiones benignas y malignas con confirmación histológica mediante biopsia quirúrgica, en cualquier ronda del cribado. Esta relación varía entre el cribado inicial y subsiguientes |
| Cáncer de intervalo | Cáncer primario de mama en una mujer que acudió al cribado y tuvo un resultado negativo. El tumor aparece o bien antes de la siguiente invitación o en un período de tiempo inferior al intervalo de cribado si la mujer ya ha alcanzado el límite superior de edad de cribado |
| Tasa de cáncer de intervalo | Proporción de cánceres de intervalo por 1.000 mujeres con resultado de cribado negativo |
El Técnico Especialista en Radiodiagnóstico (TER) es habitualmente el único profesional sanitario que atiende a la mujer7. Debe registrar información relevante para el radiólogo (anomalías palpables, retracción del pezón, telorrea espontánea, antecedentes de cirugía previa, etc.)7. Además, debería poseer habilidades para manejar la ansiedad de la mujer, explicar el procedimiento y la importancia de la compresión7. El posicionamiento correcto es esencial para conseguir la máxima visualización del tejido mamario y disminuir la rellamada por técnica inadecuada7. Siguiendo las directrices radiográficas la tasa de repetición debería ser inferior al 3%7.
Directrices radiológicasEl radiólogo es responsable de que los estudios tengan la calidad requerida7. La interpretación de la mamografía es una tarea compleja ya que la presentación radiológica del cáncer de mama es variable y algunas lesiones requieren un elevado nivel de entrenamiento y especialización para poder detectarlas20. Es necesario mantener la concentración y condiciones de lectura óptimas, recomendándose pausas cada 30-40min7. Si es posible, se recomienda la doble lectura porque aumenta la sensibilidad del test en un 5-20%7.
Actualmente la mamografía digital está reemplazando a la analógica tanto en la práctica clínica como en las Unidades de Diagnóstico Precoz4,21. La transición de la mamografía analógica a digital ha sido lenta, posiblemente debida a múltiples factores (alto coste, curva de aprendizaje, aumento inicial en la tasa de rellamada, etc.)21,22. La mamografía digital directa ofrece diversas ventajas como son la reducción de la dosis de radiación23, disminución de la tasa de repeticiones22, facilidad de comparación con estudios anteriores y empleo de herramientas que optimizan la detección (manipulación del contraste, zoom y sistemas de detección asistida por ordenador)24. Desde el punto de vista de la gestión sanitaria permite integrar la información en redes digitales y elimina costes asociados a la mamografía analógica4. Estudios publicados que comparan las mamografías analógica y digital, entre los que destaca el ensayo DMIST25,26, no han demostrado diferencias significativas en la certeza diagnóstica entre ambas técnicas24,25. Además, la mamografía digital presenta beneficios potenciales, sobre todo en menores de 50 años y en mujeres con mamas densas26. Para Salas et al., las tasas de falsos positivos e indicación de procedimientos intervencionistas fueron menores con la mamografía digital que con la analógica, sin que la tasa de detección fuese significativamente diferente27. En un futuro próximo, es muy probable que la tomosíntesis digital suponga un avance importante en el diagnóstico precoz cuando detecte tumores ocultos en la mamografía convencional28.
En el diagnóstico por imagen de la mama no debemos olvidar la importancia de la ecografía como la técnica complementaria de la mamografía. Realizada por radiólogos expertos permite caracterizar lesiones y atribuirles con mayor exactitud el grado de sospecha, seleccionar la zona más adecuada para la biopsia percutánea, buscar lesiones adicionales y hacer la estadificación prequirúrgica de la axila29.
La lectura de la mamografía de cribado es diferida, y por ello algunas mujeres reciben una segunda cita. Esta recitación o rellamada para hacer una exploración complementaria es uno de los principales inconvenientes del cribado30. Existen diversos factores que influyen en la tasa de recitación, unos relacionados con la mujer (edad, patrón glandular, estado premenopáusico o posmenopáusico, índice de masa corporal, participación en ronda prevalente o incidente, antecedentes familiares de cáncer de mama, etc.)30,31 y otros con el proceso de cribado (experiencia y entrenamiento del radiólogo, calidad de la mamografía, empleo de una o 2 proyecciones, etc.)7. Tasas de recitación elevadas incrementan los costes del programa y, sobre todo, generan ansiedad innecesaria en las mujeres7,31. Por el contrario, tasas de recitación bajas disminuyen la tasa de detección y aumentan los cánceres de intervalo (CI)7. Es deseable conseguir tasas de rellamada aceptables (inferior al 7% en ronda prevalente y al 5% en subsiguientes) que garanticen el equilibrio entre sensibilidad y especificidad, de tal manera que se diagnostiquen el mayor número de tumores y se minimicen los daños ocasionados por falsos positivos7,15,30. Los estudios previos deben estar disponibles porque ayudan a disminuir la tasa de recitación y permiten detectar algunos cánceres que de otra manera pasarían inadvertidos7,15.
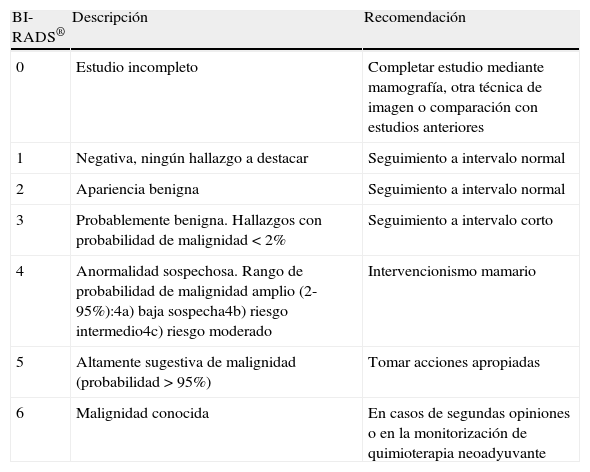
Para la clasificación de los hallazgos mamográficos se emplean las categorías BI-RADS® del Colegio Americano de Radiología, que han permitido estandarizar la terminología y categorizar las lesiones estableciendo el grado de sospecha y recomendando la actitud a tomar en cada caso32 (tabla 3).
Sistema de categorización y recomendaciones del American College of Radiolgy (ACR), Breast Imaging Reporting and Data System (BI-RADS®)
| BI-RADS® | Descripción | Recomendación |
| 0 | Estudio incompleto | Completar estudio mediante mamografía, otra técnica de imagen o comparación con estudios anteriores |
| 1 | Negativa, ningún hallazgo a destacar | Seguimiento a intervalo normal |
| 2 | Apariencia benigna | Seguimiento a intervalo normal |
| 3 | Probablemente benigna. Hallazgos con probabilidad de malignidad <2% | Seguimiento a intervalo corto |
| 4 | Anormalidad sospechosa. Rango de probabilidad de malignidad amplio (2-95%):4a) baja sospecha4b) riesgo intermedio4c) riesgo moderado | Intervencionismo mamario |
| 5 | Altamente sugestiva de malignidad (probabilidad >95%) | Tomar acciones apropiadas |
| 6 | Malignidad conocida | En casos de segundas opiniones o en la monitorización de quimioterapia neoadyuvante |
La visualización de una anomalía en la mamografía de cribado requiere de un estudio adicional (proyecciones complementarias y/o ecografía) que confirme o descarte una lesión7. Si se demuestra una lesión sospechosa, se indicarán pruebas intervencionistas de confirmación diagnóstica y tratamiento en el caso de que sea necesario. El trabajo en equipos multidisciplinares y las reuniones que se llevan a cabo de forma periódica por los distintos profesionales implicados, permiten valorar y seguir adecuadamente a todas las pacientes.
La tasa de detección debe guardar una relación adecuada con la tasa de incidencia esperada para una población determinada (tabla 1). Una tasa de detección elevada a expensas de cánceres intraductales (CID) puede indicar sobrediagnóstico33,34. La proporción de CID en relación con los cánceres infiltrantes debería ser superior al 10% (estándar mínimo) o mejor al 15% (estándar deseable)7. La proporción de cánceres invasivos ≤10mm respecto del total de cánceres detectados es un indicador importante que refleja la calidad de un programa7. En ronda inicial, su estándar mínimo se sitúa en el 20%, pero es deseable que esté por encima del 25%. En cribados sucesivos, los estándares mínimo y deseable deberían estar por encima del 25 y 30% respectivamente7.
La mamografía de cribado permite detectar la mayoría de cánceres que padece la población diana. No obstante, no todas las mujeres que acuden al cribado se benefician de el. Se estima que entre un 10-30% de los cánceres pueden no detectarse con la mamografía35. Se denomina CI al tumor mamario diagnosticado después de una exploración de cribado considerada negativa y antes de la cita para la siguiente revisión programada7,36. La tasa de CI es un indicador para valorar la calidad e impacto futuro de un programa36 y depende de la incidencia del cáncer de mama y de la periodicidad y sensibilidad de la prueba de cribado36. El CI es inevitable, pero su número debe mantenerse lo más bajo posible porque una proporción alta reduce la efectividad del programa7,36. Los falsos negativos no deberían exceder el 20% del total de CI7. El registro de CI es parte indispensable del control de calidad y requiere el seguimiento de la población diana para identificar todos los casos nuevos de cáncer de mama que se producen7,36. Los CI se clasifican en 5 categorías según lo propuesto por la Guía Europea (tabla 4)7. La tasa de CI y la proporción de casos clasificados en las diferentes categorías varía dependiendo del método empleado para detectarlo y clasificarlo radiológicamente36. El protocolo de los Programas de Detección Precoz de Cáncer de Mama36 propone una metodología para evaluar el CI y una sistemática de revisión radiológica que garantice que la obtención de datos sea exhaustiva y los criterios de inclusión y exclusión uniformes.
Clasificación de los cánceres de intervalo en categorías4
| Categorías | Mamografía de cribado | Mamografía de diagnóstico |
| Intervalo verdadero | Negativa | Positiva |
| Intervalo oculto | Negativa | Negativa |
| Falso negativo | Positiva | Positiva |
| Signos mínimos | Signos mínimos | Signos mínimos o positiva |
| Inclasificable | Positiva, negativa o no disponible | No disponible o no realizada |
Basado en la Guía de Garantía de Calidad de Radiólogos del Reino Unido (UK Quality Assurance Guidelines for Radiologists), NHSBSP mayo de 1997, página 50.
Actualmente todas las Comunidades Autónomas (CC.AA.) cuentan con Programas de Detección Precoz de Cáncer de Mama ofertados a toda la población considerada en riesgo8,17. La prueba de cribado es la mamografía con intervalo bienal8,17. Aunque los criterios operativos son comunes, existen algunas particularidades diferenciadoras entre Comunidades8,17,37 en cuanto a la edad de cribado, el número de proyecciones, el número mínimo de lecturas por año del radiólogo, el método de lectura, las revisiones intermedias y el ámbito de los estudios complementarios.
La edad de cribado abarca de 50 a 64 años. No obstante, siguiendo las recomendaciones del Consejo Europeo6 y del Sistema Nacional de Salud8,17, varias CC.AA. han ampliado el límite superior hasta los 69 años8. Seis Comunidades incluyen además el grupo de 45 a 49 años8.
El número de proyecciones es de 2 en cada mama en el cribado inicial8,37. En cribados sucesivos, aunque algunos programas comenzaron con solo una, también se ha impuesto la doble proyección37.
El número mínimo de lecturas/año no se exige en todas las Comunidades8,37. Siguiendo las directrices europeas es recomendable que cada radiólogo realice un mínimo de 5.000 lecturas anuales7.
El método de lectura es mayoritariamente la doble lectura (sin y con consenso)17. No obstante, las modalidades varían entre Comunidades, y pueden ser simple (un lector), doble con consenso (2 lectores, que indican las pruebas complementarias por acuerdo), doble sin consenso (2 lectores con indicación de prueba complementaria si alguno lo sugiere), y doble con arbitrio (2 lectores y, si no concuerdan, un tercer radiólogo para hacer prevalecer la conducta coincidente)37. Cada modelo de lectura tiene ventajas e inconvenientes. La lectura simple tiene menor coste económico, pero detecta menos cánceres38. La doble lectura independiente aumenta la detección entre un 9-20%, y en un 13% la tasa de tumores <1cm. El inconveniente es su mayor coste y el aumento en la tasa de rellamada38. La doble lectura con consenso consigue reducir la rellamada a valores similares a la lectura simple38. Para optimizar recursos sería recomendable realizar una doble lectura independiente y, en caso de desacuerdo, consenso o arbitrio15.
Para las revisiones intermedias (intervalo inferior a 2 años), el porcentaje medio de indicación está en el 3,21%, con amplia variabilidad entre programas (0,78-6,43%), posiblemente porque algunos programas incluyan recomendaciones por antecedentes familiares y no por hallazgos radiológicos39.
En cuanto a los estudios complementarios, algunos programas realizan todas las pruebas de confirmación diagnóstica (exploraciones de imagen e intervencionismo) en el entorno hospitalario. Otros, sin embargo, efectúan las proyecciones complementarias y ecografías en las Unidades de Cribado.
Los procesos de cribado se ponen en marcha por Unidades de Gestión que se encargan de depurar las bases de datos, identificar e invitar a la población diana, emitir las cartas de resultado, seguir la derivación hospitalaria e identificar el CI40. En España, la variabilidad de funcionamiento entre programas y la falta de uniformidad en el registro de datos plantea algunos problemas para explotar los resultados y comparar los indicadores entre las distintas Comunidades30. En un esfuerzo por unificar criterios, los Programas de Detección Precoz de Cáncer de Mama de Ámbito Ibérico celebran desde 1998 reuniones anuales en las que ponen en común sus resultados y hacen propuestas de consenso37,39.
Los resultados de los principales indicadores correspondientes al año 200937, muestran una participación media del 69,10%, con diferencias considerables entre Comunidades (48-91,6%), y una adherencia superior al 90%. La indicación de pruebas de imagen complementarias está en el 4,67% (1,1-7,7%) y de pruebas invasivas en el 0,65% (0,3-1,1%). La tasa de detección media en 3,62‰ (1,8-5,1‰). En cuanto al tipo de tumores, en la mayor parte alcanza o se acerca a lo esperado en un programa de cribado8: cánceres invasivos 76,7%, CID 14,1%, tipo tumoral desconocido 9,2% y el 67,6% de los tumores sin afectación ganglionar37.
Reflexiones sobre el cribado del cáncer de mamaDe acuerdo a la evidencia científica actual, los programas de cribado organizados y los tratamientos de calidad disminuyen la mortalidad por cáncer de mama4,13,41. Los programas actuales con mayor tiempo de implantación (Australia, Canadá, Dinamarca, Finlandia, Islandia, Italia, Holanda, España, Suecia y Reino Unido) están publicando reducciones de mortalidad del 16-36% entre mujeres invitadas y del 24-48% entre las que acuden al cribado41. No obstante, la validez de los ensayos clínicos que sentaron sus bases se sigue cuestionando, a la vez que se incide en los perjuicios potenciales del cribado poblacional30. Como consecuencia, el cribado mamográfico sigue poniéndose periódicamente en tela de juicio15,42. La polémica se inició en el año 2000 con el artículo de Götzsche et al.43 que cuestionaba la justificación del cribado. Posteriormente, revisiones Cochrane concluyeron que no estaba demostrado su beneficio44. En 2009 varias publicaciones tuvieron también repercusión mediática porque discutían que los beneficios eran menores y los daños mayores de lo que se pensaba hasta entonces45,46 y que el cribado podría comenzar más tarde y con menor frecuencia para lograr aproximadamente el mismo beneficio45. Aunque aún pueden existir controversias sobre la magnitud de los efectos del cribado, actualmente existe evidencia suficiente para concluir que el cribado poblacional disminuye la mortalidad por cáncer de mama4,14,41 y permite emplear tratamientos quirúrgicos y oncológicos menos agresivos47,48.
Sin embargo, la polémica sobre el cribado del cáncer de mama condiciona la falta de consenso en cuestiones relevantes:
- –
Edad de la población diana. Existe consenso sobre el rango de 50-69 años8 en el que la efectividad del cribado se ha demostrado ampliamente11,49. Sin embargo, la extensión del cribado a mujeres más jóvenes (40-49 años) genera controversia, posiblemente porque los ensayos clínicos que sentaron las bases del cribado poblacional no demostraron una reducción significativa de la mortalidad en edades más jóvenes8,11,30. No obstante, estudios recientes sugieren que también es efectivo entre los 40-49 años50,51. Aparte del impacto sobre la mortalidad, el debate en este grupo de edad también se centra en la relación coste-riesgo-beneficio52 debido a que la incidencia del cáncer es menor, los tumores son de crecimiento más rápido (menor adelanto diagnóstico y mayor tasa de CI) y la densidad mamaria es mayor (la sensibilidad y especificidad de la mamografía disminuyen)10. La recomendación sobre la edad de inicio del cribado es diferente según países y regiones, y tampoco hay unanimidad entre las distintas guías clínicas4. La falta de consenso genera mensajes contradictorios en la población y los profesionales, y da lugar a un volumen importante de cribado oportunista antes de la edad de inclusión en los programas8,30.
En cuanto a las mujeres de edad superior a 70 años, a pesar de que la incidencia del cáncer de mama es mayor y la sensibilidad de la mamografía es superior35,53, normalmente han sido excluidas de los programas poblacionales porque se preveía una tasa de participación baja54.
- –
Periodicidad del cribado. En Europa clásicamente se recomienda el cribado bienal7,8, mientras que en EE.UU. se recomendaba anualmente55. Publicaciones recientes indican que entre 50 y 74 años el intervalo bienal consigue casi todos los beneficios del cribado anual, pero con menos perjuicios45.
- –
Autoexploración y exploración física. Tienen el inconveniente de incrementar los falsos positivos. La bibliografía asegura que «no hay pruebas de que la autoexploración mamaria y la exploración clínica sean recomendables» al no estar probada su eficacia en la disminución de la mortalidad56,57. En nuestra opinión, no es motivo suficiente para no recomendarlas, al menos en mamas densas. Hay que considerar que la sensibilidad de la mamografía no es tan elevada como se comunicó en las primeras recomendaciones del cribado, donde se situaba entre un 85-95%11. La sensibilidad real de la mamografía posiblemente se mueva en un rango más amplio del 68-95%, e incluso puede ser inferior en mamas muy densas49.
- –
Número de proyecciones mamográficas. La Guía Europea recomienda la doble proyección en el cribado inicial, y deja a criterio de cada programa hacer una o dos proyecciones en cribados sucesivos7. Está demostrado que la doble proyección aumenta la sensibilidad y especificidad de la prueba y reduce la tasa de recitación7,49, por lo que, en nuestra opinión, la justificación del cribado con proyección única en rondas sucesivas debería ser únicamente económica.
- –
Riesgo de cáncer inducido por radiación. Únicamente está demostrado en supervivientes de los bombardeos nucleares en Japón y en pacientes sometidas a radioterapia30,58. La mamografía digital permite emplear una dosis glandular media un 22% inferior a la mamografía analógica23. La dosis promedio para una exploración estándar de 2 proyecciones con mamografía digital es de 3,7mGy frente a los 4,7mGy con mamografía analógica58 y se considera insignificante para producir un cáncer radioinducido59. Sin embargo, el riesgo puede incrementarse a medida que se acumulan mamografías a lo largo de la vida, especialmente cuando la mamografía periódica se inicia a edades más jóvenes60.
- –
Efectos adversos de los falsos positivos. Se consideran como tales el estrés psicológico y la morbilidad física ocasionados por la recitación e indicación de procedimientos intervencionistas «innecesarios»7,18,30,31. La mayoría de hallazgos falsos positivos únicamente requieren de proyecciones complementarias y/o ecografía para aclarar el diagnóstico de normalidad o benignidad30. Los porcentajes publicados sobre recitación e indicación de intervencionismo son variables según la bibliografía consultada, y las diferencias son claras entre programas europeos y estadounidenses30. Hubbard et al.61 publican tasas de rellamada del 16,3% en primera ronda y del 9,6% en subsiguientes, y tasas de intervencionismo del 2,5% en ronda inicial y del 1% en sucesivas. Estos autores calculan que tras 10 años de participación en un programa de cribado anual, más de la mitad de las mujeres obtendrán un resultado falso positivo y entre el 7-9% una indicación de biopsia. Por su parte, Castells et al., han estimado que un tercio de las mujeres que participan durante 10 años en un programa bienal pueden tener un resultado falso positivo como rellamada31. En la actualidad se considera que las participantes deberían disponer de información adecuada sobre la probabilidad de ser recitadas y, en último término, de la posibilidad de necesitar pruebas invasivas de confirmación diagnóstica, para que así cada mujer pueda decidir si desea participar o no en el cribado, una vez conocidos los beneficios y los riesgos31,61.
- –
Sobrediagnóstico y sobretratamiento. Son otros efectos negativos del cribado y hacen referencia al diagnóstico y tratamiento de cánceres que en ausencia de cribado nunca hubieran causado síntomas10,17,62. Su magnitud exacta no está clara, apareciendo en la literatura cifras muy dispares33. Biesheuvel et al., estimaron que el rango del sobrediagnóstico estaba entre el 4-54%63. Jorgensen y Götzche lo han cifrado entre el 52-54%, considerando que uno de cada 3 cánceres diagnosticados por cribado corresponde a sobrediagnóstico64. Por otro lado, simulaciones realizadas sobre modelos teóricos presentan estimaciones entre el 1-3%65. Un estudio reciente que utiliza la incidencia observada el programa de cribado holandés y la incidencia teórica en la población sin cribado, concluye que el riesgo de sobrediagnóstico estaría en el 2,8% en todas las edades y en el 9,7% en la edad de cribado33, cifras similares a lo estimado en el seguimiento del ensayo sueco de Malmö (7-8%)66. Duffy et al., concluyen que el beneficio del cribado es mayor que los daños ocasionados por el sobrediagnóstico y que entre 2 y 2,5 vidas se salvan por cada caso diagnosticado en exceso67. Dado que el estado de conocimiento científico actual no permite distinguir entre los cánceres de mama que evolucionarán de los que no lo harán, en la actualidad todos los cánceres que se detectan se tratan, siendo inevitable cierto grado de sobrediagnóstico y sobretratamiento64.
- –
Mujeres de alto riesgo. Las estrategias de seguimiento cada 2 años ofertadas a mujeres de riesgo intermedio son insuficientes para mujeres con riesgo elevado68. Se consideran mujeres de alto riesgo a las portadoras de mutaciones en genes BRCA1 o BRCA2 (riesgo estimado del 50-80%) y aquellas con antecedentes familiares importantes, particularmente en el caso de cáncer de mama en edades jóvenes, bilaterales y/o coexistentes con cánceres de ovario (riesgo estimado del 30-50%)68,69. La mayoría de las guías recomiendan comenzar las exploraciones entre los 25 y 30 años34. El cribado mamográfico en estas edades presenta inconvenientes por la menor sensibilidad de la mamografía, la previsión de tasas elevadas de CI y la posibilidad de provocar cánceres radioinducidos34. Otras modalidades diagnósticas como la resonancia magnética y la ecografía se están proponiendo para compensar las limitaciones de la mamografía en estas mujeres70. La resonancia magnética es la técnica que presenta mayor sensibilidad (71-94% frente al 36-59% de la mamografía) aunque no existen estudios aleatorizados que muestren cómo contribuye a reducir la mortalidad por cáncer de mama70. Los resultados del ensayo EVA concluyeron que la resonancia magnética actual es superior a la mamografía, tanto para diagnosticar los cánceres invasivos como los intraductales34. Estudios realizados en mujeres de alto riesgo reflejan una sensibilidad de la ecografía entre el 33 y 65%70,71. Los resultados del ensayo ACRIN 6666 en mujeres de alto riesgo, asintomáticas y con mama densa, demostraron que añadir la ecografía a la mamografía en el cribado aumenta la detección del cáncer71. La ecografía es una técnica económica y no utiliza radiación ionizante, pero, como inconveniente, es operador dependiente y el número de falsos positivos es mayor que con la mamografía71. Hoy en día, la resonancia magnética se perfila como la modalidad diagnóstica de elección en mujeres de alto riesgo que incluso podría extenderse a aquellas con riesgo superior al 20%34. No obstante, tanto en el caso de la ecografía como en el de la resonancia, la utilidad real de estas técnicas para el cribado dependerá también de otros factores como el número de falsos positivos y la disponibilidad de recursos humanos y económicos. En la práctica, quedan muchas cuestiones por resolver en cuanto al cribado en mujeres de alto riesgo (edad de inicio, periodicidad, técnicas empleadas, seguimiento en Unidades de Cribado poblacional o en unidades multidisciplinarias, etc.).
- –
Densidad de la mama. La densidad mamográfica elevada es uno de los factores predictores de riesgo de cáncer de mama72. Las mujeres que tienen más del 75% de la mama ocupado por zonas densas tienen un riesgo 4 a 6 veces mayor que aquellas que tienen la mama compuesta por tejido adiposo73,74. Además, en estos casos la sensibilidad de la mamografía también es menor72. Las opciones para mejorar la tasa de detección pueden ser acortar el intervalo de cribado (aunque posiblemente tampoco aumentaría la detección por la menor sensibilidad de la mamografía en mamas densas) o bien emplear otras combinaciones diagnósticas72. El empleo de mamografía digital, ecografía y resonancia magnética puede incrementar la detección en mamas muy densas en las que además el riesgo de cáncer de mama es mayor72. No obstante, y aunque parece claro que añadir exploraciones mejoraría la detección, en el contexto de un programa de cribado, hay que ser cauteloso y valorar con estudios coste-beneficio si es rentable la indicación de ecografía y/o resonancia en mamas muy densas.
La detección precoz del cáncer de mama representa un reto importante para todos los profesionales implicados. El correcto funcionamiento de un programa de cribado no se limita solo al diagnóstico de los casos, sino que debe asegurar que se manejan adecuadamente con circuitos específicos de asistencia que garanticen tratamientos homogéneos basados en la mejor evidencia científica. El trabajo en equipos multidisciplinares garantizará que podamos ofrecer a las pacientes las mejores opciones terapéuticas con el fin de lograr realmente un impacto positivo sobre la morbilidad y mortalidad de la enfermedad, intentando minimizar los efectos negativos del cribado.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Autorías- 1.
Responsable de la integridad del estudio: MM.
- 2.
Concepción del estudio: MM.
- 3.
Diseño del estudio: MM y AO.
- 4.
Obtención de los datos: No procede.
- 5.
Análisis e interpretación de los datos: No procede.
- 6.
Tratamiento estadístico: No procede.
- 7.
Búsqueda bibliográfica: MM.
- 8.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: AO.
- 9.
Redacción del trabajo: MM.
- 10.
Aprobación de la versión final: MM y AO.
Los autores declaran no tener ningún conflicto de intereses.