El tumor de células germinales testicular es una neoplasia frecuente que afecta a varones jóvenes. En la literatura médica existe un consenso en los puntos clave que se refieren a su diagnóstico y tratamiento, aunque hay elementos que se encuentran actualmente en revisión, entre ellos los métodos de seguimiento de esta enfermedad.
Presentamos un estudio estadístico que analiza, mediante las herramientas de valoración de pruebas diagnósticas, la utilidad de la ecografía abdominal comparada con la tomografía computarizada (TC) abdominal, que tomamos como prueba de referencia para diagnosticar metástasis hepáticas y adenopatías retroperitoneales en el seguimiento de pacientes con neoplasia germinal testicular.
Material y métodosAnalizamos 308 pruebas diagnósticas, 154 estudios de TC abdominal y 154 ecografías abdominales, correspondientes a 59 pacientes seguidos durante un período de al menos un año en nuestra institución. Los pacientes se estudiaron mediante una ecografía abdominal que precedía a la TC abdominal, protocolo de seguimiento estándar.
ResultadosLa ecografía abdominal presenta, respecto a la prueba de referencia, una sensibilidad del 95%, una especificidad del 92%, un VPP del 82% y un VPN del 98%.
ConclusiónLa ecografía es una prueba con gran sensibilidad que se puede utilizar para descartar la recidiva abdominal en los protocolos de seguimiento de la neoplasia primitiva de testículo.
Testicular germ cell tumors are common in young men. There is a wide consensus regarding the key points in their diagnosis and treatment, although some elements, including the best approach to follow-up, are being reviewed and revised.
We present a statistical study that uses tools for the evaluation of diagnostic tests to compare the usefulness of abdominal ultrasonography (US) in comparison with that of abdominal CT, taken as the gold standard, in the detection of liver metastases and retroperitoneal adenopathies in patients with testicular germ cell tumors.
Material and methodsWe analyzed a total of 308 diagnostic tests (154 CT studies and 154 US studies) from 59 patients with at least one year's follow-up at our institution. Patients underwent abdominal US before abdominal CT following a standard protocol.
ResultsCompared to the gold standard, abdominal US had 95% sensitivity, 92% specificity, 82% PPV, and 98% NPV.
ConclusionUS is very sensitive and can be used in protocols for the follow-up of primary testicular tumors to rule out disease.
El tumor testicular de células germinales presenta un pico de incidencia a los 20 años, siendo la neoplasia sólida maligna más frecuente en los varones entre los 16-36 años. Se diagnostica por la presencia de una masa indolora en el testículo, que se confirma mediante ecografía, y se puede asociar a dolor lumbar (por la afectación metastásica retroperitoneal, inicio de la siembra sistémica) o disnea (por afectación metastásica tumoral pulmonar)1–5.
Estos tumores presentan una alta sensibilidad a la quimioterapia basada en el cisplatino, a la radioterapia en los tumores germinales del tipo seminoma y a la cirugía. En términos generales, tanto para los tumores seminomatosos como para los no seminomatosos, el tratamiento en el estadio I clínico (tumor localizado en el testículo, tras orquiectomía radical, con marcadores tumorales dentro de la normalidad y ausencia de tumor en la TC abdominal) con linfadenectomía retroperitoneal, la quimioterapia y la vigilancia obtienen los mismos resultados a largo plazo. Si se incluyen todos los estadios, la mortalidad es inferior al 3%, siendo la neoplasia sólida maligna con mayor índice de curación. Las recidivas tras la opción de la vigilancia en el estadio I son aproximadamente del 20%, siendo el 80% en el primer año5–8.
El seguimiento mediante imagen se realiza, de forma casi constante en todos los centros, mediante estudios de TC abdominales y pélvicos durante años. Como las recidivas ocurren en los primeros 2 años, se recomienda el seguimiento mediante TC cada 3 meses el primer año, cada 4 meses el segundo y cada 6 y 12 meses en los años siguientes. En la actualidad se están realizando estudios intentando reducir la dosis acumulada de radiación que sufren estos pacientes y valorando la reducción del coste en términos económicos, identificando esta situación como un problema real9–24.
No hemos encontrado en la literatura médica referencias a estudios estadísticos que valoren distintos métodos de seguimiento de imagen, llegando a existir un consenso general para considerar la TC abdominal como única prueba de imagen utilizada en el seguimiento de las recidivas abdominales y solo se realiza valoración del tórax si existe enfermedad diseminada o si el paciente presenta clínica.
En resumen, en la práctica clínica habitual, la prueba de imagen utilizada en el seguimiento de esta entidad es la TC abdominal. Es conocido que la TC presenta una carga de radiación significativa, sobre todo si se analiza la dosis acumulada, ya que se trata de pacientes jóvenes; además, precisa del uso de contrastes yodados que, aunque escasos, presentan efectos secundarios.
Este estudio plantea la hipótesis de que las imágenes sectoriales obtenidas mediante ecografía abdominal son un método diagnóstico que puede ser útil en el seguimiento del tumor testicular. El uso de la ecografía permitiría reducir la dosis de radiación que sufren estos pacientes.
El objetivo es valorar el rendimiento diagnóstico de la ecografía respecto a la TC en el diagnóstico de las recidivas del tumor germinal de testículo en la cavidad abdominal: masas retroperitoneales adenopáticas y lesiones hepáticas focales.
Material y métodosSe ha diseñado un estudio prospectivo, epidemiológico, observacional y descriptivo que consistió en el control de la evolución durante un año de 59 pacientes consecutivos, seleccionados aleatoriamente, entre el 1 de enero de 2003 y el 1 de enero de 2008. Estos pacientes fueron diagnosticados y tratados de neoplasia testicular y entraron en un protocolo de seguimiento. No se seleccionó a los pacientes por el índice de masa corporal ni se descartó ninguno por falta de disponibilidad de los medios diagnósticos.
Siguiendo los protocolos aceptados en nuestro centro se realizaron los controles de imagen habituales mediante TC abdominal durante el primer año: 4 estudios de TC abdominal separados por un periodo de tiempo de 3 meses (TC multidetector Aquilion 16 Toshiba medical systems, protocolo: contraste oral e intravenoso (i.v.) 120ml a 3ml/s con inicio a los 40s del principio de la inyección desde las bases pulmonares a la pelvis).
Antes del primer examen de TC se informó al paciente y se pidió su consentimiento para realizar una ecografía abdominal (ecógrafo Aplio XG Toshiba medical systems) al terminar la TC y antes de los futuros controles; ningún paciente rehusó entrar en el estudio.
La ecografía fue realizada por un equipo de radiólogos, 5 especialistas experimentados, en lectura única y antes de la realización de la TC. No estaba garantizado el doble ciego.
Se incluyó un apartado en el informe en el que el radiólogo indicaba, según su opinión y experiencia, el grado de fiabilidad de la ecografía: poco fiable (si el radiólogo tenía serias dudas sobre los hallazgos de la ecografía); fiable (si el radiólogo estaba relativamente convencido del diagnóstico de la ecografía), y diagnóstica (si el radiólogo estaba convencido fuera de toda duda del diagnóstico de la ecografía). Los criterios de recidiva tumoral mediante TC y ecografía se muestran en las tablas 1 y 2.
Criterios diagnósticos de las pruebas de imagen
| Se considera que un pacientes es sano si: | La TC abdominal se informó como normal |
| Los hallazgos patológicos que muestra la TC no son indicativos de recidiva o extensión tumoral | |
| Se considera que un paciente es enfermo si: | La TC abdominal indica signos de recidiva o extensión tumoral |
| Se considera que una ecografía es positiva si: | Presenta signos radiológicos de recidiva o extensión tumoral |
| Se considera que una ecografía es negativa si: | Es informada como normal |
| Si los hallazgos patológicos no son indicativos de recidiva o extensión tumoral |
Signos radiológicos de recaída o extensión tumoral
| Se consideran signos de recidiva tumoral |
| 1. En el retroperitoneo: las masas o adenopatías retroperitoneales con eje menor mayor de 1cm localizadas en los hilios renales o en región perivascular |
| 2. En la pelvis: masas o adenopatías inguinales o ilíacas con eje menor mayor de 1 cm |
| 3. En el hígado: masas hepáticas que sean calificadas como «sospechosas», «compatibles con» o «sugestiva de» metástasis hepática. Masas que no cumplan criterios de quistes hepáticos o de hemangiomas típicos, no conocidas por los estudios de diagnóstico |
En 19 de los 59 pacientes, debido a la presencia de recidiva y su tratamiento, se varió el protocolo de seguimiento por imagen, reduciendo el período ente los estudios de TC. En todos ellos se continuó realizando la ecografía antes de las exploraciones de TC de seguimiento y diagnóstico. No se encontró ningún estudio de TC que no fuera suficiente para el diagnóstico y ningún paciente presentó contraindicaciones para la administración de contraste intravenoso.
Se rechazaron las ecografías y los estudios de TC correspondientes al diagnóstico de extensión previo al tratamiento, ya que este estudio se diseñó para valorar los estudios de seguimiento. Se recogieron en total 154 exploraciones de TC abdominales y otras tantas ecografías (tablas 1 y 2).
No se recogieron datos sobre el tamaño y número de lesiones hepáticas ni retroperitoneales, comparando únicamente la existencia o no de signos de recidiva o extensión tumoral y su localización.
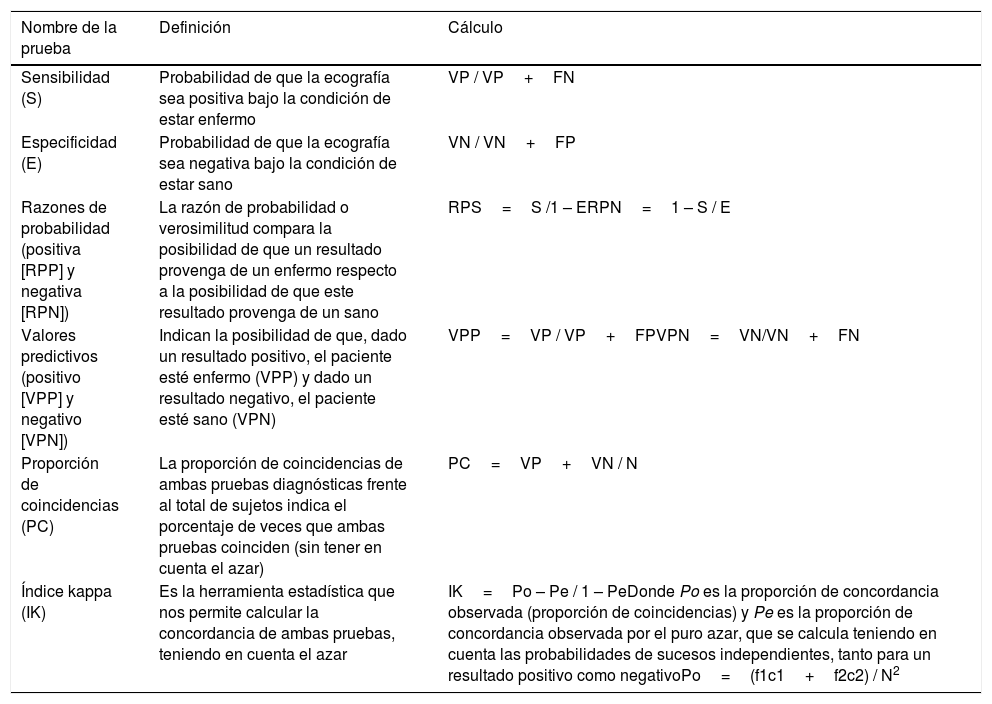
Posteriormente se analizaron estos resultados mediante herramientas estadísticas que valoraron la validez interna (sensibilidad, especificidad, valor predictivo positivo, valor predictivo negativo, razones de probabilidad, proporción de coincidencias e índice kappa, Tabla 3) de la ecografía respecto a la TC abdominal considerada como prueba de referencia.
Herramientas estadísticas de validez interna para la comparación de pruebas diagnósticas
| Nombre de la prueba | Definición | Cálculo |
|---|---|---|
| Sensibilidad (S) | Probabilidad de que la ecografía sea positiva bajo la condición de estar enfermo | VP / VP+FN |
| Especificidad (E) | Probabilidad de que la ecografía sea negativa bajo la condición de estar sano | VN / VN+FP |
| Razones de probabilidad (positiva [RPP] y negativa [RPN]) | La razón de probabilidad o verosimilitud compara la posibilidad de que un resultado provenga de un enfermo respecto a la posibilidad de que este resultado provenga de un sano | RPS=S /1 – ERPN=1 – S / E |
| Valores predictivos (positivo [VPP] y negativo [VPN]) | Indican la posibilidad de que, dado un resultado positivo, el paciente esté enfermo (VPP) y dado un resultado negativo, el paciente esté sano (VPN) | VPP=VP / VP+FPVPN=VN/VN+FN |
| Proporción de coincidencias (PC) | La proporción de coincidencias de ambas pruebas diagnósticas frente al total de sujetos indica el porcentaje de veces que ambas pruebas coinciden (sin tener en cuenta el azar) | PC=VP+VN / N |
| Índice kappa (IK) | Es la herramienta estadística que nos permite calcular la concordancia de ambas pruebas, teniendo en cuenta el azar | IK=Po – Pe / 1 – PeDonde Po es la proporción de concordancia observada (proporción de coincidencias) y Pe es la proporción de concordancia observada por el puro azar, que se calcula teniendo en cuenta las probabilidades de sucesos independientes, tanto para un resultado positivo como negativoPo=(f1c1+f2c2) / N2 |
FN: falsos negativos; FP: falsos positivos; VN: verdaderos negativos; VP: verdaderos positivos.
El período de tiempo medio entre la ecografía y el estudio de TC fue de 8,3 días, con un intervalo entre 2 y 12 días. De las 154 pruebas de imagen: las ecografías se clasificaron como positivas (50) o negativas (104), y los estudios de TC abdominal discriminaron enfermos (43) y sanos (111). De las ecografías positivas (50) eran poco fiables 3, fiables 18 y diagnósticas 29. De las ecografías negativas (104) eran poco fiables 2, fiables 50 y diagnósticas 52 (Tabla 4):
- –
Sensibilidad: VP / VP+FN=95%.
- –
Especificidad=VN / VN+FP=92%.
- –
Razón de probabilidad positiva=S /1 – E=11,8.
- –
Razón de probabilidad negativa=1 – S / E=0,05.
- –
VPP=valor predictivo positivo=VP / VP+FP=82%.
- –
VPN=valor predictivo negativo=VN/VN+FN=98%.
- –
Proporción de coincidencias=VP+VN / N=0,93.
- –
Índice kappa=Po – Pe / 1 – Pe; Po=(f1c1+f2c2) / N2=0,57; índice kappa=0,83.
Los 2 pacientes que presentaron una ecografía abdominal negativa y que la TC clasificó como enfermos (falsos negativos) presentaban lesiones hepáticas, ambas en la cúpula. En ambos casos el radiólogo valoró la ecografía como «fiable».
En 9 pacientes la ecografía diagnosticó signos de recidiva tumoral y la TC no confirmó estos hallazgos (falsos positivos). En 8 de ellos la ecografía diagnosticaba afectación retroperitoneal y el radiólogo la evaluaba como «poco fiable», en el otro la ecografía diagnosticaba afectación retroperitoneal y el radiólogo la evaluaba como «fiable».
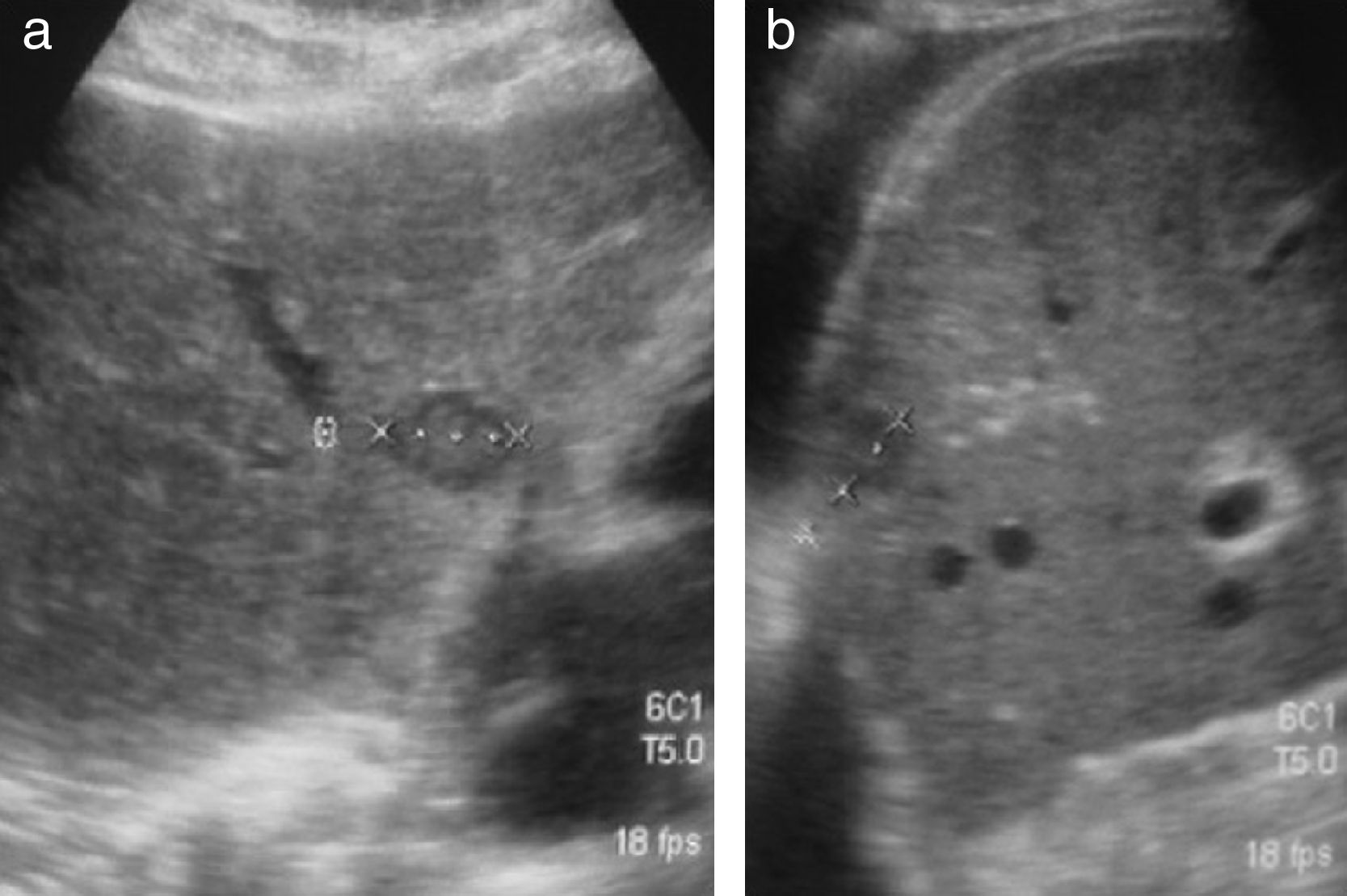
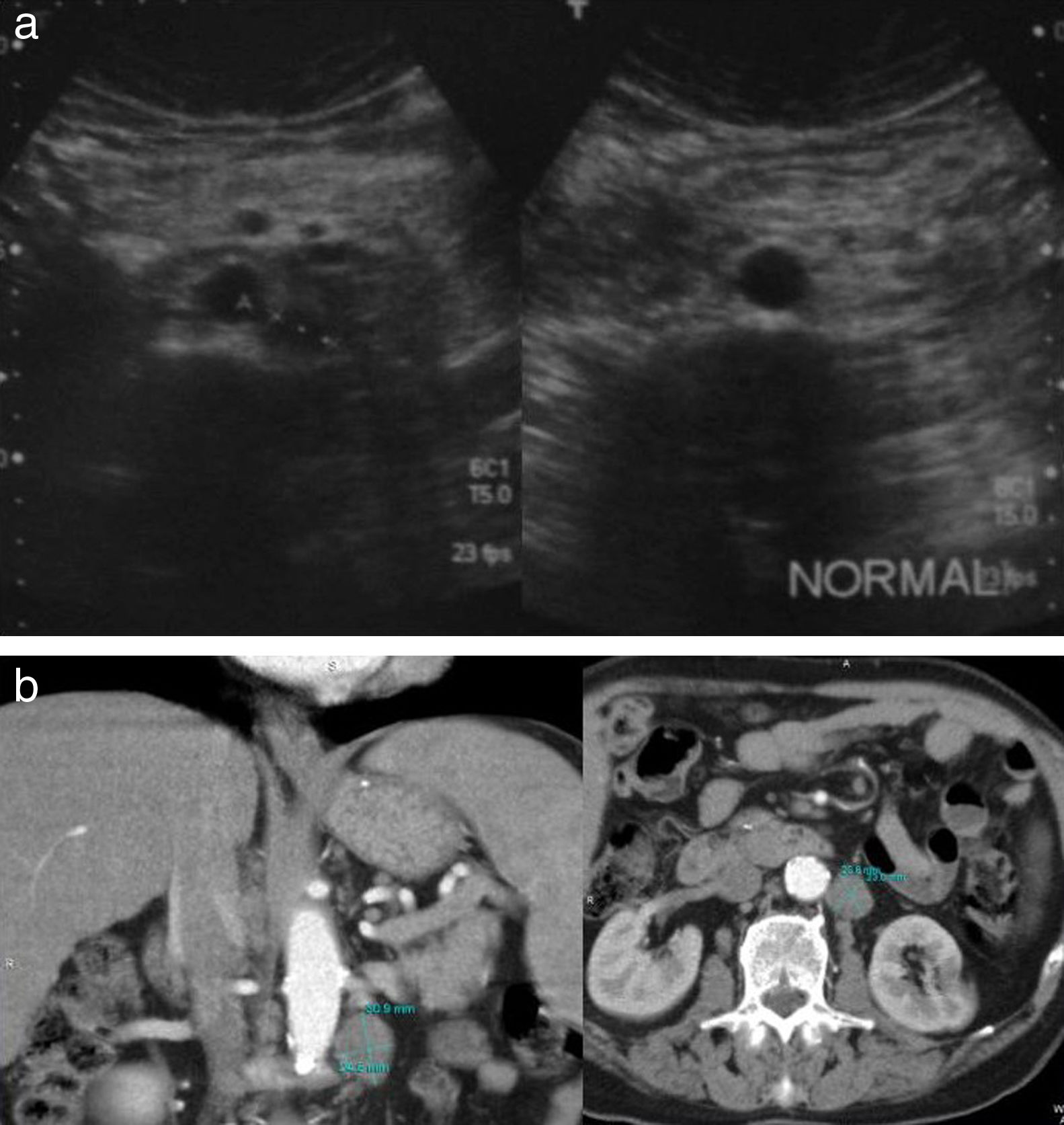
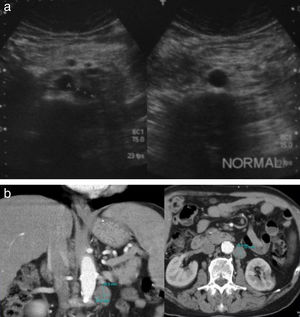
Si se analizan los verdaderos positivos, del total de 41 estudios con ecografía que diagnosticaron recidiva tumoral confirmada mediante TC abdominal, 31/41 fueron lesiones retroperitoneales y 10/41 recidiva en el hígado. Nueve de estos 10 pacientes con recidiva hepática también la tenían retroperitoneal (figs. 1 y 2).
A) Imagen obtenida por ecografía del retroperitoneo de 2 pacientes, uno con una masa patológica correspondiente con una adenopatía de una recaída tumoral y otro de un paciente sin adenopatías tumorales. B) TC abdominal de un paciente con recidiva, en reconstrucción coronal y axial, que muestra las adenopatías retroperitoneales.
Realizar estudios que comparen pruebas diagnósticas que no utilicen radiaciones ionizantes con la TC, con el objetivo de reducir la sobrecarga de radiación de los pacientes jóvenes oncológicos en seguimiento, está justificado. Existen en la literatura médica múltiples ejemplos en enfermedades tanto retroperitoneales como hepáticas y, además, en el caso concreto de la neoplasia germinal testicular, hay estudios que confirman la eficacia de la ecografía en la valoración de los pacientes sometidos a linfadenectomía, por lo que en nuestra opinión está justificado valorar esta prueba diagnóstica dentro de los protocolos de seguimiento25–31.
La ecografía abdominal permite seleccionar a individuos sanos. En nuestra serie, al poseer una alta sensibilidad (95%) con un alto VPN (98%), un paciente diagnosticado como sano mediante una ecografía abdominal negativa tiene una gran posibilidad de serlo. La baja razón de probabilidad negativa que posee nos permite afirmar que si la ecografía es negativa, con mucha probabilidad este negativo no proviene de un enfermo, ambos factores permiten a la ecografía descartar pacientes sanos. El valor del índice kappa supera el 0,8 sobre 1, indicativo de que existe un grado de acuerdo «muy bueno» entre las pruebas diagnósticas y excluye que los resultados se deban únicamente al azar.
Por otro lado, la ecografía abdominal, en nuestra serie, posee una alta especificidad (92%), aunque con un VPP (82%) no muy elevado, lo que parece demostrar que no es útil para asegurar que un paciente está realmente enfermo, ya que posee demasiados falsos positivos. Esto permite inferir que, de ser positiva, la ecografía abdominal debería confirmarse con otras pruebas que posean mayor especificidad, como la TC abdominal.
Los falsos positivos, casos diagnosticados por ecografía que no se han confirmado mediante la TC, se refieren al retroperitoneo. En 8 de los 9 el radiólogo evaluaba la ecografía como poco fiable, por lo que se puede concluir que la experiencia y la opinión del radiólogo es fundamental para reducir los falsos positivos y aumentar la especificidad y el VPP. Este dato no es problema en un protocolo de seguimiento, ya que ante una ecografía positiva se realizaría una TC abdominal que confirmaría o no la presencia de recidiva.
Es conocida la limitación de la ecografía en la valoración retroperitoneal, hallazgo que no se confirma en este trabajo, probablemente porque en la muestra predominaban los pacientes jóvenes y en buen estado clínico.
Se puede inferir, por lo tanto, que la ecografía abdominal permite, con un número muy bajo de falsos negativos, excluir la enfermedad, tanto en el retroperitoneo como en el hígado. Su aplicación clínica estaría justificada como valoración inicial en el seguimiento de una neoplasia testicular, de manera similar a como se utiliza en otros protocolos de imagen actuales como: valoración inicial del paciente traumatizado, valoración inicial de la enfermedad aguda abdominal, valoración inicial de la enfermedad urgente renal, seguimientos de enfermedades aterosclerótica y cardiaca y cribado en procesos obstétricos y ginecológicos32–36.
En nuestro caso, la ecografía se podría utilizar como prueba inicial diagnóstica de recidiva, asociada a la TC abdominal como prueba más específica para confirmar los hallazgos, tanto si existen datos patológicos como si la ecografía es a priori de baja calidad. La TC abdominal se podría pautar con mayor intervalo en el tiempo, por ejemplo reducir las exploraciones de TC abdominal a tres el primer año (al inicio, 6 y 12 meses), realizando ecografías intercaladas (meses 2, 4, 8 y 10). Esto permitiría realizar un menor número de pruebas con radiaciones ionizantes y disminuir el intervalo de seguimiento por la imagen a la mitad, con lo que se obtendría un beneficio para el paciente36–38.
Estos resultados y este protocolo se podría complementar con los marcadores tumorales que de encontrarse elevados podrían señalar un falso negativo e indicar la realización de una TC abdominal. Esta reflexión ya se encuentra incluida en otros protocolos de seguimiento de neoplasias, como en la neoplasia de mama, de cérvix uterino, ovárica o la enfermedad hepática tumoral, entre otras.
ConclusiónLa ecografía presenta una buena capacidad para descartar la presencia de enfermedad tanto en el hígado como en el retroperitoneo en pacientes con neoplasia testicular a los cuales se les realiza un seguimiento. Al incluirla en los protocolos de seguimiento se podría reducir la radiación acumulada en estos pacientes.
Autorías- 1.
Responsable de la integridad del estudio: EMQ.
- 2.
Concepción del estudio.
- 3.
Diseño del estudio: EMQ, EE, ALM.
- 4.
Obtención de los datos: EMQ, EE, SC, JRJ.
- 5.
Análisis e interpretación de los datos: AS.
- 6.
Tratamiento estadístico: EQM, ALM, AS, SC.
- 7.
Búsqueda bibliográfica.
- 8.
Redacción del trabajo: EMQ.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: JRJ.
- 10.
Aprobación de la versión final: EMQ, EE, ALM, AS, SC y JRJ.
Los autores declaran no tener ningún conflicto de intereses.