La regeneración ósea guiada con injertos de sustitutos de hueso aloplásticos ha tenido un gran impacto en la odontología quirúrgica de nuestros días. En el futuro, el ortodoncista se enfrentará de forma inevitable a pacientes con estos antecedentes médicos. Se llevó a cabo una revisión de la literatura médica para investigar los materiales que se emplean en la actualidad, sus indicaciones, y las dudas y problemas que se encuentran en el tratamiento interdisciplinario de pacientes con injertos óseos no autógenos.
Método y materialesSe realizó una búsqueda electrónica por palabras clave en las bases de datos de la literatura, PubMed de la US National Library of Medicine y la Cochrane Library (CENTRAL) de la Cochrane Collaboration. Se revisaron manualmente numerosas publicaciones, y para garantizar que la búsqueda fuera exhaustiva se revisaron también las listas de referencia de todos los artículos relacionados con el asunto. Los resúmenes de las publicaciones identificadas fueron revisados por partida doble por dos revisores independientes. Los criterios de inclusión fueron el uso de un injerto óseo no autógeno seguido por movimiento dentario ortodóncico o por erupción dentaria a través del material de injerto.
ResultadosEl número total de publicaciones identificadas fue 37. Estas pudieron dividirse en dos grandes temas, movimiento dentario ortodóncico sobre injertos óseos y erupción dentaria a través de injertos óseos. Las indicaciones para el injerto, además de las razones experimentales, habían sido defectos periodontales, lesiones quísticas, y hendiduras alveolares. Aquí, se emplearon diferentes tipos de injertos óseos. Los movimientos dentarios posteriores fueron poco complicados pero en ocasiones se acompañaron de serios efectos adversos. Los artículos resultantes presentaron un bajo nivel de evidencia y mostraron diversidad en la cuestión, la metodología, y el tipo de publicación. Por esta razón, no fue posible llevar a cabo una revisión con cuantificación. Debido a ello los artículos se van a discutir de forma descriptiva respecto a la materia en cuestión.
ConclusiónLos movimientos dentarios ortodóncicos así como la erupción dentaria a través de injertos óseos no solo son posibles sino que además podrían ofrecer resultados prometedores. Sin embargo, es necesario llevar a cabo más investigaciones sobre este tratamiento interdisciplinario para evitar riesgos y conseguir una mayor seguridad en el tratamiento ortodóncico de estos pacientes.
(Quintessence Int. 2010;41:665-72)
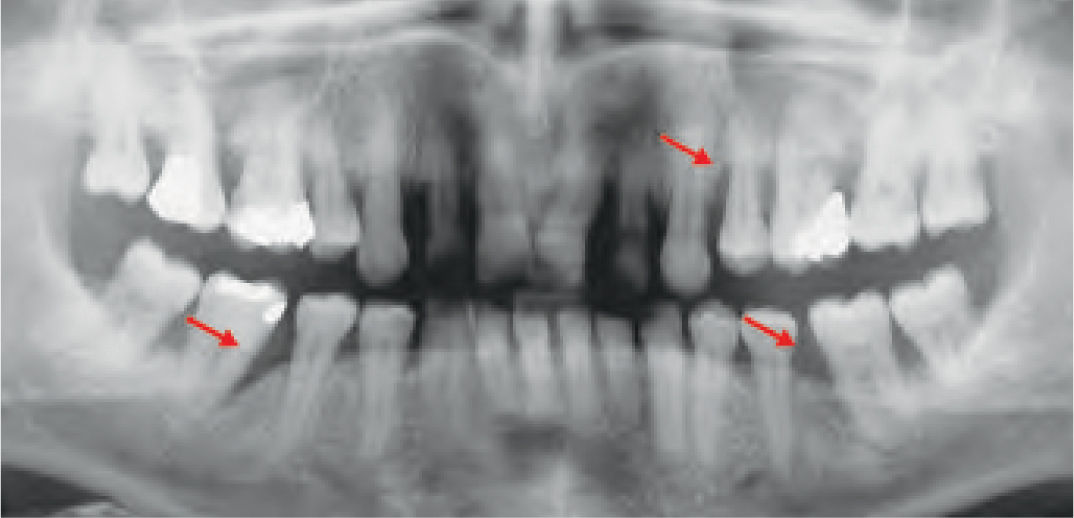
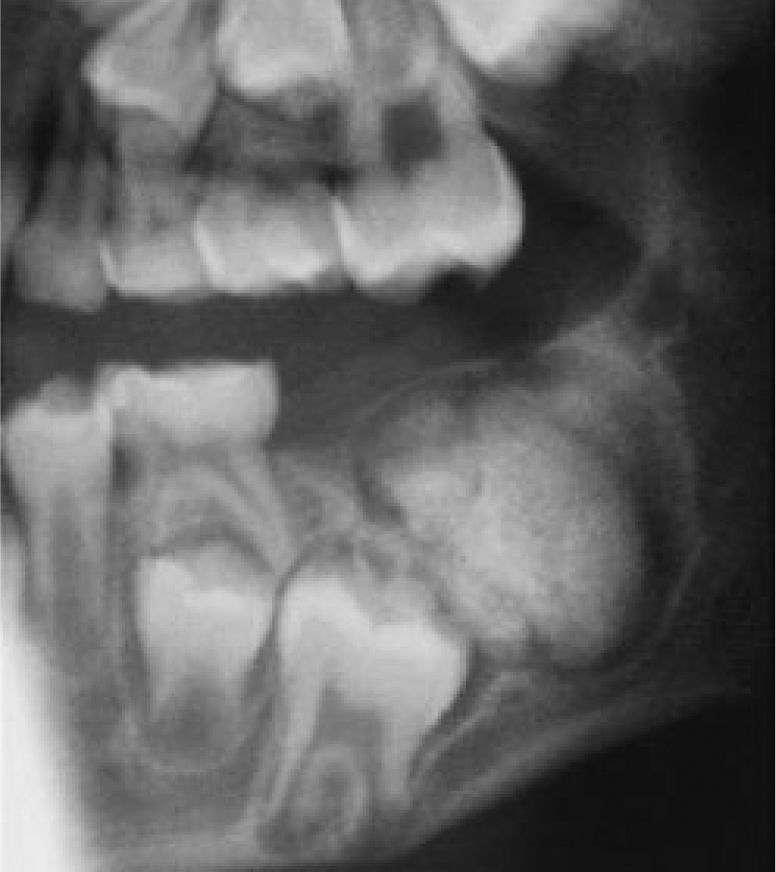
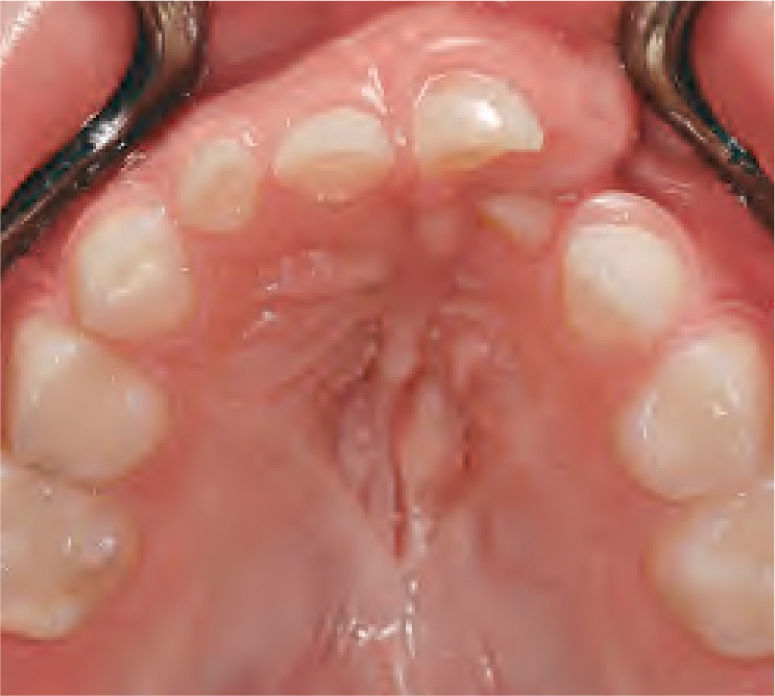
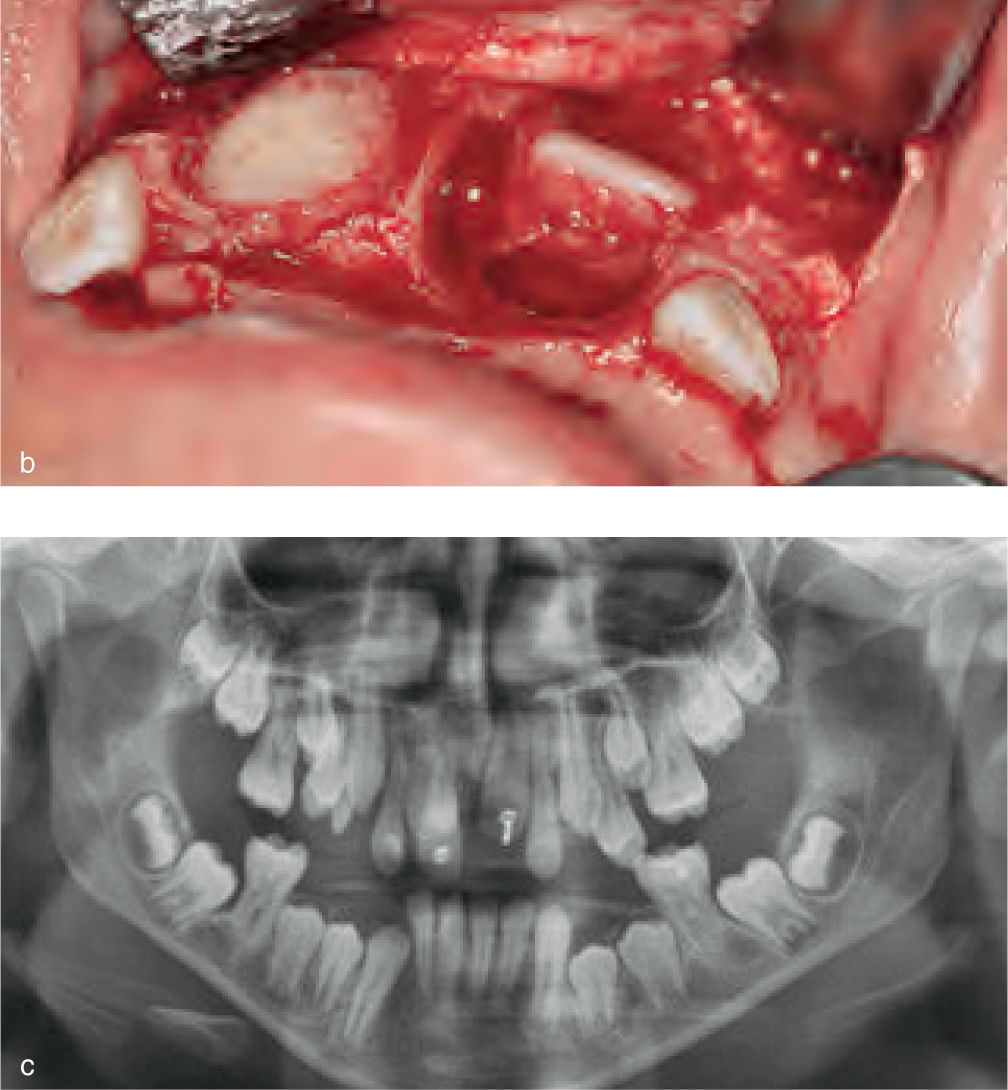
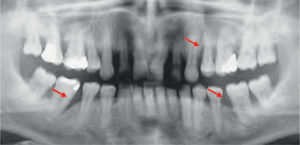
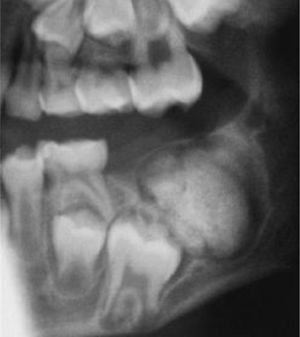
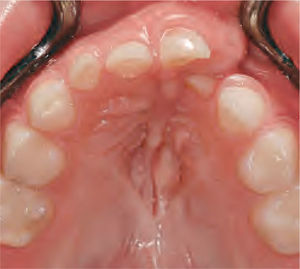
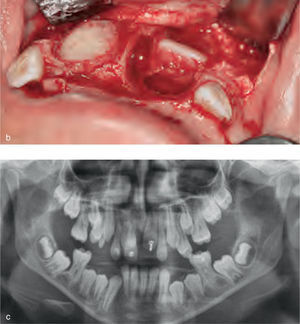
La reparación de las lesiones quísticas y de los defectos infraóseos debidos a fracaso periodontal son indicaciones comunes de la regeneración ósea guiada (ROG) (figs. 1 y 2). Los defectos óseos de las hendiduras alveolares normalmente son solucionados mediante cirugía maxilofacial con injertos óseos autógenos (fig. 3). Hasta la fecha, el material de elección en los injertos óseos ha sido el hueso autógeno en virtud de su biocompatibilidad, y de su capacidad osetoinductiva y osteoconductora1–4. Aunque el hueso autógeno es un material de injerto excelente, tiene ciertas limitaciones como la cirugía, el dolor y la morbilidad de la zona donante5.
Para evitar estos riesgos, se han ido desarrollando distintos sustitutos para injerto óseo de diferentes orígenes (alógrafos obtenidos a partir de la misma especie, xenógrafos obtenidos a partir de especies diferentes, y aloplásticos de origen sintético), diferentes propiedades de superficie, y diferentes composiciones químicas3,4.
En los últimos años, los xenógrafos y aloplásticos han alcanzado un papel crucial en la odontología quirúrgica.
Hoy en día, un alto porcentaje de los materiales xenógrafos empleados es hidroxiapatita de origen bovino. Perola procedencia puede ser también de corales, cerdos y otros orígenes. La mayoría de los injertos óseos aloplásticos se basan en compuestos de fosfato cálcico como la hidroxiapatita o el fosfato tricálcico (FTC), y en vidrio bioactivo (silicato: SIO2)2,3. Los desarrollos más recientes se han centrado en los «composites» con diferentes fases químicas que combinan varias de las características de los aloplásticos convencionales.
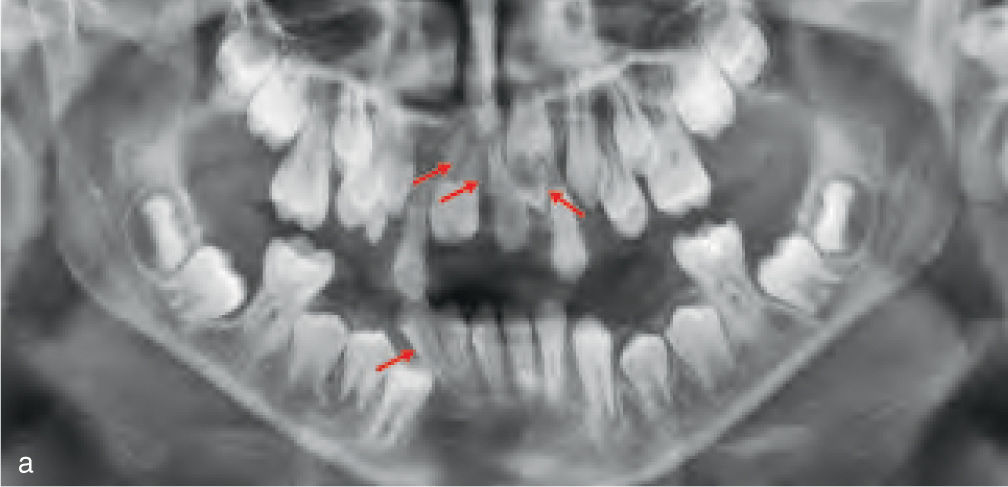
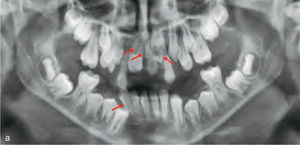
Teniendo en cuenta el impacto creciente de los injertos óseos en la odontología quirúrgica, los pacientes con antecedentes de injertos óseos no autógenos en su historia clínica van a pasar a formar parte en un fututo próximo de manera habitual de la práctica rutinaria en ortodoncia (fig. 4). Esto plantea algunas cuestiones como, hasta que punto es posible realizar movimientos dentarios en las zonas regeneradas. Por esta razón, se llevó a cabo una revisión de la literatura sobre el tema, para conocer los materiales empleados, las indicaciones y dudas actuales, y para identificar los posibles problemas de este tratamiento interdisciplinario.
Se realizó una búsqueda electrónica por palabras clave en las bases de datos de la literatura, PubMed de la US National Library of Medicine (www.pubmed.gov) y la Cochrane Library (CENTRAL) de la Cochrane Collaboration. La búsqueda en la literatura se realizó, mediante un ordenador personal, sobre los artículos publicados eninglés, francés, y alemán desde el 1 de enero de 1970, hasta el 1 de julio de 2009. Se incluyeron también los artículos disponibles online en forma electrónica antes de su publicación escrita (los denominados epub previos a la edición impresa). La revisión no se limitó por tipo de publicación o estudio.
La búsqueda electrónica se llevó a cabo aplicando los siguientes términos y palabras clave:
- •
«Orthodontics» AND «periodontology» OR «guided tissue regeneration» OR «guided bone regeneration » OR «bone graft» OR «augmentation» OR «bone cyst AND bone graft» OR «cleft AND bone graft» OR «cleft AND guided bone regeneration».
- •
«Tooth movement» AND «bone graft» OR «guided bone regeneration».
- •
«Tooth eruption» AND «bone graft» OR «guided bone regeneration».
Se revisaron numerosas revistas de manera manual hasta junio de 2009. American Journal of Orthodontics (1970-1986); American Journal of Orthodontics and Dentofacial Orthopedics (1987-2009); Revista Craneofacial de Paladar Hendido (1990-2009); International Journal of Oral and Maxillofacial Surgery (1987-2009); Interna-tional Journal of Periodontics and Restorative Dentistry (1981-2009); Journal of Oral and Maxillofacial Surgery (1982-2009); Journal of Orofacial Orthopedics/Fortschritte der Kieferorthpädie (1970-2009); Journal of Periodontology (1999-2009).
Otras fuentes de datosSe revisaron además las listas de referencias de todos los artículos identificados relacionados con el tema para garantizar que la búsqueda resultara exhaustiva. Así pues tratamos de buscar el número máximo posible de reuniones, talleres y tesis.
Criterios de inclusión y exclusión de los artículosEn la primera fase de selección, dos revisores independientes revisaron por duplicado los resúmenes de todas las publicaciones identificadas. Los criterios de inclusión fueron el empleo de injertos de hueso autógeno seguido de movimiento ortodóncico o erupción dentaria a través del material de injerto. Los criterios de exclusión fueron el uso de injertos de hueso autógeno, los movimientos dentario no activos y la erupción después del implante del material. En la segunda fase, se leyeron los céluartículos completos para determinar y garantizar la relevancia de su contenido.
Síntesis de datosLa síntesis de los datos recibidos debía aportar información sobre el diseño o tratamiento del experimento en la publicación, objetivo del tratamiento, duración del tratamiento, tiempo del movimiento dentario a través del injerto óseo, origen del injerto óseo, y efectos adversos.
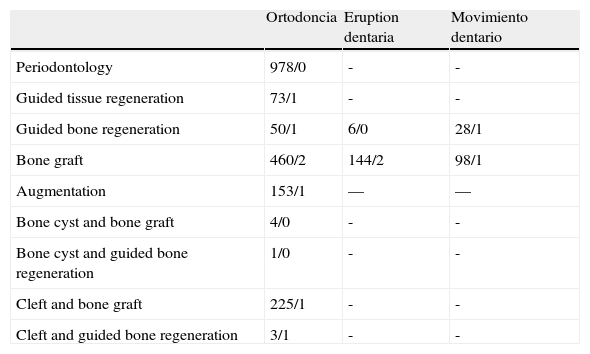
ResultadosEl número total de publicaciones identificadas en la búsqueda electrónica por palabras clave fue de 2.234. Los resultados se muestran en la tabla 1. La exclusión de los artículos repetidos y el análisis de los artículos recibidos de la búsqueda electrónica arrojaron un resultado de 34 publicaciones. El análisis de las referencias por búsqueda manual y otras fuentes de datos condujo a otras tres publicaciones, lo que ofreció un resultado total de 37. Estas se dividieron en dos temas principales: movimiento dentario ortodóncico sobre injerto óseo (n = 23) y erupción dentaria a través de injerto óseo (n = 14).
Número de artículos resultantes de la búsqueda electrónica en PubMed/Cochrane Library
| Ortodoncia | Eruption dentaria | Movimiento dentario | |
| Periodontology | 978/0 | - | - |
| Guided tissue regeneration | 73/1 | - | - |
| Guided bone regeneration | 50/1 | 6/0 | 28/1 |
| Bone graft | 460/2 | 144/2 | 98/1 |
| Augmentation | 153/1 | — | — |
| Bone cyst and bone graft | 4/0 | - | - |
| Bone cyst and guided bone regeneration | 1/0 | - | - |
| Cleft and bone graft | 225/1 | - | - |
| Cleft and guided bone regeneration | 3/1 | - | - |
Los artículos resultantes mostraron una gran diversidad en la cuestión, la metodología, y el tipo de publicación.
Los diferentes tipos de publicación fueron experimentos animales (n = 16), presentaciones de casos (n = 12), series de casos (n = 5), estudios retrospectivos (n = 1), y ensayos clínicos (n = 3).
Los artículos resultantes presentaron un bajo nivel deevidencia. Además de su pequeño tamaño y heterogeneidad, no permitieron realizar una revisión con cuantificación. Por esta razón, los resultados de las publicaciones identificadas se resumieron en forma de tabla en función del tipo de movimiento dentario (tablas 2 y 3).
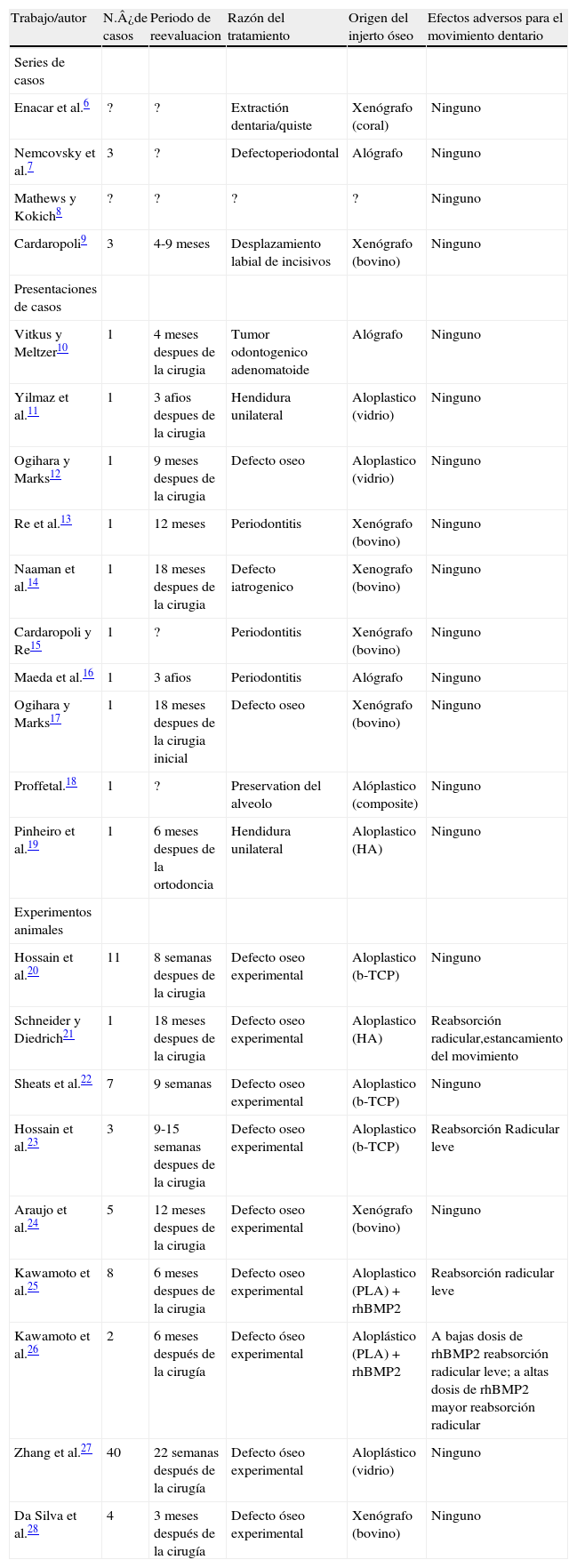
Detalles de las pubhcaciones relativas a movimientos dentarios ortodoncicos en injertos oseos
| Trabajo/autor | N.¿de casos | Periodo de reevaluacion | Razón del tratamiento | Origen del injerto óseo | Efectos adversos para el movimiento dentario |
| Series de casos | |||||
| Enacar et al.6 | ? | ? | Extractión dentaria/quiste | Xenógrafo (coral) | Ninguno |
| Nemcovsky et al.7 | 3 | ? | Defectoperiodontal | Alógrafo | Ninguno |
| Mathews y Kokich8 | ? | ? | ? | ? | Ninguno |
| Cardaropoli9 | 3 | 4-9 meses | Desplazamiento labial de incisivos | Xenógrafo (bovino) | Ninguno |
| Presentaciones de casos | |||||
| Vitkus y Meltzer10 | 1 | 4 meses despues de la cirugia | Tumor odontogenico adenomatoide | Alógrafo | Ninguno |
| Yilmaz et al.11 | 1 | 3 afios despues de la cirugia | Hendidura unilateral | Aloplastico (vidrio) | Ninguno |
| Ogihara y Marks12 | 1 | 9 meses despues de la cirugia | Defecto oseo | Aloplastico (vidrio) | Ninguno |
| Re et al.13 | 1 | 12 meses | Periodontitis | Xenógrafo (bovino) | Ninguno |
| Naaman et al.14 | 1 | 18 meses despues de la cirugia | Defecto iatrogenico | Xenografo (bovino) | Ninguno |
| Cardaropoli y Re15 | 1 | ? | Periodontitis | Xenógrafo (bovino) | Ninguno |
| Maeda et al.16 | 1 | 3 afios | Periodontitis | Alógrafo | Ninguno |
| Ogihara y Marks17 | 1 | 18 meses despues de la cirugia inicial | Defecto oseo | Xenógrafo (bovino) | Ninguno |
| Proffetal.18 | 1 | ? | Preservation del alveolo | Alóplastico (composite) | Ninguno |
| Pinheiro et al.19 | 1 | 6 meses despues de la ortodoncia | Hendidura unilateral | Aloplastico (HA) | Ninguno |
| Experimentos animales | |||||
| Hossain et al.20 | 11 | 8 semanas despues de la cirugia | Defecto oseo experimental | Aloplastico (b-TCP) | Ninguno |
| Schneider y Diedrich21 | 1 | 18 meses despues de la cirugia | Defecto oseo experimental | Aloplastico (HA) | Reabsorción radicular,estancamiento del movimiento |
| Sheats et al.22 | 7 | 9 semanas | Defecto oseo experimental | Aloplastico (b-TCP) | Ninguno |
| Hossain et al.23 | 3 | 9-15 semanas despues de la cirugia | Defecto oseo experimental | Aloplastico (b-TCP) | Reabsorción Radicular leve |
| Araujo et al.24 | 5 | 12 meses despues de la cirugia | Defecto oseo experimental | Xenógrafo (bovino) | Ninguno |
| Kawamoto et al.25 | 8 | 6 meses despues de la cirugia | Defecto oseo experimental | Aloplastico (PLA) + rhBMP2 | Reabsorción radicular leve |
| Kawamoto et al.26 | 2 | 6 meses después de la cirugía | Defecto óseo experimental | Aloplástico (PLA) + rhBMP2 | A bajas dosis de rhBMP2 reabsorción radicular leve; a altas dosis de rhBMP2 mayor reabsorción radicular |
| Zhang et al.27 | 40 | 22 semanas después de la cirugía | Defecto óseo experimental | Aloplástico (vidrio) | Ninguno |
| Da Silva et al.28 | 4 | 3 meses después de la cirugía | Defecto óseo experimental | Xenógrafo (bovino) | Ninguno |
HA: Hidroxiapatita; TCP: fosfato tricálcico; PLA: ácidos poliglicólicos.
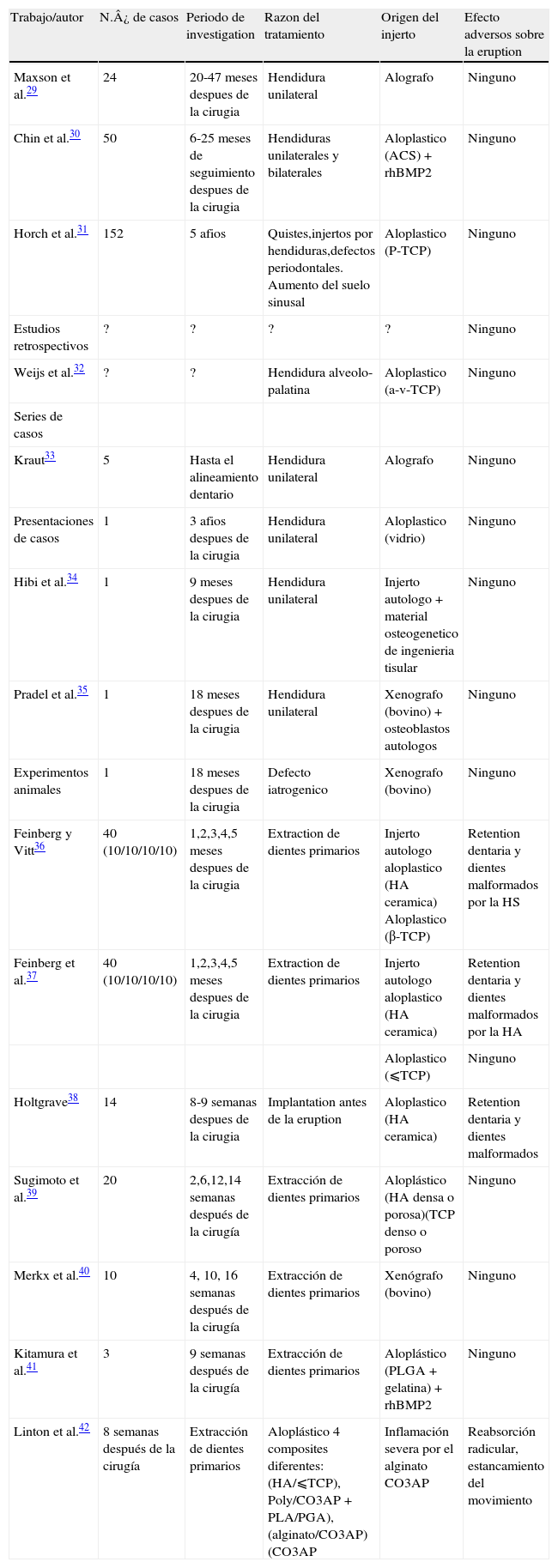
Detalles de las pubhcaciones relativas a erupcion dentaria a traves del injerto oseo
| Trabajo/autor | N.¿ de casos | Periodo de investigation | Razon del tratamiento | Origen del injerto | Efecto adversos sobre la eruption |
| Maxson et al.29 | 24 | 20-47 meses despues de la cirugia | Hendidura unilateral | Alografo | Ninguno |
| Chin et al.30 | 50 | 6-25 meses de seguimiento despues de la cirugia | Hendiduras unilaterales y bilaterales | Aloplastico (ACS) + rhBMP2 | Ninguno |
| Horch et al.31 | 152 | 5 afios | Quistes,injertos por hendiduras,defectos periodontales. Aumento del suelo sinusal | Aloplastico (P-TCP) | Ninguno |
| Estudios retrospectivos | ? | ? | ? | ? | Ninguno |
| Weijs et al.32 | ? | ? | Hendidura alveolo-palatina | Aloplastico (a-v-TCP) | Ninguno |
| Series de casos | |||||
| Kraut33 | 5 | Hasta el alineamiento dentario | Hendidura unilateral | Alografo | Ninguno |
| Presentaciones de casos | 1 | 3 afios despues de la cirugia | Hendidura unilateral | Aloplastico (vidrio) | Ninguno |
| Hibi et al.34 | 1 | 9 meses despues de la cirugia | Hendidura unilateral | Injerto autologo + material osteogenetico de ingenieria tisular | Ninguno |
| Pradel et al.35 | 1 | 18 meses despues de la cirugia | Hendidura unilateral | Xenografo (bovino) + osteoblastos autologos | Ninguno |
| Experimentos animales | 1 | 18 meses despues de la cirugia | Defecto iatrogenico | Xenografo (bovino) | Ninguno |
| Feinberg y Vitt36 | 40 (10/10/10/10) | 1,2,3,4,5 meses despues de la cirugia | Extraction de dientes primarios | Injerto autologo aloplastico (HA ceramica) Aloplastico (β-TCP) | Retention dentaria y dientes malformados por la HS |
| Feinberg et al.37 | 40 (10/10/10/10) | 1,2,3,4,5 meses despues de la cirugia | Extraction de dientes primarios | Injerto autologo aloplastico (HA ceramica) | Retention dentaria y dientes malformados por la HA |
| Aloplastico (⩽TCP) | Ninguno | ||||
| Holtgrave38 | 14 | 8-9 semanas despues de la cirugia | Implantation antes de la eruption | Aloplastico (HA ceramica) | Retention dentaria y dientes malformados |
| Sugimoto et al.39 | 20 | 2,6,12,14 semanas después de la cirugía | Extracción de dientes primarios | Aloplástico (HA densa o porosa)(TCP denso o poroso | Ninguno |
| Merkx et al.40 | 10 | 4, 10, 16 semanas después de la cirugía | Extracción de dientes primarios | Xenógrafo (bovino) | Ninguno |
| Kitamura et al.41 | 3 | 9 semanas después de la cirugía | Extracción de dientes primarios | Aloplástico (PLGA + gelatina) + rhBMP2 | Ninguno |
| Linton et al.42 | 8 semanas después de la cirugía | Extracción de dientes primarios | Aloplástico 4 composites diferentes: (HA/⩽TCP), Poly/CO3AP + PLA/PGA), (alginato/CO3AP) (CO3AP | Inflamación severa por el alginato CO3AP | Reabsorción radicular, estancamiento del movimiento |
ACS: esponja de colágeno acelular; TCP: fosfato tricálcico; HA: hidroxiapatita; PLGA: ácido polilacticocoglicólico; PLA: ácido poliláctico; PGA: ácidos poliglicólicos.
Las indicaciones y problemas por los que se habían realizado los injertos óseos antes de los movimientos ortodóncicos fueron, además de las razones experimentales, las hendiduras alveolares, la enfermedad periodontal, y otras lesiones óseas. A pesar de que los movimientos dentarios se ejecutaron sin problemas, se produjeron reabsorción radicular, inflamación, retención, y malformación.
A continuación se resumen y discuten las publicaciones de acuerdo con los materiales actualmente empleados, deuna manera descriptiva respecto al tema en cuestión.
AlógrafosLos alógrafos para injertos óseos fueron descritos por Maeda et al.16, Vitkus y Meltzer10, y Nemcosky et al.7 Aquí, los defectos periodontales y los tumores odontogénicos se trataron con este material. El movimiento dentario posterior a través de los injertos transcurrió sin complicaciones. Masón et al.29 y Kraut33 encontraron resultados similares en alografos. Los injertos óseos no influyeron en la erupción dentaria de forma negativa, consiguieron un hueso clínicamente normal, y aseguraron una erupción dentaria regular.
BiovidriosLa bioactividad de los biovidrios se refiere a su capacidad de activar una corriente de iones cuando los fluidos intersticiales entran en contacto con el injerto óseo. Esta corriente de iones produce un aumento del pH e induce el desarrollo de una capa de fosfato cálcico. La capa tiene el potencial de promover el establecimiento de céluartículos negatilas preosteoblásticas y el desarrollo de una matriz osteoblástica4, pero desafortunadamente, este mecanismo no siempre se observa in vivo. Dos presentaciones de casos y un estudio animal describían el uso de vidrio bioactivo seguido de movimiento dentario activo11,12,27 ninguno de ellas reseñaba un resultado negativo. No se ha descrito ninguna erupción dentaria a través de una región aumentada con biovidrios.
Fosfatos de calcioEl grupo de los fosfatos de calcio se divide en HA naturales o sintéticas, TCP, y composites que contienen principalmente fosfatos de calcio.
Una ventaja de las HA xenógenas es su elevado potencial osteoconductor43, sin embargo su procesamiento hace que se pierdan la mayor parte de los ingredientes orgánicos, lo que reduce su osteoinductividad7,44. En bastantes estudios y presentaciones de casos se han introducido movimientos dentarios ortodóncicos en regiones que habían sido aumentadas con HA xenógenas, con resultados alentadores9,13–15,17,24,28. En los cortes histológicos se demostraba una reabsorción completa del material después de los movimientos dentarios24,28. No aparecían signos de reabsorción radicular, y se documentaba clínica y radiologicamente una estabilidad a largo plazo del resultado9,24. En estos casos, parecía que las fuerzas or-todóncicas habían inducido una degradación activa del material. Por otro lado, Merkx et al.40 señalaron que la erupción dentaria no se veía influida por el material. Pero en los cortes histológicos el material no se reabsorbía ni integraba en el hueso alveolar sino que era empujado hacia los tejidos blandos y probablemente eliminado hacia la cavidad oral.
En un experimento animal, Schneider y Diedrich21 iniciaron el movimiento dentario en una región que había sido aumentada con HA cerámica. Aunque se puedo descartar la anquilosis del diente movido, se documentó una completa detención del movimiento dentario seguida de reabsorción radicular. Feinberg et al.37 y Holgrave38 reseñaron observaciones similares. Feinberg et al.37 reseñaron un marcado fracaso de la erupción y del desarrollo dentario con injertos de HA cerámica. Estos resultados coinciden con los de los experimentos de Holtgrave38, en los que también fracasó la erupción a través de HA cerámica.
En un ambiente natural, al contacto con el fluido intersticial, el α-TCP se convierte en HA, que es degradada a una tasa muy lenta. En cambio el β-TCP, se reabsorbe completamente y presenta unas características de degradación mejores que la HA o el β-TCP45,46. Todos los informes señalan que con el β-TCP es posible mover dientes dentro de las áreas injertadas20,22,23. Sin embargo, sigue existiendo controversia sobre el tema. Sheats et al.22 y Hossain et al.20 reseñaron que no había efectos negatilas denvos, pero un segundo estudio de Hossain et al.23 reseñó leves signos de reabsorción radicular en los β-TCP comparados con los controles.
Algunos estudios animales han comparado los patrones de erupción a través de diferentes injertos óseos36,37,39,42. En estos ensayos, primero se extraían dientes primarios en diferentes especies animales con dentición mixta. En segundo lugar, se implantaba el injerto óseo en el alveolo de extracción. En tercer lugar, se documentaba la erupción de los dientes permanentes. Feinberg y Vitt36, Feinberg et al.37 y Sugimoto et al.39 compararon la HA y el TCP. Feinberg et al.37 reseñaron que la erupción con TCP presentaba efectos adversos en comparación con los controles. Sugimoto et al.39 compararon HA y TCP densos y porosos. No reseñaron efectos adversos como fracaso de la erupción o del desarrollo dentario, ni con HA ni con TCP. Linton et al.42 probaron los efectos de diferentes injertos óseos de fosfato cálcico cerámico y composites sobre la erupción dentaria. Los materiales eran fosfato cálcico bifásico, carbonato apatita, polímero cubierto con carbonato apatita (polyCA), y alginato cubierto con apatita carbonato (algCA). Todos los injertos experimentales permitieron un desarrollo y erupción normales de los dientes permanentes, pero polyCA fue repelido hacia los tejidos blandos durante la erupción y algCA causó una severa inflamación. La experiencia de Linton y colaboradores con los injertos óseos de fosfato cálcico cerámico concuerda con las investigaciones clínicas de Horch et al.31 y Weijs et al.32 En estos estudios, se usó TCP como material de injerto. Aunque los trabajos no se centraron explícitamente en la erupción dentaria, los autores reseñaron que ésta se producía sin complicaciones.
El composite empleado en el caso presentado por Proff et al.18 era una matriz de HA nanocristalina altamente porosa embebida en un gel de sílice. Se especula que la matriz gel de dióxido de silicio es sustituida tras el implante por una matriz orgánica no estructurada y degradada después por células tipo osteoclastos en un espacio de tiempo muy corto47,48. Para este material, no se describieron efectos negativos.
OtrosSe empleó ácido poliláctico como relleno de defectos en dos estudios animales que evaluaban el movimiento denvos, detario activo25,26. En un estudio, si se permitía el movimiento dentario, pero en el otro se observó una ligera reabsorción radicular25. Otros aloplásticos empleados fueron la esponja de colágeno acelular o el ácido polilácticocoglicólico como vehículo de rhBMP230,41e injerto de hueso autólogo con material ostegenético obtenido por ingeniería tisular34. Tanto el estudio animal con ácido polilácticocoglicólico como los hallazgos en humanos con esponja de colágeno acelular como vehículo de la proteína Morfogenética de Hueso humano recombinante resultaron en un hueso clínicamente normal y aseguraron una erupción dentaria normal30,41. En el estudio de Hibi et al.34 que empleaba un injerto óseo autólogo enriquecido con material osteogenético obtenido por ingeniería tisular, el canino permanente en la zona de implante sufrió un proceso de erupción regular.
DiscusiónLa regeneración ósea guiada de los defectos óseos y la reparación de hendiduras alveolares representa un punto de intersección entre los injertos óseos y la ortodoncia8,46,49. Los quistes primordiales se detectan muchas veces de forma casual tras exploraciones radiológicas realizadas antes de los tratamientos de ortodoncia, y los injertos óseos de las hendiduras alveolares maxilares residuales se programan para que coincidan con la erupción de los dientes permanentes. En el futuro, los injertos de hueso no autólogo cobrarán un papel crucial en estos tratamientos. Hasta la fecha, el material de elección para injertos óseos ha sido el hueso autógeno, y la erupción dentaria a través del mismo se producía con normalidad46,50,51. Sin embargo, sus efectos adversos como la cirugía, dolor, morbilidad de la zona donante, disponibilidad limitada, y elevada capacidad de reabsorción5,52,53 hacen que sigan buscándose alternativas.
Los alógrafos presentan atributos similares a los injertos óseos autógenos 3,54. Los resultados de Masón et al.29 y Kraut33 con estos materiales mostraron resultados alentadores respecto al movimiento y erupción dentarias. Puede señalarse lo mismo con los xenógrafos empleados por otros investigadores9,24. Sin embargo el uso de materiales orgánicos implica un cierto riesgo de infecciones, como el virus de inmunodeficiencia humana55 (HIV) o los priones56.
Los biovidrios empleados en los artículos reseñados mostraron buenos resultados en los patrones de movimiento dentario. Sin embargo, sigue cuestionándose si este material es el injerto idóneo para estos planteamientos. Un estudio mostró una encapsulación de partículas en el tejido conectivo57. Estas partículas podrían haberse visto forzadas hacia los tejidos blandos durante el movimiento dentario. El empleo de materiales con formulas nuevas y características biológicas mejores sería la solución para este potencial peligro.
Los resultados de la HA son discutidos. Van desde una detención completa del movimiento dentario con serios efectos adversos en el tejido duro dental21,36–38 hasta patrones de movimiento sin complicaciones39,42. Esto podría explicarse por la heterogeneidad de los materiales disponibles. Aunque estos materiales resisten el colapso durante un largo periodo de tiempo (potencialmente muy útil para el plan de tratamiento ortodóncico de las hendiduras alveolares), su uso no puede recomendarse antes del movimiento dentario ortodóncico, porque existe riesgo de malformaciones dentales, reabsorción radicular y detención del movimiento dentario.
Los resultados del TCP son más prometedores. Este material ejerce un impacto positivo sobre la dimensión a largo plazo del reborde alveolar3,54. El material es biocompatible y biodegradable, y sus resultados sobre el movimiento dentario y la erupción dentaria fueron positivos31,36,37,39.
Desde nuestro punto de vista, los materiales más prometedores en el futuro serán algunos composites, con capacidad de reabsorción o biodegradación probadas, que combinan porque los aspectos positivos de los diferentes injertos óseos. En varios estudios animales y estudios histológicos, estos materiales han demostrado muy buenas características de degradación, con potencial de inducción de formación de hueso nuevo, y mantenimiento de un reborde alveolar con buena estabilidad48,58,59.
La discusión de estos temas plantea una interesante cuestión en ortodoncia: ¿cuándo se mueve un diente hacia una zona injertada sufre cambios morfológicos el ligamento periodontal?. En la mayoría de los estudios, la formación del ligamento periodontal no se vio afectada. Merkx et al.40 advirtieron «una estructura normal del ligamento periodontal». Holtgrave38 y Feinberg et al.37 reseñaron un desarrollo radicular normal, a pesar de que en su estudio no se logró producir la erupción dentaria a través del material. Araujo et al.24 demostraron un movimiento dentario activo en el área injertada. Describieron aspectos similares tanto en el lado injertado como en el control. En este caso no se encontró el material injertado (hidroxiapatita bovina) ni en el hueso ni en el ligamento periodontal. Da Silva et al.28 demostraron un movimiento intrusivo en el área injertada. Su observación sugirió una reacción normal del tejido al tratamiento ortodóncico, cuando se realizaba un tratamiento precoz de regeneración periodontal. Hossain et al.23 documentaron el detariopósito de cemento nuevo y la generación de hueso cerca del área de presión asociada a la biodegradación de los gránulos de TCP. Solo Schneider y Diedrich21 reseñaron en su observación la ausencia de un ligamento periodontal, además en su estudio no se pudo inducir el movimiento dentario. A este respecto, no existe una evidencia clara de si el ligamento periodontal sufre o no cambios morfológicos después de los movimientos a través de áreas injertadas por lo que este aspecto debería investigarse con mayor profundidad en el futuro.
ConclusiónDeterminados injertos óseos no autógenos permiten producir movimientos dentarios o erupción dentaria a través de ellos, sin embargo no debe recomendarse el empleo de HA para estos casos. No obstante, los resultados de la revisión de la literatura que hemos llevado a cabo conducen a la conclusión de que la aplicación de este tratamiento interdisciplinario exige la realización de un mayor número de estudios de alta calidad y evidencia probada sobre la materia. Desde nuestro punto de vista, no es posible ofrecer recomendaciones o normas generales sobre los materiales, momento del tratamiento, técnica de tratamiento, o pronóstico a largo plazo. Aunque existan enfoques muy alentadores sobre injertos óseos seguidos de ortodoncia, en el mejor de los casos ésta dificultaría la obtención de una buena morfología del reborde alveolar60 y la reducción de los defectos óseos60,61 y a veces contraindicaría los injertos. Pero sintetizando todos nuestros conocimientos sobre injertos óseos, creemos que la regeneración ósea guiada con injertos óseos no autólogos podría representar una opción adicional como pretratamiento, antes del movimiento dentario ortodóncico o de la erupción dentaria, en pacientes con defectos óseos. Constituiría una alternativa útil para reducir la cirugía en los injertos para hendiduras, evitar efectos adversos como las invaginaciones gingivales62 y ampliar las barreras ortodóncicas como la sínfisis mandibular63.