INTRODUCCIÓN
El trastorno depresivo mayor (TDM) es un factor de riesgo de suicidio consumado y, con frecuencia, los que lo consuman experimentan el proceso. No obstante, dicho trastorno y el suicidio tienen componentes hereditarios diferentes (Brent et al, 2005; Mann et al, 1999; Roy, 1983). Los pacientes con TDM e ideación suicida, conducta suicida o suicidio consumado familiar (a los que, por motivos de brevedad, puede hacerse referencia como suicidalidad familiar) pueden presentar o no características clínicas diferentes con una mayor gravedad del TDM o una mayor probabilidad de suicidio.
La suicidalidad es consecuencia de una combinación compleja y heterogénea de impulsividad, intolerancia del afecto negativo, baja tolerancia a la frustración, ideas disfuncionales estereotipadas y distorsiones cognitivas, consumo de sustancias y dolor psíquico intolerable, cada uno de los cuales no necesariamente forma parte del síndrome del TDM (Brent et al, 2002; Goodwin et al, 2004). La suicidalidad puede tener un componente hereditario independiente del diagnóstico psiquiátrico (Brent et al, 2004; Qin et al, 2002, 2003). Por ejemplo, se ha descrito su asociación con el gen de la triptofanohidroxilasa (Pooley et al, 2003) y el del factor neurotrófico derivado del cerebro (Dwivedi et al, 2002). La suicidalidad también se ha asociado con diferentes perfiles de neurotransmisores y receptores específicos (p. ej., Asberg, 1997; Correa et al, 2000).
Puesto que los médicos formulan preguntas a los pacientes sobre los antecedentes de suicidio en miembros de la familia como parte de las evaluaciones sistemáticas, sería importante evaluar si estos antecedentes son congruentes desde un punto de vista clínico. El objetivo de la presente investigación fue evaluar las implicaciones clínicas de la presencia de como mínimo un familiar en primer grado con antecedentes de suicidio consumado para pacientes ambulatorios con TDM no psicótico que participaban en el estudio del NIMH Sequenced Treatment Alternatives to Relieve Depression (STAR*D) (Fava et al, 2003; Rush et al, 2004).
MÉTODOS
Descripción y organización del estudio
El fundamento y el diseño del estudio STAR*D se han detallado en otra publicación (Fava et al, 2003; Lavori et al, 2001; Rush et al, 2004). Este estudio se diseñó para definir prospectivamente cuáles de diversos tratamientos son más eficaces para pacientes ambulatorios con TDM no psicótico que han presentado un resultado clínico insatisfactorio a un tratamiento inicial y, en caso necesario, a tratamientos ulteriores. Los individuos elegibles y que dieron su consentimiento para la inclusión en el STAR*D fueron tratados inicialmente con un inhibidor selectivo de la recaptación de serotonina (citalopram). Se podía incluir a los participantes que no obtuvieron la remisión de los síntomas en uno o más ensayos aleatorizados posteriores de fármacos o a tratamiento cognitivo. Los que obtuvieron una respuesta clínica adecuada podían entrar en la fase de seguimiento naturalista de 12 meses de duración.
La infraestructura del STAR*D incluyó el National Coordinating Center de Dallas, el Data Coordinating Center de Pittsburg y 14 centros regionales de los Estados Unidos. Cada centro regional revisó la implementación del protocolo en 2-4 centros clínicos identificados partiendo de la disponibilidad de pacientes ambulatorios con depresión, de médicos, ayuda administrativa y poblaciones minoritarias. Los lugares clínicos incluyeron 18 centros de atención primaria y 21 centros de asistencia psiquiátrica. Los coordinadores clínicos de la investigación (Clinical Research Coordinators [CRC]), localizados en los centros clínicos tenían formación y un diploma en la implementación de los procedimientos de tratamiento e investigación. Los CRC colaboraron estrechamente con los participantes y los médicos, administraron algunos de los instrumentos valorados por los médicos, garantizaron que se completaron todos los instrumentos autoevaluados y funcionaron como coordinadores del estudio. Los datos de los resultados de la investigación se obtuvieron a través de entrevistas telefónicas con evaluadores de los resultados de la investigación, enmascarados para el tratamiento y los centros donde se instauró, y a través de un sistema interactivo de respuesta a la voz por teléfono (Kobak et al, 1999).
Población del estudio
Entre julio de 2001 y abril de 2004, el estudio STAR*D reclutó a pacientes de 18 a 75 años de edad, que se declararon a sí mismos ambulatorios, se presentaron en las clínicas participantes y en los que el médico había establecido un diagnóstico de TDM no psicótico, aislado o recurrente mediante criterios del Diagnostic and Statistical Manual of Mental Disorders (DSM-IV) (American Psychiatric Association, 1994) que requería tratamiento. El estudio STAR*D reclutó a participantes con una puntuación > 14 (gravedad moderada) en la escala de Hamilton de valoración de la depresión de 17 ítems (HRSD17) (Hamilton, 1960), según lo valorado por los CRC, para garantizar la gravedad suficiente de los síntomas, de modo que durante el ensayo pudiera determinarse un cambio de los síntomas. Antes de obtener el consentimiento informado por escrito, se explicaron a los participantes potenciales todos los beneficios y riesgos posibles (incluidos los posibles acontecimientos adversos).
Los criterios de exclusión fueron un diagnóstico de trastorno bipolar o la presencia de síntomas psicóticos (durante la vida), un diagnóstico primario actual de trastorno obsesivo-compulsivo (TOC) o trastorno de la conducta alimentaria, riesgo de suicidio o consumo/dependencia de sustancias que requiriera tratamiento hospitalario, epilepsia o cualquier otro proceso que contraindicara las medicaciones usadas en los dos primeros niveles del estudio. Se permitieron todas las demás comorbilidades psiquiátricas y médicas. También se excluyó a las mujeres que estaban embarazadas, criaban a sus hijos al pecho o tenían planes de concebir en los 9 meses posteriores a la inclusión en el estudio, al igual que a los pacientes que no habían respondido (durante el episodio actual de depresión) a un ensayo de tratamiento adecuado de cualquiera de los utilizados en los dos primeros niveles del estudio. Los criterios de exclusión se mantuvieron en el mínimo posible para garantizar que en la práctica clínica los hallazgos serían generalizables a los ámbitos pertinentes.
Evaluaciones
Los CRC obtuvieron información demográfica de referencia y los antecedentes psiquiátricos declarados en el periodo basal y valoraron la gravedad de los síntomas depresivos de los participantes utilizando la HRSD17. En el periodo basal se obtuvo el cuestionario autoaplicado de cribado diagnóstico psiquiátrico (Psychiatric Diagnostic Screening Questionnaire [PDSQ]) (Zimmerman et al, 2001a,b) para evaluar la carga de comorbilidades psiquiátricas. En dicho periodo, los evaluadores de los resultados de la investigación utilizaron una entrevista por teléfono para administrar una segunda HRSD17 y el cuestionario de la sintomatología depresiva valorada por un médico, de 30 ítems (Inventory of Depressive Symptomatology [IDS-C30]) (Rush et al, 1996, 2000; Trivedi et al, 2004), un instrumento estudiado en profundidad, que utiliza ítems que no generan confusión para determinar tanto los síntomas diagnósticos del criterio básico como los síntomas asociados. En el IDS-C30, la ideación suicida se clasificó en una de cuatro categorías: a) no piensa en el suicidio y/o la muerte; b) considera que la vida no tiene sentido y no merece la pena vivirla; c) pensamientos de suicidio/muerte varias veces a la semana durante varios minutos, y d) pensamientos de suicidio/muerte varias veces al día en profundidad, o ha hecho planes específicos o ha intentado suicidarse.
Antecedentes familiares
Se solicitó a los participantes información relativa a los antecedentes psiquiátricos de su familia biológica inmediata (padres, hermanos, hermanastros y/o niños). Específicamente se les preguntó si en algún miembro de la familia se había establecido el diagnóstico de depresión, trastorno bipolar, alcoholismo o drogodependencia o había sido tratado para algunos de estos procesos. Los antecedentes familiares de trastorno del humor se registraron como positivos si el participante refirió que en al menos un familiar en primer grado se había establecido el diagnóstico de TDM o trastorno bipolar o había recibido tratamiento para el proceso. De forma parecida, los antecedentes familiares de drogodependencia se registraron como positivos si el participante refirió al menos un familiar en primer grado con alcoholismo o drogodependencia. Además, se preguntó a los participantes si un progenitor, hermano o hijo había consumado suicidio.
Análisis estadístico
Se presenta estadística descriptiva como porcentajes para las variables discontinuas y como medias ± desviación estándar para variables continuas. Para comparar la distribución de las características discontinuas entre participantes con y sin antecedentes familiares de suicidio, se utilizó el estadístico x2. Las comparaciones de las características continuas por los antecedentes familiares se completaron utilizando una prueba de la t de Student. Un valor de p < 0,05 indicó una asociación estadísticamente significativa. No se efectuaron ajustes de los valores de p para comparaciones múltiples, de modo que los resultados han de interpretarse en consecuencia.
RESULTADOS
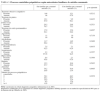
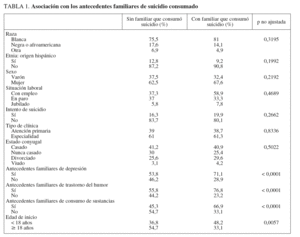
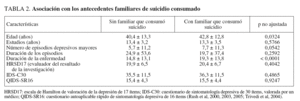
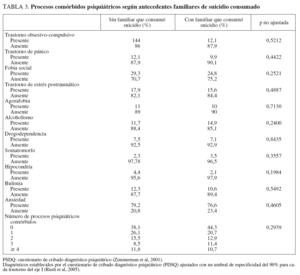
De los 4.041 pacientes reclutados en el estudio STAR*D, en 4.001 se identificaron antecedentes familiares evaluables de datos sobre suicidio. De estos 4.001 pacientes, 142 (3,5%) refirieron que un familiar había consumado suicidio. En participantes con TDM y antecedentes familiares de suicidio fueron más probables los antecedentes familiares de depresión, trastorno bipolar o cualquier trastorno del humor o drogodependencia familiar, y una edad de inicio del TDM antes de los 18 años con un tiempo más prolongado desde el inicio de la enfermedad (tabla 1). De los 142 con antecedentes familiares de suicidio, 34/142 (23,9%) tenían antecedentes familiares de trastorno bipolar, comparado con 316/3.851 (8,2%) de aquellos sin antecedentes familiares de suicidio (p = 0,0001). Ninguna otra variable demográfica o clínica diferenció a ambos grupos (tabla 2). No se identificaron diferencias en la tasa de antecedentes de intentos de suicidio entre grupos (el 16,3% sin antecedentes familiares de suicidio, el 19,9% con antecedentes familiares de suicidio; p = 0,27). En aquellos con dichos antecedentes fue más probable que manifestaran una visión pesimista del futuro (el 87,8 y el 76,5%; p = 0,0027), pero ningún otro síntoma depresivo difirió significativamente entre grupos, incluida la disminución del placer y la presencia de ideación suicida. No se identificaron diferencias en los síntomas de los procesos psiquiátricos comórbidos (tabla 3).
DISCUSIÓN
En esta cohorte a gran escala de pacientes ambulatorios que solicitaron tratamiento, menos del 4% refirió que un familiar en primer grado consumó suicidio. Entre los que lo refirieron fue más probable identificar antecedentes familiares de trastorno del humor y drogodependencia, una visión pesimista del futuro y una edad precoz de inicio. De especial mención resulta que los antecedentes familiares de suicidio tuvieron una fuerte relación con los de trastorno bipolar. No se encontraron otras diferencias significativas. En conjunto, el suicidio familiar no pareció diferenciar a un subgrupo específico de TDM por la evaluación transversal.
Los estudios previos que han examinado la relación entre suicidio familiar y trastorno depresivo mayor han prestado atención a los aspectos divergentes, tal como los pacientes con trastornos del humor que han hecho intentos de suicidio (Brent et al, 2002, 2004) y la predicción de suicidio en miembros de la familia de los que lo consumaron (Runeson et al, 2003). Aunque los estudios publicados revelan constantemente que la agresividad impulsiva y los abusos sexuales se asocian con el suicidio familiar, en ninguno se han examinado los síntomas específicos y los trastornos psiquiátricos comórbidos en individuos con TDM. En el presente estudio, encontramos que entre los pacientes con TDM que refirieron suicidio consumado en un familiar en primer grado sólo un número muy reducido de características difirió de las de aquellos sin antecedentes familiares de suicidio.
El presente estudio adolece de algunas limitaciones. Se preguntó a los pacientes por familiares en primer grado que hubieran consumado suicidio, pero no por casos de intentos de suicidio. No se obtuvo dicha información ni tampoco sobre la edad de los probandos cuando el familiar falleció. Además, las evaluaciones del estudio STAR*D se limitaron a las necesarias para deter minar el diagnóstico y la respuesta al tratamiento y no incluyeron una variedad más amplia de medidas psicológicas que podrían necesitarse para caracterizar plenamente la naturaleza de la huella psicológica infligida por el suicidio de un familiar. Los estudios futuros podrían prestar atención a estas otras secuelas potenciales del suicidio de un familiar. En el periodo basal se excluyó a los pacientes si corrían un riesgo inminente de suicidio, no se pudo tratarlos como pacientes ambulatorios o requirieron hospitalización inmediata. Aunque los antecedentes familiares de suicidio consumado no identi-ficaron grupos diferentes en el período basal, los análisis posteriores de la serie de datos del STAR*D pueden determinar si estos antecedentes predicen el curso de la enfermedad.
En resumen, los antecedentes familiares de suicidio consumado se asociaron con antecedentes familiares de trastorno del humor, en particular trastorno bipolar, y algunas diferencias clínicas transversales. En conjunto, los pacientes con trastorno depresivo mayor con estos antecedentes fueron más similares que diferentes en el periodo basal respecto a aquellos sin antecedentes familiares de suicidio consumado.
AGRADECIMIENTOS
Deseamos expresar nuestro agradecimiento por la ayuda editorial a Jon Kilner, MS, MA, y la ayuda de secretaría de la Fast Word Information Processing Inc. (Dallas, Estados Unidos).
BIBLIOGRAFÍA GENERAL
Asberg M. Neurotransmitters and suicidal behavior. The evidence from cerebrospinal fluid studies. Ann N Y Acad Sci. 1997;29:158-81.
Brent DA, Mann JJ. Family genetic studies, suicide, and suicidal behavior. Am J Med Genet C Semin Med Genet. 2005;133C:13-24.
Brent DA, Oquendo M, Birmaher B, Greenhill L, Kolko D, Stanley B. Familial transmission of mood disorders: convergence and divergence with transmission of suicidal behavior. J Am Acad Child Psych. 2004;43:1259-66.
Brent DA, Oquendo M, Birmaher B. Greenhill L, Kolko D, et al. Familial pathways to early-onset suicide attempt: risk for suicidal behavior in offspring of mood-disordered suicide attempters. Arch Gen Psychiatry. 2002;59:801-7.
Correa H, Duval F, Mokrani M, Bailey P, Tremeau F, Staner L. Prolactin response to D-Fenfluramine in major depressed patients. Psychiatry Res. 2000;93:189-99.
Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition (DSM-IV). Washington: American Psychiatric Association; 1994.
Dwivedi Y, Rizavi HS, Conley RR, Roberts RC, Tamminga CA, Pandey GN. MRNA expression of brain-derived nerve growth factor (BDNF) in prefrontal cortex of suicide victim. Biol Psychiatry. 2002;51:S176.
Fava M, Rush AJ, Trivedi MH, Nierenberg AA, Thase ME, Sackeim HA. Background and rationale for the sequenced treatment alternatives to relieve depression (STAR*D) study. Psychiatr Clin North Am. 2003;26:457-94.
Goodwin RD, Beautrais AL, Fergusson DM. Familial transmission of suicidal ideation and suicide attempts: evidence from a general population sample. Psychiatry Res. 2004;126:159-65.
Hamilton M. A rating scale for depression. J Neurol Neurosurg Psychiatry. 1960;23:56-62.
Hawton K, Haw C, Houston K, Townsend E. Family history of suicidal behavior: prevalence and significance in deliberate selfharm patients. Acta Psychiatr Scand. 2002;106:387-93.
Kobak KA, Greist JH, Jefferson JW, Mundt JC, Katzelnick DJ. Computerized assessment of depression and anxiety over the telephone using InteractiveVoice Response. MDComput. 1999;16:63-8.
Lavori PW, Rush AJ, Wisniewski SR, Alpert J, Fava M, Kupfer DJ, et al. Strengthening clinical effectiveness trials: equipoise-stratified randomization. Biol Psychiatry. 2001;50:792-801.
Mann JJ, Waternaux C, Hass GL, Malone KM. Toward a clinical model of suicidal behavior in psychiatric patients. Am J Psychiatry. 1999;156:181-9.
Pooley EC, Houston K, Hawton K, Harrison PJ. Deliberate self-harm is associated with allelic variation in the tryptophan hydroxylase gene (TPH A779C), but not with polymorphisms in five other serotonergic genes. Psychol Med. 2003;33:775-83.
Qin P, Agerbo E, Mortensen PB. Suicide risk in relation to family history of completed suicide and psychiatric disorders: a nested case-control study based on longitudinal registers. Lancet. 2002;360:1126-30.
Qin P, Agerbo E, Mortensen PB. Suicide risk in relation to socioeconomic, demographic, psychiatric, and familial factors: a national register-based study of all suicides in Denmark, 1981-1997. Am J Psychiatry. 2003;160:765-72.
Roy A. Family history of suicide. Arch Gen Psychiatry. 1983;40:971-4.
Runeson B, Asberg M. Family history of suicide among suicide victims. Am J Psychiatry. 2003;160:1525-6.
Rush AJ, Bernstein IH, Trivedi MH, Carmody TJ, Wisniewski S, Mundt JC, et al. An evaluation of the quick inventory of depressive symptomatology and the Hamilton rating scale for depression: a STAR*D report. Biol Psychiatry. 2005;59:493-501.
Rush AJ, Carmody TJ, Reimitz PE. The inventory of depressive symptomatology (IDS): clinician (IDS-C) and selfreport (IDS-SR) ratings of depressive symptoms. Int J Methods Psychiatr Res. 2000;9:45-59.
Rush AJ, Fava M, Wisniewski SR, Lavori PW, Trivedi MH, Sackeim HA, et al. Sequenced treatment alternatives to relieve depression (STAR*D): rationale and design. Control Clin Trials. 2004;25:119-42.
Rush AJ, Gullion CM, Basco MR, Jarrett RB, Trivedi MH. The inventory of depressive symptomatology (IDS): psychometric properties. Psychol Med. 1996;26:477-86.
Rush AJ, Trivedi MH, Ibrahim HM, Carmody TJ, Arnow B, Klein DN, et al. The 16-item quick inventory of depressive symptomatology (QIDS), clinician rating (QIDS-C), and self-report (QIDS-SR): a psychometric evaluation in patients with chronic major depression. Biol Psychiatry. 2003;54:573-83.
Rush AJ, Zimmerman M, Wisniewski SR, Fava M, Hollon SD, Warden D, et al. Comorbid psychiatric disorders in depressed outpatients: demographic and clinical features. J Affect Disord. 2005;87:43-55.
Trivedi MH, Rush AJ, Ibrahim HM, Carmody TJ, Biggs MM, Suppes T, et al. The inventory of depressive symptomatology, clinician rating (IDS-C) and selfreport (IDS-SR), and the quick inventory of depressive symptomatology, clinician rating (QIDS-C) and self-report (QIDS-SR) in public sector patients with mood disorders: a psychometric evaluation. Psychol Med. 2004;34:73-82.
Zimmerman M, Mattia JI. A self-report scale to help make psychiatric diagnoses: the psychiatric diagnostic screening questionnaire. Arch Gen Psychiatry. 2001;58:787-94.
Zimmerman M, Mattia JI. The psychiatric diagnostic screening questionnaire: development, reliability and validity. Compr Psychiatry. 2001;42:175-89.
Este proyecto se ha financiado con ayudas federales del National Institute of Mental Health, National Institutes of Health, con el contrato N01MH90003 al UT Southwestern Medical Center en Dallas (P.I.: AJ Rush).
Conflictos de intereses: Ninguno declarado.
Declaraciones financieras: El Dr. Nierenberg ha trabajado como asesor científico de Eli Lilly & Company, Genaissance, GlaxoSmithKline, Innapharma, Novartis, Sepracor, y Shire, y ha recibido ayuda de investigación de Bristol-Myers Squibb Company, Cederroth, Cyberonics, Inc., Forest Pharmaceuticals Inc., Janssen Pharmaceutica, Lichtwer Pharma, y Pfizer Inc. El Dr. Nierenberg ha recibido tanto ayuda de investigación como honorarios de Eli Lilly & Company, GlaxoSmithKline, y Wyeth-Ayerst Laboratories. El Dr. Alpert ha recibido ayuda de investigación de Aspect Medical Systems, AstraZeneca, Bristol-Myers Squibb Company, Cephalon, Eli Lilly & Company, Forest Pharmaceuticals Inc., GlaxoSmithKline, J & J Pharmaceuticals, Novartis, Organon Inc., Pharmavite, Pfizer Inc, Roche, Sanofi/Synthelabo, Solvay Pharmaceuticals, Inc., y Wyeth-Ayerst Laboratories. El Dr. Gaynes no ha declarado intereses financieros. La Dra. Warden posee acciones de Pfizer Inc. y opciones de compra de acciones de Bristol-Myers Squibb Company. El Dr. Wisniewski no ha declarado intereses financieros. La Dra. Biggs ha recibido honorarios por su trabajo como asesora de Bristol-Myers Squibb Company, Eli Lilly & Company, GlaxoSmithKline, Merck Co. Inc., y Pfizer Inc. El Dr. Trivedi ha proporcionado asesoría científica o ha trabajado en el comité de asesores de Bristol-Myers Squibb Company, Cyberonics Inc., Eli Lilly & Company, Forest Pharmaceuticals, Johnson & Johnson, Pfizer, Inc., Sepracor, y Wyeth-Ayerst Laboratories. Ha trabajado como conferenciante para Bristol-Myers Squibb Company, Cyberonics, Inc., Eli Lilly & Company, Forest Pharmaceuticals, y Wyeth-Ayerst Laboratories. Ha recibido ayudas de investigación de Bristol-Myers Squibb Company, Cephalon, Inc., Corcept Therapeutics, Inc., Eli Lilly & Company, Janssen Pharmaceutica, Pfizer Inc., Predix Pharmaceuticals, y Wyeth-Ayerst Laboratories. La Dra. Barkin no ha declarado intereses financieros. El Dr. Rush ha trabajado como asesor científico o en el comité de asesores de Advanced Neuronetic Systems, Inc., Bristol-Myers Squibb Company, Cyberonics Inc., Eli Lilly & Company, Forest Pharmaceuticals Inc., GlaxoSmithKline, Health Technology Systems, Merck Co. Inc., Neuronetics, Organon Inc., y Wyeth-Ayerst Laboratories Inc. Ha recibido derechos de autor de Guilford Press and Health Technology Systems. Ha trabajado como conferenciante para Cyberonics, Inc., Forest Pharmaceuticals Inc., GlaxoSmithKline, y Merck Co. Inc.
Previamente publicado en J Affect Disord. 2008;108:129-34.