INTRODUCCIÓN
La necesidad de un tratamiento anticoagulante eficaz e indefinido en las portadoras de prótesis mecánicas es incuestionable.
El nivel óptimo de anticoagulación varía en función del riesgo tromboembólico de cada paciente, del tipo de prótesis y de la calidad en el seguimiento de la paciente. En la actualidad la terapia anticoagulante en el primer trimestre sigue siendo muy controvertida; el riesgo trombótico de la terapia con heparinas se enfrenta al riesgo de embriopatía cumarínica en las pacientes tratadas con anticoagulantes orales (ACO).
CASO CLÍNICO
Paciente de 32 años de edad, gestante de 35 semanas, que ingresa en nuestro centro vía urgencias por una metrorragia del tercer trimestre.
Antecedentes personales
-- Sin reacciones alérgicas medicamentosas conocidas.
-- Portadora de doble prótesis valvular mecánica, aórtica (ST Jude n.o 21) y mitral (ST Jude n.o 25) desde el 18 de febrero de 2004, tras un diagnóstico de estenosis mitral moderada e insuficiencia aórtica moderada-grave de etiología reumática.
-- Sigue tratamiento habitual con acenocumarol.
-- Cociente internacional normalizado (internacional normalizad ratio [INR]) entre 2,5 y 3,5.
Antecedentes ginecoobstétricos
-- Menarquia a los 11 años; ciclo menstrual 5/28.
-- Parto por cesárea en 1999 por no progresión de parto, del que nació un varón vivo de 3.600 g.
-- Puerperio afebril.
-- Lactancia materna.
Embarazo actual
Se realizó un control gestacional en las consultas de embarazo de alto riesgo de nuestro hospital desde la sexta semana en colaboración con el servicio de hematología y de cardiología.
Durante la gestación se realizaron 5 controles ecográficos con biometría acorde en todo momento con la edad gestacional, sin evidenciarse alteraciones morfológicas en el feto. Serología infecciosa normal. Grupo sanguíneo 0 negativo (inmunoprofilaxis anti-D a las 28 semanas). Control analítico trimestral normal.
Tratamiento durante la gestación
-- La paciente fue tratada con enoxaparina 40 mg/12 h s.c. desde la sexta semana hasta la semana 23, momento en que se cambió a tratamiento con acenocumarol en dosis necesarias para mantener el INR entre 2,5 y 3,5 (32 mg por semana).
-- Ácido fólico y vitamina B12.
-- Doxilamina succinato (Caribán®) en el primer trimestre.
-- Control cardiológico a las 6, 20 y 30 semanas, en que se comprobó la normofuncionalidad ventricular y valvular.
Ingreso en nuestro centro
La paciente acude al servicio de urgencias por presentar metrorragia y dolor hipogástrico a las 34 + 6 semanas, desde donde se procedió a su ingreso. En este momento continúa en tratamiento con Sintrom®. Toma la última dosis ya ingresada siguiendo su tratamiento habitual pautado por cardiología, en contra de las recomendaciones de los médicos de planta.
Al ingreso se realiza un registro cardiotocográfico externo (RCTE) en el que se constata una dinámica uterina regular e intensa, sin modificación cervical. La analítica revela un INR de 2,8. Previa consulta con el servicio de hematología, se decide repetir la analítica a las 5 h para valorar la necesidad de anticoagulación con heparina, obteniéndose un INR de 3,8.
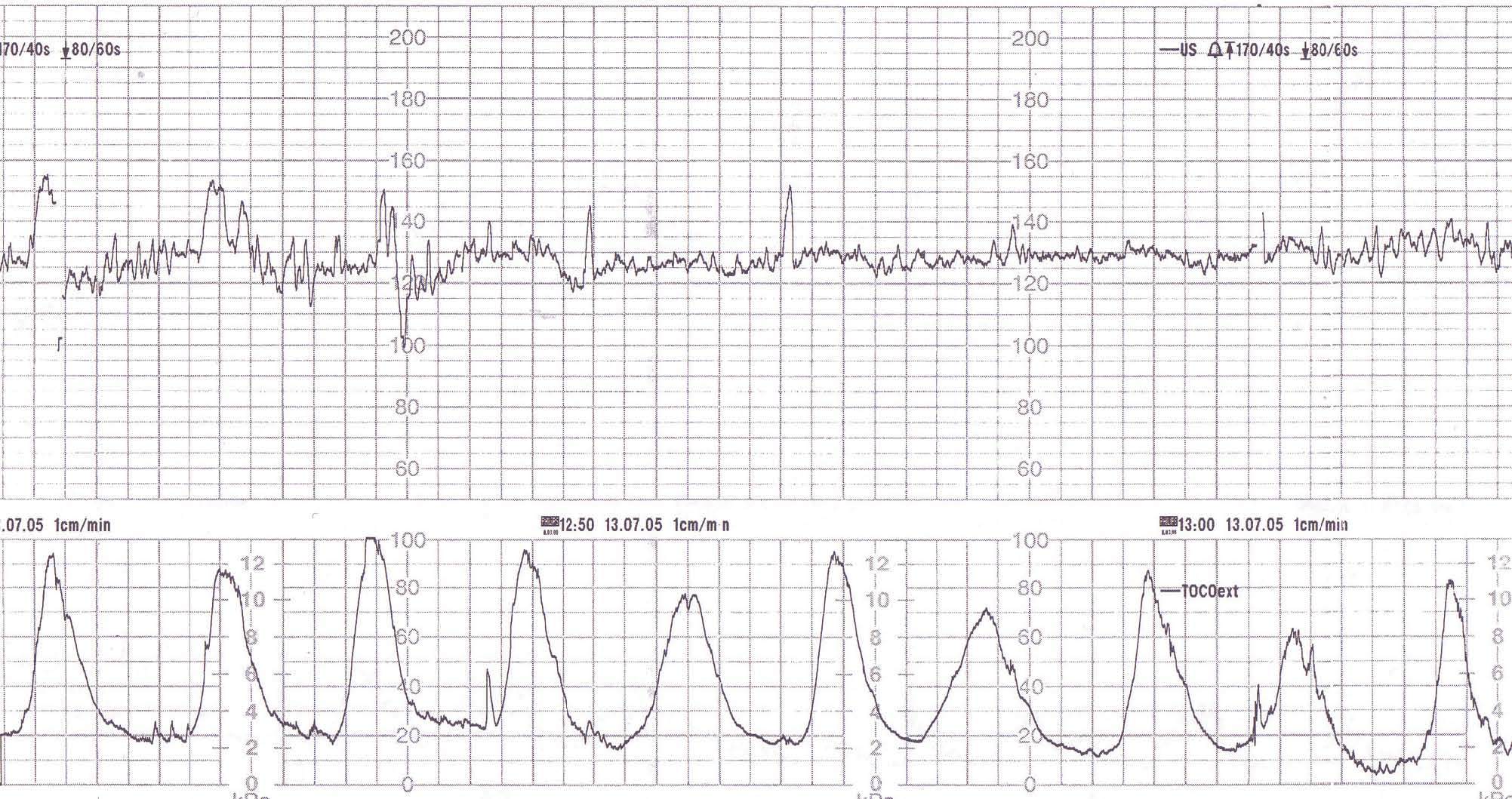
Ante la dinámica uterina persistente de gran intensidad (fig. 1) sin modificación cervical, y dado el antecedente de una cesárea anterior y el elevado riesgo de rotura uterina, se decide iniciar un ciclo de tocólisis con atosibán (Tractocile®) con el objetivo de ganar tiempo para la normalización del INR.
Figura 1.Registro cardiotocográfico al ingreso.
Tras 8 h de intento de tocólisis fallida, y dada la sintomatología de intenso dolor hipogástrico, se sospecha una dehiscencia de histerotomía, por lo que se acuerda finalizar la gestación mediante cesárea. Ante la persistencia de un INR de 3,2, superior a los valores de seguridad requeridos para la intervención quirúrgica en conjunto con el servicio de anestesiología y hematología, se administran 360 kU de NovoSeven® (factor VII recombinante), con lo que el INR disminuyó a 0,8.
Se practica una cesárea al día siguiente según la técnica de Misgav-Ladach modificada, con anestesia general y profilaxis de endocarditis infecciosa (ampicilina 2 g i.v. + gentamicina 120 mg), sin que se presentaran incidencias. El sangrado está dentro de los límites normales. Curso del postoperatorio hemodinámicamente estable.
A las 6 h de la intervención se reinicia el tratamiento con heparina sódica 24.000 U/24 h. Un día después se mantiene la perfusión de heparina sódica y se inicia Sintrom® 2 mg/24 h. La paciente recibió este tratamiento combinado durante los 3 días siguientes.
Durante la estancia en planta, la paciente desarrolla un hematoma de la pared abdominal que requiere la suspensión temporal de Sintrom® y la necesidad de tratamiento con Amchafibrin® (ácido tranexámico) y concentrados de plasma.
Posteriormente, la evolución fue favorable.
Al alta, el tratamiento anticoagulante queda a cargo del servicio de hematología y cardiología.
COMENTARIOS
Nivel óptimo de anticoagulación
Factores de riesgo ligados a la paciente1
Fibrilación auricular (el más importante), localización mitral de la prótesis, dilatación auricular izquierda, antecedentes tromboembólicos, disfunción ventricular izquierda, edad, hipertensión arterial, tabaquismo, diabetes y dislipemias.
Factores de riesgo ligados a la prótesis
Las prótesis de tercera generación de hemidisco son menos trombogénicas que las de disco de bola, y éstas menos que las válvulas de disco. La localización valvular determina también el riesgo trombogénico. Podemos citar las siguientes localizaciones de las válvulas, según el orden de mayor a menor riesgo trombogénico que provocan: mitral, tricuspídea y aórtica1.
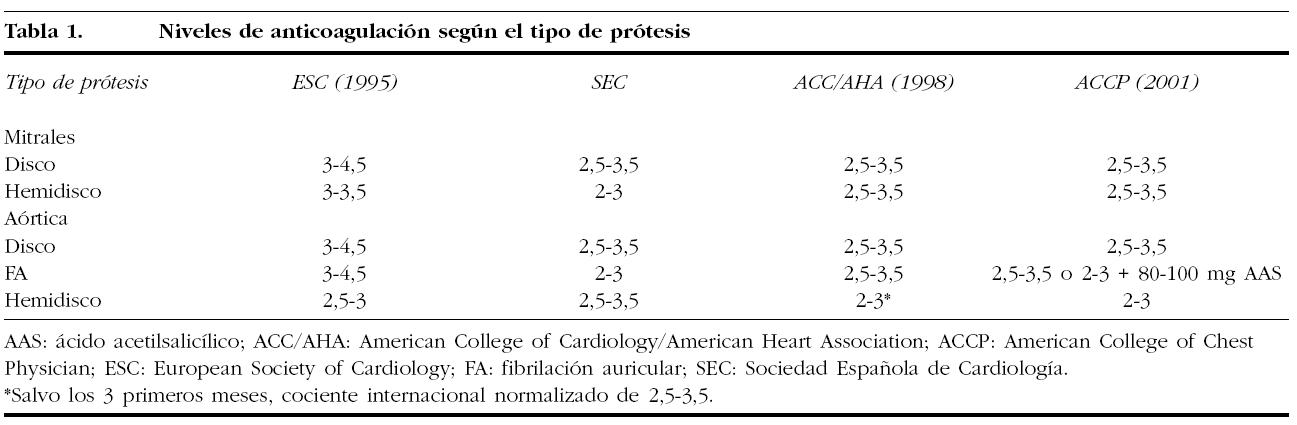
Las recomendaciones de anticoagulación oral (ACO) según el tipo de prótesis están reflejadas en la tabla 1.
En un estudio realizado2 en 158 pacientes portadoras de doble prótesis Saint-Jude en posición mitroaórtica, los autores no encontraron diferencias significativas en cuanto al número de accidentes tromboembólicos entre el grupo con tasas de anticoagulación intermedias o el de tasa de anticoagulación elevadas, lo que condujo a proponer tasas de anticoagulación con INR de 2,5-4 para pacientes portadores de doble reemplazamiento mitroaórtico.
Momento en que se introduce la anticoagulación
El consenso del American College of Chest Physician (ACCP) de 20043 sobre terapia antitrombótica incluye 3 regímenes de tratamiento:
-- Dosis altas de heparina de bajo peso molecular (HBPM) ajustadas por peso o necesarias para mantener a las 4 h de la inyección un valor de anti-Xa de 1 U/ml.
-- Dosis altas de heparina no fraccionada (HNF) ajustadas por peso y administradas cada 12 h de forma subcutánea, para mantener un tiempo de tromboplastina parcial activado (TTPA) ≥ 2 veces el control, o un valor de anti-Xa de 1,35-0,70 U/ml.
-- HNF o HBPM administradas, como se explica previamente, durante 6-12 semanas; cambiar a warfarina a las 13 semanas hasta la mitad del tercer trimestre, en que se cambiará de nuevo a heparinas hasta el momento del nacimiento.
Las recomendaciones del American College of Cardiology/American Heart Association (ACC/AHA) del año 20054 son las siguientes:
-- La decisión de usar heparinas o ACO durante el primer trimestre ha de ser conjunta entre el médico y la madre, y ésta ha de saber que el uso de heparina tiene mayor riesgo de trombosis y de hemorragia, lo que no sólo le puede afectar a ella sino también a su futuro hijo.
-- Las pacientes de alto riesgo (antecedentes de trombosis o válvulas de primera generación en posición mitral), que optan por no tomar un dicumarínico durante el primer trimestre, han de recibir HNF i.v. en dosis que prolonguen el tiempo de TTPA entre 2 o 3 veces el valor de control.
-- En pacientes que reciban un dicumarínico, el INR ha de situarse en 2-3, y en determinados casos se añadirá ácido acetilsalicílico (AAS).
-- Las pacientes de bajo riesgo pueden usar heparina cálcica subcutánea, 17.500-20.000 U, 2 veces al día, para prolongar el TTPA 2-3 veces el valor de control.
-- La ACO ha de sustituirse por heparina a las 36 semanas como máximo.
-- Si se iniciase el trabajo de parto durante el tratamiento con dicumarínicos, se debería realizar una cesárea.
-- Si tras 4-6 h del parto no se produce un sangrado significativo, ha de cambiarse de nuevo a ACO.
La retirada de la ACO y el cambio a heparinas no debe producirse más tarde de las 35-36 semanas de gestación. Los niños pretérmino cuyas madres están anticoaguladas tienen un mayor riesgo de presentar una hemorragia cerebral durante el parto, ya sea por vía vaginal o por cesárea. Si la madre tuviese factores de riesgo para el desencadenamiento de un parto pretérmino, se haría el cambio a heparina de forma más precoz5.
Heparina de elección
Las HBPM han mostrado ciertas ventajas respecto a las HNF, como son: un menor número de complicaciones hemorrágicas, menor número de trombocitopenias inducidas por heparina, menor incidencia de osteoporosis, mayor absorción subcutánea y mejor biodisponibilidad, mayor vida media, mejor predicción de la dosis respuesta, y una menor tasa de abortos6. Sin embargo, no hay evidencia científica suficiente actualmente como para usar de forma sistemática HBPM en pacientes portadoras de prótesis mecánicas cardíacas7.
Dosificación de la heparina
Debido al aumento de los requerimientos durante la gestación, no es correcto dosificar la heparina exclusivamente en función del peso de la paciente. Ésta debería alcanzar en su pico máximo (4 h tras su administración) un valor de anti-Xa alrededor de 1 U/ml. Se ha demostrado que valores de 0,5 U/ml son rangos subóptimos para este tipo de pacientes8. Actualmente, según el ACC, para un correcto control de los niveles profilácticos de heparina, se recomienda la medición bimensual de los valores de anti-Xa o de TTPA9.
Efectos adversos del tratamiento con heparina y ACO
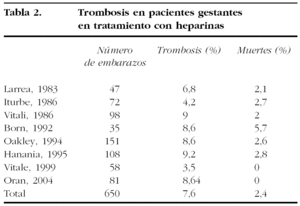
Debido al estado de hipercoagulabilidad en el embarazo, la tasa de trombosis que se producen durante él se sitúa alrededor del 7-23%10,11, con una media del 13%, la mitad de ellas debidas a una trombosis valvular. Esta complicación, cada vez menos frecuente con las válvulas modernas, que puede conducir al fallecimiento de la paciente, requiere el reemplazo valvular por una válvula biológica12.
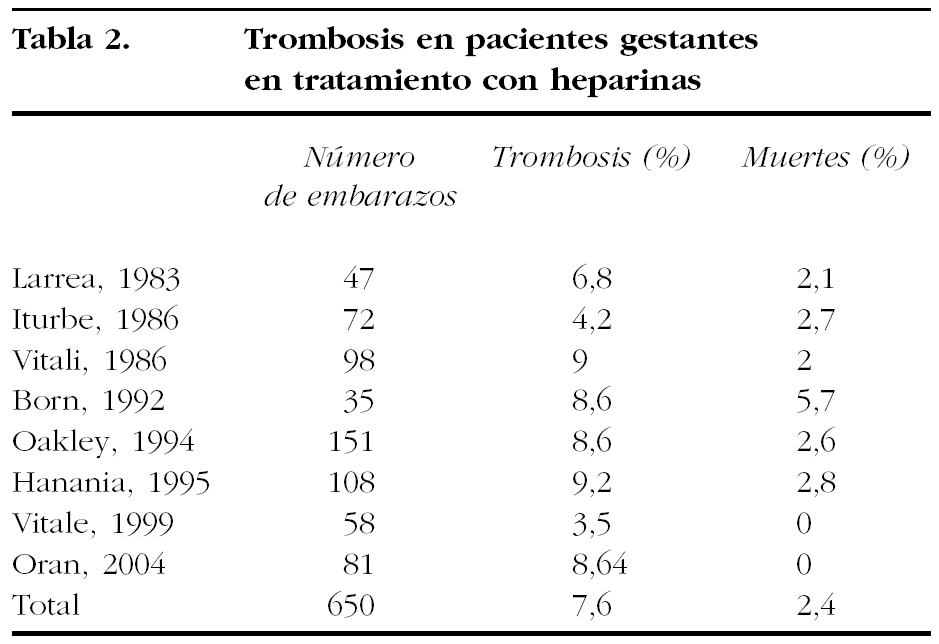
El riesgo de trombosis en pacientes con heparinas según las series publicadas se muestran en la tabla 2.
Embriopatía cumarínica
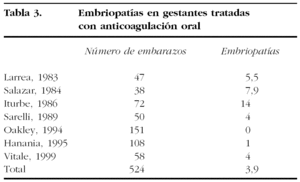
La incidencia de embriopatía por dicumarínicos varía mucho de unos estudios a otros, con un rango entre un 1,6% de los nacidos vivos13, un 4-6%14 y un 7,4%15 (tabla 3). Es probable que estas cifras estén infraestimadas, ya que la mayoría de los estudios tiene un carácter retrospectivo y no contempla los abortos. Se estima que las tasas de aborto espontáneo en pacientes con tratamiento con ACO se sitúa alrededor del 26,7%, cifras similares a las de las pacientes tratadas con heparinas16. Algunos estudios sugieren que la mayor afectación fetal se produce entre las 6 y las 12 semanas de gestación, y que el riesgo aumenta de forma proporcional a la dosis de warfarina; la mayoría de los casos se producen en pacientes tratadas con dosis superiores a 5 mg17. El acenocumarol parece ser menos teratogénico18. La embriopatía por ACO se caracteriza por la presencia de condrodisplasia punctata, hipoplasia nasal con posible estenosis de la vía aérea superior y anomalías oculares (microftalmia, atrofia óptica)19. Algunos autores también han relacionado el tratamiento con warfarina con la hemorragia fetal y las alteraciones del sistema nervioso central (SNC), con el desarrollo posterior de retraso mental16,17,20.
El estudio realizado por Chan et al14 analiza de forma comparativa 3 protocolos de anticoagulación en 1.234 gestantes portadoras de prótesis valvulares. Los resultados maternofetales obtenidos se muestran en la tabla 44.
A la vista de estos resultados puede concluirse que la profilaxis tromboembólica está mejor lograda con el uso de ACO. La terapia con heparinas durante el primer trimestre disminuye los riesgos fetales, principalmente el índice de embriopatía (de un 6,4% con ACO a un 0% con heparinas) a costa de un aumento en las complicaciones y de la mortalidad materna (de un 3,9% con ACO a un 33,3% con heparinas). Sin embargo, otras series con un menor número de pacientes muestran resultados divergentes respecto a la revisión de Chan et al.
Nassar et al21, en una serie de 82 pacientes dividas en 3 grupos superponibles a los de Chan et al, no encuentra diferencias significativas en el índice de complicaciones maternas, mientras que la tasa de abortos espontáneos y de pérdidas fetales está incrementada en el grupo de las pacientes tratadas con ACO21. Sin embargo, en el estudio prospectivo realizado en 250 gestantes realizado por Geelani et al22 no se constataron malformaciones inducidas por warfarina en el grupo de 150 pacientes tratadas con ACO, mientras que en el grupo tratado con heparina hubo una muerte materna secundaria a una trombosis valvular.
DISCUSION
A pesar de recibir un seguimento médico por parte del servicio de cardiología, la paciente no acudió a ningún tipo de consulta preconcepcional ni de consejo prenatal.
Hay que tener presente que durante la gestación se produce una situación de hipercoagulabilidad, a costa de un incremento en la estasis y la compresión venosa, a un aumento en los factores de coagulación (II, V, VII, VIII, IX y X) y a una disminución en los sistemas de fibrinólisis (aumento del fibrinógeno y del PAI-2, disminución de la actividad de la proteína S)23.
Todos estos cambios inducidos por el embarazo, sumados a la presencia de una cardiopatía embolígena, como la presencia de una prótesis mecánica, propician un riesgo elevado24-26, de ahí que la gestación en portadoras de prótesis mecánicas deba desaconsejarse26. Por ello, resulta imprescindible el consejo personalizado y multidisciplinario entre obstetras y cardiólogos.
La decisión sobre si utilizar heparina durante el primer trimestre o continuar con ACO es una decisión que debe tomarse de forma conjunta con la madre, una vez que ésta haya comprendido los riesgos que entraña un tratamiento u otro, tanto para ella como para el feto. Principalmente, hay que tener en cuenta las complicaciones tromboembólicas más frecuentes en las pacientes tratadas con heparinas (incluida la trombosis fatal de la prótesis) frente al riesgo de embriopatía dicumarínica (en el 1-7,4% de los recién nacidos)11,13. En todo caso, aunque se usen heparinas en el primer trimestre, el cambio a ACO debe realizarse a las 12 semanas1,3,4,27,28, sobre todo en pacientes de alto riesgo29, como son las portadoras de una doble prótesis. En nuestro caso, el inicio de la ACO se realizó demasiado tarde, a las 23 semanas.
Resulta cuestionable el momento oportuno para hacer de nuevo el cambio a heparinas. A pesar de estar establecido en las 35-36 semanas (según la ACC, la ACCP y la Sociedad Española de Cardiología), se recomienda hacer el cambio de forma más precoz cuando haya factores de riesgo claros de parto pretérmino. El problema es que dichos factores no son identificables en muchas ocasiones, y el riesgo que conlleva un parto prematuro en estas pacientes es muy elevado. Por una parte, el acenocumarol puede persistir en el feto durante 7-10 días tras la retirada del fármaco. Por otra, hay un riesgo elevado de hemorragia para la madre y el feto, lo que hace que en estos casos la cesárea sea la vía electiva del parto y ha de evitarse un parto vaginal4,30,31. Aun así, el feto prematuro y anticoagulado tiene un riesgo muy elevado de desarrollar una hemorragia intracraneal4, y la aparición de problemas hemorrágicos durante la cesárea es casi una constante.
Al tener la paciente una cesárea anterior, una dinámica intensa y un cérvix sin modificar, se decide terminar la gestación por el riesgo elevado de rotura uterina. Sin embargo, al presentar un INR de 3,8 se intenta tratamiento tocolítico con atosibán (Tractocile®), con el fin de ganar tiempo para revertir la coagulación y así poder disminuir el riesgo maternofetal durante la cirugía. Tras 8 h de intento tocolítico, ante la persistencia de la clínica y de los valores tan alterados de la coagulación, se corrige el INR administrando un fármaco prohemostático.
Se administran 360 kU de Novoseven®, ya que la otra alternativa, el Prothromplex Inmuno Tim 4®, se descarta por su mayor potencial trombogénico. Con ello, se logra la estabilización del INR en 0,8, y se realiza la cesárea sin incidencias.
El acenocumarol disminuye los valores de factor VII, X y IX, y proteína C reactiva, prolongando el tiempo de protrombina. Puede ser difícil revertir este efecto y normalizar la homeostasis mediante plasma y concentrados de complejo de protrombina, ya que es frecuente la aparición de fenómenos tromboembólicos32. Por ello, a pesar de que la formación del complejo trombina-protrombina se incrementa más con Prothromplex®33 y de que el tiempo de protrombina se acorta de forma más eficaz con éste que con el NovoSeven33, el riesgo tromboembólico que supone la administración de Prothromplex® en una paciente gestante con una doble prótesis mecánica resulta inadmisible.
CONCLUSIONES
-- El embarazo en portadoras de prótesis mecánicas constituye una situación de alto riesgo, y éstas han de recibir consejo preconcepcional antes de la gestación para conocer los riesgos y las recomendaciones.
-- La terapia electiva de ACO frente a heparinas durante el primer trimestre aún no se ha establecido. Son necesarios estudios prospectivos y aleatorizados que aporten más datos para poder elegir un tratamiento u otro.
-- El control y la dosificación del tratamiento con heparina ha de realizarse con la medición bimensual del anti-Xa o del TTPA.
-- El cambio de ACO a heparina en el tercer trimestre está establecido a las 35-36 semanas, aunque en determinadas situaciones deberíamos hacerlo antes. La prematuridad y la ACO son factores que se potencian entre sí para el desarrollo de una hemorragia del SNC fetal.
-- Ante un parto inminente en una paciente con ACO, la administración de NovoSeven® constituye una buena opción para revertir la anticoagulación, ya que es menos trombogénico que otros fármacos prohemostáticos.
Correspondencia:
Dra. A. Martínez Rodríguez-Marín.
Servicio de Obstetricia y Ginecología. Hospital Universitario La Paz.
Ronda de Sobradiel, 6-A. 28043 Madrid. España.
Correo electrónico: agowak@hotmail.com
Fecha de recepción: 20/4/06.
Aceptado para su publicación: 12/1/07.