INTRODUCCIÓN
La inflamación crónica del hígado causada por el virus de la hepatitis C (VHC) es una enfermedad ampliamente extendida en todo el mundo, aunque la prevalencia es variable y distinta en diferentes zonas geográficas. En los países de la zona mediterránea es relativamente frecuente y en España aproximadamente un 2% de la población presenta infección por el VHC.
Es una enfermedad de transmisión parenteral, pero en numerosos pacientes es difícil delimitar el episodio causante de la infección. Es frecuente el antecedente de hospitalizaciones previas, por lo que la transmisión nosocomial puede haber desempeñado un gran papel. En general, cursa como una hepatitis crónica de evolución subclínica que tiende a evolucionar a cirrosis hepática. La infección predispone al desarrollo de hepatocarcinoma. En la mayoría de los casos no es posible determinar el momento de la primoinfección, ya que habitualmente no desarrolla el síndrome clínico de una hepatitis aguda. El conocimiento de la infección en la fase subclínica suele ser casual, al realizar análisis por otros motivos.
La patogenia de la hepatitis C es poco conocida. El VHC se replica en el hepatocito y en las células mononucleares de sangre periférica. Aunque el virus puede ejercer un efecto citopático sobre los hepatocitos, existen evidencias de que la inflamación crónica del hígado está causada por mecanismos inmunológicos. Los pacientes que han padecido infección por el VHC desarrollan anticuerpos específicos (anti-VHC). El aumento de las transaminasas, junto con los anticuerpos anti-VHC, es un signo de infección y de posible evolución a la cronicidad. La presencia de ARN-VHC en el suero es signo definitivo de infección activa.
La respuesta inmunológica a la infección viral puede ser la causante de las frecuentes manifestaciones de autoinmunidad que presentan estos pacientes. La tendencia al desarrollo de neoplasias está también incrementada (hepatocarcinoma, linfoma B no Hodgkin). La pre- sencia de crioglobulinas en el suero es un hecho muy frecuente, pero no siempre tiene relevancia clínica. Sin embargo, en algunos casos, la crioglobulinemia puede ser el nexo de unión entre la infección por el VHC y el desarrollo de linfoma1.
Los pacientes con hepatitis crónica por VHC con frecuencia presentan lesiones cutáneas2. Algunas están relacionadas con la propia enfermedad y otras causadas por los medicamentos utilizados en el tratamiento de la hepatitis (tabla I).
MANIFESTACIONES DERMATOLÓGICAS RELACIONADAS CON LA INFECCIÓN POR EL VHC
Se ha descrito la asociación de hepatitis VHC con numerosas enfermedades cutáneas. Sin embargo, es posible que en algunos casos se trate de una asociación casual (tabla II)1,3-7.
Parece razonable considerar que el tratamiento de la hepatitis por el VHC tendría que ser efectivo para la solución de las enfermedades dermatológicas asociadas. Sin embargo, no siempre es así, y en algunos casos se han evidenciado efectos paradójicos, probablemente relacionados con respuestas inmunológicas genéticamente determinadas. Por este motivo, a continuación se describen, individualmente, las características de los procesos más claramente asociados con el VHC, así como su abordaje terapéutico.
Crioglobulinemia
Un 95% de los pacientes con crioglobulinemia mixta (tipos II y III) son portadores de anticuerpos anti-VHC, y los pacientes con hepatitis crónica por VHC tienen crioglobulinas entre el 36 y el 54% de los casos8.
La relación entre el VHC y la crioglobulinemia mixta se basa en las siguientes evidencias: a) la ya mencionada prevalencia de anti-VHC entre los pacientes con crioglobulinemia; b) la demostración del VHC en los crioprecipitados; c) la identificación de inmunoglobulinas específicas contra el VHC (anti-VHC) en las paredes de los vasos de pacientes con vasculitis cutánea; y d) la mejoría de los síntomas secundarios a la crioglobulinemia con el tratamiento antiviral8.
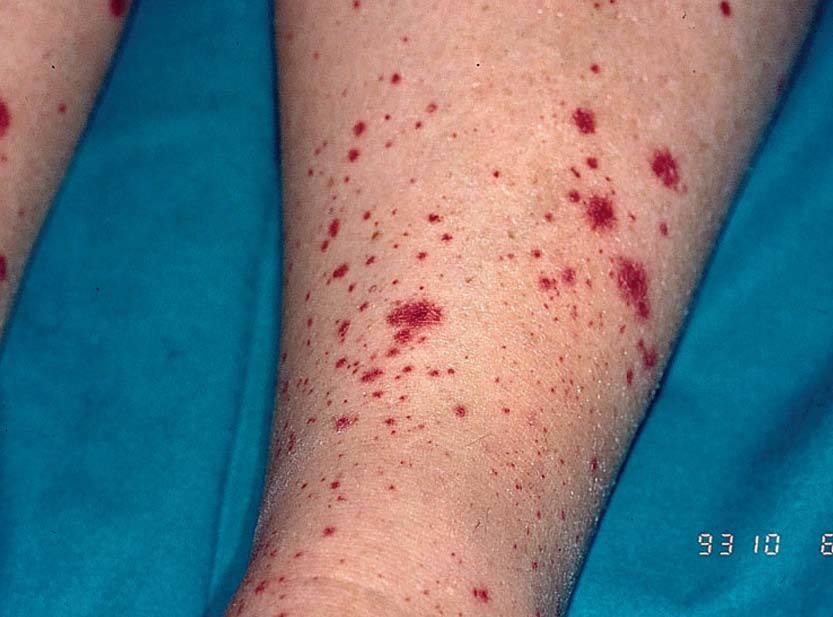
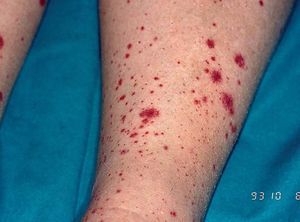
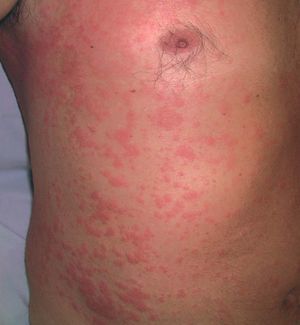
Los signos clínicos relacionados con la crioglobulinemia mixta son secundarios a la vasculitis (púrpura por vasculitis leucocitoclástica o poliarteritis nudosa, artralgias, polineuritis, afectación renal) (fig. 1). La hiperestimulación de las células B se ha relacionado con la posible aparición de gammapatías monoclonales, macroglobulinemia9 o linfomas de células B en los pacientes con crioglobulinemia mixta tipo II1. Los signos clínicos de la crioglobulinemia son más frecuentes en las siguientes situaciones: a) pacientes de edad avanzada; b) infección por el VHC de larga duración; c) crioglobulinemia mixta de tipo II; y d) elevada concentración de crioglobulinas en el suero10.
Figura 1. Vasculitis por crioglobulinemia.
El tratamiento de la infección por el VHC es habitualmente efectivo para evitar los signos clínicos de la crioglobulinemia11. El tratamiento con interferón (IFN) alfa o con IFN pegilado consigue la remisión clínica de la vasculitis en la mayoría de los pacientes en los que se consigue disminución de la carga viral. La asociación de ribavirina puede ser útil en pacientes resistentes a la monoterapia con IFN12. La mejoría se valora por la remisión de los signos clínicos, no por la disminución del criocrito. La dosis y la duración del tratamiento no están claramente definidos, ya que se han observado recidivas al suspender la medicación8. En los pacientes en los que el ARN-VHC se mantiene persistentemente negativo se ha comprobado una disminución significativa y también persistente de las crioglobulinas séricas13. En algún caso aislado, se ha descrito un empeoramiento de los signos de vasculitis tras el inicio del tratamiento antiviral con IFN pegilado14.
La plasmaféresis y la criofiltración, con corticoides y/o inmunosupresores, son tratamientos indicados en pacientes con cuadros graves y de riesgo vital, que no responden a IFN y ribavirina. El rituximab, un anticuerpo monoclonal quimérico anti-CD20, se ha mostrado efectivo en el tratamiento de la crioglobulinemia y del posible linfoma asociado15-17.
Porfiria cutánea tarda
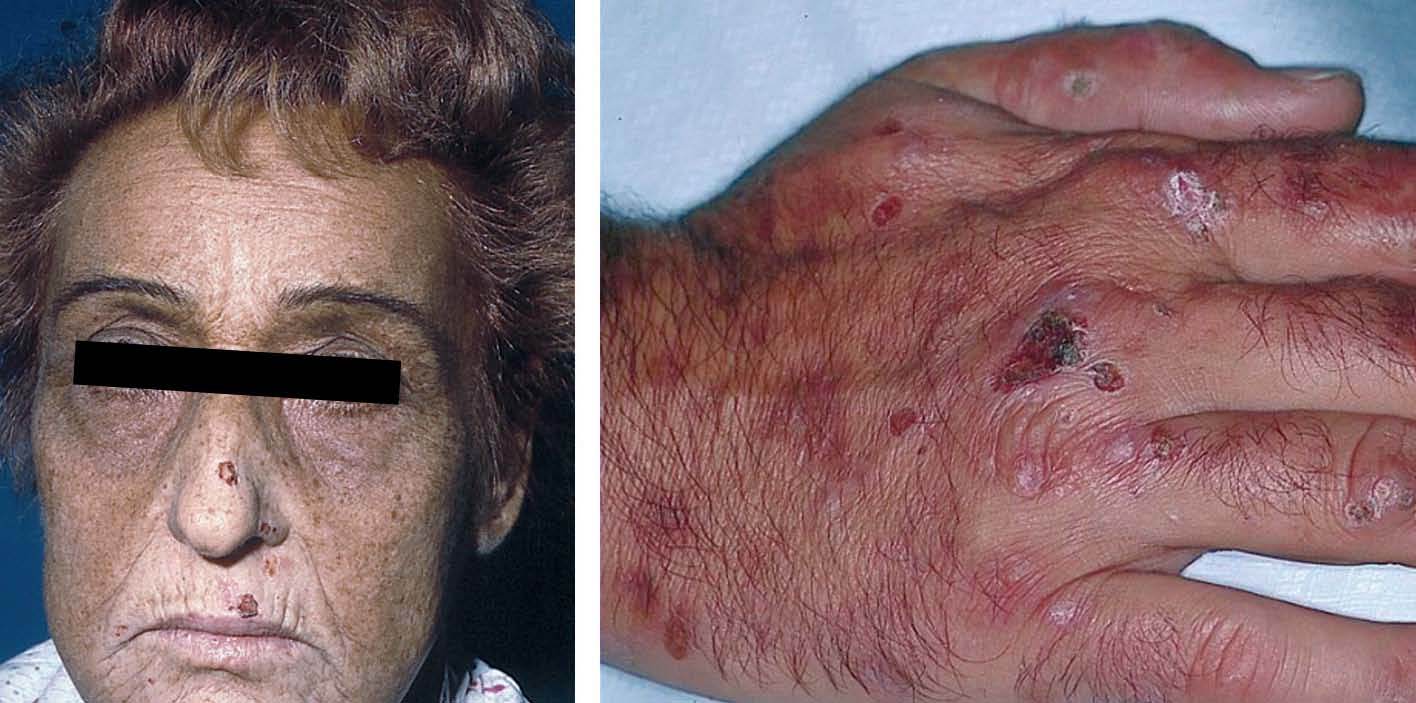
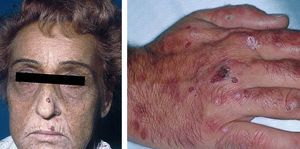
La porfiria cutánea tarda (PCT) es una enfermedad causada por una deficiencia de la enzima uroporfirinógeno decarboxilasa (UROGEN-D) en los hepatocitos. Es una enzima de la vía de síntesis del hemo y su déficit causa aumento de la síntesis de porfirinas en el hígado, que se acumulan en los tejidos y se eliminan por la orina. El depósito de porfirinas en la piel es causante de las manifestaciones clínicas de fotosensibilidad propias de esta enfermedad: fragilidad y erupción de ampollas en las zonas de piel expuestas al sol, sobre todo en el dorso de las manos (fig. 2).
Figura 2. Izquierda: paciente con porfiria cutánea tarda asociada al virus de la hepatitis C (VHC). Facies característica con hiperpigmentación e hipertricosis. Derecha: afección constante en el dorso de manos con fragilidad cutánea y formación de ampollas, erosiones, quistes de milium e hipertricosis.
En el desarrollo de la enfermedad clínicamente activa participan varios factores. En un 20% de los casos el defecto enzimático es congénito y se transmite de forma autosómica dominante. Sin embargo, esta deficiencia enzimática congénita puede estar muy bien compensada y, por sí sola, no causar enfermedad. El desarrollo clínico de la PCT, tanto en las formas hereditarias como en las adquiridas, precisa la concomitancia de otros factores que inciden en la función hepática y causan una mayor inhibición de la enzima: a) incremento de los depósitos de hierro hepático (coherencia del gen de la hemocromatosis, hemólisis crónica); b) inducción del citocromo P450-1A (alcohol, estrógenos, sulfamidas, hidrocarburos policíclicos); c) inflamación crónica del hígado (VHC, virus de la hepatitis B [VHB] y virus de la inmunodeficiencia humana [VIH])18.
Desde los inicios de la década de los noventa se conoce la asociación de PCT y VHC. La frecuencia de esta asociación es variable según las zonas geográficas y muy elevada en los países de la cuenca mediterránea19-21. Aunque esta relación es evidente, no se conoce el mecanismo a través del que la inflamación crónica del hígado es capaz de desencadenar la PCT. Existe además una ausencia de relación causa-efecto, así: a) es muy posible que la hepatitis crónica se inicie años antes del desarrollo de la PCT, y b) el tratamiento con sangrías o cloroquina es capaz de inducir la remisión de la PCT, a pesar de que la infección vírica persista crónicamente activa.
La PCT se ha relacionado esporádicamente con enfermedades autoinmunes. Esta relación puede ser sólo fortuita, sin embargo, la hepatitis crónica VHC puede ser la causa de las alteraciones autoinmunes o del desarrollo de linfomas en los pacientes con PCT22.
Diversos autores han ensayado el tratamiento de la PCT asociada a VHC con IFN-*, con eficacia variable. Debe tenerse en cuenta que la siderosis hepática, frecuente en pacientes con PCT, es un factor que incide negativamente en la eficacia del IFN23.
Por otro lado, se han observado pacientes en los que la PCT se manifiesta clínicamente después del inicio del tratamiento con IFN con o sin ribavirina. Probablemente estos casos se traten de formas hereditarias de PCT, con un 50% de actividad enzimática, en las que los cambios ocasionados por el tratamiento desencadenan la enfermedad. El aumento de hierro hepático secundario a la hemólisis osmótica ocasionada por la ribaviriba puede ser la causa del desarrollo de PCT en individuos genéticamente predispuestos, de manera que el tratamiento antivírico sería el causante de la PCT sólo de manera indirecta24.
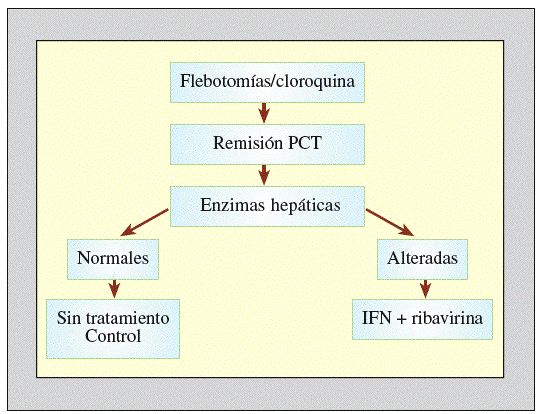
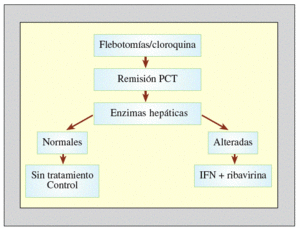
El tratamiento de los pacientes con PCT y hepatitis crónica por VHC obliga a valorar globalmente las dos condiciones. Se deben intentar resolver los posibles desencadenantes de la PCT, para conseguir la máxima eficacia del tratamiento antivírico. Según criterios basados en nuestra experiencia, recomendamos la siguiente pauta (fig. 3):
Figura 3. Tratamiento de la porfiria cutánea tarda asociada al virus de la hepatitis C (VHC). PCT: porfidia cutánea tarda; IFN: interferón.
1. Proceder inicialmente al tratamiento de la PCT por los métodos clásicos: depleción de los depósitos de hierro hepático mediante sangrías periódicas y/o cloroquina a dosis bajas (100 mg/2 veces por la semana). Al mismo tiempo, se recomienda eliminar todos los posibles factores desencadenantes, como son el alcohol o determinados fármacos. En un período de 6-12 meses se consigue la remisión completa de la PCT y la eliminación de los depósitos hepáticos de porfirinas, a pesar de que la infección viral continúe su actividad.
2. El inicio del tratamiento antiviral en este momento aumenta su eficacia. La adición de ribavirina y la utilización del IFN pegilado ha aumentado la tasa de respuestas a un 50% de los casos aproximadamente.
En el caso particular de PCT en pacientes hemodializados, la realización periódica de sangrías de 50-100 ml/semana y la corrección de la posible anemia con eritropoyetina es eficaz en el tratamiento de la porfiria, incluso en pacientes con hepatitis crónica por VHC25.
Liquen plano
El liquen plano es una enfermedad cutánea de causa autoinmune, cuyos mecanismos patogenéticos son desconocidos hasta el momento. La células del infiltrado son predominantemente linfocitos T CD4+, con evidente epidermotropismo. Son células con marcadores de activación positivos, y probablemente tienen una acción citotóxica. El desarrollo de lesiones liquenoides en el síndrome de injerto contra el huésped, así como en otras enfermedades autoinmunes, permite confirmar que son lesiones mediadas inmunológicamente.
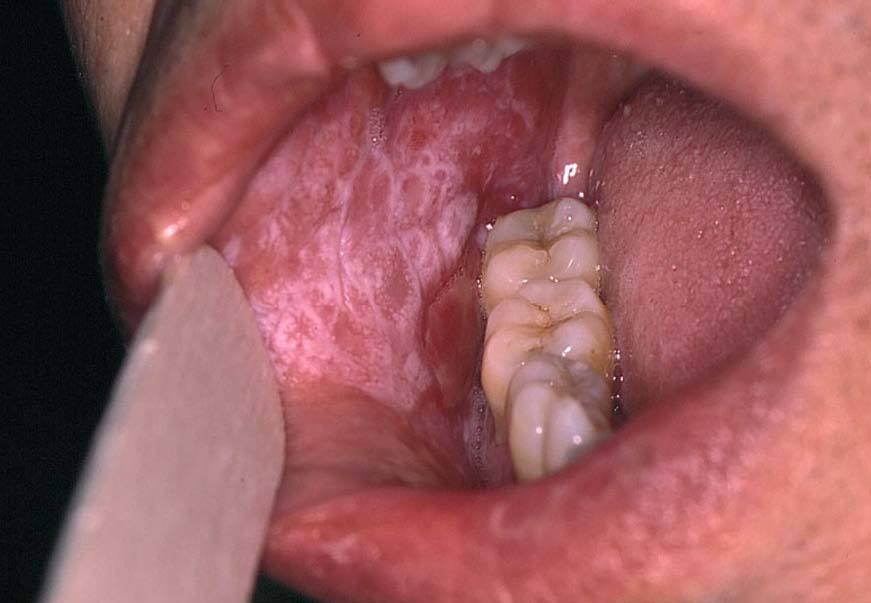
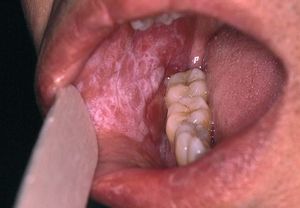
La asociación de liquen plano con la hepatitis es un concepto controvertido. La prevalencia de infección por el VHC en pacientes con liquen plano, sobre todo de localización oral, oscila entre un 10 y un 40%, según las zonas, pero siempre es superior a la de la población general26,27 (fig. 4). El hallazgo de células CD4 con especificidad frente al VHC en las lesiones cutáneas de liquen plano apoya esta relación28. La observación en algún caso de la permanencia del liquen plano oral después de ser eliminado el ARN-VHC sérico sugiere la posibilidad de una respuesta autoreactiva persistente, que incluso podría estar favorecida por la acción del IFN29.
Figura 4. Lesiones características de liquen plano oral en un paciente con hepatitis C.
El tratamiento con IFN y ribavirina puede mejorar algunos casos, pero se ha descrito la aparición o el empeoramiento de lesiones de liquen oral después del inicio de este tratamiento, que incluso ha obligado a suspender la medicación en algún paciente30-32.
Prurito
El prurito es un síntoma clínico que refieren con frecuencia los pacientes con enfermedad hepática. Es característico de los procesos que causan colestasis; sin embargo, otros procesos inflamatorios del hígado no asociados a aumento de las sales biliares pueden también causar prurito.
En el caso de la hepatitis por el VHC el prurito es un síntoma frecuente y, en ocasiones, conduce a realizar exploraciones y análisis que permiten el descubrimiento de la enfermedad hepática33.
El tratamiento del prurito no es fácil y se basa fundamentalmente en la aplicación tópica de emolientes. El uso de antihistamínicos a dosis altas, antidepresivos tricíclicos o antagonistas de los receptores opiáceos no es recomendable. Si el síntoma es muy intenso puede ensayarse la irradiación con UVB. En estos casos debe ser previamente descartada la presencia de una porfiria.
EFECTOS SECUNDARIOS CUTÁNEOS DE LA TERAPIA ANTIVIRAL
La infección por el VHC es causa de gran morbilidad. Se están produciendo grandes avances en su tratamiento, pero todavía están en fase de investigación clínica. Hasta hace poco tiempo el tratamiento se basaba en la monoterapia con IFN-*, que permitía conseguir la remisión completa en menos de un 20% de los pacientes. Esto ha motivado la introducción de diferentes cambios en la estrategia terapéutica:
1. IFN-*-2b, que es una molécula recombinante que no ha mostrado mayor eficacia ni menores efectos secundarios que el IFN-*.
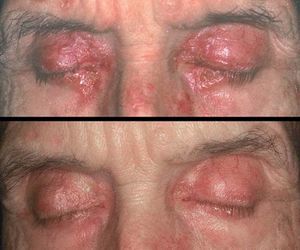
2. IFN pegilado, formado por la unión del IFN a moléculas de polietilenglicol. La pegilación provoca un retraso en la eliminación de producto, lo que permite mantener niveles plasmáticos de IFN constantes, con lo que aumenta no sólo su efectividad sino también sus efectos secundarios (fig. 5).
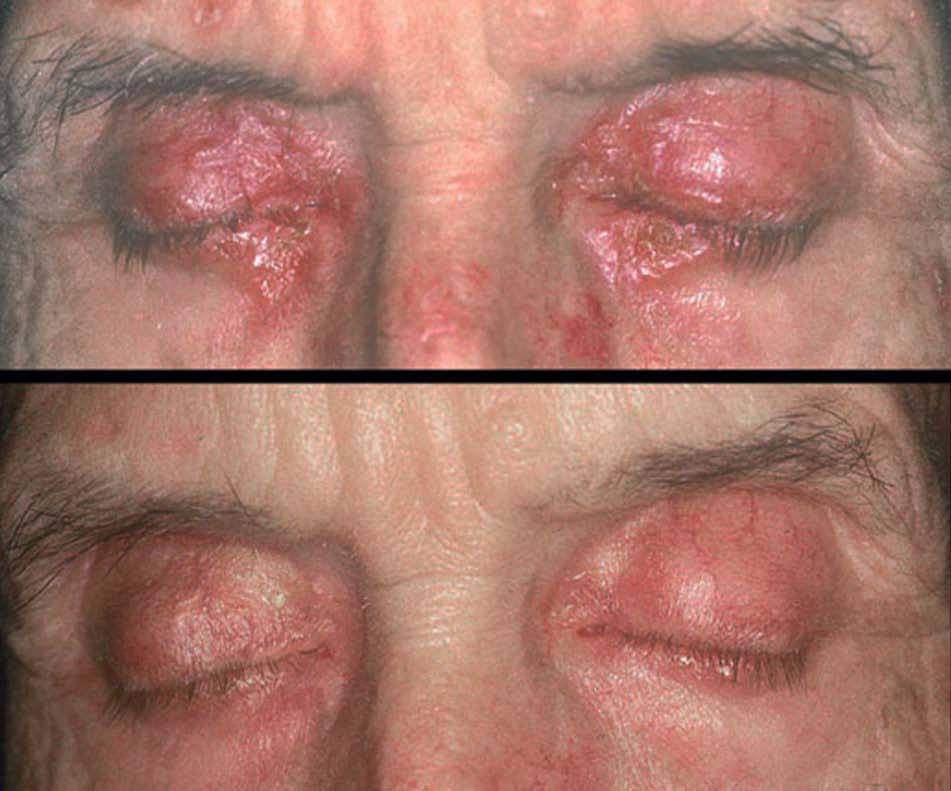
Figura 5. Sarcoidosis en un paciente tratado con interferón pegilado. Placas eritematoanaranjadas en ambos párpados. La afección cutánea y pulmonar se resolvió tras la suspensión del interferón.
3. IFN asociado a ribavirina. La ribavirina es un análogo de los nucleósidos con actividad antivírica. Utilizado como único fármaco no ha mostrado eficacia alguna en la eliminación del VHC. Sin embargo, la acción sinergística de ribavirina e IFN permite obtener mayor eficacia terapéutica. Mediante el tratamiento con IFN pegilado y ribavirina se consigue la negatividad del ARN viral en un 50% del los pacientes con VHC genotipo 1 (el más frecuente en España) y en un 90% de los pacientes con genotipo 2 y 3, con respuestas mantenidas. Los pacientes con VHC genotipo 1 deben seguir el tratamiento a dosis completas durante 1 año, mientras que el tratamiento de los genotipos 2 y 3 es de 6 meses. El total cumplimiento del tratamiento es esencial para conseguir su plena eficacia. Los criterios que permiten predecir una buena respuesta son: persona joven y no obesa, con genotipos VHC 2 y 3, viremia inferior a 2 * 106 copias, y observación de escasa fibrosis en la biopsia hepática. El análisis de la viremia ha permitido comprobar que desciende espectacularmente en los primeros días de tratamiento, por bloqueo en la replicación vírica. Posteriormente, ya desciende más lentamente, por eliminación de las células infectadas. La mayoría de pacientes negativizan el ARN VHC durante las primeras 12 semanas y en ellos la respuesta virológica es sostenida. Sin embargo, la respuesta virológica sólo se consigue en un 3% de los que no negativizan el ARN a los 3 meses34.
4. Recientemente se ha añadido un tercer fármaco, la amantadina, actualmente también en fase de estudio clínico, pero con menor experiencia.
Entre los efectos secundarios de la terapia antivírica (tabla III)35-57 son frecuentes los que afectan a la piel (el 10-30% de los casos, según las series), aunque algunos sólo se han descrito en casos aislados. Se han observado complicaciones dermatológicas graves, con posible compromiso vital, en un 0,1% de los pacientes tratados58. Si bien las descripciones de lesiones cutáneas asociadas al tratamiento con IFN y ribavirina son numerosas, algunas sólo se han descrito en pacientes aislados. Por ello, prestaremos especial atención a las más frecuentes: reacción en el punto de inyección del IFN y dermatitis eccematosa a distancia.
Reacción en el punto de inyección
La aparición de una reacción inflamatoria con eritema, edema e induración en el punto de inyección del IFN es un efecto secundario frecuente59. En general, es una reacción autolimitada que se resuelve en pocos días sin especiales complicaciones. Sin embargo, en algunos casos la reacción puede evolucionar hasta la formación de necrosis cutáneas44. La aparición de necrosis cutáneas habitualmente ocurre en un promedio de 5 meses después de iniciado el tratamiento y no está en relación con la dosis. La reaparición de necrosis cutánea después de variar el lugar de inyección puede ser uno de los motivos que obliguen a suspender el tratamiento con IFN.
En una paciente se observó la aparición de un eritema facial después de cada inyección de IFN, de 1-2 días de duración57.
Reacción eccematosa difusa a distancia
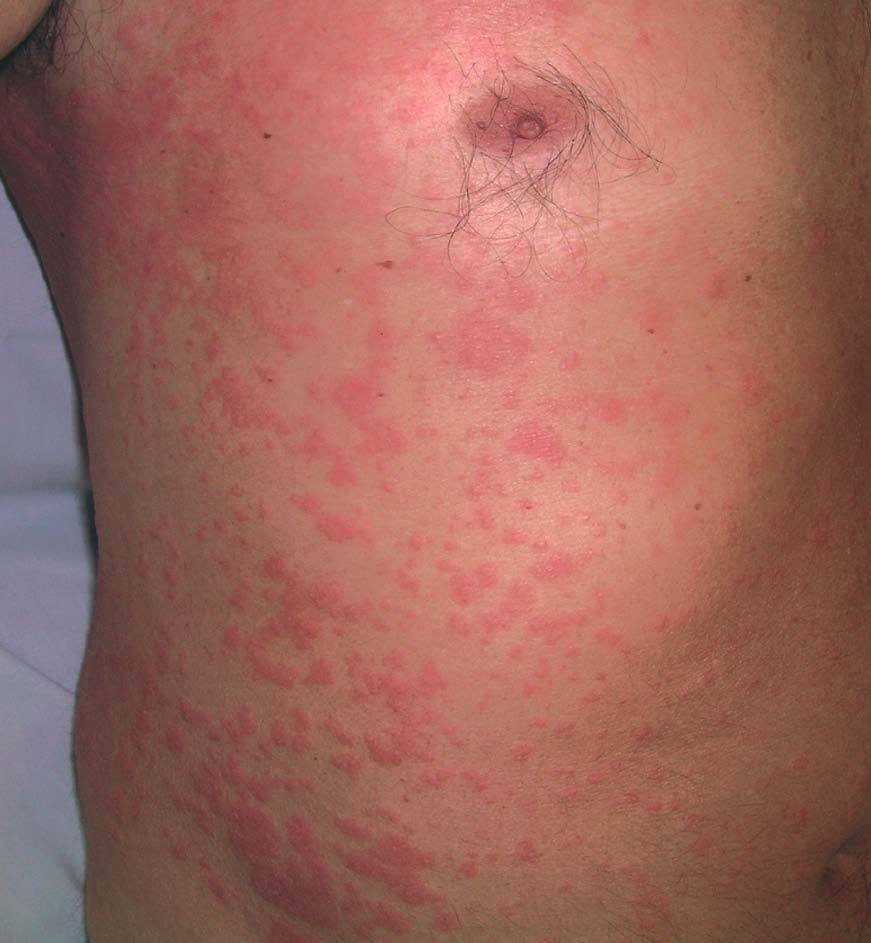
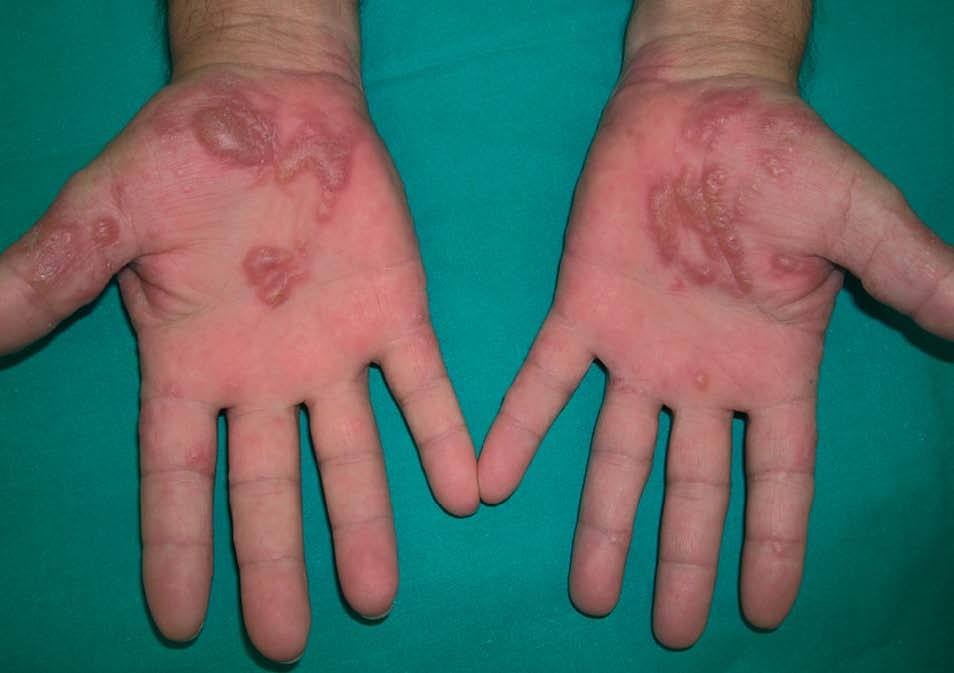
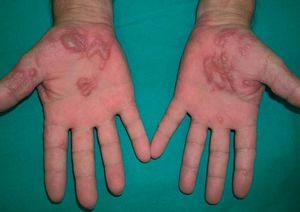
Entre los pacientes que presentan lesiones cutáneas relacionadas con el tratamiento antiviral, un 20% aproximadamente presentan una dermatitis pruriginosa35-37. Se caracteriza por la aparición de lesiones papuloeritematosas y vesiculosas, con tendencia a confluir en forma de placas, de localización extensa pero de predominio en las partes distales de las extremidades, cuello y cara (figs. 6 y 7). Esta erupción se inicia entre las 2 y 12 semanas de iniciado el tratamiento (promedio 9 semanas) y, en ocasiones, se asocia a erosiones en la mucosa oral e inflamaciones perinévicas.
Figura 6. Erupción eccematosa generalizada tras 12 semanas de tratamiento con interferón pegilado.
Figura 7. Lesiones vesiculoampollosas dishidrosiformes en las palmas en un paciente en tratamiento con interferón pegilado.
En algún caso, los pacientes presentan fotosensibilidad, y se ha observado la provocación del eritema con UVB y no con UVA en una paciente en tratamiento con IFN y ribavirina, relacionando el caso con fotosensibilidad a ribavirina (espectro de absorción de 282,5 nm)51. En los pacientes en tratamiento con IFN pegilado se ha sugerido el posible papel del polietilenglicol en el desarrollo de esta dermatitis eccematosa, ya que este producto ha sido asociado a dermatitis de contacto41. Sin embargo, esta dermatitis eccematosa se ha observado también en pacientes que utilizaban el IFN no pegilado.
La biopsia de estas lesiones muestra un infiltrado mononuclear en la dermis superficial, en banda y perivascular, con espongiosis, vesiculación y necrosis aislada de los queratinocitos.
La patogenia del proceso es desconocida, aunque se supone que el efecto inmunomodulador del IFN puede causar respuestas aberrantes de los linfocitos T frente a diferentes estímulos. La relación entre la dermatitis y el IFN se confirma por el hecho de que la interrupción del tratamiento va seguida de la remisión de la erupción en 2-3 semanas y el reinicio del IFN causa la recidiva de las lesiones35.
HEPATOTOXICIDAD DEL TRATAMIENTO DE ENFERMEDADES CUTÁNEAS EN PACIENTES CON HEPATITIS C
Existen numerosos fármacos utilizados en dermatología potencialmente hepatotóxicos. Entre éstos destacan los retinoides orales y el metotrexate que son de amplia utilización.
El hecho de que un paciente tenga una hepatitis C no es una contraindicación absoluta de ninguno de estos tratamientos y es preciso individualizar cada caso y ponderar los riesgos y beneficios de los mismos, así como realizar un control estricto de las transaminasas.
CONDUCTA A SEGUIR
La infección crónica por el VHC es una enfermedad potencialmente grave, que puede evolucionar a una cirrosis hepática y desarrollar un carcinoma hepatocelular. Por este motivo es importante procurar la inactivación del VHC y su eliminación del organismo. Se ha comentado previamente que la eficacia del tratamiento antivírico está en relación con el perfecto cumplimiento de las pautas terapéuticas que se indican. Por ello, es recomendable continuar con la medicación si las complicaciones o los efectos secundarios no son extremadamente graves.
El paciente debe ser informado de los inconvenientes del tratamiento, pero también de su posible eficacia, intentando conseguir la máxima tolerancia a los efectos secundarios. En la mayoría de los casos, y así es deseable, el tratamiento sintomático de los mismos permite seguir con la medicación antivírica37,38. Sin embargo, la gravedad de las reacciones cutáneas puede imposibilitar el cumplimiento del tratamiento35,39,44.
Las mismas consideraciones deben hacerse ante aquellos casos de aparición o exacerbación de enfermedades dermatológicas, como son el liquen plano erosivo de las mucosas, la psoriasis, el lupus eritematoso, etc.
De todo ello se deduce la importancia de la atención del paciente de manera próxima y continuada y de la acción conjunta de las diversas especialidades médicas implicadas.