Debido a la urgencia sanitaria por la infección de SARS-CoV-2 se vio la necesidad del rápido desarrollo de múltiples vacunas que favorecieron la prevención y control de la morbimortalidad de la misma1. Dentro de las tecnologías desarrolladas se incluyeron vacunas basadas en ARN mensajero (Pfizer-BioNTech y Moderna), vectores de adenovirus humanos y primates (Janssen-Johnson & Johnson, Astra-Zeneca y Sputnik-V) y vacunas inactivadas del virus completo (Sinovac)2,3.
Posterior al inicio de la vacunación global acelerada se ha reportado la aparición de diferentes efectos adversos, dentro de estos, se han descrito múltiples formas de manifestaciones cutáneas3, que incluyen desde reacciones locales inmediatas en el sitio de la inyección hasta reacciones tardías. Estas últimas incluyen exantemas morbiliformes, urticaria, eritema multiforme, pitiriasis rosada, púrpura, liquen plano, entre otros3,4, siendo la mayoría de estas presentaciones autolimitadas3. El dermatólogo juega un papel clave en el reconocimiento de estas lesiones, ya que en ocasiones la diferenciación entre la manifestación relacionada y no relacionada a la vacuna puede ser desafiante4.
Presentamos una serie de 3 casos de reacciones en la piel relacionados a la vacunación para COVID-19.
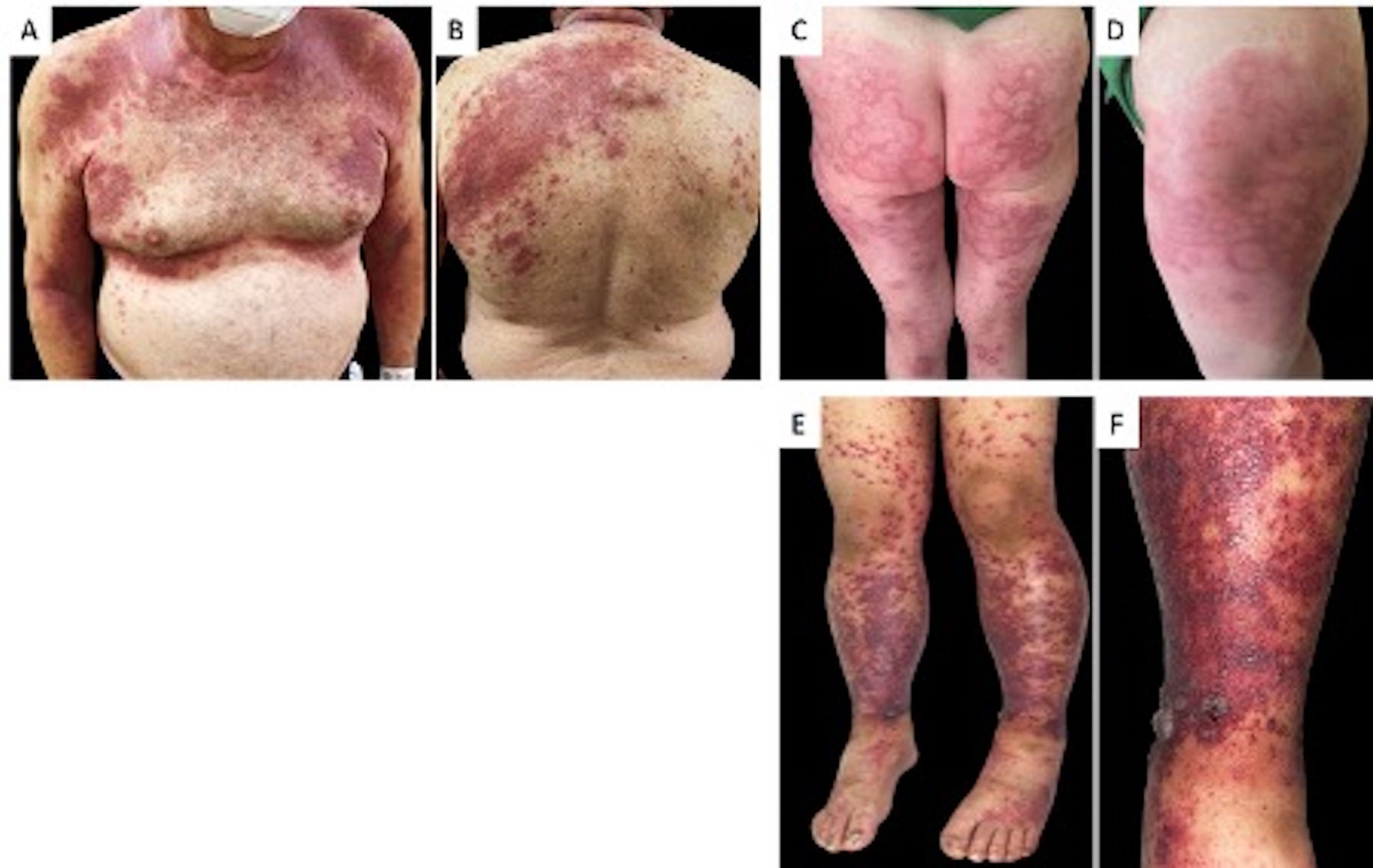
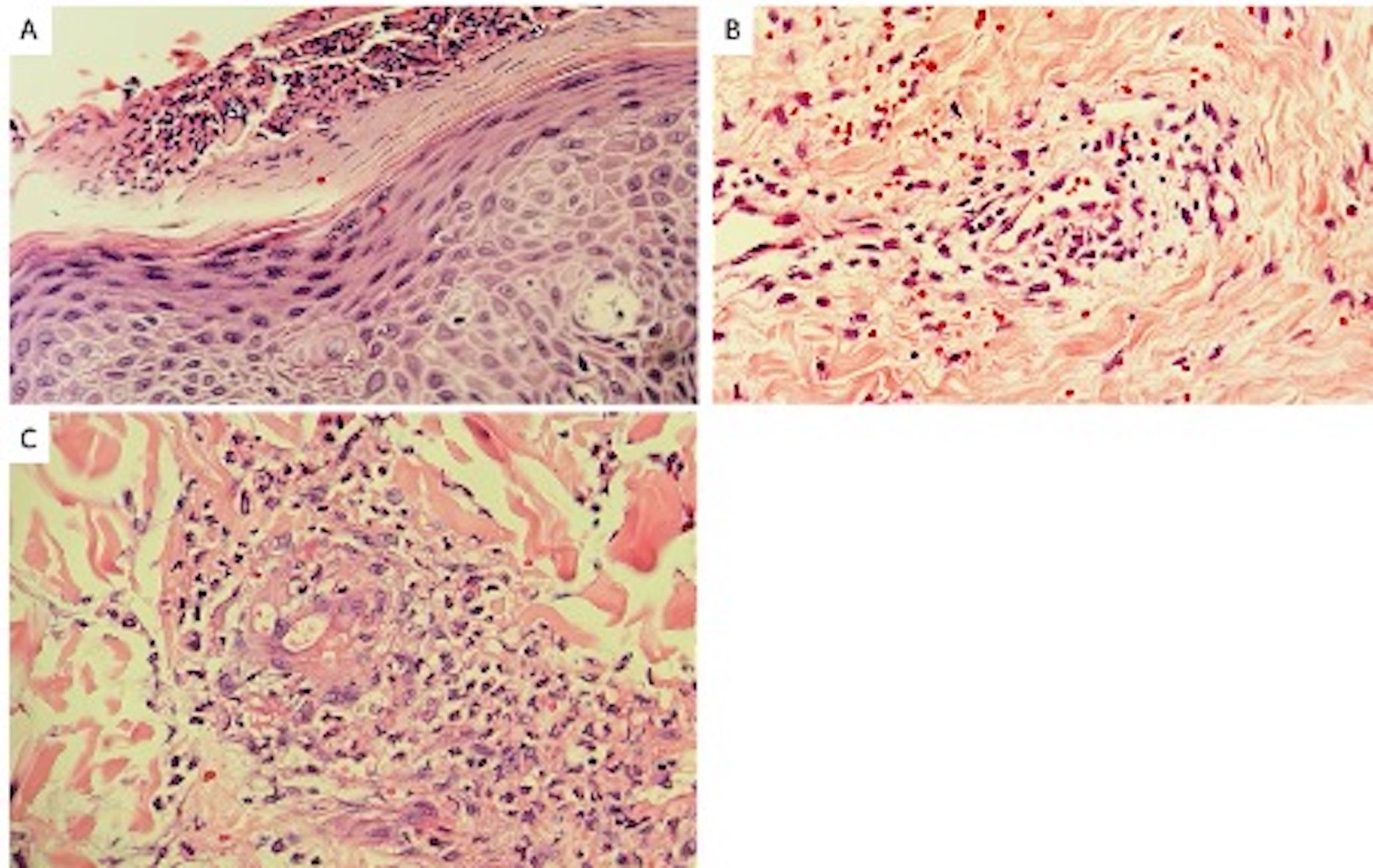
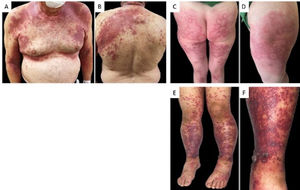
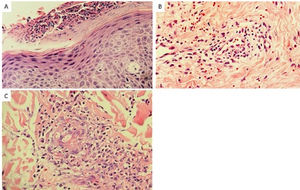
Casos clínicosUn hombre de 72 años, con antecedentes de diabetes mellitus tipo II, hipertensión arterial e hipotiroidismo controlados consulta por un cuadro que inicia 3 días posteriores a la aplicación de la vacuna Sinovac, consistente en lesiones eritemato-violáceas asociadas a múltiples pústulas (fig. 1A y B). Se toman paraclínicos que muestran una leucocitosis de 15,2 x 10^12/l con marcada neutrofilia (9,9 x10^12/l), sin otros hallazgos anormales. Además, una biopsia de piel que confirma el diagnóstico de pustulosis exantemática generalizada aguda (fig. 2A). Se da tratamiento con prednisolona 50 mg diarios y betametasona en crema 0,05% cada 12 horas, ambas terapias por una semana.
A y B) En el tórax anterior y el dorso se evidencian múltiples micropústulas sobre placas eritematosas, de bordes regulares, bien definidas. C y D) En la región glútea y las extremidades inferiores presenta múltiples placas eritematodescamativas de configuración anular. E y F) En los miembros inferiores con múltiples máculas y placas eritematovioláceas de bordes irregulares bien definidos, asociado a ampollas de contenido hemorrágico.
Una mujer de 56 años, sin antecedentes de interés, con un cuadro que inicia una semana después de la aplicación de la primera dosis de la vacuna Moderna. Las lesiones consisten en placas de configuración anular que se iniciaron en la pierna derecha con posterior extensión a la pierna izquierda y los glúteos, asociado a dolor y prurito (fig. 1C y D). Consultó a dermatología extrainstitucional donde se le indicó tratamiento con itraconazol oral, sin mejoría de las lesiones, por lo cual la paciente decide consultar a urgencias. En el ingreso, se toma una biopsia de piel documentándose dermatitis de patrón exfoliativo más probablemente en relación a la reacción por hipersensibilidad (fig. 2B) que, sumado a la clínica, favorece el diagnóstico de eritema anular centrífugo. Se prescribe tratamiento oral esteroideo con mejoría del cuadro.
Un hombre de 21 años, sin antecedentes de importancia, con aparición de lesiones purpúricas y formación de ampollas en los miembros inferiores con extensión a los miembros superiores y pabellones auriculares, asociado a dolor (fig. 1E y F) un día posterior a la aplicación de la primera dosis de la vacuna Pfizer. Bajo sospecha de vasculitis leucocitoclástica, se solicitan paraclínicos con un perfil infeccioso y autoinmune negativo y se toma una biopsia de la piel (fig. 2C) más inmunofluorescencia, que confirma el diagnóstico. Se inicia el tratamiento con prednisolona 1mg/kg/día. Ante la falta de mejoría se pasó a pulsos de corticoide IV con posterior resolución del cuadro clínico.
ComentariosLas reacciones cutáneas posteriores a la administración de la vacuna contra el SARS-CoV-2 parecen ser heterogéneas, poco frecuentes y que no ponen en peligro la vida, siendo la Pfizer-BioNTech y Moderna las más frecuentemente reportadas5. Los eventos adversos cutáneos se presentan con mayor frecuencia dentro de los primeros 7 días posteriores a la aplicación, siendo más común en las mujeres (proporción 4,5:1) con una edad media de 44 años, una recurrencia reportada entre el 8 y 46% y como una manifestación primaria o exacerbación de una dermatosis preexistente como la psoriasis, la dermatitis atópica, entre otros6,7.
En cuanto a su fisiopatología, existen diferentes modelos de inflamación cutánea. Estas abarcan todo el espectro de la respuesta inmune e incluyen: 1) la activación de los linfocitos T hacia un perfil Th1, 2) respuesta tipo Th2, 3) las reacciones inmediatas tipo I en caso de sensibilización previa a algún componente de la vacuna generalmente causados por los ingredientes de las vacunas, 4) reacciones alérgicas de hipersensibilidad retardada tipo IV, 5) activación vía Th17/Th22 y 6) reacciones granulomatosas mediadas por histiocitos6. Otros efectos pueden incluir la formación de complejos inmunes llevando, por ejemplo, a las vasculitis leucocitoclástica6.
Clínicamente, las lesiones son heterogéneas y se pueden clasificar en diferentes patrones de acuerdo a sus características clínicas, histopatológicas y patogénicas: 1) reacción en el sitio de la inyección, 2) exantemas, 3) urticariales, 4) vasculares, 5) eccematosas, 6) ampollares autoinmunes y 7) toxicodermias severas8–10.
Una revisión sistemática que incluyó 5.941 casos, documentó como las reacciones más usuales las locales en el lugar de la inyección (n = 2.023), seguida de exantema (n = 1.954), urticaria (n = 647), angioedema (n = 318), herpes zóster (n = 160) y erupción morbiliforme (n = 106). Adicionalmente, dicha revisión encontró 46 casos de vasculitis leucocitoclástica (principalmente secundaria a la vacuna Pfizer), 4 casos de pustulosis exantemática generalizada aguda (PEGA) (secundarias a Pfizer, Astrazeneca y Moderna) y 2 casos de exantema anular (secundario a Astrazeneca: 1 JJ:1)1, como los que se muestran en el presente reporte8.
Un registro de 414 reacciones cutáneas a la vacuna ARNm de Moderna (83%) y Pfizer (17%), como la expuesta en nuestros casos, evidenció que la mayoría de pacientes no tenían historia previa de dermatosis inflamatorias (84%), no presentaban enfermedades asociadas (62%) o alergias conocidas a vacunas (92%) y además, el 43% de los pacientes con reacciones a la primera dosis experimentó recurrencia con la segunda dosis11. Asimismo, las reacciones locales retardadas fueron las más comunes, seguido de reacciones locales en el lugar de la inyección, erupciones urticariales y erupciones morbiliformes; dentro de este grupo, hubo un paciente con vasculitis posprimera dosis Pfizer y 2 pacientes posprimera dosis Moderna. No se reportaron casos de eritemas anulares ni PEGA11.
A diferencia de las vasculitis por hipersensibilidad, el registro de eritema anular centrífugo y PEGA asociado a la vacunación para COVID-19 es más limitado.
Kreuter A et al., expusieron un caso de una paciente de 55 años quien 10 días posteriores a la aplicación de la vacuna Pfizer desarrolló lesiones de eritema anular centrífugo en los miembros inferiores, las cuales recurrieron tras la segunda dosis12,13.
Por su parte, Kim JC et al. describieron otro caso en otra paciente de 74 años quien desarrolló esta entidad en las extremidades superiores 5 días posteriores a la vacuna. En ambos casos los tiempos de desarrollo de las lesiones fueron similares a los presentados por nuestra paciente, lo que sugiere un mecanismo de hipersensibilidad retardada, además en dichos pacientes, incluyendo a la nuestra, hubo predilección por las extremidades y se presentaron únicamente en las mujeres14.
Adicionalmente, se han descrito pocos casos de PEGA, como el de Sung-Yoon Kang et al., quienes presentaron un paciente de 32 años que desarrolló lesiones 3 semanas posteriores a la aplicación de la vacuna Astrazeneca14. De igual manera, Anna Agaronov et al. y Fouad Mitri et al. publicaron el caso de 2 pacientes de 27 años, quienes desarrollaron PEGA a las pocas horas y a los 4 días respectivamente, ambos asociados a la vacuna Moderna15,16.
En relación al tratamiento de las reacciones cutáneas, es importante tener en cuenta que la mayoría de los casos son entidades auto resolutivas, de curso benigno y que no desarrollan ningún tipo de secuela, por ende, el manejo se enfoca en el control sintomático de la enfermedad. En un estudio que incluyó 405 casos, se observó que el 71,5% de los pacientes fueron tratados; de estos, el 36,9% fueron tratados con corticoides tópicos, seguido de antihistamínicos orales en un 25,45%, antibióticos tópicos y sistémicos en un 3,8 y 3,1% respectivamente, y corticoides sistémicos en un 2,3% de los casos7. En los casos aquí presentados, el esteroideo sistémico fue la principal herramienta terapéutica presentando mejoría clínica en todos los pacientes7.
Consentimiento informadoContamos con los consentimientos requeridos por la legislación vigente para la publicación de cualquier dato personal o imágenes de pacientes, sujetos de investigación u otras personas que aparecen en los materiales enviados a Elsevier. Hemos conservado una copia escrita de todos los consentimientos y, en caso de que Elsevier lo solicite, acepto proporcionar las copias o pruebas de que de dichos consentimientos han sido obtenidos.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.