En general, la leucemia mieloide crónica (LMC) es una enfermedad mortal con pocas opciones terapéuticas. El trasplante alogénico de células progenitoras hematopoyéticas (TPH) ha sido hasta ahora el único tratamiento potencialmente curativo, pero menos del 20% de los pacientes recién diagnosticados son candidatos a trasplante y, además, su efectividad se ve limitada por la toxicidad asociada al tratamiento.
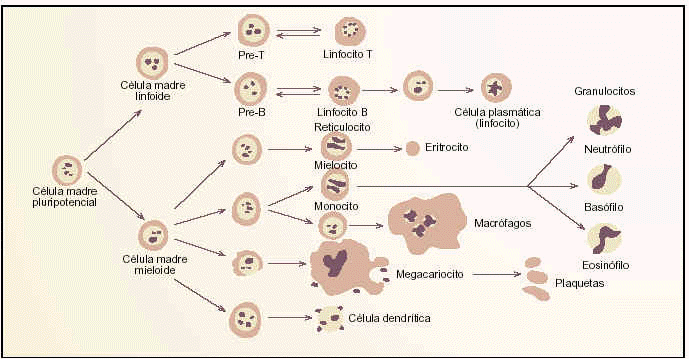
La médula ósea produce, durante la vida, una amplia variedad de células sanguíneas mediante un proceso denominado hematopoyesis. En líneas generales, las células sanguíneas maduras se dividen en dos grupos principales: los glóbulos rojos, que transportan el oxígeno por todo el organismo, y los glóbulos blancos o leucocitos. Los leucocitos se subdividen a su vez en la estirpe mieloide, que participa en la defensa innata e inmediata del organismo y en la inflamación, y en la estirpe linfoide que constituye el sistema inmunitario específico. Entre los linfocitos, se diferencian los linfocitos B que producen anticuerpos, los linfocitos T, y los linfocitos citotóxicos, que reconocen y destruyen tanto agentes infecciosos, células infectadas por virus, como células cancerosas tempranas.
Las células de estirpe mieloide son las relacionadas con la inmunidad y sus principales componentes son monocitos, macrófagos, células dendríticas y granulocitos. Estos agentes de la función inmunitaria actúan recogiendo células muertas del propio organismo y sustancias extrañas para eliminarlas, ya sea directamente o presentándoselas a los linfocitos para estimular una respuesta inmunitaria. Los granulocitos (según el tipo de granulación específica serán neutrófilos, eosinófilos y basófilos) son las células mieloides prevalentes en la circulación normal. La serie granulopoyética, desde las etapas inmaduras hasta las maduras, es la que aumenta masivamente en número en la LMC.
La transducción de señales es la vía por la que las células traducen la información del entorno en diversas funciones celulares, tales como la diferenciación, la proliferación e incluso la muerte celular programada.
Estirpes celulares y puntos de diferenciación
Los tumores malignos hematológicos son crecimientos neoplásicos o cánceres de las células sanguíneas. La transformación maligna es un proceso de múltiples pasos que conduce a que una única célula adquiera una ventaja en términos de crecimiento o de supervivencia. El crecimiento incontrolado de esta célula, y de sus descendientes, da lugar a la expansión de una población celular clonal o idéntica. Cuando este proceso se produce en cualquiera de las estirpes celulares de leucocitos, el cáncer resultante es una leucemia.
A menudo, las transformaciones neoplásicas se inician a partir de un acontecimiento genético que da lugar a un crecimiento celular desequilibrado o incontrolado. Puede ser consecuencia de una mutación genética puntual, de la pérdida, duplicación o recombinación inadecuada (translocación) de cromosomas, y estas anomalías pueden dar lugar a la sobreexpresión de un gen que promueve la proliferación o la supervivencia celular (protooncogén) o la pérdida de la expresión de un gen que inhibe la proliferación celular o promueve la apoptosis (gen supresor tumoral).
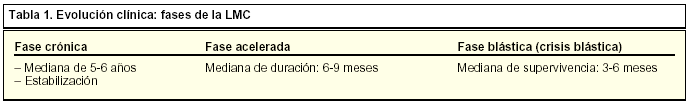
La leucemia se clasifica en función de su estirpe celular, mieloide o linfoide, y del grado de diferenciación terminal, relacionado con la evolución clínica de la enfermedad (tabla 1). El origen de la leucemia es la proliferación maligna de células hematopoyéticas en la médula ósea que posteriormente pasa a sangre periférica. En las leucemias agudas proliferan células inmaduras, evolucionan rápidamente y precisan una intervención terapéutica rápida. Según la estirpe que prolifere, se tratará de leucemia mieloide aguda (LMA) o leucemia linfoide aguda (LLA). Las leucemias crónicas se originan a partir de una célula madre que conserva la capacidad de diferenciarse.
Leucemia mieloide aguda crónica
La LMC se caracteriza por la proliferación clonal de células madre mieloides malignas que da lugar a un número excesivo de células mieloides en todas las fases de maduración. Sin embargo, como también hay otras estirpes celulares no mieloides presentes, se considera que es una enfermedad cuyo origen es la célula madre hematopoyética primitiva.
La LMC fue el primer cáncer vinculado casualmente a una anomalía genética. En 1969 se observó que un cromosoma anormal se asociaba a esta enfermedad; se le denominó «cromosoma Philadelfia», ya que fue descubierto en esta ciudad, y es el resultado de una translocación o intercambio de material genético entre los brazos largos de los cromosomas 9 y 22.
El cromosoma Ph se puede detectar mediante técnicas citogenéticas habituales en la gran mayoría de los pacientes. En pacientes que son citogenéticamente negativos para el cromosoma Ph, pueden ser útiles técnicas moleculares como la hibridación in situ con fluorescencia (FISH) o la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR). El uso de estas técnicas especiales puede tener implicaciones en el futuro para el estadiaje de la enfermedad o la valoración de la enfermedad residual.
La LMC evoluciona durante tres fases de la enfermedad que se caracterizan por la progresión tanto de los rasgos clínicos como de los resultados de laboratorio. La enfermedad se diagnostica en el 85% de los pacientes cuando están en la fase crónica.
Tratamiento de la LMC
El objetivo inmediato del tratamiento de los pacientes con LMC es estabilizar las cifras sanguíneas y alcanzar una respuesta hematológica y citogenética.
La respuesta hematológica consiste en reducir la leucocitosis hasta los valores normales, eliminar las células mieloides inmaduras de la sangre periférica y erradicar los signos y síntomas de la enfermedad.
La respuesta citogenética se basa en el análisis de los aspirados de médula ósea, en la reducción o eliminación de la células Ph+ en sangre o médula ósea y una respuesta citogenética parcial, como la presencia de un 1-35% de células Ph+ detectadas mediante técnicas citogenéticas habituales. En conjunto, las respuestas completas y parciales constituyen una respuesta citogenética mayor. También se pueden usar análisis moleculares para controlar la evolución de la enfermedad, pero no está claro el valor pronóstico de estas técnicas.
Las opciones terapéuticas para el tratamiento de la LMC consisten en: trasplante de células progenitoras hematopoyéticas (TPH), tratamiento con interferón alfa y quimioterapia con hidroxiurea o busulfán.
Trasplante de células progenitoras hematopoyéticas
El trasplante de células progenitoras hematopoyéticas (TPH) alogénico de hermanos HLA (antígeno leucocitario humano), compatibles o donantes no emparentados (DnE), es en la actualidad la única posibilidad de curación. Se han descrito tasas de supervivencia del 40-70% a los 5 años en pacientes que recibieron los trasplantes durante la fase crónica inicial de la LMC. Es preferible realizar el trasplante al año siguiente del diagnóstico y en la fase crónica de la enfermedad. El uso de hidroxiurea previo al trasplante parece mejorar el resultado en relación al uso de busulfán, mientras que la administración prolongada de IFN-alfa en la fase crónica de la LMC antes del TPH puede afectar negativamente al resultado. El retraso en el trasplante y la fase avanzada de la enfermedad parecen tener un impacto negativo sobre el resultado.
El acceso al trasplante está limitado por la disponibilidad de donantes compatibles y por la edad de los pacientes. Los pacientes mayores de 50-55 años no son candidatos al procedimiento debido a la morbilidad y mortalidad asociadas. Sólo el 15-20% de los pacientes son candidatos a un TPH de hermano HLA compatible.
La tasa de recidiva después del TPH puede oscilar desde aproximadamente entre el 10-20%, en los pacientes que son buenos candidatos, hasta el 60-70% en los pacientes que reciben trasplantes en la fase acelerada de la enfermedad. Además, el trasplante se asocia a una morbilidad significativa que incluye enfermedad de injerto contra huésped grave, inmunosupresión y toxicidad orgánica. La tasa de morbilidad es muy variable.
La mortalidad asociada al TPH en la LMC en fase crónica es del 10% en pacientes menores de 50 años en la fase crónica temprana.
Interferón alfa
El interferón alfa (IFN-alfa) es un miembro de la familia natural de proteínas que se producen como respuesta a la división celular y a los estímulos víricos. El mecanismo de acción exacto en la LMC no está claro, pero se sabe que tiene efectos biológicos como la inhibición del crecimiento celular, la regulación de la expresión de citocinas y la modulación inmunitaria.
En la LMC en la fase crónica temprana se han comunicado respuestas citogenéticas completas en el 8-38% de pacientes, con una media de tiempo transcurrido de 12-18 meses. En los pacientes que alcanzan una respuesta citogenética mayor con IFN-alfa, la duración de la fase crónica se prolonga y la supervivencia es más larga. En la enfermedad en la fase crónica tardía y en fase avanzada, IFN-alfa tiene sólo una actividad modesta.
No existen pruebas de curaciones con IFN-alfa como agente único ni en combinación con otros agentes.
La toxicidad de IFN-alfa es alta, más del 90% de los pacientes presentan un síndrome pseudogripal de leve a moderado acompañado de un número amplio de efectos secundarios.
Quimioterapia: hidroxiurea y busulfán
La hidroxiurea (inhibidor de la síntesis del ácido) y el busulfán (agente alquilante) son dos agentes quimiotrópicos orales de elección en pacientes que no son candidatos a TPH e intolerantes a IFN-alfa. Ninguno de estos fármacos inhibe la progresión de la LMC, pero se consideran agentes paliantes de los síntomas producidos por la leucocitosis.
Imatinib
Imatinib es el primer inhibidor de la tiroquinasa disponible en la actualidad para uso clínico. Está indicado en pacientes con LMC en crisis básica, en fase acelerada o fase crónica, después del fracaso con el tratamiento de IFN-alfa. Su acción principal radica en bloquear selectivamente la proliferación celular e inducir la apoptosis en las células que expresan cromosoma Ph+ y albergan la tiroquinasa bcr-Abl, anomalía causante de la LMC.
Imatinib ha mostrado una buena tolerancia y su administración vía oral es cómoda. Este fármaco supone una nueva esperanza en el tratamiento de la LMC y establece un punto de partida para el desarrollo de nuevos fármacos.