Análisis de la Directiva 2004/24
El auge de los medicamentos elaborados a base de plantas medicinales ha llevado a la Unión Europea a legislar de forma específica en este campo. Las autoras en este artículo estudian la Directiva 2004/24/CE del Parlamento Europeo y del Consejo, de 31 de marzo de 2004, por la que se modifica de forma específica, en lo que se refiere a los medicamentos tradicionales a base de plantas, la Directiva 2001/83/CE, por la que se establece un código comunitario sobre medicamentos para uso humano.
La reciente modificación del derecho farmacéutico comunitario comprende la Directiva 2004/27/CE1, el Reglamento 726/2004 y la Directiva 2004/24, relativa a los medicamentos a base de plantas medicinales.
La Directiva 2004/24/CE responde al objetivo de armonizar las distintas normativas de los diferentes Estados miembros en materia de medicamentos con una larga tradición, para facilitar así su comercio y la competitividad entre los fabricantes dentro de la Comunidad.
Sin una normativa específica, la mayoría de estos productos no reunirían los requisitos de eficacia y seguridad que deben demostrar los medicamentos para obtener la autorización de comercialización. Como la mayoría de estos medicamentos, con una larga tradición, son sustancias vegetales, ha sido conveniente comenzar con la aprobación de una directiva específica sobre los medicamentos tradicionales a base de plantas y ampliar en un futuro su ámbito de aplicación a otras categorías de medicamentos.
Con carácter previo al estudio de su contenido conviene especificar que, a pesar de tratarse de una directiva sobre medicamentos tradicionales a base de plantas, viene a incorporar modificaciones a otra directiva, en concreto la Directiva 2001/83/CE, por la que se aprueba el código comunitario sobre medicamentos para uso humano (DO L 136 de 30-4-2004).
En concreto, la Directiva 2004/24/CE incorpora al artículo primero del código nuevas definiciones e inserta un nuevo capítulo en el título III, el Capítulo 2 bis: «Disposiciones particulares aplicables a los medicamentos tradicionales a base de plantas», que comprende una serie de artículos, desde el 16 bis hasta el 16 décimo.
Los puntos más destacables de la directiva sobre medicamentos tradicionales a base de plantas son los siguientes:
* Definiciones.
* Registro para uso tradicional.
* Expediente de registro.
* Causas de denegación de la autorización.
* Etiquetado y prospecto.
* Publicidad.
* Comité de medicamentos a base de plantas.
* Transposición nacional.
Definiciones
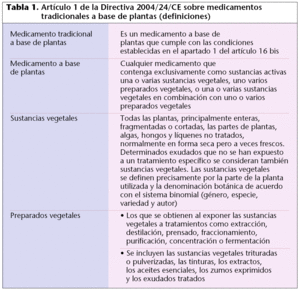
Al artículo primero de la Directiva 2001/83/CE, por la que se establece un código comunitario de medicamentos de uso humano, se incorporan 4 nuevas definiciones, las correspondientes a: medicamento tradicional a base de plantas, medicamento a base de plantas, sustancias vegetales y preparados vegetales (tabla 1).
Registro para uso tradicional
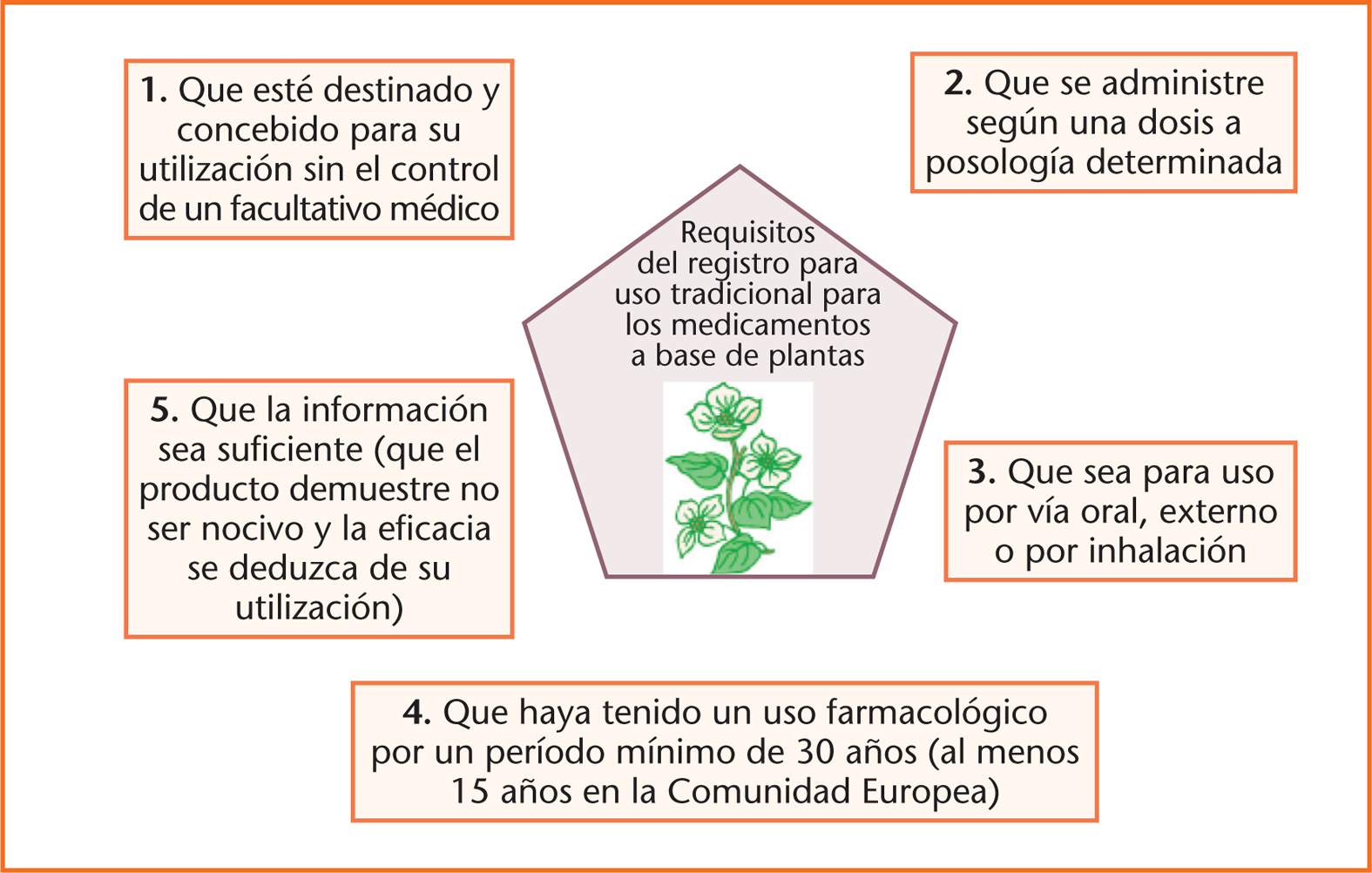
Como novedad destacable, figura el establecimiento de un procedimiento simplificado del «registro para uso tradicional» para los medicamentos a base de plantas que reúnan los siguientes criterios (fig. 1):
Fig. 1. Requisitos del registro para uso tradicional para los medicamentos a base de plantas.
* Que tengan indicaciones apropiadas exclusivamente para medicamentos tradicionales a base de plantas que, por su composición y finalidad, estén destinados y concebidos para su utilización sin el control de un facultativo médico a efectos de diagnóstico o de prescripción o seguimiento de un tratamiento.
* Que se administren, exclusivamente, de acuerdo con una dosis o posología determinada.
* Que se trate de preparados para uso por vía oral, externo o por inhalación.
* Que haya transcurrido el período de uso tradicional según lo establecido en la letra c) del apartado 1 del artículo 16 quater (uso farmacológico durante un período mínimo de 30 años antes de la fecha de la solicitud, de los que al menos 15 años deben ser en la Comunidad Europea).
* Que la información sobre el uso tradicional del medicamento sea suficiente, en particular que el producto demuestre no ser nocivo en las condiciones de uso especificadas y la acción farmacológica o la eficacia del medicamento se puedan deducir de su utilización y experiencia de larga tradición.
La presencia de vitaminas o minerales, cuya seguridad esté bien documentada, en el medicamento a base de plantas no impedirá que el producto esté sujeto a registro simplificado (el registro para uso tradicional), siempre que la acción de las vitaminas sea secundaria con respecto a la de las sustancias activas vegetales en lo referente a la indicación o indicaciones específicas afirmadas.
Independientemente de lo expuesto, si las autoridades competentes consideran que un medicamento tradicional a base de plantas reúne los criterios para un registro completo (con arreglo al artículo 6 o al artículo 14 para medicamentos homeopáticos), lo dispuesto en este artículo no le será de aplicación.
El solicitante y el titular del registro deberán estar radicados en la Comunidad Europea.
Para facilitar el registro de determinados medicamentos a base de plantas en cuanto a su seguridad, la directiva contempla la elaboración de una lista de sustancias vegetales que, cuando cumplan ciertos criterios, no se considerarán nocivas en condiciones normales de uso
Expediente de registro
Se considera, en general, que la larga tradición de un medicamento permite reducir la necesidad de aportar ensayos clínicos en el expediente de registro, ya que la eficacia del medicamento se puede deducir de su utilización y experiencia de larga duración. Lo mismo sucede con las pruebas preclínicas, aunque las autoridades competentes podrán solicitar toda la información que consideren necesaria si existe cualquier preocupación sobre la seguridad del producto, aun siendo éste de larga duración. Para facilitar el registro de determinados medicamentos a base de plantas en cuanto a su seguridad, la directiva contempla la elaboración de una lista de sustancias vegetales que, cuando cumplan ciertos criterios, no van a ser consideradas nocivas en condiciones normales de uso.
En cuanto a la calidad, es independiente de su uso tradicional, y por tanto se deben presentar las pruebas fisicoquímicas, biológicas y microbiológicas necesarias, de igual forma que cualquier otro medicamento.
En el artículo 16 quater se describen de forma detallada los datos y los documentos que deben acompañar a la solicitud de autorización de un medicamento tradicional a base de plantas.
Causas de denegación de la autorización
El registro para uso tradicional se denegará si la solicitud no reúne todos los criterios para este uso; si el solicitante o el titular no están radicados en la Comunidad Europea; si la solicitud no contiene los datos y los documentos requeridos; o si se da, al menos, una de las siguientes condiciones:
* La composición cualitativa y cuantitativa no coincide con la declarada.
* Las indicaciones no respetan las condiciones establecidas en el artículo 16 bis.
* El producto pudiera ser nocivo en condiciones normales de uso.
* La información sobre el uso tradicional es insuficiente, especialmente si los efectos farmacológicos o la eficacia no se deducen de su utilización y experiencia de larga tradición.
* Su calidad farmacéutica no está satisfactoriamente demostrada.
Etiquetado y prospecto
Además de los requisitos para cualquier medicamento, el etiquetado y el prospecto de medicamentos tradicionales a base de plantas contendrán una declaración sobre los siguientes extremos:
* El producto es un medicamento tradicional a base de plantas para uso en una indicación o indicaciones específicas, basado exclusivamente en un uso de larga tradición.
* El usuario deberá consultar a un médico o a un profesional sanitario cualificado si persisten los síntomas durante el uso del medicamento, o si se producen reacciones adversas no mencionadas en el prospecto.
Un Estado miembro podrá exigir que el etiquetado y el prospecto mencionen, asimismo, la naturaleza de la tradición en cuestión.
Toda la publicidad de un medicamento tradicional a base de plantas contendrá la siguiente mención: «Medicamento tradicional a base de plantas para su uso en indicación o indicaciones específicas, basado exclusivamente en un uso de larga tradición»
Publicidad
Además de los requisitos para cualquier medicamento, toda la publicidad de un medicamento tradicional a base de plantas contendrá la siguiente mención: «Medicamento tradicional a base de plantas para su uso en indicación o indicaciones específicas, basado exclusivamente en un uso de larga tradición».
Comité de Medicamentos a Base de Plantas
En el seno de la Agencia Europea de Medicamentos (AEM) se ha creado el Comité de Medicamentos a Base de Plantas. Las competencias asignadas a este comité son las siguientes:
Por lo que se refiere al registro simplificado
* Emitir un dictamen sobre la suficiencia de la experiencia de larga tradición en la utilización del medicamento correspondiente, así como si el producto se ha usado en la Comunidad Europea durante menos de 15 años pero puede acogerse por otros motivos al registro simplificado. El Estado miembro en que se haya presentado la solicitud de registro para uso tradicional remitirá el producto al comité, y éste considerará si cumple plenamente los demás criterios para el registro simplificado. En este caso, si el comité lo considera posible elaborará una monografía comunitaria que deberá tenerse en cuenta por el Estado miembro para adoptar su decisión definitiva.
* Funciones relacionadas con el procedimiento de registro por reconocimiento mutuo.
* Preparará un proyecto de lista de sustancias y preparados vegetales que, cuando cumplan ciertos criterios, no se considerarán nocivas en condiciones normales de uso.
* Elaborará monografías comunitarias sobre medicamentos tradicionales a base de plantas.
Por lo que se refiere a las autorizaciones de medicamentos a base de plantas
Elaborará monografías comunitarias sobre plantas medicinales para los medicamentos a base de plantas.
Peticiones de dictamen
* Se encargará de las peticiones de dictamen presentadas a la AEM en virtud de un reconocimiento mutuo.
* Cuando, para un reconocimiento mutuo, se pida a la AEM su dictamen sobre otros medicamentos que contengan sustancias vegetales, emitirá, si procede, un dictamen sobre la sustancia vegetal.
Otras
Cumplirá cualquier otra función que le sea encomendada en virtud del derecho comunitario.
Transposición nacional
Si se cumple el calendario previsto, todos los Estados miembros, a fecha de 30 de octubre de 2005, deberán haber adoptado las disposiciones necesarias para cumplir con lo establecido en la Directiva.
FE DE ERRORES
En el trabajo titulado «Reducción del precio de las especialidades farmacéuticas y de los márgenes empresariales», publicado el pasado mes de marzo en la sección «Derecho farmacéutico» (Offarm. 2005;24[3]:56-8), se decía, al final del texto, que en relación con las facturaciones de las recetas del SNS, MUFACE, ISFAS y MUGEJU «el mismo criterio y plazos se aplicaron a los precios que entraron en vigor el pasado 1 de marzo de 2006», cuando en realidad debería decir «el mismo criterio y plazos se aplicarán a los precios que entren en vigor el 1 de marzo de 2006».