En todo organismo multicelular adulto debe existir un equilibrio entre la generación o proliferación y la desaparición o muerte de las células que lo componen, con el fin de mantener un tamaño constante. La alteración de este equilibrio conduce a situaciones patológicas como el cáncer, cuando la proliferación se encuentra aumentada, o las enfermedades degenerativas, cuando los procesos de muerte celular están incrementados.
Desde el embrión hasta el organismo adulto fisiológicamente sano, millones de células mueren sin dejar cicatrices ni activar células inflamatorias. Este fenómeno no tiene lugar de una forma aleatoria, sino que se trata de un proceso activo, bien definido genéticamente, en el que las células están destinadas a morir en un tiempo fijado. Así, los episodios que rodean a la muerte celular programada entran a formar parte de los procesos fisiológicos que resultan necesarios para el funcionamiento normal de un organismo.
Durante la historia, la muerte celular fisiológica ha sido conocida por varios nombres. Virchow, en 1858, fue el primer investigador en describir los procesos de muerte celular y, basándose sólo en parámetros macroscópicos, los definió como degeneración, mortificación y necrosis. En 1879, utilizando observaciones microscópicas se introducen los términos Karyorhesis y Karyolysis, que hacen referencia a la desintegración y desaparición del núcleo. Diez años más tarde, Arnheim, propone los términos piknosis y marginación de la cromatina. Flemming, estudiando los folículos de los ovarios de los mamíferos, observó y describió la desaparición de células, denominando a este proceso chromatolisis, término que fue reutilizado por Gräper, en 1914, como antónimo de los procesos de mitosis. Pero no fue hasta 1972 cuando Kerr, Wyllie y Currie implantan el término «apoptosis», ampliamente utilizado en nuestros días, que evoca a la caída de las hojas desde los árboles en otoño o la de los pétalos de las flores. En la última década, hemos sido testigos de un crecimiento exponencial de los trabajos de investigación realizados sobre los procesos que rodean a la muerte celular y parece que se ha llegado al consenso de englobarlos en dos grandes grupos: necrosis y apoptosis.
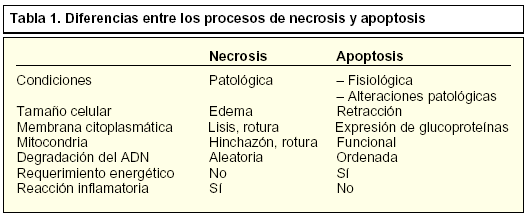
El término necrosis reúne los procesos violentos y catastróficos, donde la degeneración celular es pasiva sin un requerimiento de energía en forma de ATP. Aparece frecuentemente como consecuencia de un daño traumático o por la exposición a toxinas. En ella tiene lugar la pérdida aguda de la regulación y de la función celular que conlleva un proceso osmótico desmesurado y finaliza con la lisis de la membrana celular, liberando el contenido intracelular. Este fenómeno conduce a las células vecinas también hacia la muerte, atrayendo, al mismo tiempo, a las células inflamatorias, lo que hace que en las áreas donde se observan células necróticas sea frecuente encontrar nuevas células que desarrollan este tipo de muerte celular, además de originar una reacción de inflamación y una cicatriz fibrosa que deforma el tejido y el órgano afectado.
El segundo tipo de muerte celular es conocido como apoptosis o muerte celular programada. En este proceso las células se autodestruyen sin desencadenar reacciones de inflamación ni dejar cicatrices en los tejidos. La apoptosis es por tanto considerada como una muerte natural fisiológica, resultando en un mecanismo de eliminación de células no deseadas, dañadas o desconocidas y que desempeña un papel protector frente a posibles enfermedades.
Las rutas apoptóticas, por tanto, intervienen en algunos procesos fisiológicos, a saber:
Las etapas de desarrollo donde se producen células en exceso. En el refinamiento de la inervación al retirar aquellas neuronas menos capacitadas, a modo de selección celular darwiniana en el sistema nervioso, en la apertura de los orificios en el tubo digestivo, en la formación de órganos como los riñones o en la remodelación de los huesos y cartílagos y durante la morfogénesis de los dedos en la eliminación de las áreas interdigitales. Como dato curioso, mencionaremos que los procesos de apoptosis son los responsables de que los humanos tengamos cinco dedos en cada extremidad y que su ausencia, por ejemplo, en las aves palmípedas les hace conservar su característica pata palmeada.
La selección de linfocitos. Al mediar en la eliminación de aquellos que reconocen antígenos propios y en la eliminación de células infectadas o tumorales por histólisis y también, en los mecanismos de defensa frente a tumores en que intervienen células que incluyen los linfocitos T citolíticos, las natural killer y los macrófagos.
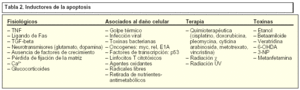
No obstante, dependiendo de la etiología, los procesos apoptóticos pueden resultar perjudiciales, siendo responsables de diversas afecciones (ver tabla) y su desregulación conduce a situaciones patológicas. Así, aumentos en áreas del sistema cardiovascular como el nodo sinusal, pueden causar arritmias paroxísticas en el nodo AV o en el haz de His pueden originar bloqueos o reentradas y en el miocardio contráctil conducir a miocardiopatías dilatadas o displasia arritmogénica. En los vasos con lesiones arterioscleróticas, un aumento de los procesos apoptóticos, puede ocasionar inestabilidad de las placas y contribuir, asimismo, en la respuesta a la lesión postangioplastia y originar una displasia fibromuscular focal y degeneración de la capa media de las arterias coronarias. En pacientes con enfermedades neurodegenerativas se ha observado una disminución en el número de células en determinadas poblaciones neuronales, por ejemplo, en la enfermedad de Alzheimer (EA) aparece una depleción en neuronas colinérgicas del hipocampo, amígdala y corteza. En la enfermedad de Parkinson (EP) son las neuronas dopaminérgicas de la sustancia nigra y ganglios basales las afectadas, mientras que en enfermedades como la de Huntington son las neuronas de los ganglios basales y del tálamo y, por último, en la esclerosis lateral amiotrófica (ELA) se han descrito disminuciones en la población de motoneuronas. Esta pérdida neuronal se refleja en la aparición de disfunciones como alteraciones en los procesos de memoria y lenguaje en la EA, modificación en el control y la coordinación del movimiento en la EP, disminución en las capacidades intelectuales y aparición de movimientos irregulares e involuntarios de las extremidades o de los músculos de la cara en la enfermedad de Huntington y la progresiva paralización de los músculos que intervienen en la movilidad, el habla, la deglución y la respiración en la ELA.
Características morfológicas
Los procesos apoptóticos se caracterizan por cambios morfológicos como:
Aumento brusco de la densidad intracelular. El retículo endoplasmático se dilata, formando vesículas y fusionándose con la membrana plasmática, eliminando así su contenido al medio extracelular. Esta rápida, pero selectiva, salida de fluidos de iones intracelulares se encuentra mediada por transportadores iónicos (cotransportador cloro-potasio-sodio, que inhibe la pérdida de agua y sodio de las células afectadas).
Incremento moderado, pero sostenido, de la concentración de calcio libre citoplasmática ([Ca+2]i), diferencia clara frente a los procesos de necrosis, donde su aumento es drástico.
Cambios en la composición de la membrana celular. Translocación de grupos glicanos a la superficie celular que van a actuar como señal de reconocimiento, permitiendo la unión de fagocitos y, de esta manera, evitando la liberación del contenido celular y la posible reacción de inflamación.
Alteración en la conformación de elementos del citoesqueleto. Como consecuencia aparece una deformación, resultado de la actividad de las proteasas, modificándose el transporte intracelular retrógrado de factores de crecimiento y de proteínas.
Aumento y activación de la síntesis de determinadas proteínas necesarias en las rutas metabólicas de los procesos de muerte celular.
Condensación y fragmentación de la cromatina, por acción de endonucleasas endógenas, en fragmentos denominados oligonucleosomas.
Técnicas de determinación
Las técnicas utilizadas para la detección de la participación de los procesos de apoptosis están basadas, fundamentalmente, en los cambios descritos en el apartado anterior. Entre ellas, las más utilizadas son:
El uso de fluorocromos capaces de intercalarse en el ADN que permiten visualizar, gracias a la ayuda del microscopio, la morfología de la cromatina. Estos colorantes, como el etidio, propidio y hoechst, son utilizados con frecuencia en citometría de flujo y aplicaciones como la hipoploidía hacen de ella una técnica cuantitativa.
La microscopia electrónica que permite la visualización en detalle de la cromatina sin necesidad de tinción específica.
La electroforesis en geles de agarosa de ADN aislado de tejidos o de cultivos celulares que, teñidos con colorantes como el yoduro de etidio, permiten el análisis de la integridad del genoma.
La tinción TUNEL, basada en la capacidad que presentan los extremos del ADN hidrolizados por la endonucleasa a unirse a una cadena de dioxigenina dUTP. El uso de técnicas immunológicas permite su identificación posterior.
El marcaje de fostatidilserina en el lado extracelular de la membrana citoplasmática con la proteína annexina V.
Durante los procesos de muerte celular se pueden distinguir tres etapas: activación, propagación y ejecución.
Fase de activación
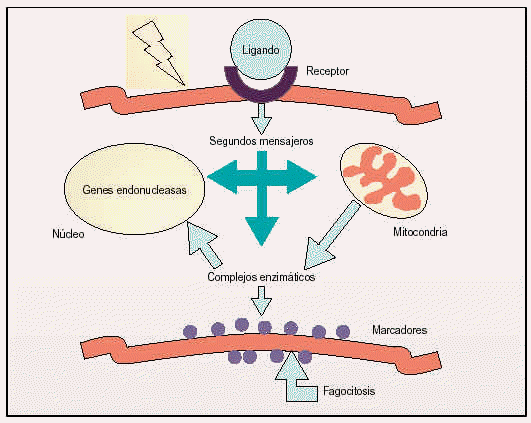
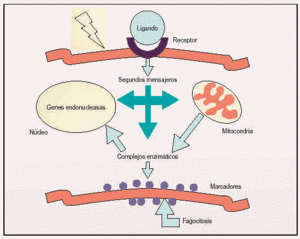
Los procesos apoptóticos pueden ser activados bien por una inducción negativa (como la pérdida de una actividad supresora, la falta de factores de crecimiento o la disminución de los contactos con las células que la rodean) o por una inducción positiva como es el resultado de la unión de un ligando a un receptor o la recepción de señales conflictivas. Por otro lado, los mamíferos presentan mecanismos que permiten al organismo dirigir a células individuales a la autodestrucción, apoptosis «instructiva», especialmente importante en el sistema inmunológico.
Fig 1. Rutas celulares activadas durante los procesos apoptóticos.
Receptores
Localizados preferentemente en la membrana citoplasmática, los receptores establecen conexiones con el espacio extracelular y reciben continuamente señales desde el exterior y de las células vecinas. Los receptores que participan en los procesos de muerte celular se pueden clasificar en dos grupos: aquellos cuya activación siempre conduce a la muerte de la célula, conocidos como «receptores de muerte» --receptor Fas y receptor del factor de necrosis tumoral (TNF)-- y aquellos que desempeñan una función fisiológica, pero su sobreactivación puede conducir también a la muerte (receptores de glutamato, de trombina y canales iónicos dependientes de voltaje).
Los receptores de muerte se caracterizan por presentar un dominio extracelular, rico en cisteína y un segundo dominio de localización citoplasmática conocido como el «dominio de la muerte» que es el responsable de la activación de la maquinaria apoptótica. Una vez activados, los receptores transfieren la información al interior celular mediante un sistema complejo de interacciones proteína-proteína que activan diversas cascadas intracelulares.
La proteína transmembrana Fas, en su porción intracelular, enlaza con FADD (factor associated death domain), activando las caspasas 8 y 10. Este receptor y su ligando desempeñan un papel importante en modelos apoptóticos como son la supresión periférica de las células T maduras al final de una respuesta inmune, la muerte de células diana (células infectadas por virus), la destrucción de células cancerosas mediada por células T citotóxicas y por natural killer, así como la eliminación de las células inmunes reactivas a tumores que expresan constitutivamente el ligando de Fas.
El receptor para el TNF conecta con complejos como el TRADD (TNFR-associated death domain) que actúa como una plataforma de adaptación para reclutar moléculas de señalización, como la proteína de interacción con el receptor, y activa factores de transcripción (NFk B y el JNK/AP-1). A diferencia de Fas, el receptor de TNF raramente activa procesos de apoptosis, a menos que la síntesis de proteínas se encuentre bloqueada, sugiriendo la existencia de factores celulares que suprimen los estímulos apoptóticos generados por el TNF.
El factor de crecimiento nervioso (NGF) es una neurotrofina que desempeña un papel crucial en el desarrollo de determinadas áreas del sistema nervioso. Sus acciones están mediadas por receptores unidos a cinasas de tirosina (TrKA) y por el receptor p75. Este último posee un dominio de muerte que activa rutas paralelas, como la cascada de cinasas conocidas genéricamente como cinasas de proteínas activadas por estrés, o el factor de transcripción NF-kB, conjuntamente con la cascada de caspasas y en algunos modelos es mediada por la ceramida.
Por último, los receptores del aminoácido neurotransmisor glutamato participan en más del 80% de las sinapsis excitadoras del SNC y se han relacionado con los procesos que rodean a la memoria y a la transmisión nerviosa. Sin embargo, su sobreestimulación puede desencadenar la muerte neuronal --excitotoxicidad-- descrita en los procesos como isquemia/reperfusión, infarto, esclerosis lateral amiotrófica o enfermedad de Parkinson.
Rutas de señalización
Entre los segundos mensajeros que participan en los procesos de muerte celular más estudiados se encuentran el calcio y las especies reactivas del oxígeno, aunque recientemente están adquiriendo gran importancia otros como la ceramida y algunas proteínas tales como factores de transcripción (p53) y oncogenes (c-myc, familia de bcl). La activación de estos segundos mensajeros suele conducir a la disfunción de las organelas citoplasmáticas, como la mitocondria y el retículo endoplásmico, o la regulación de la actividad de complejos enzimáticos como cinasas y fosfatasas que a su vez regulan la función de otras proteínas.
Durante el procesamiento normal de señales (la contracción de la fibra muscular, la secreción de neurotransmisores) tienen lugar aumentos transitorios de la [Ca2+]i. Sin embargo, incrementos aberrantes pueden producir daño celular y en algunos casos su muerte. En estos procesos, el calcio puede activar enzimas como proteasas y lipasas, induciendo la producción de radicales libres, además de regular y potenciar la expresión génica al modular la actividad de factores de trasncripción.
El papel de las EROS fue revisado con detalle en el trabajo de Paredes y Roca en esta Revista. En condiciones fisiológicas, las células presentan un equilibrio entre la generación de radicales libres y los sistemas antioxidantes de defensa. En algunos procesos de muerte celular se ha descrito la ruptura de este equilibrio, observándose un aumento en la oxidación de proteínas con la f ormación de grupos carbonilo y peroxidación lipídica, habiéndose demostrado la existencia de una localización compartimentada de derivados carbonílicos libres a partir de lípidos, proteínas, hidratos de carbono y ácidos nucleicos (2,4-dinitrofenilhidracina).
La ceramida empieza a ser considerada como un segundo mensajero que participa en los procesos de muerte celular. Es un glucolípido sintetizado en el retículo plasmático y en las mitocondrias, cuya mayor concentración se localiza junto a la porción interna de la membrana plasmática. Su traslocación a la mitocondria provoca cambios iónicos entre la matriz mitocondrial y el citoplasma, produciendo un descenso del potencial transmembrana mitocondrial y la formación del poro de permeabilidad transitoria mitocondrial, conduciendo a la apoptosis. Los valores de ceramida pueden ser aumentados tanto por factores externos (radiación UV, agentes oxidantes), como a través de receptores de membrana (FasR y TNFR) o directamente por glucocorticoides. Alteraciones no corregidas del ADN, en especial mutaciones cancerígenas, activan el p53 que provoca apoptosis a través de un mecanismo mediado por ceramida.
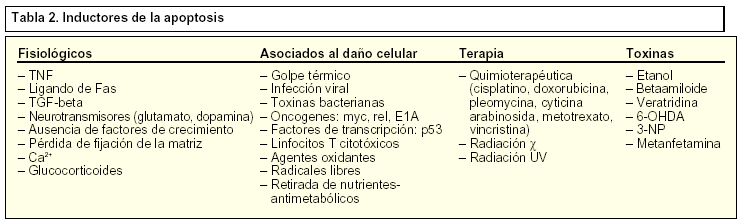
Durante algunos procesos de muerte celular es necesaria la síntesis de novo de proteínas. Entre las familias de genes que median la destrucción controlada de la célula, destacan los conocidos como genes de respuesta inmediata, al que pertenecen proteínas como c-jun y c-fos. Otros genes que participan activamente en los procesos apoptóticos son p53, c-myc y la familia de Bcl-2. El gran número y diversidad de genes envueltos en la muerte celular muestra la complejidad de los procesos de apoptosis en el ámbito genético (tablas 1 y 2).
La proteína p53 es un factor de transcripción que es activado en respuesta al daño en el ADN. Aumentos en los valores p53 conducen a la inducción en la transcripción de otros genes como p21/WAF1/Cip 1, un inhibidor de proteínas cinasas reguladas por ciclinas, inhibiendo la entrada en fase S del ciclo celular. El resultado neto de estas interacciones es una parada en fase G1, la cual provee de una barrera cinética en la replicación de un genoma potencialmente dañado. Si la célula no puede reparar el daño genético, p53 induce la muerte celular por un mecanismo que todavía no se conoce. Se ha postulado que este proceso puede estar mediado por aumentos en la síntesis de Bax, una proteína de la familia de Bcl-2 con propiedades proapoptóticas. De esta manera, p53 se convierte en el guardián del genoma y, por extensión, del organismo, vigilando la correcta reparación de las alteraciones genéticas originadas por diversos factores externos. Un mal funcionamiento del gen p53 puede promover el desarrollo de tumores al permitir la proliferación de células que no han completado la reparación del ADN.
Bcl-2 da nombre a una familia de oncogenes en los que se encuentran miembros que favorecen la supervivencia celular (Bcl-X y Bcl-2) mientras que otros (Bid, Bad, Bax) ayudan al suicidio celular. Estas proteínas antagonistas forman dímeros unos con otros, siendo su abundancia relativa la que determina el umbral de desencadenamiento de la muerte celular. La expresión de Bcl-xL es indispensable, por ejemplo, para la supervivencia de los linfocitos embrionarios, mientras que los linfocitos de los ratones que carecen de Bcl-2 perviven con normalidad hasta el nacimiento aunque desaparecen, todos ellos, pocos días después. La sobreexpresión de bcl-2 y de bcl-xl confiere a las células protección frente a agentes tóxicos.
Por último, el protooncogén c-myc desempeña un papel decisivo tanto en procesos de proliferación celular como de apoptosis. Así, se ha descrito que mientras su ablación conduce a la parada de la proliferación celular, su sobreexpresión es un estímulo apoptótico.
Fase de decisión
Una vez que la célula recibe una señal de muerte, debe decidir si debe sobrevivir o desencadenar los procesos de muerte. En esta fase de decisión se ha situado a la mitocondria como organelo fundamental. La función de ésta fue objeto de estudio por nuestro grupo de investigación en una revisión previa en esta Revista. Uno de los acontecimientos principales que tienen lugar en la mitocondria es la alteración de la permeabilidad de sus membranas debido a la formación de un complejo multiproteico (poro de permeabilidad transitoria mitocondrial) que conduce a la liberación del contenido intramitocondrial como el citocromo C, el factor inductor de apoptosis y miembros de la familia de caspasas. Otros episodios son alteraciones en la cadena transportadora de electrones, pérdida del potencial electroquímico de membrana y cambios del ciclo metabólico de óxido/reducción.
Fase de ejecución
Una vez que la célula ha tomado la decisión de morir, en su interior se produce una serie de procesos bioquímicos que conducen a la degradación de proteínas y de la cromatina.
La proteólisis, a diferencia de la mayoría de las modificaciones postranslacionales, es irreversible y quizás por ello es altamente específica. Regula fenómenos biológicos críticos en los que se ve involucrado un grupo reducido de sustrato. La mayoría de las proteasas son sintetizadas como precursores de muy baja actividad catalítica que son activados por procesamiento proteolítico mediado por la unión a un cofactor o por la retirada de un inhibidor.
Entre las proteasas implicadas en los procesos de muerte celular se encuentran las caspasas, las calpaínas, la granzima B y el complejo multiproteico denominado proteosoma.
Las caspasas son una familia de cisteína-proteasas que han sido reconocidas como los homólogos en mamíferos del producto del gen proapoptótico ced-3 del nematodo C. elegans. Éstas se engloban en tres grupos: caspasas implicadas en la producción de citocinas (caspasas 1, 4, 5 y 13), caspasas de señalización o de activación de otras caspasas (caspasas 2, 8, 9 y 10) y caspasas efectoras de muerte o ejecutoras (caspasas 3, 6 y 7) las cuales hidrolizan sustratos selectivos.
La activación de las caspasas puede tener lugar en respuesta a estímulos tanto extracelulares como intracelulares. Éstas hidrolizan secuencias específicas de tetrapéptidos que contienen un residuo aspartato. Entre sus sustratos se encuentran: elementos del citoesqueleto (actina, fodrina, proteína Tau y catenina), enzimas encargadas de reparar (PARP) o degradar (ADNasa) el ADN celular, factores de transcripción (retinoblastoma, HDM2), proteínas reguladoras (proteína cinasa C, fosfatasas 2A, cinasas de adhesión focal), así como miembros de la familia del oncogén Bcl-2 (Bid).
Las calpaínas son cisteína proteasas que requieren Ca2+ para su traslocación hasta la membrana citoplasmática, rápida autólisis y activación. Entre sus sustratos se encuentran también factores de transcripción, oncogenes, proteínas de membrana y del citoesqueleto. Éstas están sobreactivadas durante procesos excitotóxicos e isquémicos y en patologías como la enfermedad de Alzheimer.
Dianas farmacológicas
Estas diferencias entre apoptosis y necrosis son críticas en la observación del desarrollo de los tratamientos clínicos. La naturaleza controlada de la vía apoptótica permite la intervención o interrupción en la progresión de las patologías degenerativas. Sin embargo, en los casos de necrosis, el daño celular es irreversible e imparable.
El conocimiento del mecanismo de señalización intracelular, desde la activación de receptores hasta la fase ejecutora, está permitiendo establecer nuevas dianas farmacológicas en diversas enfermedades como el cáncer, enfermedades neurodegenerativas y el sida. El estudio de estas vías de señalización hace posible la intervención y, en algunos casos, la interrupción de la progresión de los procesos de muerte celular.
Son varias las líneas abiertas dentro de este campo de investigación debido a que la mayoría de las células están programadas genéticamente para el suicidio, hecho que se encuentra reforzado por los resultados obtenidos con la utilización de fármacos inhibidores de la síntesis de proteínas que previene a las células frente a determinados estímulos. Otras se centran en el diseño y estudio de fármacos que bloquean los incrementos descontrolados de la [Ca2+] en el interior de la célula con el fin de ampliar el abanico de fármacos utilizados en patologías cardíacas y neurodegenerativas. Destacan también los avances realizados en fármacos antioxidantes o en moduladores de la trascripción habiéndose obtenido resultados esperanzadores en modelos experimentales. No podemos dejar de lado el gran avance realizado en el campo de las enzimas degradadoras, destacando algunos tetrapéptidos sintéticos inhibidores de caspasas.
Por último, recordaremos que el estudio de los procesos de muerte celular nos permite también poder activarla en poblaciones de células no deseadas, como es el caso del cáncer. La activación de los receptores de muerte para inducir apoptosis en células cancerosas resulta atractiva, más aún cuando, a diferencia de la mayoría de los agentes quimioterapéuticos o la radioterapia, los receptores de muerte inician la apoptosis de forma independiente a la proteína p53, que se encuentra mutada en más de la mitad de los cánceres. La utilidad clínica tanto de TNF como del ligando de Fas ha sido pobre debido a sus efectos tóxicos colaterales. La administración sistémica de TNF puede ocasionar un síndrome de respuesta inflamatoria que recuerda el golpe séptico y, por otro lado, la de un anticuerpo agonista de Fas resulta letal en ratones portadores de tumores, por la inducción de apoptosis en los hepatocitos. Sin embargo, Apo2L o TRAIL, un ligando para los subtipos de receptores de TNF implicados en apoptosis, presenta diferencias con el propio TNF y con el ligando de Fas que le convierten quizás en un agente más adecuado. La diferente afinidad por los subtipos de receptores y la expresión diferencial de receptores señuelo y de muerte puede convertir a Apo2L en un inductor apoptótico en células tumorales, pero no en células normales.
Bibliografía general
Deigner HP, Kinscherf R. Modulating apoptosis: current applications and prospects for future drug development. Curr Med Chem 1999;6:399-414.
Diez J. Apoptosis en enfermedades cardiovasculares. Rev Esp Cardiol 2000;53:267-74.
Huang Z. Bcl-2 family proteins as targets for anticancer drug design. Oncogene 2000;19:6627-31.
Jordán J. Avances en el tratamiento de las enfermedades neurodegenerativas. Offarm 2003;22:102-12.
Jordán J, Galindo MF, Ceña V, González-García C. Cisteína proteasas y neurodegeneración. Rev Neurol 2000;3:333-40.
Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer 1972;26:239-57.
Paredes F, Roca JJ. Influencia de los radicales libres en el envejecimiento celular. Offarm 2002;21;7:96-100.
Reed JC. Apoptosis-based therapies. Nat Rev Drug Discov 2002;1:111-21.
Tornero D, Ceña V, Jordán J. La mitocondria como diana farmacológica en los procesos neurodegenerativos. Offarm 2002;21(11):126-30.
Van Cruchten S, Van Den Broeck W. Morphological and biochemical aspects of apoptosis, oncosis and necrosis. Anat Histol Embryol 2002;31:214-23.