El cáncer de mama es una enfermedad compleja, heterogénea y multifactorial, en la que intervienen tanto factores genéticos como no genéticos. Sólo el 5-10% de cánceres de mama son hereditarios; el 90% restante tiene también un componente genético, pero es esporádico, es decir, no heredable. En el presente trabajo se analizan los factores de riesgo y protectores del cáncer de mama, los genes involucrados en su desarrollo y las implicaciones clínicas de su conocimiento molecular.
Todo cáncer tiene un componente genético aunque sólo un 0,1-10%, dependiendo del cáncer, es hereditario. En el caso del cáncer de mama, alrededor del 5-10% es hereditario, es decir, sólo una pequeña proporción es consecuencia de uno o más genes mutados, heredados de los progenitores, mientras que el 95% restante se produce de forma esporádica.
En otras palabras, la mayoría de los estudios demuestran que los cánceres de mama se producen por otros factores no heredables, pero que conducen a la mutación de un gen que, en consecuencia, dará origen al desarrollo de las células cancerígenas.
El cáncer de mama hereditario o esporádico es una enfermedad compleja y heterogénea causada por múltiples factores genéticos y no genéticos que, combinados, alteran primeramente el ADN de una única célula. Ésta adquiere capacidades proliferativas anormales, desarrollándose el tumor y, consecuentemente, la invasión del resto de tejidos.
Efectos acumulativos de la exposición a distintos factores ambientales hacen que el avance de la edad sea el mayor factor de riesgo para presentar este tipo de cáncer. En los países occidentales es una de las principales causas de muerte entre las mujeres de 40-55 años. El porcentaje de casos ha aumentado en las últimas décadas, aunque también se ha registrado un notable aumento de las expectativas de vida. Se trata de un grave problema de salud pública y es por esto que se están destinando muchos recursos en investigaciones en biología celular, mediante las técnicas de biología molecular, para intentar buscar alguna respuesta a esta enfermedad.
En los últimos años se han descrito diversos genes relacionados con el cáncer de mama. Dos de ellos, BRCA1 y BRCA2 (el nombre viene del inglés breast cancer o cáncer de pecho), parece que por ahora son los más importantes, aunque no se descartan otros genes BRCA X. Estos dos genes se asocian particularmente con el cáncer de mama hereditario, pero existen otros genes como Rb, p53 y NF-1 que se pueden encontrar mutados tanto en cánceres de tipo esporádico como hereditario.
Cada día surgen nuevas teorías sobre el origen genético del cáncer de mama. Cada día se descubren nuevos genes implicados en el desarrollo de esta enfermedad, nuevas funciones de éstos y nuevas iteraciones entre ellos. Todo ello ha abierto un nuevo camino hacia el desarrollo de nuevas técnicas de diagnóstico molecular para poder prevenir de forma eficaz este tipo de cáncer.
Factores de riesgo y protectores
Historia familiar y riesgo hereditario
En los últimos 20 años de investigación epidemiológica se han identificado varios factores de riesgo al cáncer de mama y otros factores que actúan como agentes protectores.
Tal como hemos contado, el cáncer de mama hereditario representa un 5-10% de todos los casos de cáncer de mama y presenta varias características distintivas cuando se compara con el cáncer de mama esporádico.
La edad de aparición de cáncer de mama hereditario es considerablemente inferior a la de los casos esporádicos; la prevalencia de cáncer de mama bilateral es más alta e incluso en algunas familias aparecen otros tumores asociados entre los que se encuentran los de ovario, colon, próstata, endometrio y sarcomas1.
La menarquia temprana y la menopausia tardía también se han asociado a un mayor riesgo de cáncer de mama
Aparte de la predisposición genética heredable, existen otros factores ambientales que pueden acelerar el desarrollo o ser la causa del inicio del cáncer de mama.
Un ejemplo de ello es la exposición acumulativa de las glándulas mamarias a los estrógenos y supuestamente la progesterona. Estas hormonas actúan de forma sinérgica e intervienen en el proceso de la división celular, dando lugar a una proliferación de las células epiteliales de la mama. Esta proliferación celular vuelve a las células mamarias más susceptibles a errores genéticos, puesto que aumentan el número de divisiones celulares y, con ello, aumenta el riesgo de que se produzcan errores genéticos durante la replicación del ADN, lo que puede llevar al desarrollo de un fenotipo maligno.
Por otro lado, la menarquia temprana y la menopausia tardía también se han asociado a un mayor riesgo de cáncer de mama, ya que al maximizarse el número de ciclos ovulatorios aumenta el afecto acumulativo de las dosis de estrógenos en el epitelio mamario.
También el consumo excesivo de alcohol (3-4 vasos por día) parece que aumenta las concentraciones plasmáticas de estrógenos, pudiendo conferir un pequeño aumento del riesgo de presentar este tipo de cáncer.
En contrapartida, la edad temprana del primer embarazo, juntamente con la lactancia y la actividad física regular, son factores protectores o preventivos que pueden disminuir el riesgo de presentar el cáncer de mama.
Existen otros factores de agrupamiento familiar de cáncer de mama (que de entrada podemos pensar que se trata de un cáncer hereditario) que pueden explicar esta mayor prevalencia en determinadas familias, como la exposición a determinados carcinógenos ambientales limitados en zonas geográficas y la edad tardía del nacimiento del primer hijo, que puede estar condicionada por influencias socioeconómicas.
Cáncer esporádico, no hereditario
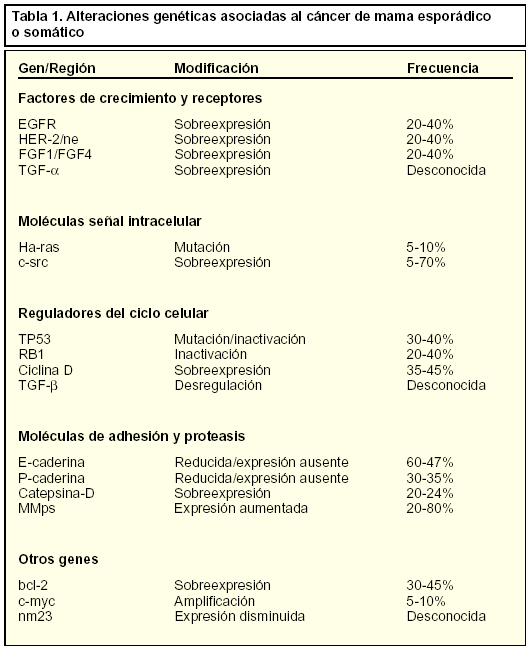
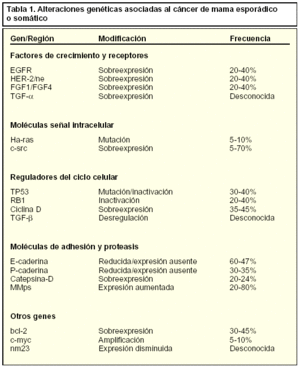
Aunque el cáncer hereditario, por sus características, es seguramente el más estudiado, la gran mayoría de los tumores de cáncer de mama no obedecen a patrones de herencia y se asocian a distintas alteraciones genéticas somáticas, es decir, que no afectan a las células germinales. En la tabla 1 se relacionan las distintas alteraciones genéticas asociadas al cáncer de mama esporádico o somático.
Los tumores cancerosos esporádicos se asocian a mutaciones (errores puntuales en los aminoácidos que configuran los genes), deleciones (eliminación de una región del gen) y amplificaciones (varias copias de un mismo gen) de distintos genes.
Por otro lado, al igual que el cáncer de mama hereditario, el cáncer de mama esporádico también está condicionado por los distintos factores ambientales contados anteriormente.
Aunque no se han identificado todos los genes o mutaciones relacionadas con este tipo de cáncer, se han encontrado algunas regiones cromosómicas comunes en el cáncer de mama, algunos genes mutados y otros desregulados. Se trata de distintos genes con funciones muy distintas como factores de crecimiento, moléculas que actúan como señales intracelulares, reguladores del ciclo celular y moléculas de adhesión.
Genes involucrados
El 5-10% de los cánceres mamarios son el resultado de la herencia autosómica dominante de un gen mutado, mientras que el 95% restante es debido a mutaciones esporádicas en las células somáticas.
BRCA1 y BRCA2
Las primeras evidencias de que existía un gen dominante de la susceptibilidad al cáncer de mama surgieron en 1984 mediante un modelo estadístico utilizado por Williams y Anderson a partir del estudio de 200 familias2. Este primer estudio, junto a otros posteriores, pusieron en evidencia que las mutaciones en el gen BRCA1 daban lugar a la aparición de síndrome de cáncer de mama y ovario en el 90% de los casos (el 45% sólo de mama).
Posteriormente, se localizó otro gen relacionado con esta susceptibilidad que se identificó como BRCA2. Los estudios del gen BRCA2 han puesto en evidencia que es el responsable del 35% de los cánceres de mama hereditarios en mujeres y de un 14% del cáncer de mama en varones3.
Los primeros estudios epidemiológicos llegaron a atribuir el 90% de los casos de cáncer de mama hereditario a los genes BRCA, mientras que estudios recientes cifran esta prevalencia entre el 45 y el 68%4.
Se han descrito alrededor de 600 mutaciones distintas en el gen BRCA1 y más del 75% dan origen a una proteína truncada, incrementando el riesgo del desarrollo del cáncer de mama entre los 40 y 50 años, el cáncer de ovario, el cáncer de próstata y el cáncer de colon.
Este gen se halla ubicado en el brazo largo del cromosoma 17 (17q21) y codifica para una proteína encargada de regular el proceso de reparación del ADN.
La proteína BRCA1 interviene en las fases S y G2 del ciclo celular. Cuando se produce un daño en el ADN, la proteína BRCA1 se hiperfosforila y se relocaliza en los sitios de síntesis de ADN, formando un complejo con otras proteínas como la BRCA2 y la Rad51, encargadas de reparar el daño al ADN asociado a la replicación.
El gen BRCA1 parece que regula los genes para encontrar y reconocer el daño del ADN y se cree que induce la expresión de genes reparadores que trabajan para reducir el daño y ayudar a la replicación del ADN5. Por otro lado, este gen se expresa en las células de los distintos epitelios del organismo durante el desarrollo. Su expresión se ve aumentada durante el embarazo y diminuye tras el parto. Se ha observado que BRCA1 es inducido por estrógenos. La inhibición de este gen, causa un aumento de la proliferación de células del epitelio mamario.
La expresión normal del gen BRCA1 se ha demostrado en ratas de experimentación que puede inhibir el crecimiento de células tumorales de mama y ovario, mientras que una deleción de los 10 últimos aminoácidos de BRCA1 es suficiente para abolir esta capacidad inhibidora tumoral.
Un gran número de tumores de mama y ovario de las pacientes portadoras de mutaciones presentan la pérdida de la copia normal del BRCA1, quedando sólo la forma que contiene la mutación heredada. Esto es lo que se denomina pérdida de la heterocigosidad (LHO).
Respecto al gen BRCA2, se han descrito unas 450 mutaciones y, al igual que las mutaciones del BRCA1, muchas son de significado incierto. Las mutaciones de BRCA2 se hallan asociadas a un riesgo incrementado para el desarrollo de diversos cánceres, como el de mama femenino y masculino, el de ovario, de próstata, de páncreas y de laringe.
BRCA2 se halla ubicado en el brazo largo del cromosoma 13 (13q 12-13). Al igual que BRCA1, el producto génico de BRCA2 está involucrado en el proceso de reparación del ADN, formando un complejo multiproteico con otras proteínas como la Rad 51, BARD1 y BRCA1.
Por otro lado, parece que existe una relación sinérgica de BRCA2 con el gen p53. El gen p53, al igual que BRCA1 y BRCA2, es un gen supresor de tumores, pero, a diferencia de los dos primeros, se encuentra mutado en la mitad de los casos de cáncer en general6.
En resumen, aunque los genes BRCA1 y BRCA2 son responsables de un alto porcentaje de cánceres hereditarios de mama y ovario, es importante destacar que una mujer portadora de alguno de estos genes no nace con la certeza absoluta de presentar cáncer, sino con una predisposición para desarrollarlo. En las mujeres la herencia a través de la línea germinal (ya sea a través del óvulo o el espermatozoide de sus progenitores) de una mutación en uno de los alelos no es suficiente para desarrollar la enfermedad y se requieren otros factores u otras mutaciones para que se desarrolle el cáncer.
Otros genes de predisposición
A través de distintos estudios familiares se han identificado diferentes síndromes que se heredan de forma autosómica dominante, es decir, los hijos de progenitores afectados tienen el riesgo del 50% de presentar estas enfermedades; sin embargo, no están ligados a los genes BRCA.
El síndrome de Li-Fraumeni se hereda de forma autosómica dominante con alta penetrancia. La alteración genética se basa en la mutación en el gen p53 localizado en el brazo corto del cromosoma 17 (17p13.1)7.
Esta mutación supone un riesgo aumentado para el desarrollo de múltiples neoplasias, tales como sarcomas de partes blandas, osteosarcomas, tumores cerebrales y cáncer de mama (frecuentemente bilateral y comienzo en edades tempranas). El 77% de los casos de mujeres con este síndrome que presentan cáncer de mama se diagnostica entre los 22 y 45 años; el 25% presenta tumores bilaterales.
Esta alteración no es una explicación común para la aparición del cáncer de mama en la población, puesto que sólo se presenta en un 1% de las mujeres con edades inferiores a 40 años.
La posibilidad de identificar los genes asociados a la aparición del cáncer de mama abre una serie de interrogantes
Otro síndrome que representa un pequeño aumento en la incidencia de cáncer de mama es la enfermedad de Cowden, que también es de herencia autosómica dominante, pero con baja expresión. El gen mutado es un gen supresor de tumores, igual que los BRCA, denominado PTEN y se halla ubicado en el brazo largo del cromosoma 10 (10q23).
Ser portador de este gen mutado supone un riesgo elevado para el desarrollo de cáncer de mama y tiroides. El cáncer de mama afecta al 90% de las mujeres portadoras de este síndrome, con edad media de diagnóstico alrededor de los 40 años.
La asociación entre el cáncer de mama y ovario fue descrita por Lynch. El síndrome de Lynch está relacionado con una mutación en el cromosoma 17 (17q21). Se estima que el riesgo de cáncer de mama u ovario, entre las portadoras de este síndrome, es del 46%.
Existen otros tipos de cánceres de mama hereditarios, sin asociación a otras neoplasias, con un patrón hereditario de cáncer tardío como las mutaciones que afectan al gen ER. La frecuente expresión de este gen está asociada a la sensibilidad del tumor a las hormonas como el estrógeno y la progesterona. Por tanto, mutaciones en ER pueden modificar la respuesta hormonal del epitelio mamario y, potencialmente, ello podría desembocar en una mayor susceptibilidad hereditaria al cáncer de mama.
En definitiva, aunque el papel de los genes BRCA en la predisposición al cáncer de mama parece estar muy claro, no son los únicos; por ahora se conocen otros genes --como los que acabamos de describir-- que podrían tener un papel relevante en el desarrollo de este tipo de neoplasia y que aún se están estudiando.
Además, cada día surgen nuevas publicaciones que confirman el papel de los genes ya conocidos y otras que abren nuevas vías para conocer mejor el mecanismo molecular del cáncer de mama y que permitirán el desarrollo de nuevas terapias para afrontar esta enfermedad.
Implicaciones clínicas del conocimiento molecular
La posibilidad de identificar los genes asociados a la aparición del cáncer de mama abre una serie de interrogantes. Las pruebas genéticas para la identificación de genes de predisposición al cáncer de mama deben realizarse de forma controlada, junto a un asesoramiento genético que proporcione toda la información y el soporte psicológico necesario para la realización de este tipo de pruebas. Por otra parte, los test genéticos para identificar susceptibilidades para presentar cáncer deben ser realizados dentro de un contexto de trabajos clínicos de larga duración y seguimiento muy controlado.
Este tipo de pruebas, además de la información que da sobre cánceres ya desarrollados, es un vía muy prometedora en el tratamiento preventivo y la erradicación futura del cáncer de mama. Actualmente, se están desarrollando programas clínicos con los genes BRCA1 y BRCA2.
El test para determinar si existen mutaciones en estos genes debe ir acompañado de un consejo genético. Este asesoramiento debe incluir informaciones sobre las propiedades de las pruebas genéticas de los genes BRCA, los riesgos que conllevan los resultados y, sobre todo, explicar los posibles beneficios y «peligros» de la prueba, las opciones disponibles dependiendo del resultado, así como las implicaciones legales, éticas y sociales.
El carácter hereditario de un cáncer de mama no puede ser excluido definitivamente, aunque el test de los BRCA no dé positivo
Los criterios para realizar el análisis de los genes BRCA son los siguientes:
Pacientes con cáncer de mama y ovario que tengan dos o más familiares de primer grado afectados por esta enfermedad.
Pacientes con cáncer de mama y ovario diagnosticados antes de los 45 años y que tengan un familiar de primer grado afectado.
Pacientes con cáncer de mama y ovario diagnosticados antes de los 35 años
Pacientes de sexo masculino con cáncer de mama.
Aquellas pacientes que no cumplan los requisitos deben ser informadas de que el riesgo de desarrollo de la enfermedad es muy bajo respecto a los genes conocidos hasta ahora.
Asimismo, el carácter hereditario de un cáncer de mama no puede ser excluido definitivamente, aunque el test de los BRCA no dé positivo, ya que podrían existir otras mutaciones en estos mismos genes que no se han identificado, o mutaciones en otros genes de susceptibilidad que son, todavía hoy, desconocidos.
Bibliografía general
Bars Culver. MS, et al. BRCA1 and BRCA2 hereditary breast/ovarian cancer. Gene Reviews formerly Gene Clínics. Marzo 2000 [Consultado 3/04/03]. Disponible en: http://www.geneclinics.org
Domchek S, et al. Application of breast cancer risk prediction models in clinical practice. Journal of Clinical Oncology 2003;21;593-601.
Hernández Muñoz G, Bernardello ETL, Aristodermo J. Cáncer de mama. Caracas (Venezuela): McGraw-Hill Interamerican, 1998; p. 232-41.
Líneas asistenciales preferentes. Mutaciones en los genes BRCA1 y PRCA2. Cáncer de mama y ovario hereditario [Consultado 3/04/03]. Disponible en: http://www.santpau.es
Márquez A, Trujillo R. Cáncer de mama hereditario I y II [Consultado 24/03/03]. Disponible en: http.//www.medspain.com