LA GASOMETRÍA EN SANGRE ARTERIAL (GSA) nos permite determinar el grado de oxigenación del paciente (a través de la presión parcial del oxígeno en sangre arterial [PaO2] y de la saturación del oxígeno en sangre arterial [SaO2]), el equilibrio acidobásico, la función pulmonar (a través de la presión parcial del dióxido de carbono en sangre arterial [PaCO2]) y el estado metabólico. En este artículo vamos a ver cómo obtener información clínicamente útil a través de la GSA, con presentación de tres casos clínicos centrados en el uso de la GSA para optimizar la ventilación mecánica.
La intubación endotraqueal y la ventilación mecánica pueden ser necesarias en los pacientes que son incapaces de mantener una oxigenación o una ventilación apropiadas, o que necesitan una protección de la vía respiratoria. El objetivo de la ventilación mecánica es mejorar la oxigenación y la ventilación, facilitando el descanso de los fatigados músculos de la respiración.
La ventilación mecánica es un tratamiento de tipo complementario debido a que realmente no actúa sobre las causas de la enfermedad ni sobre sus posibles complicaciones. No obstante, la ventilación mecánica ahorra tiempo para la aplicación de otras intervenciones terapéuticas que permiten el restablecimiento de la homeostasis corporal.
Cuando se aplica este tipo de intervención vital, los clínicos deben dar los pasos necesarios para evitar o minimizar la denominada lesión pulmonar inducida por el respirador (VILI, ventilator-induced lung injury), que se describe con detalle más adelante en este artículo. En cualquier caso, se debe retirar la ventilación mecánica del paciente siempre que su situación clínica lo permita.
El estado crítico de un paciente puede cambiar de forma rápida y dramática, y la necesidad del apoyo ventilatorio en términos de oxigenación o de ventilación también puede presentar variaciones en las distintas fases de la enfermedad. La GSA es una herramienta diagnóstica indispensable para la monitorización de la situación clínica del paciente y para evaluar su respuesta frente a las distintas intervenciones. A través de la revisión de las GSA efectuadas al paciente, y de su estado clínico, el clínico puede ajustar los parámetros del respirador para mejorar la oxigenación, la ventilación y el equilibrio acidobásico, o bien para retirar el respirador1–7.
Las cifras normales de los parámetros evaluados en la gasometría varían ligeramente entre los distintos laboratorios, pero “en términos generales” son las siguientes:
- •
PaO2, 80 a 100mmHg
- •
SaO2, 95% a 100%
- •
pH, 7,35 a 7,45
- •
PaCO2, 35 a 45mmHg
- •
HCO3, 22 a 26 mEq/l.
La concentración sérica del lactato también se determina a menudo junto con la GSA y su valor es normalmente inferior a 2 mmol/l en los pacientes en situación clínica crítica4–9.
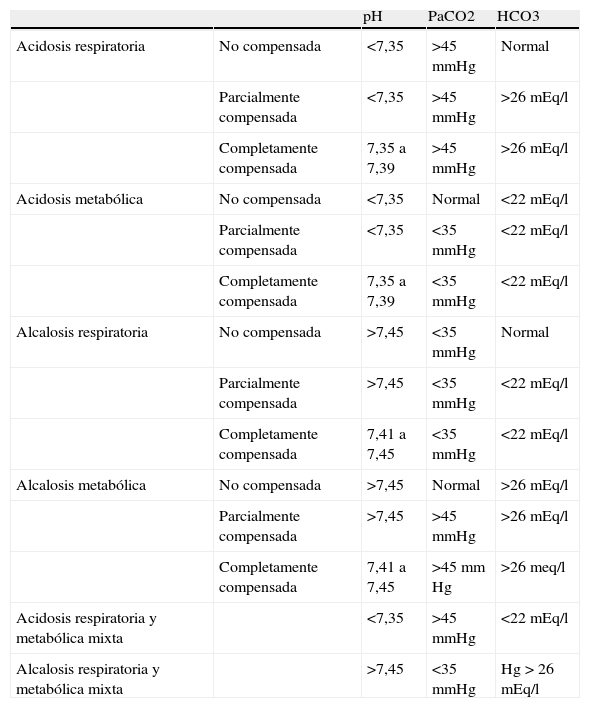
En el cuadro Tipos de desequilibrio acidobásico se recoge una panorámica general de los distintos trastornos del equilibrio acidobásico.
En los pacientes tratados mediante ventilación mecánica los elementos clave para mejorar la oxigenación son el incremento de la fracción inspiratoria de oxígeno (FiO2) o el aumento de la presión positiva al final de la espiración (PEEP, positive end-expiratory pressure). Hay que tener en cuenta que el volumen minuto del paciente es igual a la frecuencia respiratoria multiplicada por el volumen corriente (VT, tidal volume). Por tanto, cualquier intervención que modifique la frecuencia respiratoria o el VT puede tener utilidad para solucionar un problema de hipercapnia o de hipocapnia, y para rectificar un desequilibrio acidobásico1–5,10–12.
- •
En la ventilación en modo control del volumen, el incremento del VT, de la frecuencia respiratoria o de ambos disminuye la PaCO2 y mejora la ventilación3,10–12
- •
En la ventilación en modo de control de la presión, las intervenciones para mejorar la ventilación son el aumento de la presión inspiratoria, de la frecuencia respiratoria o de ambas; la prolongación del tiempo de inspiración, y la disminución de la resistencia de la vía respiratoria mediante la administración de broncodilatadores, la
- •
aspiración de las secreciones respiratorias o el uso de un tubo endotraqueal de diámetro grande3,10–14.
- •
En la ventilación en modo presión de soporte, las intervenciones para la mejora de la ventilación son el aumento del nivel de presión de soporte y la disminución de la resistencia en la vía respiratoria mediante la administración de broncodilatadores, la aspiración de las secreciones respiratorias o el uso de un tubo endotraqueal de calibre grande3,10–13.
Un hombre de 52 años es ingresado en la unidad de cuidados intensivos (UCI), procedente del servicio de urgencias, por un cuadro de dificultad respiratoria e hipotensión secundario a una sepsis neutropénica. En el paciente son necesarias la reanimación mediante sueroterapia y la administración de inótropos positivos por vía intravenosa (i.v.). Ha presentado diarrea y fiebre a lo largo de las últimas 3 semanas y sufre un linfoma B de linfocitos grandes difuso (que ha sido tratado mediante quimioterapia), infección por el virus de la hepatitis C, alcoholismo y cirrosis.
Tipos de desequilibrio acidobásico6,7| pH | PaCO2 | HCO3 | ||
| Acidosis respiratoria | No compensada | <7,35 | >45 mmHg | Normal |
| Parcialmente compensada | <7,35 | >45 mmHg | >26 mEq/l | |
| Completamente compensada | 7,35 a 7,39 | >45 mmHg | >26 mEq/l | |
| Acidosis metabólica | No compensada | <7,35 | Normal | <22 mEq/l |
| Parcialmente compensada | <7,35 | <35 mmHg | <22 mEq/l | |
| Completamente compensada | 7,35 a 7,39 | <35 mmHg | <22 mEq/l | |
| Alcalosis respiratoria | No compensada | >7,45 | <35 mmHg | Normal |
| Parcialmente compensada | >7,45 | <35 mmHg | <22 mEq/l | |
| Completamente compensada | 7,41 a 7,45 | <35 mmHg | <22 mEq/l | |
| Alcalosis metabólica | No compensada | >7,45 | Normal | >26 mEq/l |
| Parcialmente compensada | >7,45 | >45 mmHg | >26 mEq/l | |
| Completamente compensada | 7,41 a 7,45 | >45 mm Hg | >26 meq/l | |
| Acidosis respiratoria y metabólica mixta | <7,35 | >45 mmHg | <22 mEq/l | |
| Alcalosis respiratoria y metabólica mixta | >7,45 | <35 mmHg | Hg > 26 mEq/l |
La enfermera debe seguir la estrategia de los cinco pasos (véase el recuadro Pasos para la interpretación de la GSA) para analizar los estudios de GSA efectuados en el momento del ingreso:
- •
PaO2 de 81,3mmHg (mientras el paciente está recibiendo oxígeno suplementario con un volumen de 6 l/min a través de una mascarilla), lo que indica que su oxigenación es apropiada.
- •
pH de 7,14, lo que indica una acidosis.
- •
PaCO2de 41,8mmHg, lo que indica que el volumen minuto es apropiado respecto a la situación metabólica.
- •
HCO3– de 13,8 mmol/l, lo que refleja unaalteración metabólica en la dirección de la acidosis.
- •
Concentración sérica del lactato de 5,8 mmol/l, lo que indica una hiperlactacidemia.
La alteración metabólica del paciente ha desplazado su pH hacia la acidosis, pero no presenta ningún problema respiratorio.
Específicamente, los valores de la PaCO2 y la PaO2 demuestran que su sistema respiratorio puede mantener una ventilación y una oxigenación adecuadas, mientras recibe oxígeno suplementario con un volumen de 6 l/min. Este perfil de la GSA demuestra una acidosis metabólica no compensada.
La acidosis metabólica del paciente posiblemente ha sido debida a la diarrea, al tiempo que se ha agravado significativamente por la sepsis y por el shock séptico. Tras un episodio agudo de shock séptico, las GSA efectuadas en el momento del ingreso del paciente no muestran una compensación respiratoria de la acidosis metabólica, aunque generalmente dicha compensación tiene lugar con bastante rapidez.
La acidosis láctica se caracteriza por hiperlactacidemia asociada a acidosis metabólica6. Los valores del lactato y del pH del paciente confirman el diagnóstico de acidosis láctica. La hipotensión disminuye la perfusión tisular y altera el aporte de oxígeno a los tejidos, con hipoxia tisular.
La GSA es una herramienta diagnóstica indispensable para la monitorización de la situación clínica del paciente y para evaluar su respuesta frente a las distintas intervenciones.
La hipoxia tisular da lugar a un metabolismo anaerobio e incrementa la producción de lactato. La disfunción hepática reduce la eliminación del lactato1,6. La acidosis láctica de nuestro paciente posiblemente haya sido debida al shock séptico y a la cirrosis preexistente.
Además de los antibióticos, el paciente recibió sueroterapia y fármacos inótropos positivos para mantener la presión arterial media (PAM) por encima de 70mmHg. Dado que la oxigenación y la ventilación eran apropiadas, no se inició en esa fase el apoyo mediante ventilación mecánica, pero el paciente siguió recibiendo oxígeno suplementario.
Tres horas y media después del último resultado de la GSA, en la nueva GSA se observan los resultados siguientes: pH, 7,29; PaCO2, 35,3mmHg; PaO2, 99,7mmHg; HCO3–, 17 mEq/l, y lactato 5,77 mmol/l.
El paciente presenta ahora una acidosis metabólica no compensada menos intensa con una disminución marginal del lactato, pero ha mostrado signos de incremento del trabajo respiratorio: inquietud, disnea, utilización de los músculos accesorios de la respiración y sudoración profusa. Dado que muestra un aumento en el riesgo de fatiga de los músculos respiratorios, se aplica una ventilación no invasiva con una presión positiva continua en la vía respiratoria (CPAP, continuous positive airway pressure) de 10cm H2O.
Después de que el paciente se mantiene con la CPAP durante 4h, la GSA muestra los resultados siguientes: pH, 7,34; PaCO2, 32,4mmHg; PaO, 95,9mmHg; HCO –, 19 mEq/l y lactato 6,7 mmol/l. La disminución de la PaCO2 hasta una cifra inferior al intervalo normal sugiere que el paciente ha presentado hiperventilación para eliminar una cantidad mayor de dióxido de carbono (CO2) e incrementar el pH. En otras palabras, su sistema respiratorio ha estado compensando la acidosis metabólica. Ahora, el diagnóstico es el de acidosis metabólica parcialmente compensada. No obstante, su concentración del lactato todavía está muy elevada.
- •
¿Presenta hipoxemia el paciente? Valorar la PaO2 y la SaO2.
- •
¿Cuál es el equilibrio acidobásico? Comprobar el pH.
- •
¿Cuál es la situación pulmonar del paciente? Valorar la PaCO2.
- •
¿Cuál es la situación metabólica del paciente? Revisar el HCO3–.
- •
¿Hay alguna alteración o compensación? ¿Cuál es la causa primaria del desequilibrio acidobásico y qué alteración es el resultado de un cambio secundario (compensador)? La comparación de la PaCO2 y del HCO3–puede tener utilidad para determinar cuál es la causa primaria y cuáles son los cambios secundarios. Evaluar la concentración sérica del lactato, la hemoglobina, la glucosa y los electrólitos.
La hiperlactacidemia puede indicar una perfusión tisular insuficiente, pero la PAM del paciente se ha mantenido por encima de los 70mmHg y su eliminación de orina ha sido superior a 0,5ml/ kg/h, lo que indica que la perfusión tisular es apropiada. La reducción lenta de la hiperlactacidemia posiblemente fue debida a la alteración de la función hepática.
Después, se retira la CPAP y se administra oxígeno humidificado con un volumen de 6 l/min a través de una mascarilla. Al día siguiente la GSA tiene los resultados siguientes: pH, 7,41; PaCO2, 34,2mmHg; PaO2, 90,7mmHg; HCO3 --, 20 mEq/l, y lactato 5,41 mmol/l. La alteración metabólica se ha aliviado de manera significativa a través del establecimiento y el mantenimiento de una perfusión tisular apropiada. Además, la compensación respiratoria ha normalizado el equilibrio acidobásico. En esta fase, el diagnóstico es el de acidosis metabólica plenamente compensada.
Al cuarto día del ingreso, la temperatura corporal del paciente se incrementa hasta 39,7°C y cae la oxigenación. En la GSA efectuada en ese momento se observan los resultados siguientes: pH, 7,34; PaCO2, 52,6mmHg; PaO2, 60,7mmHg (una cifra indicativa de hipoxemia); HCO –, 27,6 mEq/l, y lactato 2,44 mmol/l. La fiebre incrementa el consumo de oxígeno y la producción de CO2. El sistema respiratorio del paciente es incapaz de mantener una oxigenación y una ventilación suficientes como para cubrir las demandas metabólicas, tal como indican la hipoxemia y la hipercapnia. La retención de CO2 da lugar a una acidosis respiratoria. Por otra parte, el proceso metabólico está intentando incrementar el pH, lo que sugiere una compensación metabólica de la acidosis respiratoria.
El perfil de la GSA que acabamos de ver es congruente con una acidosis respiratoria parcialmente compensada. La intensa disminución de la concentración del lactato es el resultado de la reducción de la producción del lactato y del incremento en la eliminación del lactato debido a la mejora de la perfusión tisular desde el momento del ingreso.
La presión positiva con dos niveles en la vía respiratoria (BiPAP, bilevel positive airway pressure) es un método para aplicar por separado una presión positiva inspiratoria en la vía respiratoria (IPAP, inspiratory positive airway pressure) y una presión positiva espiratoria en la vía respiratoria (EPAP, expiratory positive airway pressure).
La solución de continuidad entre la IPAP y la EPAP genera presión de soporte. En comparación con la CPAP, la BiPAP es más eficaz para eliminar el CO2 debido a la presión de soporte que genera un flujo de continuidad entre la IPAP y la EPAP15,16. Se inicia la BiPAP (IPAP, 15cm H2O; EPAP, 7cm H2O) con una FiO2 de 0,40 para tratar la hipoxemia y la hipercapnia, y para dejar descansar los músculos respiratorios.
Con los parámetros anteriores se genera una presión de soporte de 8cm H2O (15cm H2O – 7cm H2O = 8cm H2O). Porotra parte, el tratamiento antibiótico es modificado en función de los resultados recientes del cultivo y el antibiograma.
Al cabo de una hora y media los resultados de la GSA son los siguientes: pH, 7,39; PaCO2, 42,1mmHg; PaO2, 90,1 mmHg; HCO –, 25,4 mEq/l, y lactato 2,4 mmol/l; estos resultados sugieren que se han corregido la hipoxemia, la retención del CO2 y la acidosis respiratoria.
Al día siguiente, mientras el paciente está siendo tratado con BiPAP los resultados de la GSA son los siguientes: pH, 7,27; PaCO2, 58,9mmHg; PaO, 89,5mmHg; HCO3–, 26,8 mEq/l, y lactato 1,78 mmol/l.
Se ha producido una recidiva de la acidosis respiratoria parcialmente compensada, lo que puede haber sido debido a una respiración espontánea inadecuada a consecuencia del letargo. Dado el riesgo cada vez mayor de intolerancia del paciente a la BiPAP, es intubado por vía endotraqueal y se aplica ventilación en modo de presión de soporte, con los parámetros siguientes: FiO2, 0,40; PEEP, 10 cm H2O, y presión de soporte 16cm H2O.
Trece horas después, los resultados de la GSA son los siguientes: pH, 7,51; PaCO2, 34,1mmHg; PaO, 99,2mmHg; HCO –, 26,8 mEq/l, y lactato 2,39 mmol/l.
La ventilación con presión de soporte incrementa el VT espontáneo y permite eliminar una cantidad mayor de CO2.
Los valores más recientes de la GSA de nuestro paciente demuestran que el soporte ventilatorio ha convertido la acidosis respiratoria en una alcalosis. Dado que las alteraciones respiratorias metabólicas han desplazado el pH hacia la alcalosis, ha desarrollado una alcalosis respiratoria y metabólica mixta.
Dos días después, los parámetros del respirador se han reducido hasta los siguientes: FiO2, 0,30; PEEP, 10cm H2O y presión de soporte 12cm H2O. Ahora, los valores en la GSA son los siguientes: pH, 7,59, PaCO2, 28,4mmHg; PaO2, 156,3 mmHg; HCO –, 26,6 mEq/l, y lactato 1,60 mmol/l. La alcalosis respiratoria y metabólica mixta está empeorando.
La disminución de la PaCO2 desde 34,1 hasta 28,4mmHg sugiere una ventilación excesiva.
La hipocapnia y la alcalosis respiratoria pueden ser debidas a dolor, agitación, anemia intensa, hipoxia, lesión del tronco encefálico o ventilación mecánica excesiva1,4,5. Dado que nuestro paciente no presenta dolor, agitación, anemia ni otros problemas, lo más probable es que la causa de su hiperventilación sea una ventilación excesiva asociada a la presión de soporte.
En consecuencia, se reducen la presión de soporte y la PEEP hasta 5cm H2O. En menos de 2h la GSA muestra los valores siguientes: pH, 7,49; PaCO2, 37,2mmHg; PaO, 96,9mmHg; HCO –, 28,2 mEq/l, y lactato 1,53 mmol/l. La disminución de la presión de soporte ha corregido la hipocapnia y ha eliminado la alcalosis respiratoria. Ahora, el paciente sólo presenta una alcalosis metabólica no compensada.
Tres días después, el paciente es extubado y se coloca una mascarilla de oxígeno, con una FiO2 de 0,30. Ahora, los valores de la GSA son los siguientes: pH, 7,46; PaCO2, 42,4mmHg; PaO2, 114,8mmHg;HCO3–, 29,8 mEq/l, y lactato 1,10 mmol/l, lo que refleja una alcalosis metabólica no compensada de grado leve.
Dado que la disfunción hepática reduce la producción de HCO3 y de las proteínas (con su efecto de amortiguación), lo más probable es que la alcalosis metabólica de grado leve que presenta el paciente sea debida a su cirrosis.
Caso clínico 2: Patología doble e hipercapnia permisivaUn hombre de 84 años que presenta insuficiencia renal desarrolla un cuadro de síndrome de dificultad respiratoria aguda (SDRA). Estaba recibiendo furosemida mediante infusión i.v. A consecuencia de la hipoxemia intensa y de la hipercapnia profunda, es intubado y ventilado con niveles elevados de FiO2, PEEP y presión de soporte, durante un período de tiempo prolongado.
Mientras el paciente está ventilado con el modo de presión de soporte, con una FiO2 de 0,45, una PEEP de 17,5cm H2O yuna presión de soporte de 12cm H2O, losvalores en la GSA son los siguientes:
- •
PaO2 de 85mmHg, lo que indica que no existe hipoxemia con el soporte ventilatorio.
- •
pH de 7,39 (dentro de los límites normales).
- •
PaCO2 de 65mmHg, indicativa de que el volumen minuto es inadecuado, con hipercapnia y acidosis respiratoria.
- •
HCO3 de 38 mEq/l, lo que refleja una alteración metabólica en la dirección de la alcalosis, posiblemente debida a la infusión de furosemida y a los cambios compensadores de la hipercapnia y la acidosis respiratoria.
- •
Lactato de 1,21 mmol/l, lo que indica que la perfusión tisular es adecuada.
El SDRA ha dado lugar a una acidosis respiratoria. Por otra parte, la infusión de furosemida y la compensación metabólica de la acidosis respiratoria han dado lugar a una alcalosis metabólica. Estos trastornos mixtos del equilibrio acidobásico cursan con un pH normal.
Algunos pacientes pueden necesitar un nivel elevado de soporte ventilatorio para alcanzar y mantener valores óptimos en la GSA. Ello conlleva un riesgo de desarrollo de VILI debido a los elevados volúmenes corrientes o a la presión positiva, o bien a la toxicidad del oxígeno por los elevados valores de la FiO2, lo que puede retrasar la retirada del respirador. En los pacientes con hipoxemia resistente o hipercapnia intensa son aceptables una hipoxemia leve o una hipercapnia permisiva durante un corto espacio de tiempo, debido a que esta estrategia ventilatoria de protección pulmonar puede minimizar la VILI3,17–22.
El soporte ventilatorio permite ganar tiempo para que puedan actuar las demás intervenciones terapéuticas, al tiempo que se restablece la homeostasis corporal.
El resumen del protocolo de la ventilación mecánica desarrollado por los National Institutes of Health, el National Heart, Lung, and Blood Institute y el ARDS Clinical Network recomienda en los pacientes con SDRA el mantenimiento de la PaO2 entre 55 y 80mmHg, o el mantenimiento de la SpO2 entre el 88% y el 95%, así como el mantenimiento del pH entre 7,30 y 7,4517.
Para el restablecimiento del equilibrio acidobásico de nuestro paciente con el objetivo de una oxigenación apropiada, los clínicos dejan que tenga lugar una hipercapnia permisiva y no modifican los parámetros del respirador a pesar de una PaCO2 de 65mmHg. Finalmente, el paciente se recupera, es extubado y recibe el alta hacia su domicilio.
Caso clínico 3: DeshidrataciónUna mujer de 79 años es hospitalizada en la UCI tras ser intervenida mediante una hemicolectomía; los parámetros del respirador son los siguientes: FiO2, 0,40; PEEP, 10cm H2O, y presión de soporte 10cm H2O. Los resultados obtenidos en la GSA son los siguientes:
- •
PaO2 de 85,2mmHg, lo que indica la ausencia de hipoxemia en la situación de soporte ventilatorio.
- •
pH de 7,27, lo que indica acidosis.
- •
PaCO2 de 41,5mmHg, lo que indica que la ventilación pulmonar es apropiada respecto al estado metabólico.
- •
HCO3– de 18,6 mEq/l, lo que refleja una alteración metabólica en la dirección de la acidosis.
- •
Lactato de 1,57 mmol/l, un nivel normal que sugiere que la perfusión tisular es apropiada.
Ésta es una situación de acidosis metabólica no compensada. Más adelante, la paciente presenta una sepsis con insuficiencia renal. Dadas la insuficiencia renal y la acidosis metabólica intensa, se inicia un procedimiento de hemodiafiltración venovenosa continua (CVVHDF, continuous venovenous hemodiafiltration) con eliminación de150ml/h de líquido.
Cinco días después, los valores en la GSA son los siguientes: pH, 7,49; PaCO2, 41,2mmHg; PaO, 92,9mmHg; HCO –, 31,3 mEq/l, y lactato 2,38 mmol/l. Los parámetros del respirador son los siguientes: FiO2, 0,30; PEEP, 7,5cm H2O, y presión de soporte 5cm H2O. La acidosis metabólica se ha corregido mediante la CVVHDF, pero la paciente ha desarrollado una alcalosis metabólica no compensada. La elevación del lactato posiblemente se debe a la sepsis. Dado que la concentración sérica de la creatinina se ha normalizado y que la eliminación de orina es adecuada, se interrumpe el tratamiento mediante CVVHDF.
Tras el incremento de la presión de soporte desde 5 hasta 12cm H2O, la presión arterial (PA) sistólica disminuye desde 140mmHg hasta menos de 110mmHg. La presión venosa central (PVC) es de 5mmHg. (Durante las primeras 6h de la reanimación mediante sueroterapia, los objetivos respecto a la hipoperfusión inducida por la sepsis incluyen una PVC de 8-12mmHg.)23 Además, la eliminación de la orina ha disminuido significativamente. Los valores en la GSA son los siguientes: pH, 7,51; PaCO2, 36,3mmHg; PaO2, 106,2 mmHg; HCO –, 28,3 mEq/l, y lactato 1,30 mmol/l. Este perfil de la GSA indica un empeoramiento de la alcalosis metabólica debido a que el incremento de la presión de soporte ha aumentado la cantidad de CO2 eliminado y ha elevado el pH.
La PEEP influye en todo el ciclo respiratorio (inspiración y espiración). Sin embargo, la presión de soporte sólo se aplica durante la fase inspiratoria de los movimientos respiratorios espontáneos. Por tanto, en comparación con la presión de soporte, la PEEP induce un efecto más intenso sobre la disminución del gasto cardíaco y sobre la reducción de la PA. En los pacientes en situación de ventilación mecánica, la PA suele disminuir cuando se incrementa la PEEP si el paciente presenta un volumen intravascular insuficiente1,3. Sin embargo, la disminución de la PA no suele tener lugar después del incremento de la presión de soporte, a menos que el paciente presente una deshidratación intensa.
En nuestra paciente, la intensa reducción de la PA y de la eliminación de orina, así como las bajas cifras de la PVC, apuntan hacia la posibilidad de una deshidratación profunda, lo que incrementa de manera importante la sensibilidad frente al aumento de la presión de soporte. La deshidratación también puede dar lugar a acidosis metabólica. En consecuencia, en la paciente se reduce la presión de soporte de nuevo hasta 5cm H2O. La PA sistólica aumenta de manera inmediata hasta una cifra que oscila entre 140 y 160mmHg. Además, se administra en dos ocasiones una carga de 250ml de una solución de cloruro sódico al 0,9% y se incrementa la tasa de infusión de la sueroterapia i.v. de mantenimiento desde 60 hasta 100ml/h. En consecuencia, la PVC aumenta hasta 7mmHg.
A continuación se lleva a cabo la infusión de 500ml de albúmina al 4% durante 4h. La eliminación de orina aumenta hasta 17-35ml/h. Cuando finaliza la infusión de la albúmina, los valores de la GSA son los siguientes: pH, 7,46; PaCO2, 36,1mmHg; PaO2, 94,3mmHg; HCO3, 25,1 mEq/l, y lactato 1,17 mmol/l.
Dado que la situación crítica de un paciente puede cambiar de manera rápida y dramática, son esenciales las revisiones dinámicas de la GSA.
El tratamiento de la deshidratación y la reducción de la presión de soporte solucionan casi de manera completa laalcalosis metabólica de la paciente en un período inferior a 6h.
Estrategia dinámicaDado que el estado clínico de un paciente en situación crítica puede cambiar de manera rápida y dramática, son esenciales las revisiones dinámicas de las GSA. A través del conocimiento de la ventilación mecánica y de la interpretación de los resultados de la GSA, es posible modificar las estrategias de ventilación en función de lo necesario para conseguir solucionar el problema del paciente. ¿
FinanciaciónJin Xiong Lian es especialista en enfermería clínica en la UCI del Concord Repatriation General Hospital, un hospital universitario de la University of Sydney, en Australia.
Este artículo se publicó por primera vez en Nursing2012 CriticalCare. 2012;7(2):30-5.
Conflicto de interesesLa autora y los editores declaran que no existen conflictos de interés económicos relacionados con este artículo.