El síndrome de Kinsbourne u opsoclonus-mioclonus ataxia (SOMA) es una entidad neurológica poco común, crónica, agresiva y recurrente de origen paraneoplásico, parainfeccioso o idiopático con implicaciones inmunológicas, que afecta una etapa crítica del neurodesarrollo ya que, la mayoría de los casos, ocurre en la edad pediátrica entre los 6 meses y los 3 años de vida. Se caracteriza por la aparición aguda o subaguda de opsoclonus (giros oculares anormales, multidireccionales de gran amplitud), asociadas a inestabilidad troncal, mioclonías difusas y ataxia cerebelosa1–3. Además de estos hallazgos clásicos, también pueden asociarse a irritabilidad, trastornos del ciclo sueño-vigilia, cefalea, trastorno del lenguaje o visual, disfagia, vómitos, sialorrea y letargo1.
Dado que, la mayoría de los casos se han visto relacionados a infecciones, inmunizaciones y procesos por alteraciones en la regulación del sistema inmunológico, hoy en día, existe una gran evidencia con respecto a una base inmune, mediada por anticuerpos asociados a la disfunción de linfocitos B y T o a la presencia de anticuerpos contra ACTH, anti-proteínas de neurofilamentos o contra epítopes Hu (ANNA-1), Ri (ANNA-2), Yo, Tr, decarboxilasa del ácido glutámico o ampifisina, como origen de la enfermedad. Empero, no se ha encontrado aún el anticuerpo específico; por tal motivo se carece de modelos terapéuticos originadas a través de ensayos clínicos que aporten un protocolo farmacológico sistematizado; es así como el armamento terapéutico incluye desde corticoides a dosis altas, ACTH, inmunoglobulinas intravenosas, ciclofosfamida, plasmaféresis e incluso rituximab1–4.
A continuación se comenta el caso de una paciente cuyo manejo fue mediante terapia inmunosupresora basada en la aplicación de dexametasona, inmunoglobulina humana (IgIV), ciclofosfamida y verapamilo.
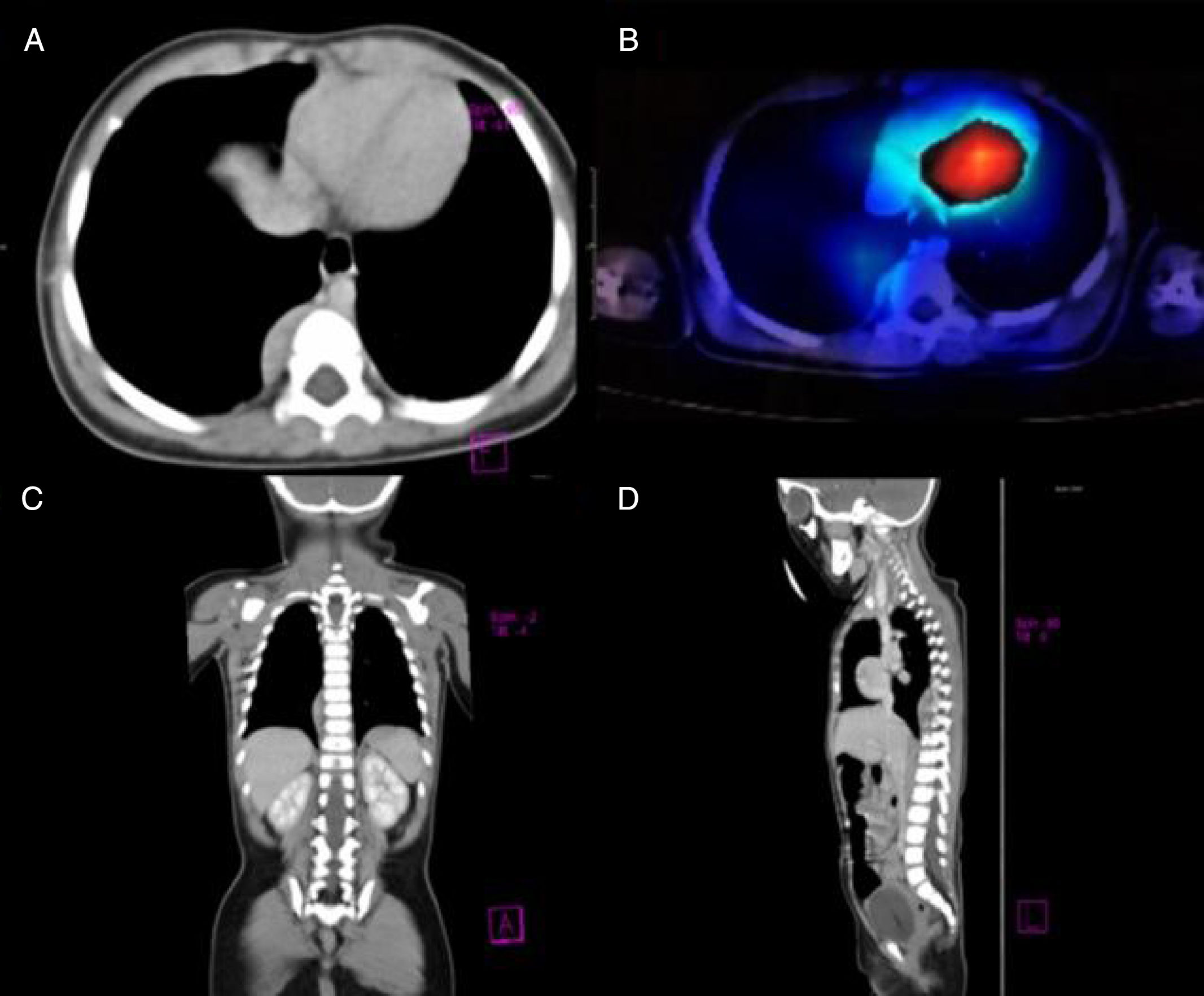
Femenino de 9 meses previamente sana, originaria del Estado de México, últimas vacunas a los 6 meses, quien inició 3 semanas previas a su ingreso con paresia de IV nervio craneal, a lo que se agregó ataxia troncal e irritabilidad; 2 semanas después se exacerbó la ataxia, perdiendo la capacidad para la sedestación y se agregó opsoclonus progresivo; además de alteraciones en el ciclo sueño-vigilia. Se le realizaron TC de cráneo (01/01/15) y resonancia magnética de encéfalo (02/01/15) para descartar lesiones ocupativas, inflamatorias o desmielinizantes. Se sospechó de cerebelitis postinfecciosa, por lo cual se realizó punción lumbar sin encontrar alteraciones en el citoquímico, citológico, tinción de Gram, cultivos ni serologías virales del líquido cefalorraquídeo. Finalmente se sospechó de síndrome opsoclonus-mioclonus ataxia. Se decidió realizar tomografía de tórax y SPECT con MIBG-I131 (30/01/2015), en donde se evidenció tumor en región paravertebral derecha (fig. 1). Se realizó cirugía resectiva con resultados anatomopatológicos que reportaron neuroblastoma en diferenciación. Tras confirmar el diagnóstico de síndrome de opsoclonus-mioclonus ataxia de etiología paraneoplásica se inició protocolo de tratamiento farmacológico con ciclos mensuales de dexametasona (20mg/m2/dosis por 3 días), inmunoglobulina humana (IgIV) (2g/kg/dosis) y ciclofosfamida (150mg/m2/dosis por 7 días); así como verapamilo (15mg/8h, hasta el inicio de la adolescencia), durante 6 meses. Actualmente la paciente tiene una remisión completa, sin secuelas a 2 años del tratamiento.
A) Corte axial obtenido mediante TC, el cual muestra una masa paravertebral a nivel de T7, sin evidencia de invasión a tejidos periféricos. B) Imagen comparativa SPECT MIBG-I131 demostrando el área positiva para tejido cromafín. C y D) Corte coronal y parasagital (respectivamente), se observa masa ocupativa paravertebral de límites entre T6 y T10.
Existen múltiples protocolos de tratamiento para SOMA; lo más frecuente en caso de que se asocie a tumor, es la resección del mismo y posterior terapia inmunomoduladora con ACTH e IgIV3; no obstante, considerado que el SOMA es una entidad muy agresiva, el objetivo del tratamiento para estos pacientes es reducir la formación de anticuerpos posiblemente implicados en la fisiopatología3, con la subsecuente regresión y remisión de los síntomas o complicaciones que hayan podido presentarse; es así como en este caso se decidió utilizar corticosteroides e inmunoglobulina para disminuir las respuestas linfocíticas, fagocíticas y la producción de interleucinas1; además, la administración conjunta de ambos agentes tiene la enorme ventaja de inducir inmunomodulación sin inmunosupresión y logra desaparecer por completo los síntomas neurológicos en casos paraneoplásicos5. Mientras tanto, la ciclofosfamida es una sustancia alquilante e inmunosupresora utilizada en el tratamiento de trastornos autoinmunes1,6; esto aunado a que, en años recientes, distintos estudios han señalado que la administración crónica de inhibidores de la P-glicoproteína (p. ej., verapamilo) ha demostrado reducir la producción de IL2 y la proliferación de linfocitos T in vitro7.
Si bien, un retraso en el diagnóstico o en el inicio de la inmunoterapia puede causar daño cerebral, con deterioro irreversible en el funcionamiento neurológico, el verapamilo se ha sugerido como un neuroprotector para prevenir el déficit cognitivo-conductual en modelos experimentales para la enfermedad de Alzheimer; esto debido al bloqueo de la entrada de calcio en las neuronas; así como la inhibición de la neurotoxicidad dopaminérgica inducida por lipopolisacáridos, y la disminución de la producción de mediadores inflamatorios generados a partir de NADPH oxidasa microglial, por tal motivo se decidió añadirlo al esquema8.
El pronóstico para SOMA en la infancia es pobre; la recuperación completa se observa solo en menos del 20% de los niños afectados, y tiende a la cronicidad con recaídas variables en número e intensidad6; sin embargo, en este caso, posterior a 24 meses de tratamiento la paciente se ha mantenido asintomática; sin secuelas a corto plazo.
Cabe mencionar que, aunque hubo un efecto benéfico en el caso aquí descrito se requiere de un número mayor de pacientes, así como un mayor tiempo de seguimiento para concluir si este tratamiento es igual o más efectivo que ACTH para SOMA. De igual forma, debemos recordar que, el tratamiento debe ser individualizado y multidisciplinario.