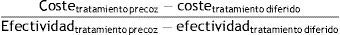El estudio BENEFIT ha mostrado los beneficios del uso precoz del interferón beta 1b (IFNβ-1b). El objetivo del trabajo fue estimar la eficiencia del tratamiento precoz vs. diferido del IFNβ-1b en pacientes con un síndrome desmielinizante aislado (SDA) indicativo de esclerosis múltiple (EM) en España.
MétodosSe desarrolló un modelo de Markov desde la perspectiva social, con un horizonte temporal de 2 años hasta toda la vida. Una cohorte de 1.000 pacientes con SDA y estados de salud definidos por la Expanded Disability Syndrome Scale (EDSS) fue tratada o no con IFNβ-1b al inicio. Los datos del BENEFIT se usaron para la progresión en la EDSS y las transiciones a EM. Los costes se estimaron de la literatura. Las utilidades derivaron del EQ-5D y publicaciones y la mortalidad de tablas de mortalidad y de la EDSS. Costes (€ de 2013) y resultados se descontaron al 3% anual. Se realizó un análisis de sensibilidad probabilístico.
ResultadosEn el caso base, tanto la razón de coste utilidad incremental (RCUI) como la razón de coste efectividad incremental (RCEI) del IFNβ-1b vs. no tratamiento fueron dominantes (más eficaz y menos costoso) bajo la perspectiva social. Bajo la perspectiva del SNS, la RCUI fue de 40.702 €/AVAC y la RCEI de 13 €/recaída evitada.
ConclusiónEl tratamiento precoz con IFNβ-1b después de un SDA frente al tratamiento diferido es eficiente desde la perspectiva social, pero puede no ser eficiente desde la perspectiva del SNS al no tener en cuenta los costes no sanitarios.
The BENEFIT study has demonstrated the benefits of early treatment with interferon beta 1b (IFNβ-1b). The objective of this study was to estimate the efficiency of early vs delayed IFNβ-1b treatment in patients with clinically isolated syndrome (CIS) suggestive of multiple sclerosis (MS) in Spain.
MethodsA Markov model reflecting the social perspective was developed with time horizons ranging from 2 years to lifetime. A cohort of 1000 patients with CIS, whose health status had been measured on the Expanded Disability Symptom Scale (EDSS), included patients who received early IFNβ-1b treatment and those who did not. Data from the BENEFIT study were used to model EDSS progression and transitions to MS. Costs were estimated from published literature. Patient utilities were derived from EQ-5D data and published data. Mortality was estimated using life tables and EDSS data. Costs (€ at 2013 rates) and outcomes were discounted at 3% per annum. A probabilistic sensitivity analysis was performed.
ResultsIn the base case, both the incremental cost utility ratio (ICUR) and the incremental cost effectiveness ratio (ICER) of IFNβ-1b versus no treatment were dominant (more effective and less costly) from a social perspective. From the perspective of the Spanish Health System, the ICUR was € 40,702/QALY and the ICER was € 13/relapse avoided.
ConclusionEarly treatment with IFNβ-1b after a CIS versus delayed treatment is efficient from a social perspective, but it may not be efficient from the perspective of the NHS which does not take non health-related costs into account
La esclerosis múltiple (EM) es una enfermedad del sistema nervioso central caracterizada por una desmielinización inflamatoria que tiende a progresar a lo largo del tiempo. En la mayoría de los pacientes, la EM se asocia con una discapacidad física avanzada y problemas cognitivos1.
En España, la prevalencia registrada en un estudio reciente en La Rioja es de 65 casos por 100.000 habitantes y la EM afecta predominantemente a mujeres jóvenes2. El coste medio anual total de la EM por paciente es de 24.272 €; de ellos, los costes directos representan alrededor del 60% de los costes totales3.
En el 85% de los adultos jóvenes que desarrollan EM clínicamente definida (EMCD), la primera manifestación de la actividad de la enfermedad es un evento consecuencia de una desmielinización aislada que afecta a los nervios ópticos, al tronco encefálico o a la médula espinal1,4. La manifestación de este evento se denomina «síndrome desmielinizante aislado» o SDA.
Los tratamientos modificadores de la enfermedad (TME), como el interferón beta-1b (IFNβ-1b) son el tratamiento estándar de primera línea de los pacientes con brotes de la enfermedad, puesto que han demostrado en ensayos clínicos reducir la frecuencia de los brotes y enlentecer la progresión de la enfermedad1,5-7.
El ensayo Betaferon® in Newly Emerging Multiple Sclerosis for Initial Treatment (BENEFIT)8 mostró que el tratamiento precoz después de un SDA indicativo de EM reducía el riesgo de conversión a EMCD en el 41% en comparación con el tratamiento diferido. Además, varios estudios demostraron que el tratamiento precoz reducía el riesgo de progresión de la discapacidad entre el 40-45% en comparación con el tratamiento diferido7-10.
Mientras que el coste-efectividad de los tratamientos para los pacientes con EM ha sido bien documentado, este no es el caso para el SDA indicativo de EM11-15.
El objetivo de este estudio fue estimar el coste-efectividad del IFNβ-1b en pacientes con un SDA indicativo de EM en España.
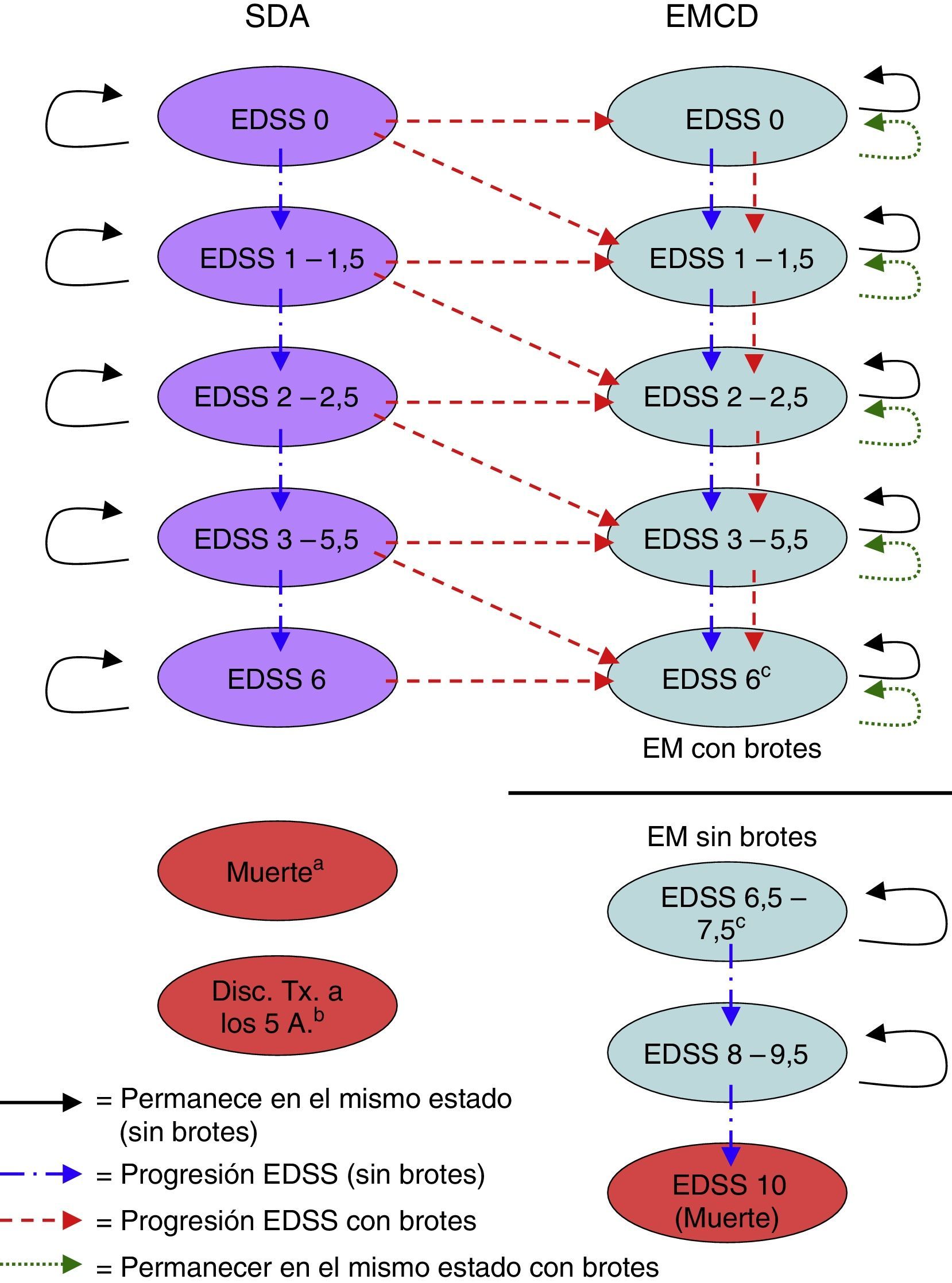
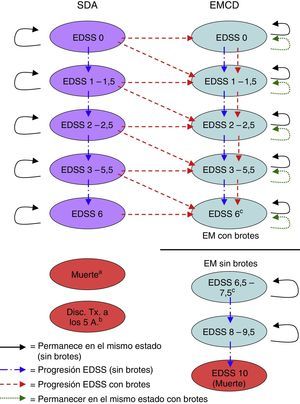
Material y métodosDescripción del modeloSe realizó un modelo de Markov en Excel® para calcular los costes y beneficios de una cohorte hipotética de 1.000 pacientes (edad media 30 años, 70% mujeres, en consonancia con la población del BENEFIT) con un SDA, tratados alternativamente con IFNβ-1b (250mg a días alternos) inmediatamente después de un SDA indicativo de EM (tratamiento precoz), o diferido hasta el inicio de la EMCD (tratamiento diferido)9,10. El modelo simuló los resultados en horizontes temporales que iban desde los 2 años hasta toda la vida. En cada ciclo de 6 meses del modelo, los pacientes tenían la probabilidad de presentar diversos eventos clínicos, como la progresión en la puntuación en la Expanded Disability Status Scale (EDSS), la aparición de una recaída de la EM o la supervivencia y acumulación de años de vida. Cada estado de salud tenía un conjunto único de probabilidades de transición para permanecer en el mismo estado de salud o para transitar a otros estados de salud durante cada ciclo (fig. 1).
Estados de salud del modelo de Markov.
Disc. Tx a 5 A: discontinuación del tratamiento a los 5 años; EMCD: esclerosis múltiple clínicamente definida; EDSS: Expanded Disability Status Scale; SDA: síndrome desmielinizante aislado.
a El paciente puede pasar a «muerte» desde cualquier estado de salud durante cualquier ciclo del modelo.
b Los pacientes que abandonan el tratamiento en el estado de SDA en el quinto año se eliminan del modelo al final del quinto año.
c Las transiciones no ocurren entre el estado de salud EDSS 6 y el estado de salud EDSS 6,5-7,5. El usuario del modelo determina en qué puntuación comenzar las formas no recidivantes de EM (es decir, 6, 6,5, 7 o 7,5) y el estado de salud EDSS 6-7,5 se divide proporcionalmente en función de la puntuación del EDSS elegida.
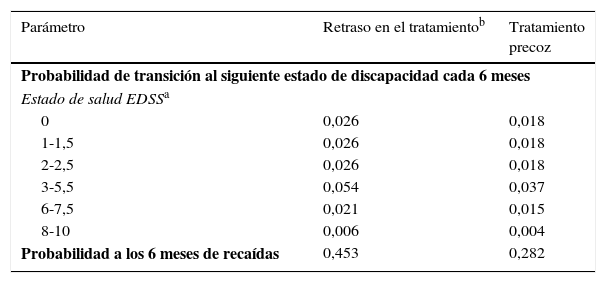
Los estados de salud se definieron de acuerdo con el nivel de discapacidad dado por las puntuaciones en la EDSS16, la aparición de un segundo evento que indicara el diagnóstico de EMCD y la muerte. Las diferentes categorías de la EDSS (EDSS 0; 1 a 1,5; 2-2,5; 3-5,5; 6; 6,5 a 7,5; 8-9,5 y 10) se determinaron a través de un examen de los datos disponibles en la literatura sobre las probabilidades de transición5,6,17-22 (tabla 1), consensuadas posteriormente con expertos clínicos para determinar las categorías de la EDSS que representaban los principales marcadores de discapacidad.
Principales datos clínicos de la literatura
| Parámetro | Retraso en el tratamientob | Tratamiento precoz |
|---|---|---|
| Probabilidad de transición al siguiente estado de discapacidad cada 6 meses | ||
| Estado de salud EDSSa | ||
| 0 | 0,026 | 0,018 |
| 1-1,5 | 0,026 | 0,018 |
| 2-2,5 | 0,026 | 0,018 |
| 3-5,5 | 0,054 | 0,037 |
| 6-7,5 | 0,021 | 0,015 |
| 8-10 | 0,006 | 0,004 |
| Probabilidad a los 6 meses de recaídas | 0,453 | 0,282 |
Tomado de The IFNB Multiple Sclerosis Study Group5, The IFNB Multiple Sclerosis Study Group and the University of British Columbia MS/MRI Analysis Group6, Weinshenker et al.18, Runmarker y Andersen19, Goodkin et al.20, Weinshenker y Ebers21 y Weinshenker et al.22.
Los estados de salud de la EDSS 0, 1-1,5 y 2-2,5 son el resultado de dividir los estados de salud 0-2,5 encontrados en las fuentes de datos citadas anteriormente. La probabilidad de progresión desde el estado de salud 0-2,5 en las citadas fuentes de datos fueron aplicados del mismo modo a cada uno de los estados de salud en que se dividieron los estados de salud.
El modelo incluyó 2 tipos de recaídas: conversión de SDA a EMCD y recaídas posteriores una vez diagnosticada la EMCD. La probabilidad de recaída de los pacientes en ambos grupos de tratamiento (tratamiento precoz o diferido) en los pacientes con EMCD se obtuvo a partir de la literatura (tabla 1)17. Para tener en cuenta el efecto del tratamiento con IFNβ-1b, se aplicó la reducción de la probabilidad de aparición de recaídas del ensayo clínico con IFNβ-1b en ambos grupos5,6.
En el modelo se incluyeron 2 tipos de mortalidad: por todas las causas y mortalidad atribuible a la EM. La mortalidad por todas las causas se estimó utilizando las probabilidades de muerte en función de la edad y el género extraídas de las tablas de mortalidad españolas23. La mortalidad atribuible a la EM ocurría cuando los pacientes transitaban a la puntuación de 10 en la EDSS (muerte).
Los pacientes podían abandonar el tratamiento en cualquier momento durante el horizonte temporal, reflejando la situación del mundo real. Además, se asumió que el tratamiento con IFNβ-1b se interrumpía cuando la puntuación en la EDSS de un paciente alcanzaba el 7, sobre la base de la opinión de expertos clínicos.
Al final de la simulación del modelo, se calcularon todos los costes y beneficios de todos los ciclos para generar estimaciones de costes y beneficios de la opción de tratamiento precoz vs. diferido. El diagnóstico de la EMCD se realizó de acuerdo con los criterios diagnósticos desarrollados por Poser et al.24 y McDonald et al.25.
En cada ciclo, los pacientes que continuaban vivos acumulaban 6 meses de vida, que después se ajustaron según la utilidad que correspondía a su estado de salud y a la aparición de una recaída (si procedía). Los resultados de estos cálculos se refirieron como años de vida ajustados por calidad (AVAC). Al final del modelo, los AVAC de todos los ciclos incluidos en el horizonte temporal se sumaron en cada grupo para poder calcular la razón de coste-utilidad incremental (RCUI). La RCUI se calculó como el tratamiento precoz vs. tratamiento diferido mediante la siguiente fórmula:
Del mismo modo, se procedió para calcular la razón de coste-efectividad incremental (RCEI) con las recaídas evitadas en cada grupo de tratamiento.
Se utilizó un horizonte temporal de 50 años para el análisis, ya que la edad media de los pacientes que participaron en el ensayo BENEFIT8 fue de 30 años y el promedio de vida en España es de alrededor de 80 años26.
El modelo se construyó desde la perspectiva social española. Además, se realizó un análisis adicional desde la perspectiva del Sistema Nacional de Salud (SNS). Todos los costes se calcularon en euros del 2013 y los costes y los resultados fueron descontados en un 3% anual27.
Fuentes de datosLa fuente de datos básica para el modelo fue el estudio BENEFIT8. El ensayo BENEFIT8 evaluó el impacto del tratamiento con IFNβ-1b después de un SDA (tratamiento precoz) en relación con retrasar la terapia con IFNβ-1b hasta el diagnóstico de EMCD (tratamiento diferido)9,10. El ensayo fue un estudio prospectivo, controlado con placebo, realizado en 98 centros de 20 países. Se reclutó a un total de 468 pacientes con un SDA con una duración superior a 24 h, sintomático y con unas pruebas radiológicas que indicaban una lesión única o más de una lesión en el sistema nervioso central. Los pacientes se asignaron aleatoriamente a IFNβ-1b (250mg a días alternos) o a placebo, durante los 2 primeros años. Los pacientes en el grupo con placebo continuaron recibiendo placebo hasta que fueron diagnosticados de EMCD sobre la base de los criterios de Poser et al.24 o hasta el final del estudio, a los 2 años. A los pacientes que completaron la fase con placebo se les ofreció la posibilidad de tratamiento con IFNβ-1b durante un máximo de 5 años desde su asignación al tratamiento inicial. Los resultados obtenidos después de 2 años de estudio demostraron que un número significativamente menor de pacientes en el grupo con IFNβ-1b desarrollaron EMCD en comparación con el grupo placebo (28% vs. 45%, p<0,0001)9. Los resultados obtenidos después de 5 años demostraron que el riesgo de conversión a EMCD en los pacientes que recibieron tratamiento con IFNβ-1b después de un SDA se redujo en el 37%, p=0,003, en comparación con aquellos que recibieron placebo10.
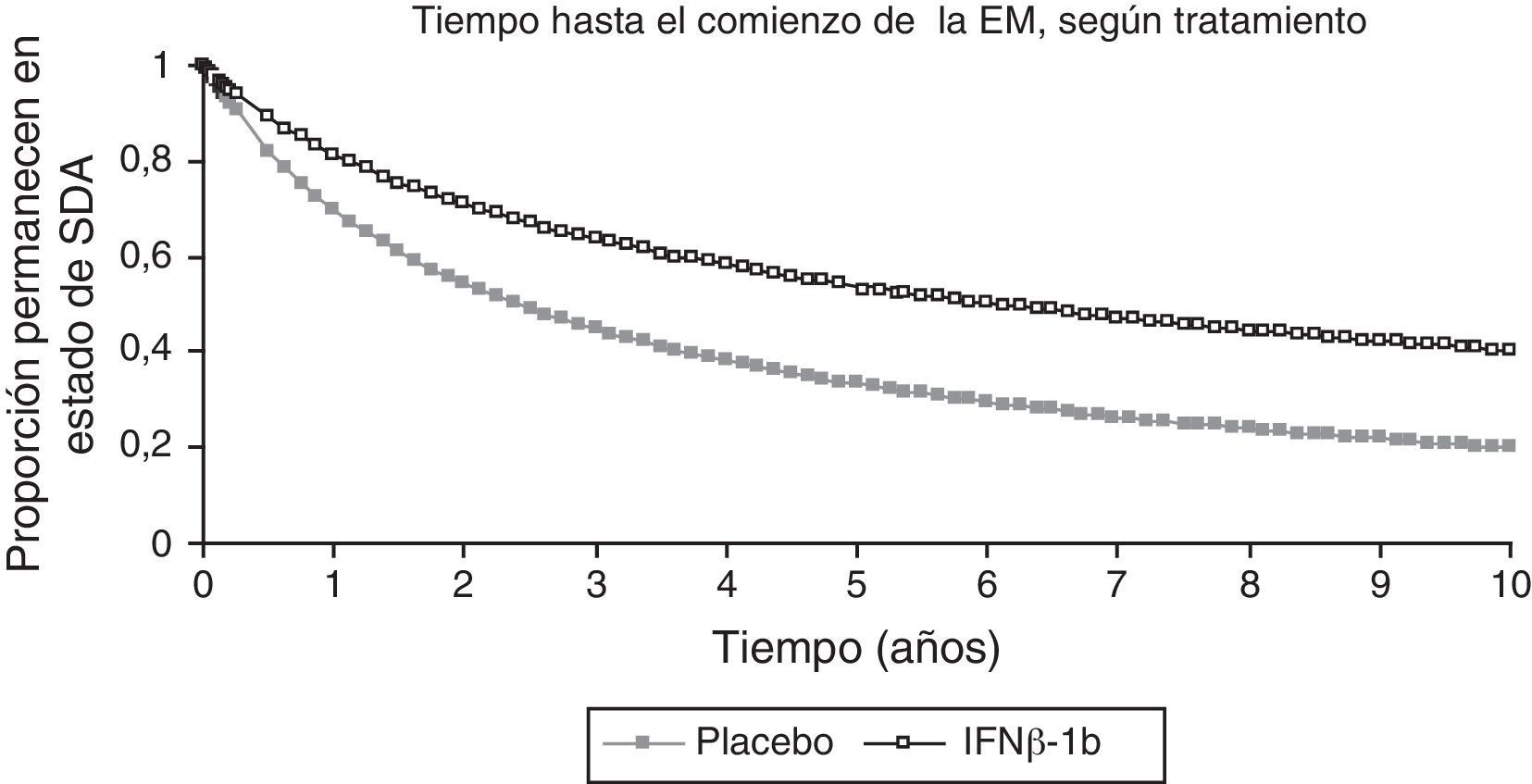
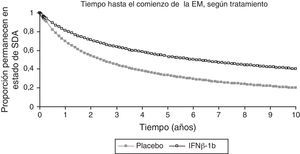
Para calcular la probabilidad de conversión de SDA a EM en ambos grupos durante 10 años, estimada mediante la curva de supervivencia de Kaplan-Meier (fig. 2), se utilizaron los datos del BENEFIT de los 2 primeros años para el grupo placebo y de los 5 años para el grupo con IFNβ-1b. Para ser conservadores, no se llevó a cabo la extrapolación más allá de 10 años. Para los ciclos del modelo más allá de los 10 años, se utilizaron las probabilidades de conversión en cada ciclo del décimo año.
Extrapolación de los datos de supervivencia del estudio BENEFIT.
BENEFIT, datos de 2 años utilizados para la extrapolación del grupo placebo; datos de 5 años utilizados para la extrapolación del tratamiento activo.
EM: esclerosis múltiple; IFNβ: interferón beta-1b; SDA: síndrome desmielinizante aislado.
Las tasas de interrupción del tratamiento se aplicaron tanto al tratamiento precoz como al diferido y se obtuvieron a partir de extrapolaciones basadas en los datos del Stockholm Swedish MS Registry28. Se ajustaron a los datos del registro distribuciones de Weibull y se hicieron extrapolaciones para extraer las tasas de distribución del tratamiento para un período de 50 años. La tasa de abandono del tratamiento aumentó con el tiempo y, aproximadamente, a la mitad del horizonte temporal todos los pacientes habían abandonado el tratamiento. La tasa de abandono del tratamiento no varió entre los 2 grupos de tratamiento. Además, una vez que los pacientes interrumpieron el tratamiento (sin cambio de tratamiento), se supuso que era hasta el final del horizonte temporal.
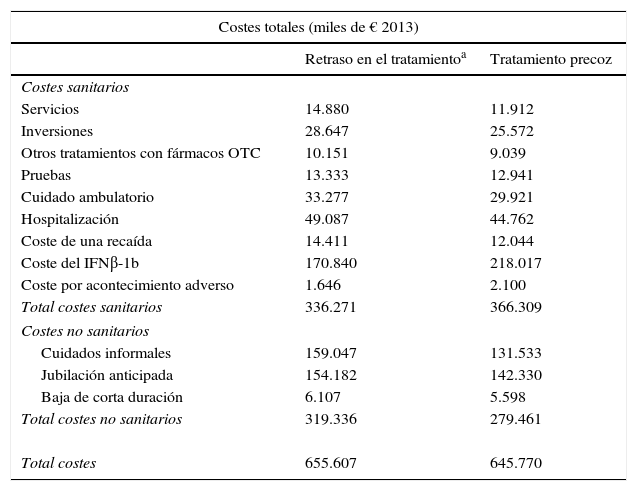
Los costes sanitarios y los costes no sanitarios (cuidados informales y pérdidas de productividad laboral) del tratamiento de la EM se estimaron a partir de la publicación de Kobelt et al.29 (tabla 2). Los costes según las puntuaciones de la EDSS utilizados para los pacientes con EM también se utilizaron para los pacientes con SDA. Se asumió que se producía un acontecimiento adverso (que requiriese una visita al médico no programada a la que se aplicó un coste unitario de una visita al médico) anual debido a la terapia con IFNβ-1b. El coste anual de la adquisición de IFNβ-1b (no incluida la administración) se obtuvo de la web del CGCOF30.
Costes (miles de euros de 2013)
| Costes totales (miles de € 2013) | ||
|---|---|---|
| Retraso en el tratamientoa | Tratamiento precoz | |
| Costes sanitarios | ||
| Servicios | 14.880 | 11.912 |
| Inversiones | 28.647 | 25.572 |
| Otros tratamientos con fármacos OTC | 10.151 | 9.039 |
| Pruebas | 13.333 | 12.941 |
| Cuidado ambulatorio | 33.277 | 29.921 |
| Hospitalización | 49.087 | 44.762 |
| Coste de una recaída | 14.411 | 12.044 |
| Coste del IFNβ-1b | 170.840 | 218.017 |
| Coste por acontecimiento adverso | 1.646 | 2.100 |
| Total costes sanitarios | 336.271 | 366.309 |
| Costes no sanitarios | ||
| Cuidados informales | 159.047 | 131.533 |
| Jubilación anticipada | 154.182 | 142.330 |
| Baja de corta duración | 6.107 | 5.598 |
| Total costes no sanitarios | 319.336 | 279.461 |
| Total costes | 655.607 | 645.770 |
Se utilizaron los datos del EQ-5D recogidos durante el ensayo BENEFIT cada 6 meses para estimar las utilidades específicas de cada estado de salud de la EDSS del modelo. Se calculó el valor medio para cada estado de salud de la EDSS, utilizando el algoritmo de conversión desarrollado por Dolan31. Más allá del período de seguimiento del estudio BENEFIT, las utilidades de los estados de salud se estimaron utilizando datos publicados definidos por la puntuación en la EDSS y la aparición de recaídas32,33.
Análisis del modeloEl análisis del caso base evaluó la RCUI y la RCEI comparando la diferencia de costes y AVAC o recaídas evitadas descontados entre el tratamiento precoz vs. diferido desde la perspectiva social. Adicionalmente, se realizaron los mismos análisis desde la perspectiva del SNS.
Se realizó un análisis de sensibilidad probabilístico para determinar la robustez del modelo mediante una simulación de Monte-Carlo de segundo orden. Se construyeron distribuciones beta utilizando los resultados del BENEFIT para las probabilidades de eficacia (progresión de la EDSS/discapacidad, la aparición de recaídas y la conversión de SDA a EMCD) y los valores de utilidad y se utilizó una distribución gamma para los costes.
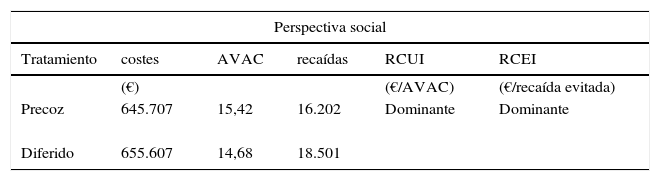
ResultadosEn el caso base (horizonte de 50 años), tanto la RCUI como la RCEI del tratamiento precoz con IFNβ-1b vs. el tratamiento diferido, usando tanto los criterios diagnósticos de Poser como los de McDonald, fueron dominantes (más eficaz y menos costoso) bajo la perspectiva social (tabla 3).
Resultados básicos del análisis de coste-efectividad
| Perspectiva social | |||||
|---|---|---|---|---|---|
| Tratamiento | costes | AVAC | recaídas | RCUI | RCEI |
| (€) | (€/AVAC) | (€/recaída evitada) | |||
| Precoz | 645.707 | 15,42 | 16.202 | Dominante | Dominante |
| Diferido | 655.607 | 14,68 | 18.501 | ||
| Perspectiva SNS | |||||
|---|---|---|---|---|---|
| Costes | AVAC | Recaídas | RCUI | RCEI | |
| (€) | (€/AVAC) | (€/recaída evitada) | |||
| Precoz | 366.309 | 15,42 | 16.202 | 40.702 | 13 |
| Diferido | 336.271 | 14,68 | 18.501 | ||
AVAC: años de vida ajustados por calidad; RCEI: razón de coste efectividad incremental; RCUI: razón de coste utilidad incremental; SNS: Sistema Nacional de Salud.
Bajo la perspectiva del SNS, la RCUI fue de 40.701,9 €/AVAC y la RCEI de 13,07 €/recaída evitada (incluyendo solamente los costes sanitarios) (tabla 2).
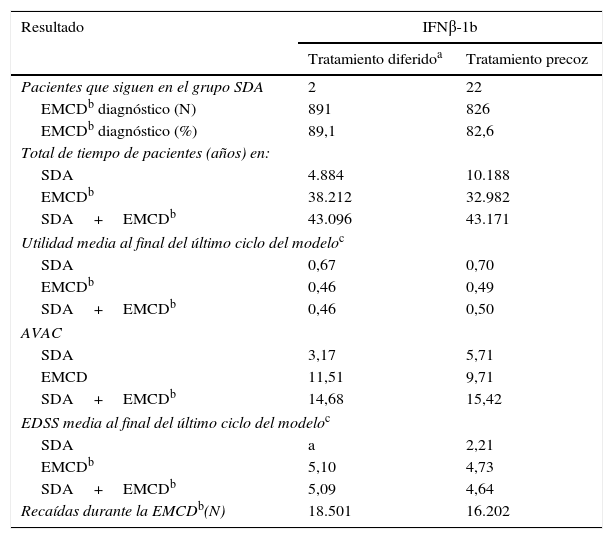
El número de recaídas (transiciones de un SDA a EMCD y recaídas una vez con EMCD) en el grupo con tratamiento precoz fue menor en comparación con el grupo con tratamiento diferido, indicando los beneficios clínicos de la intervención con IFNβ-1b precoz después de un SDA (tabla 4).
Resultados clínicos del modelo
| Resultado | IFNβ-1b | |
|---|---|---|
| Tratamiento diferidoa | Tratamiento precoz | |
| Pacientes que siguen en el grupo SDA | 2 | 22 |
| EMCDb diagnóstico (N) | 891 | 826 |
| EMCDb diagnóstico (%) | 89,1 | 82,6 |
| Total de tiempo de pacientes (años) en: | ||
| SDA | 4.884 | 10.188 |
| EMCDb | 38.212 | 32.982 |
| SDA+EMCDb | 43.096 | 43.171 |
| Utilidad media al final del último ciclo del modeloc | ||
| SDA | 0,67 | 0,70 |
| EMCDb | 0,46 | 0,49 |
| SDA+EMCDb | 0,46 | 0,50 |
| AVAC | ||
| SDA | 3,17 | 5,71 |
| EMCD | 11,51 | 9,71 |
| SDA+EMCDb | 14,68 | 15,42 |
| EDSS media al final del último ciclo del modeloc | ||
| SDA | a | 2,21 |
| EMCDb | 5,10 | 4,73 |
| SDA+EMCDb | 5,09 | 4,64 |
| Recaídas durante la EMCDb(N) | 18.501 | 16.202 |
EDSS: Expanded Disability Status Scale; EMCD: esclerosis múltiple clínicamente definida; EMRR: esclerosis múltiple remitente recurrente; EMSP: esclerosis múltiple secundaria progresiva; IFNβ-1b: interferón beta-1b; SDA: síndrome desmielinizante aislado.
Los pacientes con tratamiento precoz acumularon mayores costes sanitarios (30.038 € más), mientras que los pacientes con tratamiento diferido acumularon mayores costes no sanitarios (39.875 € más) en el horizonte temporal de 50 años (tabla 2). En ambos grupos, los costes por jubilación anticipada representaron más del 96% del total de los costes por pérdidas de productividad. Al sumar los costes totales sanitarios y no sanitarios, los pacientes con tratamiento diferido acumularon mayores costes totales (9.837 € más) que con tratamiento precoz (tabla 2).
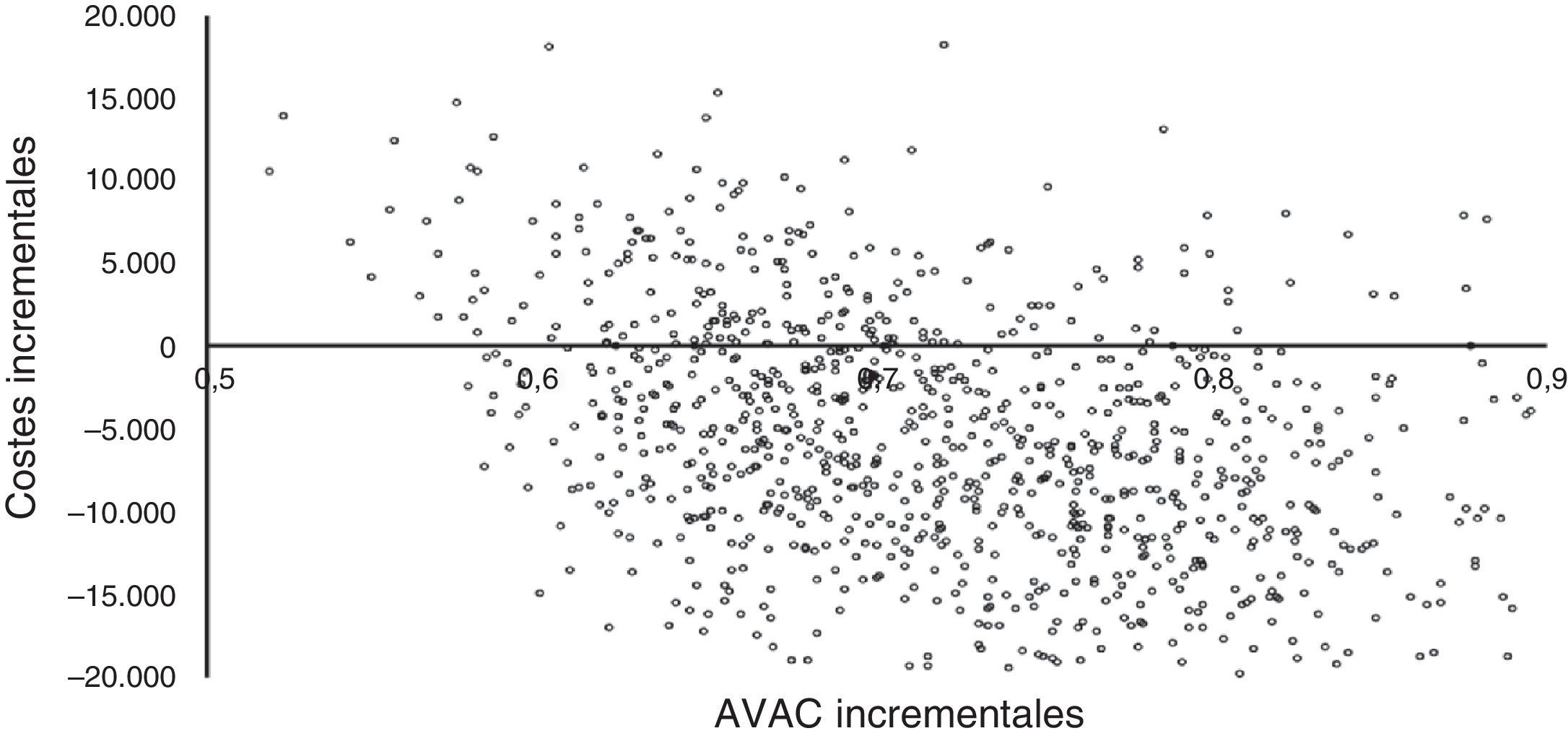
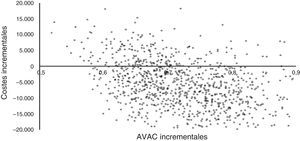
La figura 3 muestra los resultados de la simulación de Monte-Carlo utilizada para el análisis de sensibilidad. Los costes incrementales y los AVAC incrementales están representados por puntos individuales en el plano de coste-efectividad para cada uno de los 1.000 pacientes simulados. La figura muestra cómo más de la mitad de los puntos se sitúan en el cuadrante inferior derecho del plano, lo que indica menor coste y mayor efectividad, mientras que todos los puntos con un coste superior (cuadrante superior derecho) presentan una RCUI inferior a 30.000 €/AVAC (umbral de eficiencia utilizado en España)34.
DiscusiónEste estudio evaluó el coste-efectividad del tratamiento con IFNβ-1b de pacientes con un SDA, en comparación con el tratamiento diferido hasta el inicio de la EMCD. Los análisis mostraron que el tratamiento precoz se asoció a menores costes y mayor efectividad que el tratamiento diferido utilizando tanto los criterios diagnósticos de Poser como de McDonald desde una perspectiva social.
Aunque los AVAC son el denominador más común en las RCEI, otras métricas de coste-efectividad incluidas en este modelo proporcionan también información útil sobre la importancia del inicio precoz del tratamiento. Por ejemplo, el tratamiento precoz también demostró ser menos costoso y más efectivo al definir la eficacia como el número total de recaídas sufridas en el grupo con EM, proporcionando una evidencia adicional para apoyar la conclusión de que el tratamiento precoz ofrece una buena relación coste-beneficio en salud en términos de reducción de la carga de las recaídas en el grupo con EM, en gran medida, al retrasar la transición de un SDA a EMCD.
Existe poca información publicada en la literatura sobre el coste-efectividad del tratamiento precoz de un SDA. Lazzaro et al.35 mostraron cómo, en comparación con el retraso en el tratamiento, el tratamiento precoz con IFNβ-1b fue dominante desde la perspectiva social en Italia, lo cual es coherente con el presente trabajo. Iskedjian et al.36 también llevaron a cabo una evaluación económica con un TME después de un SDA y hallaron que el tratamiento con IFNβ-1b era coste-efectivo desde la perspectiva social en Canadá. Sin embargo, debido a que los resultados de los beneficios en salud en ese modelo no se presentaron en términos de coste por AVAC, sus resultados no son directamente comparables con los del presente modelo. Hay 2 publicaciones más recientes con datos comparables desde la perspectiva social37,38. Pan et al.37 publicaron los resultados de este mismo modelo adaptado a EE. UU. que muestra una RCEI de 46.357 $/AVAC ganado y 30.967 $/año de vida ganado. Mientras que en la adaptación de este modelo en Suecia38, el tratamiento precoz con IFNβ-1b fue dominante vs. el tratamiento diferido cuando se utilizaron los AVAC como medida de eficacia. Estos 2 últimos artículos muestran resultados de este modelo, que además son resultados diferentes cuando se comparan Suecia y España (resultados similares) o los 2 países y EE. UU., probablemente debido a los diferentes sistemas de salud y costes de estos 2 países y EE. UU.
Dado que los TME son eficaces para reducir las tasas de recaídas y para desacelerar la progresión de la EM, y el tratamiento precoz de los pacientes con SDA podría alargar el tiempo hasta la conversión a EMCD, y a pesar de algunas limitaciones e incertidumbres de los modelos económicos, numerosos estudios han demostrado que el aumento de la discapacidad se asocia al aumento de los costes39,40. Como consecuencia de estos estudios, la estabilidad de la enfermedad en bajos grados funcionales de discapacidad debería tener como objetivo no solo mejorar la calidad de vida de los pacientes individuales, sino también proporcionar un beneficio en aspectos socio-económicos. Si la progresión se puede empezar a retrasar lo antes posible en el curso de la enfermedad, la calidad de vida y la independencia funcional de los pacientes mejorarán, y los costes para los sistemas de salud, la sociedad y los pacientes también se reducirán41.
Este análisis está sujeto a ciertas limitaciones. En primer lugar, el impacto del tratamiento con IFNβ-1b en la progresión de la enfermedad se basa únicamente en el ensayo clínico BENEFIT. No había información disponible en la literatura sobre datos a largo plazo del tratamiento precoz después de un SDA vs. el diferido que pudiesen o no ser diferentes de los observados en el ensayo BENEFIT. Por lo tanto, los resultados de este modelo deben tratarse con precaución en su transferibilidad a poblaciones reales. En segundo lugar, se asumió que los costes y las utilidades eran los mismos si los pacientes estaban en la misma categoría en la EDSS, independientemente de si tenían EM o un SDA, dada la falta de datos en pacientes con SDA. En tercer lugar, existe una incertidumbre adicional sobre el umbral de la EDSS a partir del cual detener el uso del TME, que se basa en una extrapolación de los datos del ensayo BENEFIT y de la opinión de expertos. En cuarto lugar, se supuso que una vez que los pacientes interrumpieron el tratamiento, este se detuvo hasta el final del horizonte temporal del modelo. En el mundo real, algunos de ellos podrían haber cambiado a otro tratamiento. También, debido a la falta de disponibilidad de datos a largo plazo sobre el riesgo de acontecimientos adversos de los TME, se asumió que había un acontecimiento adverso por persona y año, sobre la base de la opinión de expertos. Sin embargo, ello puede haber generado un coste adicional que podría ser excesivo. Por último, los pacientes con EM que recibieron INFB-1b podrían haber desarrollado anticuerpos neutralizantes antiinterferón beta, que podrían haber reducido la eficacia clínica del INFB-1b. No se incluyó en este modelo el estudio del impacto potencial de los anticuerpos sobre la eficacia del tratamiento con TME debido a la falta de datos.
En conclusión, los resultados del modelo muestran que el tratamiento precoz con IFNβ-1b después de un SDA frente al tratamiento diferido es eficiente desde la perspectiva social tanto si utilizamos los AVAC, como denominador como las recaídas evitadas (dominante en ambos casos) y puede dejar de ser eficiente desde la perspectiva del SNS al no tener en cuenta los costes no sanitarios (cuidadores informales y bajas laborales) y utilizar como denominador los AVAC.
Conflicto de interesesDurante la etapa de realización del modelo, la autora trabajaba en Bayer, empresa comercializadora del medicamento del estudio. La vinculación contractual con la empresa finalizó antes de realizar este manuscrito.
Quisiera agradecer a Txomin Arbizu su colaboración en la realización de este estudio, a Juan Oliva sus siempre sabios consejos y a Max Brosa su ayuda, sin la cual no habría podido finalizar este artículo.
Este trabajo se presentó en una versión anterior (datos de 2009) en:.
Arbizu T, Piñol C, Casado V, Caloyeras JP. Coste utilidad de interferón beta en el tratamiento de pacientes con síndrome desmielinizante aislado sugestivo de esclerosis múltiple en España. XXVIII Jornadas de la Asociación de Economía de la Salud. Málaga 17-19 de junio 2009. Gaceta Sanitaria. 2009;23 Espec Cong 2:65.
Arbizu T, Piñol C, Casado V. Cost-utility of interferon beta-1b in the treatment of patients with a clinical isolated syndrome suggestive of multiple sclerosis in Spain. ISPOR 12th Annual European Congress. Paris, France, 24-27 October 2009. Value in Health. 2009;12(7):A370.