La trombosis venosa cerebral (TVC) es una patología infrecuente de etiología multifactorial, incluyendo trombofilias hereditarias. La hiperhomocisteinemia, secundaria a mutaciones en mutación de la metilentetrahidrofolato reductasa (MTHFR), es un posible factor de riesgo.
Caso clínicoMujer de 29 años con obesidad grado III, preeclampsia y antecedentes familiares de trombosis cerebral, consultó por cefalea progresiva. La neuroimagen mostró trombosis extensa de senos durales e hipertensión intracraneana. Se identificó hiperhomocisteinemia y mutación MTHFR (c.677C>T), iniciándose anticoagulación con dabigatrán.
ConclusionesLa relación entre TVC y mutaciones en MTHFR es controversial. No hay evidencia sólida que respalde la búsqueda sistemática de hiperhomocisteinemia en trombosis cerebral sin un claro factor desencadenante.
Cerebral venous thrombosis (CVT) is an uncommon condition with a multifactorial etiology, including hereditary thrombophilias. Hyperhomocysteinemia, secondary to MTHFR mutations, is a potential risk factor.
Case reportA 29-year-old woman with grade III obesity, preeclampsia, and a family history of cerebral thrombosis presented with progressive headache. Neuroimaging revealed extensive dural sinus thrombosis and intracranial hypertension. Hyperhomocysteinemia and an MTHFR (c.677C>T) heterozygous mutation were identified, leading to anticoagulation with dabigatran.
ConclusionsThe association between CVT and MTHFR mutations remains controversial. There is no solid evidence supporting the systematic screening of hyperhomocysteinemia in cerebral thrombosis without a clear triggering factor.
La trombosis venosa cerebral (TVC) se define como la presencia de un trombo sanguíneo en los senos venosos durales, las venas cerebrales o ambos territorios vasculares1. Registros basados en estudios de cohorte señalan que la TVC afecta predominantemente a personas menores de 55 años, con mayor prevalencia en el sexo femenino2,3. En cuanto a la localización del compromiso trombótico, los territorios más frecuentemente afectados son el seno transverso (25-60%), el seno sagital superior (25-45%), las venas corticales (15-17%) y múltiples senos (18-50%)4. Su incidencia varía según la población estudiada; sin embargo, se estima en aproximadamente 1,32 casos por 100.000 personas por año5.
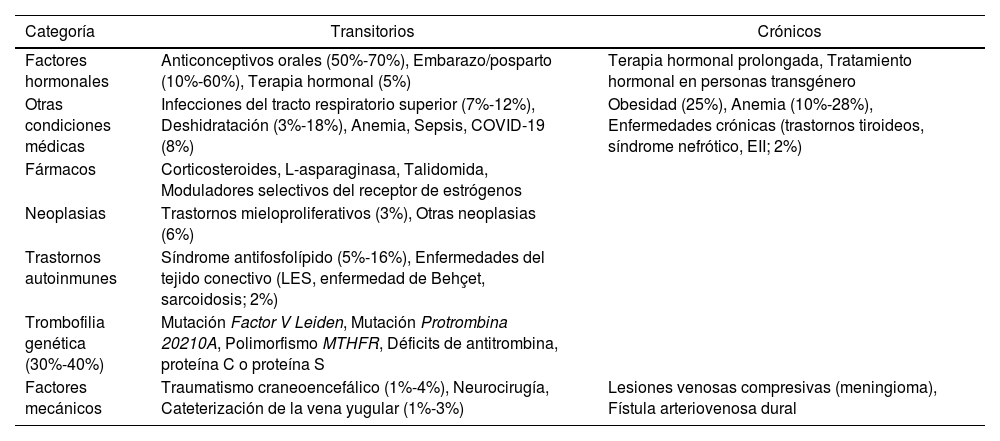
Los factores predisponentes para la TVC pueden ser transitorios, persistentes o, en algunos casos, no identificarse claramente6. La frecuencia de TVC es mayor en mujeres jóvenes, particularmente durante la gestación, la lactancia o el uso de terapia hormonal oral (principalmente con estrógenos), lo que incrementa el riesgo de trombosis hasta ocho veces7. Otros factores de riesgo se detallan en la tabla 1.
Factores predisponentes asociados a la trombosis venosa cerebral
| Categoría | Transitorios | Crónicos |
|---|---|---|
| Factores hormonales | Anticonceptivos orales (50%-70%), Embarazo/posparto (10%-60%), Terapia hormonal (5%) | Terapia hormonal prolongada, Tratamiento hormonal en personas transgénero |
| Otras condiciones médicas | Infecciones del tracto respiratorio superior (7%-12%), Deshidratación (3%-18%), Anemia, Sepsis, COVID-19 (8%) | Obesidad (25%), Anemia (10%-28%), Enfermedades crónicas (trastornos tiroideos, síndrome nefrótico, EII; 2%) |
| Fármacos | Corticosteroides, L-asparaginasa, Talidomida, Moduladores selectivos del receptor de estrógenos | |
| Neoplasias | Trastornos mieloproliferativos (3%), Otras neoplasias (6%) | |
| Trastornos autoinmunes | Síndrome antifosfolípido (5%-16%), Enfermedades del tejido conectivo (LES, enfermedad de Behçet, sarcoidosis; 2%) | |
| Trombofilia genética (30%-40%) | Mutación Factor V Leiden, Mutación Protrombina 20210A, Polimorfismo MTHFR, Déficits de antitrombina, proteína C o proteína S | |
| Factores mecánicos | Traumatismo craneoencefálico (1%-4%), Neurocirugía, Cateterización de la vena yugular (1%-3%) | Lesiones venosas compresivas (meningioma), Fístula arteriovenosa dural |
COVID-19: enfermedad por coronavirus 2019; EII: enfermedad inflamatoria intestinal; LES: lupus eritematoso sistémico; MTHFR: metilentetrahidrofolato reductasa; TVC: trombosis venosa cerebral.
Adaptado de Saposnik G et al.4.
La hiperhomocisteinemia es un trastorno bioquímico caracterizado por el aumento de los niveles plasmáticos de homocisteína8. Se ha asociado con múltiples enfermedades de interés clínico, incluyendo patologías cardiovasculares, cerebrovasculares y neurodegenerativas, así como trastornos renales y metabólicos8. En particular, se ha identificado como un factor de riesgo independiente para la TVC, con una prevalencia estimada entre el 27% y el 52,1% en los primeros casos diagnosticados9–12.
En la práctica clínica actual, no existen indicaciones estandarizadas para el tamizaje rutinario de esta entidad, y no hay un consenso claro entre las diversas sociedades internacionales sobre la medición sistemática de homocisteína en la evaluación de trombosis venosa sin causa aparente. A continuación, se presenta el caso único de una paciente de 29 años con cefalea y síntomas neurológicos inespecíficos, en quien se estableció el diagnóstico de una trombosis de senos venosos durales secundaria a una mutación en el gen mutación de la metilentetrahidrofolato reductasa (MTHFR).
Presentación del casoSe trata de una mujer de 29 años con antecedentes de obesidad grado III, preeclampsia, eclampsia en gestaciones previas, historia familiar de trombosis cerebral en un hermano y su padre antes de los 30 años. Consultó a un centro local por cefalea hemicraneana derecha de una semana de evolución, con aumento progresivo en intensidad. Inicialmente, recibió manejo analgésico sin mejoría, motivo por el cual fue remitida a un centro de mayor complejidad.
Al ingreso a nuestra institución, presentaba presión arterial dentro de rangos de normalidad y un examen neurológico sin alteraciones significativas; como único hallazgo positivo, refería náuseas sin emesis. Dadas las características de la cefalea y el antecedente familiar de trombosis cerebral, se realizó una tomografía de cráneo simple (fig. 1), en la que se evidenció una TVC con extensión desde el seno sagital superior, la tórcula de Herófilo, el seno transverso derecho y el seno sigmoide ipsilateral. Se inició tratamiento con enoxaparina 100mg cada 12 horas y se solicitaron estudios complementarios para descartar diagnósticos diferenciales como síndrome antifosfolípido o lupus eritematoso sistémico.
Durante la evaluación por el servicio de Medicina Interna Vascular, la paciente presentó un empeoramiento de la cefalea, acompañado de diplopía. Ante estos hallazgos, se realizó una resonancia magnética cerebral, que evidenció trombosis en el seno transverso derecho (fig. 2, panel C), aplanamiento posterior del globo ocular (fig. 2, panel D), engrosamiento de la vaina del nervio óptico y dilatación compensatoria del seno recto (fig. 2, panel E), hallazgos sugestivos de hipertensión intracraneana. Tras evaluar el riesgo-beneficio, se decidió no realizar manejo endovascular y se inició tratamiento con acetazolamida 250mg cada ocho horas, con posterior mejoría de los síntomas neurológicos.
Resonancia de cráneo: C) secuencia ponderada en T1 y supresión grasa: la flecha indica un realce anómalo que corresponde a una ocupación trombótica del seno transverso derecho. D) secuencia ponderada en T1 y supresión grasa: la flecha indica el aplanamiento posterior del globo ocular derecho. E) reconstrucción 3D del sistema venoso: la flecha naranja indica una dilatación compensatoria del seno transverso. La flecha roja indica un flujo filiforme a nivel seno transverso derecho.
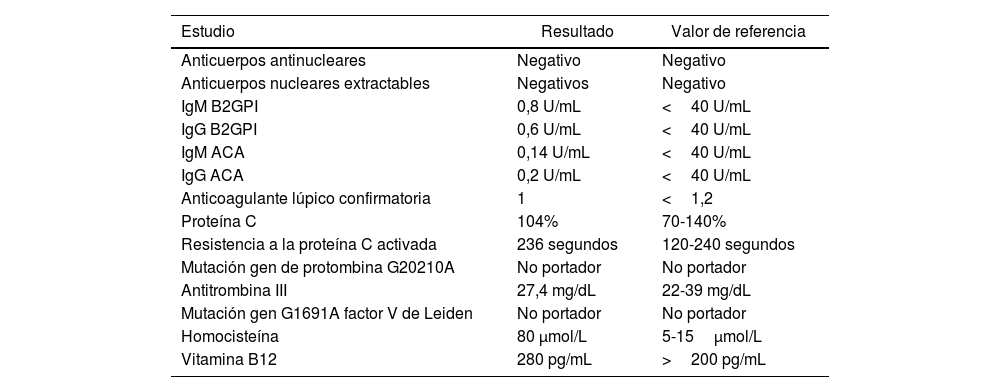
Ante la alta sospecha de trombosis venosa de origen hereditario, se solicitaron estudios de trombofilia. Se descartó deficiencia de proteína C y mutación en el gen de la protrombina (tabla 2). Sin embargo, se documentó una hiperhomocisteinemia sin deficiencia de vitamina B12. Dado el antecedente familiar de trombosis con características similares, se solicitó un estudio genético para mutaciones en el gen MTHFR, el cual resultó positivo para la variante c.677C>T (A222V) en genotipo heterocigoto. Con este hallazgo, se definió anticoagulación indefinida con dabigatrán 150mg cada 12 horas con evolución favorable.
Estudios etiológicos
| Estudio | Resultado | Valor de referencia |
|---|---|---|
| Anticuerpos antinucleares | Negativo | Negativo |
| Anticuerpos nucleares extractables | Negativos | Negativo |
| IgM B2GPI | 0,8 U/mL | <40 U/mL |
| IgG B2GPI | 0,6 U/mL | <40 U/mL |
| IgM ACA | 0,14 U/mL | <40 U/mL |
| IgG ACA | 0,2 U/mL | <40 U/mL |
| Anticoagulante lúpico confirmatoria | 1 | <1,2 |
| Proteína C | 104% | 70-140% |
| Resistencia a la proteína C activada | 236 segundos | 120-240 segundos |
| Mutación gen de protombina G20210A | No portador | No portador |
| Antitrombina III | 27,4 mg/dL | 22-39 mg/dL |
| Mutación gen G1691A factor V de Leiden | No portador | No portador |
| Homocisteína | 80 μmol/L | 5-15μmol/L |
| Vitamina B12 | 280 pg/mL | >200 pg/mL |
B2GPI: β2 glicoproteína I; ACA: anticuerpos anticardiolipina.
La homocisteína es un aminoácido sulfhídrico no esencial y no proteinogénico que actúa como intermediario en el metabolismo de la metionina1,2. Este metabolismo sigue dos vías principales: la remetilación, mediante la cual se convierte nuevamente en metionina por acción de la enzima metiltetrahidrofolato reductasa (MTHFR), con la vitamina B12 y el ácido fólico como cofactores; y la transulfuración, en la que la homocisteína se convierte en cistationina mediante la cistationina β-sintasa (CBS), dependiente de vitamina B6, para luego transformarse en cisteína a través de la cistationina γ-liasa, también dependiente del mismo cofactor (fig. 3)13.
Desde el punto de vista patológico, la hiperhomocisteinemia se define como un trastorno metabólico caracterizado por niveles plasmáticos de homocisteína superiores a 15μmol/L, lo que se asocia con diversas patologías14. Las causas más frecuentes incluyen mutaciones en las enzimas MTHFR y CBS, así como deficiencias de sus cofactores. Además, condiciones como la enfermedad renal crónica, hipotiroidismo, enfermedades hepáticas, alcoholismo, tabaquismo, sedentarismo y el uso de ciertos fármacos pueden contribuir a su desarrollo14,15.
Las manifestaciones clínicas de la hiperhomocisteinemia afectan múltiples sistemas. A nivel cardiovascular, se ha identificado como un factor de riesgo para disfunción endotelial, aterosclerosis, enfermedad arterial periférica, estenosis arterial progresiva y diferentes eventos tromboembólicos16. La disfunción endotelial, mediada por alteraciones en la biodisponibilidad de óxido nítrico y la retroalimentación de la respuesta inflamatoria favorecen el desarrollo de estados protrombóticos17. Además, la activación del factor tisular en el endotelio disfuncional, la presencia de monocitos y células endoteliales proinflamatorias, junto con el aumento en la producción de trombina, facilitan la conversión de fibrinógeno en fibrina. Adicionalmente, se observa una disminución de la trombomodulina, lo que impide la activación de la proteína C, así como una reducción de la capacidad fibrinolítica debido a la interferencia en la unión del activador del plasminógeno tisular a la superficie endotelial. Todo esto no solo promueve la génesis trombótica, sino que también genera coágulos más estables18,19.
La variante c.677C>T - A222V del gen MTHFR (genotipo heterocigoto) afecta la actividad de la enzima MTHFR, disminuyéndola en función del grado de afectación18–20. A diferencia del genotipo wild-type (C/C) y del genotipo homocigoto, el genotipo heterocigoto conlleva un compromiso parcial de la enzima, lo que no es tan grave como en el caso del genotipo homocigoto, pero se ha descrito como un factor de riesgo independiente para la TVC, que, en coexistencia de esta mutación con otros factores de riesgo como la deficiencia de cofactores o la presencia de otras alteraciones patológicas, se ha descrito como factor de riesgo relevante para eventos trombóticos y su recurrencia20.
Diversos estudios han explorado el papel de la hiperhomocisteinemia como factor de riesgo potencial en la TVC. En una serie de casos y controles, Martinelli et al.10 identificaron una prevalencia significativamente mayor de hiperhomocisteinemia en pacientes con TVC (43%) en comparación con controles sanos (13%), incluso en ausencia de mutaciones genéticas identificables como la mutación C677T en el gen MTHFR. Además, en su análisis multivariado, la hiperhomocisteinemia se asoció de forma independiente con un mayor riesgo de TVC, sugiriendo un papel etiológico potencial más allá de la predisposición genética10. Este estudio, fue uno de los primeros en establecer una asociación estadísticamente significativa entre homocisteína elevada y la TVC, independientemente de otros factores de riesgo conocidos. Cabe destacar que dicha investigación incluyó pacientes jóvenes sin comorbilidades relevantes, lo que refuerza la hipótesis de su papel como factor de riesgo primario.
Kalita et al.11 en su estudio prospectivo realizado en la India, reportaron una frecuencia de hiperhomocisteinemia del 47% en pacientes con TVC. Más aún, encontraron que los niveles elevados de homocisteína se correlacionaban significativamente con puntuaciones más altas en la escala del National Institutes of Health Stroke Scale al ingreso, así como con un peor desenlace funcional durante el seguimiento evaluado por la escala de Rankin modificada11. El diseño prospectivo de este estudio permite una evaluación temporal más clara de la relación entre hiperhomocisteinemia y la gravedad clínica del evento, y subraya la relevancia potencial de este marcador no solo en el diagnóstico etiológico, sino también como factor pronóstico en el contexto de la TVC.
Por su parte, Boncoraglio et al.9 analizaron una cohorte europea de pacientes con TVC, encontrando que el 38,4% presentaba hiperhomocisteinemia. Curiosamente, una proporción significativa de estos pacientes no presentaba polimorfismos del gen MTHFR, lo que sugiere que factores ambientales o deficiencias vitamínicas (folatos, B6, B12) podrían estar contribuyendo a los niveles elevados de homocisteína en estos casos9. Este hallazgo es de particular importancia, ya que sugiere la necesidad de una evaluación nutricional completa en pacientes con TVC e hiperhomocisteinemia, especialmente en ausencia de factores genéticos. Asimismo, se propuso que, en ciertos pacientes, el tratamiento con suplementación vitamínica podría tener un rol en la reducción de homocisteína, aunque su beneficio clínico directo sigue siendo objeto de debate.
En sumatoria, se ha planteado que niveles>50μmol/L de homocisteína podrían asociarse con un mayor riesgo de recurrencia trombótica y retraso en la recanalización venosa, aunque esta asociación aún requiere validación en estudios prospectivos de mayor tamaño10,11.
Pese a estos hallazgos, no existe consenso sobre el tamizaje sistemático de homocisteína en todos los pacientes con TVC. Su medición podría considerarse en individuos jóvenes, sin factores de riesgo adquiridos o con antecedentes personales o familiares de eventos trombóticos. Aunque, no se ha demostrado una asociación consistente entre la hiperhomocisteinemia y la trombosis venosa en otros territorios, por lo que las guías clínicas actuales no recomiendan su determinación de forma rutinaria.
En nuestro centro, el abordaje diagnóstico de la TVC se realiza de forma escalonada. Inicialmente se investigan causas adquiridas frecuentes, como infecciones, deshidratación, uso de anticonceptivos orales. Si no se identifica una etiología clara, se amplía el estudio hacia trombofilias como el síndrome antifosfolípido o enfermedades autoinmunes siempre y cuando la presentación clínica oriente a estas condiciones. En el caso clínico que presentamos, se realizó la medición de homocisteínas considerando que se trataba de un evento no provocado con historial de trombosis cerebral en familiares de primer grado sin factor desencadenante aparente. No obstante, tras revisar la evidencia actual, consideramos que la indicación de la medición de homocisteína debe evaluarse con cautela en escenarios similares.
La anticoagulación es el pilar fundamental en el tratamiento de la TVC, con el objetivo de prevenir la extensión trombótica, reducir el riesgo de recurrencia y favorecer la recanalización efectiva4. Según guías internacionales, la duración del tratamiento es de tres a seis meses en presencia de un factor de riesgo transitorio, seis a 12 meses en casos sin factores desencadenantes y, en situaciones relacionadas con trombofilias o recurrencia trombótica, se debe considerar la anticoagulación de manera indefinida4. Respecto al fármaco de elección, los antagonistas de la vitamina K han sido el tratamiento de referencia. Sin embargo, con el advenimiento de los anticoagulantes orales directos, las limitaciones y efectos adversos de la warfarina han cobrado mayor relevancia, lo que ha impulsado la necesidad de evaluar alternativas seguras y eficaces para el tratamiento de la trombosis cerebral.
En este contexto, en 2019 se llevó a cabo el estudio RE-SPECT CVT, cuyo objetivo principal fue comparar la seguridad y eficacia del dabigatrán etexilato (150mg cada 12 horas) frente a la warfarina (dosis ajustada para lograr un INR entre 2-3) en la prevención de recurrencia trombótica cerebral21. Entre los resultados, destacó la ausencia de recurrencias en ambos grupos, la aparición de un sangrado gastrointestinal en el grupo del dabigatrán y dos sangrados intracerebrales en el grupo de warfarina. Se concluyó que tanto la warfarina como el dabigatrán son eficaces en la prevención de recurrencias trombóticas, y, que este último es una opción razonable según el contexto clínico individual21.
En contra parte, el estudio Study of Rivaroxaban in Cerebral Venous Thrombosis (SECRET), un ensayo clínico fase II, aleatorizó a 53 pacientes con TVC en una proporción 1:1 para recibir rivaroxabán 20mg diarios o anticoagulación estándar (warfarina con INR objetivo de 2.0-3.0 o heparina de bajo peso molecular) por un mínimo de seis meses22. Tras este periodo, en el grupo de rivaroxabán se reportó un caso de recurrencia de TVC (3,8% [IC 95%: 0,1%-19,6%]), una hemorragia intracerebral sintomática (3,8% [IC 95%: 0,1%-19,6%]) y dos episodios de sangrado clínicamente relevante no mayor (7,7% [IC 95%: 0,9%-25,1%]), mientras que en el grupo de tratamiento estándar no se documentó recurrencias ni eventos hemorrágicos. En conclusión, aunque no se evidenció un claro aumento en el riesgo de sangrado con el uso temprano de anticoagulantes orales directos en TVC, se requiere de nueva evidencia que aporte información adicional sobre su seguridad en este contexto22.
En cambio, el ACTION-CVT, un análisis retrospectivo internacional, comparó a 845 pacientes con TVC tratados con antagonistas de la vitamina K o anticoagulantes orales directos (apixabán 67%, rivaroxabán 18% y dabigatrán 14%) en un periodo de cinco años, 2015 a 202023. Entre sus hallazgos, no se observaron diferencias significativas en la recurrencia de tromboembolismo venoso (HR [Hazard Ratio] ajustado: 0,94 [IC 95%: 0,15-1,73]), y se evidenció un menor riesgo de hemorragia mayor en el grupo de anticoagulantes orales directos (HR ajustado: 0,35 [IC 95%: 0,15-0,82]), principalmente por reducción del sangrado intracerebral y las tasas de recanalización fueron similares en ambos grupos, lo que sugiere que el uso de anticoagulantes orales directos puede ser una alternativa razonable, segura y eficaz en este contexto23.
Respecto al tratamiento endovascular (TEV), su beneficio clínico en comparación con la anticoagulación estándar no se encuentra claramente definido24. Estudios sobre trombectomía mecánica, trombólisis intrasinusal y el uso de stents han mostrado resultados controvertidos en términos de seguridad y complicaciones. Respecto a esto, el ensayo clínico TO-ACT no evidenció mejoría clínica con TEV en pacientes con TVC grave, y análisis amplios han asociado esta estrategia con mayor mortalidad sin un claro beneficio24. Actualmente, el TEV se considera una terapia de rescate en casos con deterioro clínico, fracaso o contraindicación para la anticoagulación.
Por último, en el manejo específico de la hiperhomocisteinemia, se sugiere que la reducción de los niveles de homocisteína mediante suplementación con cofactores podría ser útil en la prevención de eventos trombóticos25. Sin embargo, el seguimiento rutinario de estos niveles es controversial, y, dada la falta de evidencia concluyente y su limitada aplicabilidad en la práctica clínica no es una conducta que se recomiende ampliamente más allá de la anticoagulación adecuada cuando se documentan eventos trombóticos.
ConclusionesPresentamos el caso de una paciente joven con TVC secundaria a una mutación en el gen MTHFR, en quien se logró el diagnóstico mediante un enfoque basado en la exclusión de diagnósticos diferenciales. Sin embargo, a la luz de la evidencia actual, no existe un consenso claro que recomiende la medición sistemática de homocisteína en eventos tromboembólicos sin un claro factor desencadenante. A pesar de ello, la anticoagulación indefinida y la reposición de deficiencias de vitaminas (en casos de deficiencia) podrían representar una estrategia razonable. No obstante, se resalta la necesidad de nuevos estudios con un adecuado diseño metodológico que ayuden a dilucidar el impacto a largo plazo del manejo personalizado en pacientes con TVC asociada a hiperhomocisteinemia.
FinanciaciónNo se recibe financiación.
Conflicto de interesesLos autores afirman no tener conflictos de interés a la realización del presente reporte de caso.