La potenciación de larga duración (LTP) ha sido considerada por largo tiempo como un índice de la plasticidad sináptica. Su presencia ha sido demostrada recientemente en humanos utilizando técnicas de potenciales evocados. Al mismo tiempo, la enfermedad de Alzheimer ha sido propuesta hace un tiempo como una falla sináptica. Sin embargo, los nuevos criterios diagnósticos para el Alzheimer no utilizan ningún criterio picofisiológico. Teniendo en cuenta que los criterios excluyen a pacientes que no presentan deterioro de la memoria, sería de particular utilidad aplicar estas nuevas técnicas no invasivas para establecer fallos tempranos de la plasticidad sináptica.
Long term potentiation (LTP) is considered an index of synaptic plasticity. It has been recently demonstrated in humans using non-invasive techniques. At the same time, Alzheimer's disease has been seen as a synaptic failure, but the new diagnostic criteria do not include any psychophysiological measure. Considering that the new criteria exclude patients that do not show memory deterioration, it may be useful to utilize an index of synaptic plasticity in order to improve the chances of early detection.
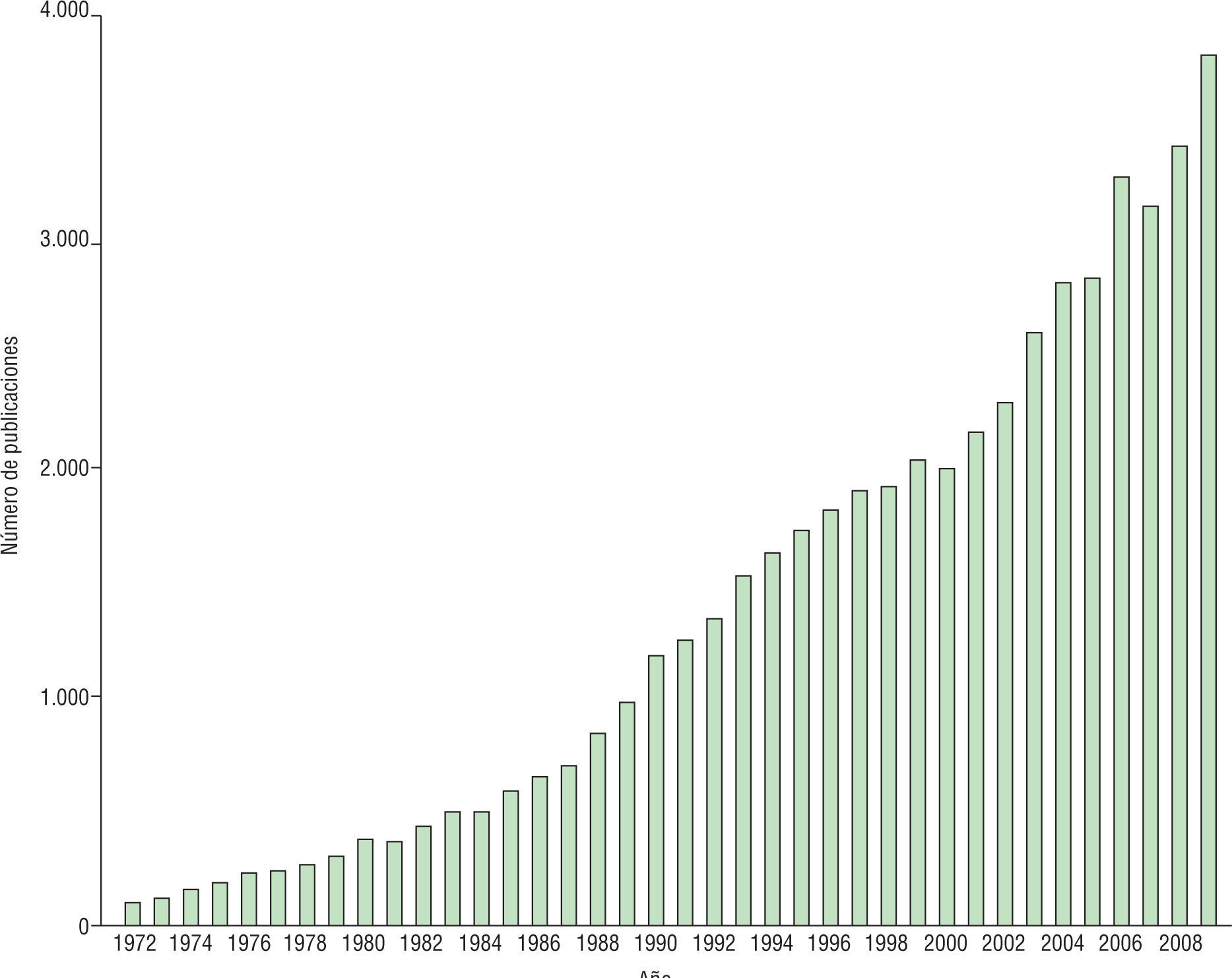
La potenciación sináptica de larga duración (LTP, long term potentiation) ha sido considerada largamente como un índice esencial de la plasticidad sináptica y la memoria. Desde su descubrimiento en 1973, el número de publicaciones sobre LTP ha aumentado exponencialmente (fig. 1). Sin embargo, el estudio de la plasticidad sináptica es un claro ejemplo de la dicotomía entre la investigación básica y la práctica clínica. Aunque la LTP goza de gran popularidad en el ambiente de la investigación básica, su utilidad clínica aún no ha sido aprovechada en todo su potencial.
Definida como un aumento de la transmisión sináptica después de que las vías neurales hayan sido sometidas a una estimulación de alta frecuencia, este cambio fisiológico se caracteriza por su larga duración y su especificidad1. La LTP comúnmente se estudia en un paradigma experimental basado en el hipocampo bien establecido, en el cual se mide el tamaño de los potenciales postsinápticos excitatorios (PPSE) (fig. 2). La LTP depende de la activación postsináptica del receptor glutamatérgico al N-metil-D-aspartato (NMDA), hallándose presente en varias áreas cerebrales, incluida la corteza2, como así también en varias especies de invertebrados y vertebrados3.
Ejemplo de inducción de potenciación de larga duración (LTP) en la vía perforante del hipocampo de rata luego de una estimulación de alta frecuencia del septum medial. Se observa un aumento en la amplitud del potencial postsináptico excitatorio (PPSE). B) Desarrollo temporal de la LTP en el hipocampo de rata. La estimulación de alta frecuencia (HFS) se aplicó en el tiempo 0 (flecha) y la amplitud del PPSE fue medida durante 270min (n=5). Se aprecia un aumento en la amplitud de la espiga poblacional luego de la HFS comparado con los registros basales (antes de 0 minutos).
En humanos existe un correlato de los PPSE registrados en preparaciones animales. Corresponde a la técnica de potenciales evocados que pueden obtenerse de forma no invasiva utilizando datos electroencefalográficos alineados con un estímulo específico ya sea auditivo, visual o somatosensorial. Después de producir una media de registros para eliminar posibles artefactos, es posible detectar cambios en la amplitud de los potenciales evocados. Los potenciales evocados se han vuelto una importante herramienta para la detección de cambios plásticos en humanos.
Utilizando esta técnica, Teyler et al4 reportaron cambios sinápticos de larga duración en la corteza visual humana tras una rápida estimulación luminosa. Un estudio similar5, utilizando resonancia magnética, demostró cambios en el flujo sanguíneo de la corteza estriada cuando se presentaron estímulos con patrones visuales en blanco/negro (tablero de ajedrez) luego de la estimulación a alta frecuencia. Así mismo, una forma de LTP se ha demostrado en la corteza auditiva como un aumento del componente N1 de los potenciales evocados6. Estas técnicas requieren la aplicación de un protocolo ABA en el cual cada sujeto es su propio control. El fenómeno descrito en humanos parece ser dependiente de receptores NMDA y se halla ausente en pacientes diagnosticados de enfermedad de Alzheimer (EA)7. Estas técnicas no invasivas de laboratorio podrían adaptarse al estudio de pacientes con deterioro cognitivo leve (DCL), con el fin de evaluar la plasticidad sináptica. Para una reciente revisión del estado de la LTP en humanos, véase Córdoba-Montoya et al8.
Se ha propuesto que la EA se presenta en sus estadios tempranos como una falla sináptica9. Estos cambios sinápticos serían la base de fallos cognitivos leves que se expresarían como incapacidad para codificar nueva información, progresando hacia el deterioro completo de la memoria declarativa. En un estudio, evaluando coherencia cortical, un índice cuantitativo de sincronización entre diferentes áreas de la corteza cerebral, comparada a lo largo de un año, ésta se mostró irregular en pacientes con EA, especialmente en la corteza frontal10. Paralelamente, el beta amiloide es capaz de inhibir el desarrollo de la LTP in vivo11,12. Estos hallazgos demuestran una asociación entre la EA y los mecanismos fisiológicos de plasticidad de la LTP.
Los nuevos criterios diagnósticos para la EA incluyen biomarcadores que se sirven de neuroimágenes, neuropsicología o análisis del líquido cefalorraquídeo para evaluar la presencia de beta amiloide o de la proteína tau13. Ningún criterio psicofisiológico ha sido aplicado hasta la fecha, a pesar de las conocidas alteraciones sinápticas presentes en la enfermedad14. Por otro lado, los nuevos criterios diagnósticos de EA excluyen un tercio de pacientes que no presentan deterioro de memoria15. Pero esto puede cambiar con el desarrollo y la aplicación de estas nuevas técnicas no invasivas.
El estudio de la plasticidad sináptica en pacientes atípicos podría facilitar un diagnóstico temprano. La utilización de la LTP como índice de la plasticidad sináptica ha sido perfeccionado durante más de treinta años de investigación, y las recientes experiencias citadas antes han demostrado que dicho paradigma puede ser trasladado a humanos, posibilitando, de esta manera, nuevos enfoques preventivos. Este tipo de procedimiento puede aplicarse como parte de un chequeo cognitivo con un mínimo de estrés y costo para el paciente. Así mismo, podría ser de utilidad para un diagnóstico más completo y el planeamiento de una más eficaz intervención clínica.
FinanciaciónEste trabajo ha sido financiado por el Instituto Nacional de Salud (NCMHD) y el Departamento de Salud y Servicios Humanos de Estados Unidos (P20 MD001089).
Conflicto de interesesEl autor declara que no tiene ningún conflicto de intereses.