La neurogranina es clave en la señalización sináptica, y conocer su interacción con la proteína beta-amiloide es crucial. Proteínas como SYT1, GAP43 y SNAP25 podrían mediar este efecto.
ObjetivoDeterminar si la neurogranina es modulada por la proteína beta-amiloide a través de su interacción con biomarcadores sinápticos en etapas preclínicas de la enfermedad de Alzheimer.
Materiales y métodosEstudio analítico de datos secundarios conformado por 339 adultos con y sin presencia de beta-amiloide en el líquido cefalorraquídeo (LCR) y/o en la tomografía por emisión de positrones. Se analizaron concentraciones de neurogranina, SYT1, GAP43 y SNAP25 en el LCR. Se empleó un modelo de mediación paralela (modelo 4 PROCESS de Hayes) para estimar efectos directos e indirectos de la beta-amiloide sobre la neurogranina, mediado por biomarcadores sinápticos. La significancia de los efectos indirectos se evaluó mediante bootstrapping, con 5.000 remuestreos, generando intervalos de confianza al 95%.
ResultadosLos modelos de regresión lineal múltiple mostraron asociaciones significativas entre beta-amiloide y SYT1, GAP43 y SNAP25. Los coeficientes fueron 34,104 (SYT1), 3,652,464 (GAP43) y 12,371 (SNAP25), sin embargo, no hubo efecto directo significativo entre beta-amiloide y neurogranina (p=0,6888). Los efectos indirectos mediante SYT1 y GAP43 mostraron influencias significativas en la neurogranina (efectos de 269,921 y 658,495, respectivamente). El efecto indirecto mediado por SNAP25 no fue significativo.
ConclusionesAunque la proteína beta-amiloide no se asoció directamente con la neurogranina, su influencia se ejerce de forma indirecta a través de mediadores sinápticos como SYT1 y GAP43. Estos hallazgos refuerzan la importancia de las vías sinápticas en etapas preclínicas de la enfermedad de Alzheimer.
Neurogranin is key in synaptic signaling. Understanding its interaction with beta-amyloid protein is crucial. Proteins such as SYT1, GAP43, and SNAP25 could mediate this effect.
ObjectiveTo determine whether neurogranin is modulated by beta-amyloid protein through its interaction with synaptic biomarkers in preclinical stages of Alzheimer's disease.
Materials and methodsThis is a secondary data analysis study consisting of 339 adults with and without the presence of beta-amyloid in cerebrospinal fluid (CSF) and/or positron emission tomography. CSF concentrations of neurogranin, SYT1, GAP43, and SNAP25 were analyzed. A parallel mediation model (Hayes PROCESS 4 model) was used to estimate the direct and indirect effects of amyloid-beta on neurogranin, mediated by synaptic biomarkers. The significance of indirect effects was assessed using bootstrapping with 5,000 resamples, generating 95% confidence intervals.
ResultsMultiple linear regression models showed significant associations between amyloid-beta and SYT1, GAP43, and SNAP25. The coefficients were 34.104 (SYT1), 3.652464 (GAP43), and 12.371 (SNAP25); however, there was no significant direct effect between amyloid-beta and neurogranin (p=0.688). The indirect effects through SYT1 and GAP43 showed significant influences on neurogranin (effects of 269,921 and 658,495, respectively). The indirect effect mediated by SNAP25 was not significant.
ConclusionsAlthough beta-amyloid protein was not directly associated with neurogranin, its influence is exerted indirectly through synaptic mediators such as SYT1 and GAP43. These findings reinforce the importance of synaptic pathways in preclinical stages of Alzheimer's disease.
La neurogranina, proteína presente en las espinas dendríticas de las neuronas postsinápticas, principalmente del hipocampo y la corteza cerebral, regula la señalización intracelular y la plasticidad sináptica, procesos esenciales para el aprendizaje, la memoria y la adaptación del cerebro a nuevas experiencias1. Su implicación en enfermedades neurodegenerativas, como el Alzheimer, ha sido objeto de creciente interés en los últimos años2. En este contexto, la proteína beta-amiloide es un biomarcador central en la enfermedad de Alzheimer, cuya acumulación en el cerebro está estrechamente asociada con el deterioro neuronal y sináptico3.
Synaptotagmin-1 (SYT1), neurofilamento de crecimiento-43 (GAP43) y la proteína sináptica asociada-25(SNAP25) son esenciales en la vesiculación sináptica y la plasticidad neuronal, contribuyendo a la liberación de neurotransmisores y a la remodelación sináptica4,5. Estos procesos son fundamentales en las enfermedades neurodegenerativas, por lo que es posible que la acumulación de beta-amiloide interfiera con la función normal de estas proteínas, contribuyendo a la disfunción neuronal. Sin embargo, la forma precisa en que la beta-amiloide modula la actividad de SYT1, GAP43 y SNAP25, y cómo estos cambios afectan a la neurogranina, sigue siendo un área poco explorada, más aún en etapas tempranas ya sintomáticas de enfermedades neurodegenerativas como la enfermedad de Alzheimer.
El estudio de la interacción entre la beta-amiloide y estas proteínas sinápticas resulta particularmente relevante en las fases preclínicas de la enfermedad de Alzheimer, donde los cambios moleculares subyacentes aún no han producido un daño clínico evidente6. Esta fase temprana de la enfermedad ofrece una oportunidad única para comprender los mecanismos patológicos antes de que se manifiesten de forma más severa. La comprensión de cómo la beta-amiloide afectaría a la neurogranina a través de la modulación de SYT1, GAP43 y SNAP25 podría abrir nuevas vías para el desarrollo de líneas de investigación que se orienten a terapias que restauren la función sináptica y frenen la progresión de la neurodegeneración, incluso antes de que los síntomas clínicos se desarrollen.
En ese sentido, el objetivo de este estudio fue determinar la modulación de la neurogranina por la proteína beta-amiloide a través de su interacción con estas proteínas sinápticas, con el fin de identificar mecanismos patológicos tempranos implicados en el deterioro sináptico, y explorar posibles enfoques terapéuticos para mitigar los efectos de la enfermedad de Alzheimer en etapas asintomáticas.
Materiales y métodoDiseño y poblaciónEstudio observacional, analítico y transversal, basado en datos secundarios extraídos del repositorio internacional de acceso abierto de datos de investigación (www.datadryad.org). Este repositorio promueve la reutilización de datos científicos y médicos para generar nuevos conocimientos. Los datos utilizados provienen de una investigación titulada CSF synaptic biomarkers in the preclinical stage of Alzheimer's disease and their association with MRI and PET markers of neurodegeneration (Biomarcadores sinápticos del LCR en la etapa preclínica de la enfermedad de Alzheimer y su asociación con marcadores de neurodegeneración por resonancia magnética y TEP)7. En este estudio el autor proporcionó una base de datos que incluye las concentraciones de neurogranina, SYP-1, SNAP-25, GAP-43 y la variable de «presencia de proteína beta-amiloide en LCR y/o TEP». No se pusieron a disposición todas las variables de la investigación original, pero sí las mencionadas anteriormente. La población estudiada consistió en 339 adultos sin problemas cognitivos, con y sin presencia de proteína beta-amiloide en el líquido cefalorraquídeo (LCR) y/o en la tomografía por emisión de positrones (TEP).
VariablesEn este estudio se analizaron diversas variables relacionadas con los biomarcadores en la etapa preclínica de la enfermedad de Alzheimer. La neurogranina fue medida en el LCR, expresada en pg/ml. El marcador SNAP25, asociado con la actividad neuronal, también fue expresado en pg/ml. El marcador SYT1, relacionado con las vesículas sinápticas, se midió igualmente en pg/ml. Por su parte, GAP43, vinculado a la plasticidad neuronal, fue registrado en pg/ml. Finalmente, la proteína beta-amiloide fue una variable categórica, representada por su presencia o ausencia en los pacientes. Estas variables son clave para comprender las relaciones entre los biomarcadores y su rol en la progresión de la enfermedad de Alzheimer en sus etapas preclínicas.
Análisis estadísticoEl objetivo principal del análisis estadístico fue evaluar la presencia de efectos indirectos de la proteína beta-amiloide (variable independiente) sobre los niveles de neurogranina (variable dependiente), a través de la mediación de 3 biomarcadores sinápticos: SYT1, GAP43 y SNAP25 (variables mediadoras). Para ello, se aplicó un enfoque de mediación estadística basado en modelos de regresión múltiple, específicamente el modelo 4 del macro PROCESS de Andrew F. Hayes, que permite estimar efectos de mediación en presencia de múltiples mediadores en paralelo8. La elección del modelo 4 se justifica por tratarse de un diseño de mediación simple con múltiples mediadores paralelos, en el cual se busca determinar si una parte del efecto de la exposición (proteína beta-amiloide) sobre la variable de resultado (neurogranina) se transmite a través de otras variables (SYT1, GAP43 y SNAP25), manteniendo una estructura causal clara y teóricamente sustentada. Este enfoque resulta particularmente útil en investigaciones de carácter neurobiológico, donde se busca explorar mecanismos fisiopatológicos potenciales.
La mediación fue evaluada a través de los siguientes pasos: 1) estimación del efecto total de la proteína beta-amiloide sobre la neurogranina (sin incluir mediadores); 2) estimación del efecto directo de la proteína beta-amiloide sobre la neurogranina, controlando por los mediadores; 3) estimación de los efectos indirectos, es decir, el efecto que la proteína beta-amiloide ejerce sobre la neurogranina a través de cada uno de los mediadores (SYT1, GAP43 y SNAP25). Para evaluar la significancia de los efectos indirectos se utilizó el método de bootstrap, con 5.000 remuestreos con reemplazo, generando intervalos de confianza al 95% (IC 95%) corregidos por sesgo. Este método permite una estimación robusta de los efectos indirectos sin asumir la normalidad en su distribución, lo cual es una ventaja importante en estudios con mediadores fisiológicos o biomarcadores que pueden presentar distribuciones sesgadas. Se consideró que existía un efecto indirecto significativo cuando el intervalo de confianza generado por bootstrap no incluía el valor cero. Asimismo, se reportaron los coeficientes de regresión no estandarizados, errores estándar, valores t, valores de p y los límites inferior y superior del intervalo de confianza para cada ruta del modelo.
Los análisis se realizaron utilizando el software IBM SPSS Statistics versión 27 con el complemento PROCESS v4.2, disponible públicamente y ampliamente utilizado en investigación en ciencias sociales, médicas y biológicas.
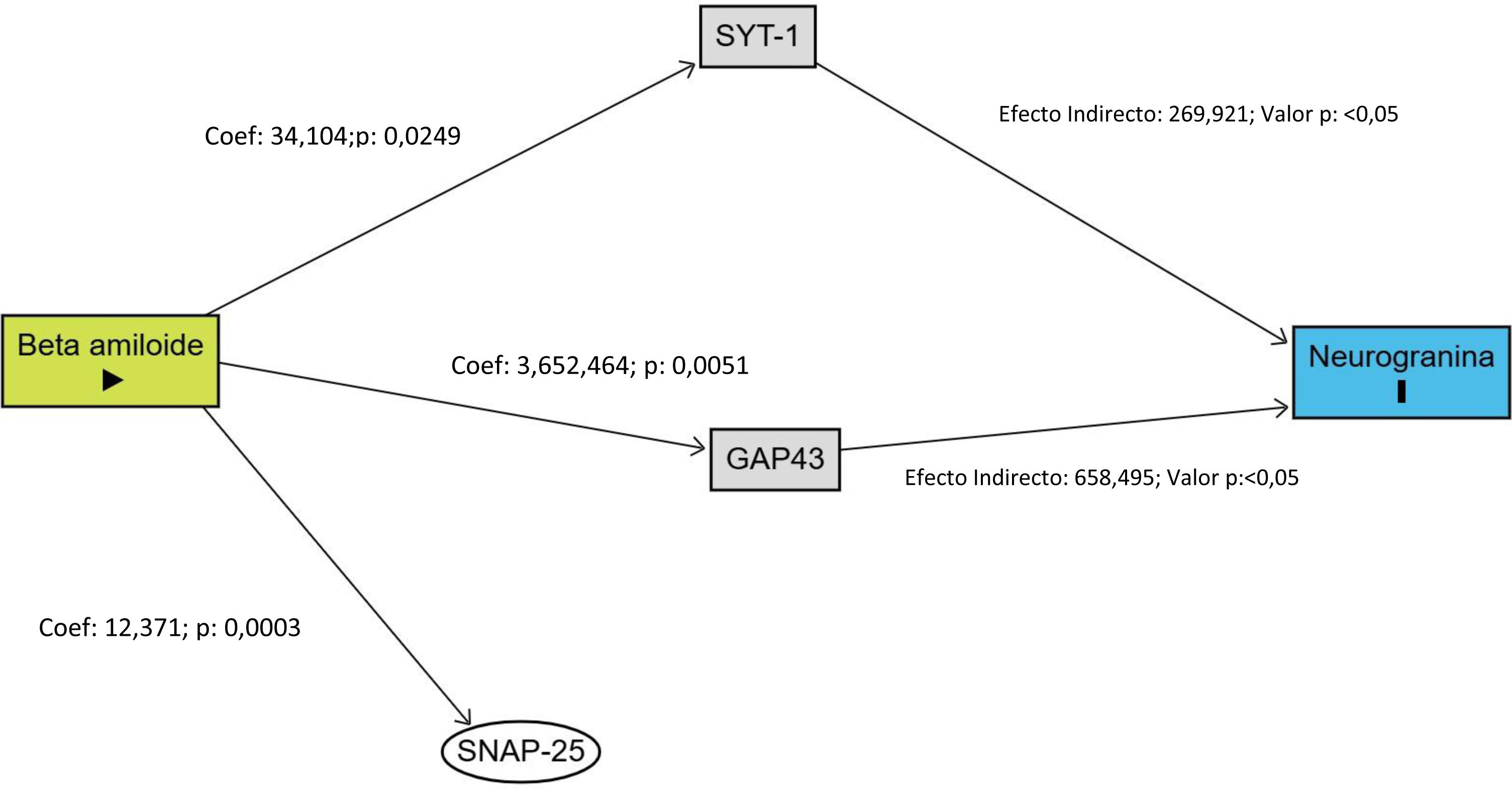
Finalmente, se elaboró un diagrama acíclico dirigido (DAG) para representar gráficamente las relaciones teóricas y empíricas entre la proteína beta-amiloide (exposición), los biomarcadores sinápticos (mediadores) y la neurogranina (resultado). Esta representación permitió visualizar las rutas causales propuestas y apoyar la interpretación de los resultados desde un enfoque conceptual, orientado a mecanismos biológicos plausibles en el contexto de la enfermedad de Alzheimer en la fase preclínica.
Todo el análisis estadístico fue realizado bajo un nivel de significancia estadística de p<0,05.
Consideraciones éticasEste estudio se basó en el análisis de datos secundarios disponibles públicamente, provenientes del repositorio Dryad. Los datos fueron anonimizados y recopilados previamente en el marco de investigaciones que contaron con la aprobación ética correspondiente, tal y como se detalla en la documentación original del repositorio. El presente análisis no involucró contacto directo con seres humanos ni la recolección de datos personales identificables, por lo que no fue necesario someterlo a revisión por un comité de ética institucional adicional.
Se respetó íntegramente los principios éticos contenidos en la Declaración de Helsinki de la Asociación Médica Mundial, asegurando la integridad científica, la confidencialidad de la información y la protección de los participantes originales del estudio primario.
La base de datos utilizada, junto con sus archivos complementarios, puede consultarse en el siguiente enlace: https://datadryad.org/dataset/doi:10.5061/dryad.vdncjsxv4.
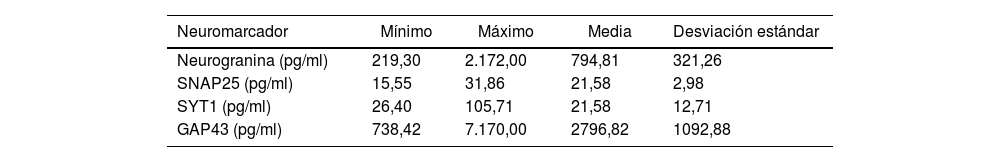
ResultadosLos estadísticos descriptivos y las frecuencias de los neuromarcadores en pacientes en etapas preclínicas de la enfermedad de Alzheimer se presentan a continuación. La neurogranina tuvo un rango de 219,30 a 2172, con una media de 794,81 y alta variabilidad. El marcador SNAP25 mostró un rango de 15,55 a 31,86, con una media de 21,58 y una dispersión considerable. SYT1 oscila entre 26,40 y 105,71, con una media de 51,76 y variabilidad moderada. En cuanto a GAP43, el rango fue de 738,42 a 7 170, con una media de 2796,82 y alta dispersión. Respecto a la presencia de proteína beta-amiloide, 224 pacientes (56,4%) presentaron este biomarcador, mientras que 115 (33,9%) no lo tuvieron, lo que representa el 100% de la muestra (tabla 1).
Estadísticos descriptivos y frecuencias de marcadores en pacientes en etapas preclínicas de la enfermedad de Alzheimer
| Neuromarcador | Mínimo | Máximo | Media | Desviación estándar |
|---|---|---|---|---|
| Neurogranina (pg/ml) | 219,30 | 2.172,00 | 794,81 | 321,26 |
| SNAP25 (pg/ml) | 15,55 | 31,86 | 21,58 | 2,98 |
| SYT1 (pg/ml) | 26,40 | 105,71 | 21,58 | 12,71 |
| GAP43 (pg/ml) | 738,42 | 7.170,00 | 2796,82 | 1092,88 |
| Presencia de proteína beta-amiloide | Frecuencia | Porcentaje |
|---|---|---|
| Sí | 224 | 66,10% |
| No | 115 | 33,90% |
| Total | 339 | 100% |
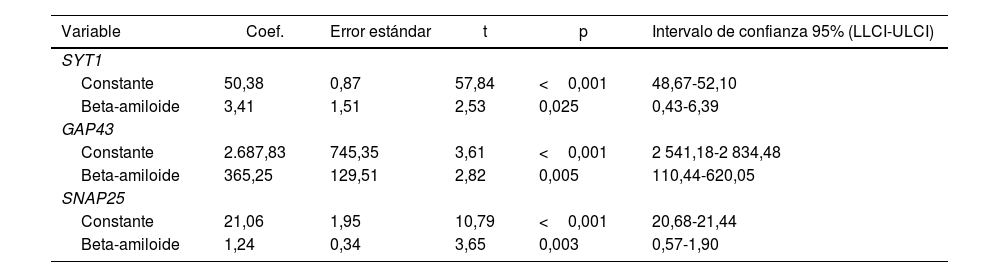
Los resultados indicaron que la proteína beta-amiloide muestra una relación estadísticamente significativa con los marcadores SYT1, GAP43 y SNAP25. En el modelo de SYT1, el coeficiente fue 3,41 (p=0,0249), lo que sugiere una relación positiva significativa. Para GAP43, el coeficiente fue 365,25 (p=0,0051), también indicando una relación positiva significativa. En el caso de SNAP25, el coeficiente fue 1,24 (p=0,003), lo que refuerza la significancia de la relación. En todos los casos, los intervalos de confianza no incluyeron el valor nulo, lo que respalda la fortaleza de las asociaciones. Estos resultados sugieren una relación directa y significativa entre la proteína beta-amiloide y los tres mediadores sinápticos (tabla 2).
Coeficientes del modelo para SYT1, GAP43 y SNAP25
| Variable | Coef. | Error estándar | t | p | Intervalo de confianza 95% (LLCI-ULCI) |
|---|---|---|---|---|---|
| SYT1 | |||||
| Constante | 50,38 | 0,87 | 57,84 | <0,001 | 48,67-52,10 |
| Beta-amiloide | 3,41 | 1,51 | 2,53 | 0,025 | 0,43-6,39 |
| GAP43 | |||||
| Constante | 2.687,83 | 745,35 | 3,61 | <0,001 | 2 541,18-2 834,48 |
| Beta-amiloide | 365,25 | 129,51 | 2,82 | 0,005 | 110,44-620,05 |
| SNAP25 | |||||
| Constante | 21,06 | 1,95 | 10,79 | <0,001 | 20,68-21,44 |
| Beta-amiloide | 1,24 | 0,34 | 3,65 | 0,003 | 0,57-1,90 |
Coef: coeficiente que representa la magnitud de la relación entre la variable independiente (en este caso la proteína beta amiloide) y la variable dependiente (SYT1, GAP43, o SNAP25); LLCI-ULCI: intervalo de confianza del 95% (lower limit confidence interval-upper limit confidence interval); p: valor de p, que indica la probabilidad de que el coeficiente sea igual a cero (sin efecto);t: valor de t, que se utiliza para probar la significancia estadística del coeficiente.
Los resultados mostraron que la proteína beta-amiloide no tuvo un efecto directo significativo sobre neurogranina, con un valor p de 0,6888 y un intervalo de confianza de –52,99 a 31,89, lo que sugirió que la relación directa no era confiable. Sin embargo, la proteína beta-amiloide ejerció un efecto indirecto significativo sobre neurogranina, con un valor total de 96,98 (p<0,001) y un intervalo de confianza de 28,20 a 168,72, lo que indicó que la relación indirecta era estadísticamente significativa. Los mediadores SYT1 y GAP43 mostraron efectos significativos, con valores de 26,99 (IC95%: 4,16 – 55,72) y 65,85 (IC95%: 19,96 – 115,99), respectivamente, lo que indicó que jugaron un papel importante en esta relación. En cambio, el efecto indirecto de SNAP25 fue de 4,14 (IC95%: –17,77 a 13,68), con un intervalo de confianza que incluyó valores negativos y positivos, lo que sugirió que SNAP25 no mediaba de manera significativa la relación entre la proteína beta-amiloide y neurogranina. En resumen, la influencia de la proteína beta-amiloide sobre neurogranina se dio de forma indirecta, mediada principalmente por SYT1 y GAP43 (tabla 3).
Efectos directos e indirectos de beta-amiloide sobre la neurogranina
| Tipo de efecto | Coeficiente | Error estándar | t | p | IC 95% (inferior-superior) |
|---|---|---|---|---|---|
| Efecto directo | 53,98 | 134,66 | 0,4008 | 0,6888 | –52,99-31,89 |
| Efectos indirectos | |||||
| Total | 96,98 | 35,05 | 28,20-168,72 | ||
| SYT1 | 26,99 | 12,92 | 4,16-55,72 | ||
| GAP43 | 65,85 | 23,89 | 19,96-115,99 | ||
| SNAP25 | 4,14 | 44,32 | –17,77-13,68 | ||
p: valor p, que indica la probabilidad de que el coeficiente sea igual a cero (sin efecto); t: valor de t, que se utiliza para probar la significancia estadística del coeficiente.
Se propuso un modelo de análisis basado en un DAG para explorar las relaciones entre la proteína beta-amiloide y la neurogranina, mediadas por SYT1, GAP43 y SNAP25. La beta-amiloide fue identificada como la exposición principal, mostrando efectos directos significativos sobre SYT1, GAP43 y SNAP25, con coeficientes positivos y asociaciones estadísticas significativas (p<0,05). SYT1 y GAP43 actuaron como mediadores clave en la relación entre la beta-amiloide y la neurogranina, sugiriendo que esta relación es indirecta, mediada principalmente por estas 2 proteínas. En cambio, aunque SNAP25 formó parte del camino causal, no mostró un efecto mediador significativo. Este modelo destaca la importancia de los mediadores SYT1 y GAP43 en la influencia de la proteína beta-amiloide sobre la neurogranina, mientras que SNAP25 no tiene un impacto relevante. La visualización de estas relaciones en el DAG facilita la comprensión de la dinámica causal entre las variables y subraya el rol de ciertos mediadores en los procesos biológicos asociados a la beta-amiloide (fig. 1).
DiscusiónLos resultados obtenidos en este estudio sugieren que la proteína beta-amiloide está significativamente asociada con varios mediadores sinápticos, específicamente SYT1, GAP43 y SNAP25, en individuos en etapas preclínicas de la enfermedad de Alzheimer. Los coeficientes positivos observados en los modelos de regresión reflejan una relación directa y significativa entre la proteína beta-amiloide y estos mediadores, sugiriendo que la acumulación de beta-amiloide podría estar afectando los procesos sinápticos en etapas tempranas de la enfermedad.
En particular, los coeficientes obtenidos para SYT1 (coeficiente de 34,104; p=0,0249) y GAP43 (coeficiente de 3.652,464; p=0,0051) son significativos, lo que indica que la proteína beta-amiloide influye en la función sináptica en estas fases preclínicas. Estos mediadores están involucrados en la regulación de la vesiculación sináptica y la plasticidad neuronal9, procesos fundamentales para el funcionamiento cognitivo. La proteína beta amiloide, al acumularse en el cerebro, forma placas que interfieren con la comunicación entre neuronas, afectando la liberación de neurotransmisores y alterando la capacidad de adaptación sináptica10. Estos resultados sugieren que la proteína beta-amiloide podría alterar estos mecanismos mucho antes de que se presenten los síntomas clínicos de la enfermedad de Alzheimer, lo que apunta a posibles biomarcadores para la detección temprana de la enfermedad.
En cuanto a los efectos indirectos de la proteína beta-amiloide sobre la neurogranina, los resultados mostraron que la influencia de la proteína beta-amiloide no es directa, sino mediada a través de SYT1 y GAP43. El efecto total indirecto de 969,796 (p<0,001), con un intervalo de confianza entre 28,2035 y 168,7159, es estadísticamente significativo, lo que indica que la proteína beta-amiloide ejerce una influencia indirecta sobre la neurogranina a través de estos mediadores sinápticos. Ello se puede atribuir a que la proteína beta-amiloide interfiere con la dinámica de las proteínas involucradas en la vesiculación y liberación de neurotransmisores11,12, como SYT1 y GAP43, modulando, y alterando, la plasticidad sináptica y la comunicación neuronal13. Esta disfunción sináptica, que involucra la interacción de la proteína beta-amiloide con SYT1 y GAP43 puede desencadenar un desequilibrio en la regulación de la neurogranina, una proteína clave en la señalización sináptica14, sugiriendo que los cambios en los mecanismos sinápticos podrían ser responsables de las alteraciones en los niveles de neurogranina en las fases preclínicas de la enfermedad de Alzheimer.
SYT1 y GAP43 desempeñan un papel clave en la plasticidad neuronal y la función sináptica, por lo que su mediación en esta relación es significativa. Los coeficientes para ambos mediadores (269,921 para SYT1 y 658,495 para GAP43) indican que tienen un impacto importante en la modulación de neurogranina bajo la influencia de la proteína beta-amiloide. Estos mediadores pueden estar involucrados en los primeros cambios funcionales que se producen en el cerebro antes de la manifestación clínica de la enfermedad. Específicamente, SYT1 y GAP43 son esenciales para el mantenimiento y la regeneración de las sinapsis y procesos neurotróficos15, procesos que podrían ser alterados por la proteína beta-amiloide y contribuir a la disfunción neuronal temprana observada en la enfermedad de Alzheimer.
Por otro lado, el efecto indirecto de SNAP25 no fue significativo. El intervalo de confianza para SNAP25 (–17,7743 a 13,6805) incluyó valores negativos y positivos, lo que sugiere que esta proteína no media de manera relevante la relación entre la proteína beta-amiloide y la neurogranina en las etapas preclínicas del Alzheimer. Esta ausencia de relación podría atribuirse a que si bien SNAP25 participa en la fusión vesicular y la liberación de neurotransmisores16, su papel podría no estar directamente vinculado con los mecanismos patológicos tempranos modulados por la beta-amiloide, o estar más implicado en fases más avanzadas de la disfunción sináptica. Además, su expresión podría estar menos alterada en las primeras etapas, en comparación con SYT1 y GAP43, que están más directamente asociadas con cambios plásticos tempranos en la sinapsis.
Los resultados obtenidos en este estudio sugieren que la proteína beta-amiloide tiene un efecto indirecto significativo sobre la neurogranina a través de mediadores sinápticos clave como SYT1 y GAP43 en las etapas preclínicas de la enfermedad de Alzheimer. Aunque la beta-amiloide no ejerce un efecto directo sobre la neurogranina, su influencia se ejerce a través de estos mediadores, lo que podría tener importantes implicaciones para la comprensión de los mecanismos patológicos subyacentes en la etapa preclínica de la enfermedad. La implicación de SYT1 y GAP43 en esta relación sugiere que estas proteínas desempeñan un rol fundamental en la disfunción sináptica inducida por la beta-amiloide, lo que podría alterar la comunicación neuronal antes de que los síntomas clínicos sean evidentes. Estos hallazgos abren nuevas perspectivas en cuanto a la identificación de biomarcadores para el diagnóstico temprano, y podrían ofrecer nuevas estrategias terapéuticas centradas en la modulación de estos mediadores sinápticos para prevenir o ralentizar la progresión de la enfermedad. Además, la monitorización de estos mediadores podría servir como una herramienta para seguir la progresión de la enfermedad y evaluar la efectividad de intervenciones terapéuticas en las fases preclínicas.
Una de las principales limitaciones de este estudio fue su diseño transversal, que impide establecer relaciones causales definitivas entre la proteína beta-amiloide, los mediadores sinápticos (SYT1, GAP43, SNAP25) y la neurogranina. La ausencia de un seguimiento longitudinal limita nuestra capacidad para evaluar cómo las interacciones entre estas variables evolucionan a lo largo del tiempo, especialmente en las etapas preclínicas de la enfermedad de Alzheimer. Otra limitación es la posible variabilidad en la medición de los biomarcadores, ya que los niveles de proteína beta-amiloide y neurogranina podrían estar sujetos a influencias de factores externos, como comorbilidades o tratamientos previos, que no fueron controlados en este estudio. Finalmente, aunque los mediadores sinápticos considerados en este análisis son relevantes, no se incluyen todos los posibles factores involucrados en la enfermedad de Alzheimer, por lo que los resultados deben interpretarse con cautela hasta que se realicen estudios más amplios y con diseño prospectivo.
En conclusión, estos resultados subrayan la importancia de los mediadores SYT1 y GAP43 en la relación indirecta entre la proteína beta-amiloide y la neurogranina. Aunque no se observó un efecto directo significativo de la proteína beta-amiloide sobre la neurogranina, la influencia de la proteína beta-amiloide sobre la función sináptica, mediada por estos factores, parece ser un mecanismo relevante en las etapas preclínicas de la enfermedad de Alzheimer. Estos hallazgos podrían ser fundamentales para el desarrollo de estrategias de intervención temprana y biomarcadores que permitan identificar a individuos en riesgo antes de la aparición clínica de la enfermedad, así como para el desarrollo de una mayor comprensión de las vías que conducen a la disfunción sináptica atribuible a la acumulación de proteína beta-amiloide.
AutoríaAlberto Guevara Tirado es responsable del contenido de esta investigación.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesSin conflicto de intereses.