La proteína asociada al crecimiento-43 (GAP-43) es un biomarcador crucial en el desarrollo y la plasticidad neuronal. Su expresión está estrechamente relacionada con la regeneración axonal y la formación de sinapsis, convirtiéndola en un indicador importante en estudios de neurociencia y enfermedades neurodegenerativas.
ObjetivoDeterminar los biomarcadores sinápticos asociados a GAP-43 en presencia o ausencia de proteína beta amiloide.
Materiales y métodoEstudio analítico de una base de datos secundaria de 398 pacientes con y sin presencia de proteína beta amiloide en líquido cefalorraquídeo. Las variables fueron: proteína asociada al crecimiento-43 (GAP-43), neurogranina, sinaptotagmina-1 (SYT-1) y proteína asociada a sinaptosomas-25 (SNAP-25). Se utilizó el modelo de regresión lineal múltiple y gráfico de dispersión con coeficiente de determinación R2.
ResultadosEn ausencia de beta amiloide, GAP-43 aumentó significativamente con los niveles de neurogranina y SYT-1 (F=597,533) y R2=0,896, explicando el 90% de la variabilidad en GAP-43. En presencia de beta amiloide, solo neurogranina mostró una relación significativa con GAP-43 (F=182,337), con R2=0,844, explicando el 84% de la variabilidad en GAP-43. En ausencia de proteína beta amiloide, GAP-43 aumentó 2,139pg/ml por cada pg/ml de neurogranina, y aumentó 32,776pg/ml por cada pM de SYT-1. En presencia de beta amiloide, GAP-43 aumentó 2,478pg/ml por cada pg/ml de neurogranina.
ConclusionesLos biomarcadores sinápticos neurogranina y SYT-1 tuvieron una relación significativa con GAP-43 en ausencia de proteína beta amiloide en LCR, mientras que, en presencia de beta amiloide, solo la neurogranina mantuvo una relación significativa con GAP-43.
Growth-associated protein-43 (GAP-43) is a crucial biomarker in neuronal development and plasticity. Its expression is closely related to axonal regeneration and synapse formation, making it an important indicator in neuroscience and neurodegenerative disease studies.
ObjectiveTo determine the synaptic biomarkers associated with GAP-43 in the presence or absence of beta amyloid protein.
Materials and methodAnalytical study of a secondary database of 398 patients with and without the presence of beta amyloid protein in cerebrospinal fluid. The variables were growth-associated protein-43 (GAP-43), neurogranin, synaptotagmin-1 (SYT-1) and synaptosomal-associated protein-25 (SNAP-25). The multiple linear regression model and scatter plot with coefficient of determination R2 were used.
ResultsIn the absence of amyloid beta, GAP-43 increased significantly with neurogranin and SYT-1 levels (F=597.533) and R2=0.896, explaining 90% of the variability in GAP-43. In the presence of amyloid beta, only neurogranin showed a significant relationship with GAP-43 (F=182.337), with R2=0.844, explaining 84% of the variability in GAP-43. In the absence of amyloid beta protein, GAP-43 increased 2,139pg/mL for each pg/mL of neurogranin, and increased 32,776pg/mL for each pM of SYT-1. In the presence of beta amyloid, GAP-43 increased 2,478pg/mL for each pg/mL of neurogranin.
ConclusionsThe synaptic biomarkers neurogranin and SYT-1 had a significant relationship with GAP-43 in the absence of CSF beta amyloid protein, whereas in the presence of beta amyloid, only neurogranin maintained a significant relationship with GAP-43.
La disfunción cognitiva abarca una variedad de trastornos que afectan la memoria, el pensamiento, el lenguaje y la capacidad de realizar tareas cotidianas1. Es un problema de salud global significativo, en especial la demencia, de la que se estima que más de 50 millones de personas en todo el mundo la padecieron en 20202, siendo esta una de las formas más comunes de disfunción cognitiva, y estimándose que esta cifra se triplique para 2050 debido al envejecimiento de la población3. La disfunción cognitiva, además de afectar a los pacientes, impone una carga considerable sobre las familias, los sistemas de salud y las economías4, por lo que comprender las causas y desarrollar estrategias efectivas para la prevención y el tratamiento de la disfunción cognitiva es crucial para abordar este desafío creciente.
GAP-43, también conocida como la proteína asociada al crecimiento-43, es una proteína crucial en el sistema nervioso, especialmente durante el desarrollo neuronal y la plasticidad sináptica. Esta proteína juega un papel fundamental en la regeneración axonal y la formación de nuevas conexiones sinápticas5, lo que la convierte en un biomarcador importante en estudios de neurociencia e investigación de enfermedades neurodegenerativas como el Alzheimer y el Parkinson. La expresión de GAP-43 es un indicador clave de la capacidad neuronal para adaptarse y reorganizarse en respuesta a lesiones o cambios en el entorno6.
Se han estudiado diversos biomarcadores de disfunción sináptica, entre ellos, la neurogranina, la cual es una proteína post-sináptica cerebral que desempeña un papel crucial en los mecanismos de la memoria y el aprendizaje. Se encuentra principalmente en las neuronas, sobre todo en las espinas dendríticas7. SYT-1, también conocido como sinaptotagmina-1, es una proteína integral de las vesículas sinápticas que actúa como sensor de calcio en el proceso de tráfico vesicular y exocitosis, siendo crucial para la liberación de neurotransmisores en la sinapsis en respuesta a la unión del calcio. También regula la fusión de vesículas sinápticas con la membrana presináptica, facilitando la transmisión de señales entre neuronas8. SNAP-25 es una proteína que forma parte del complejo de proteínas Soluble NSF Attachment Protein Receptor (SNARE). Es crucial para la fusión de vesículas sinápticas con la membrana plasmática, paso necesario para la liberación de neurotransmisores en las sinapsis del cerebro9.
Dada la proximidad de estos biomarcadores a nivel de la estructura neuronal pre y post-sináptica con GAP-43, es posible que su relación se vea alterada en presencia de lesiones crónicas asociadas a la disfunción cognitiva, como la presencia de proteína beta amiloide, lo cual puede ser relevante desde los puntos de vista clínico y de investigación de enfermedades neurodegenerativas. Por ello, el objetivo de esta investigación fue determinar los biomarcadores sinápticos asociados a GAP-43 en presencia o ausencia de proteína beta amiloide. Este estudio tuvo como propósito investigar si los biomarcadores sinápticos como neurogranina, SYT-1 y SNAP-25 influyen en la regulación de la proteína43 asociada al crecimiento en pacientes con y sin presencia de beta amiloide, con la posibilidad de ofrecer nuevas perspectivas para el diagnóstico, el seguimiento y el tratamiento de enfermedades neurodegenerativas.
Materiales y métodoDiseño y población de estudioEstudio analítico y transversal, basado en datos secundarios realizados entre los años 2016 a 2019 del repositorio internacional de acceso abierto de datos de investigación (www.datadryad.org). Este repositorio, que se basa en artículos de publicaciones científicas y médicas, promueve la reutilización de datos de investigación para generar nuevos conocimientos. Los datos utilizados fueron recopilados por Suárez-Calvet, uno de los autores del artículo titulado CSF synaptic biomarkers in the preclinical stage of Alzheimer's disease and their association with MRI and PET markers of neurodegeneration (Biomarcadores sinápticos del LCR en la etapa preclínica de la enfermedad de Alzheimer y su asociación con marcadores de neurodegeneración por resonancia magnética y TEP)10. No todas las variables del estudio original estaban disponibles en forma de acceso abierto, ya que se incluyeron los valores de neurogranina, SYP-1, SNAP-25, GAP-43 y la variable «presencia de proteína beta amiloide en LCR y/o TEP». La población del estudio consistió en 396 adultos sin problemas cognitivos, con y sin presencia de proteína beta amiloide en líquido cefalorraquídeo (LCR) y/o tomografía por emisión de positrones (TEP), en quienes se determinaron las concentraciones de neurogranina.
Variables y medicionesEl estudio fue realizado según la presencia de proteína beta amiloide (Aβ) en LCR y/o en TEP. La base de datos clasificó la presencia de Aβ en tres grupos: 1)Aβ-negativo (LCR Aβ42/40 negativo y Aβ PET <30centiloides); 2)baja carga de Aβ (relación en LCR Aβ42/40 positivo, pero PET Aβ <30centiloides), y 3)positivo (LCR positivo Aβ42/40 y Aβ PET ≥30centiloides). Estos datos fueron divididos en dos cohortes según la ausencia (negativo para beta amiloide) y presencia (grupo con carga baja o elevada de beta amiloide).
La variable dependiente fue la proteína asociada al crecimiento-43 (GAP-43, en picogramos/mililitro), mientras que las variables independientes incluyeron la neurogranina (picogramos/mililitro), la sinaptotagmina-1 (SYT-1, en picomoles) y la proteína asociada a sinaptosoma-25 (SNAP-25, en picomoles). Estos biomarcadores se encuentran en diferentes partes del sistema nervioso central, como el citoplasma, las vesículas sinápticas y las espinas dendríticas, y sus concentraciones se midieron en muestras de líquido cefalorraquídeo.
Análisis estadísticoSe utilizó la regresión lineal múltiple para evaluar el efecto de varios biomarcadores sinápticos (neurogranina, SYT-1 y SNAP-25) sobre las concentraciones de GAP-43 en el LCR, tanto en presencia como en ausencia de proteína beta amiloide. Este método permite determinar cómo cada biomarcador independiente influye en GAP-43 mientras se controlan los efectos de los otros biomarcadores en el modelo.
Asimismo, se utilizó el coeficiente de determinación R2 para medir la proporción de la variabilidad en GAP-43 que pudo ser explicada por el modelo de regresión lineal múltiple. Un valor de R2 cercano a 1 indicará si el modelo explica la variabilidad en GAP-43, lo que sugiere la relevancia de los biomarcadores y un posible impacto significativo en las concentraciones de GAP-43.
Consideraciones éticasLa información original provino de la base de datos de libre acceso Dryad, que publica datos bajo la licencia de dominio público Creative Commons (CC0) y no admite la publicación de datos confidenciales11.
La información complementaria, incluida la base de datos, se encuentra disponible en el siguiente enlace: <https://datadryad.org/stash/dataset/doi:10.5061/dryad.vdncjsxv4#methods>.
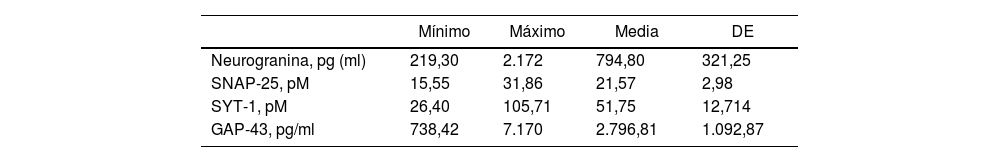
ResultadosSe observó que los niveles de los biomarcadores sinápticos en el LCR varían considerablemente entre los pacientes. La neurogranina tiene una media de 794,81pg/ml y una desviación estándar de 321,26, indicando una dispersión moderada. SNAP-25 presentó una media de 21,58pM y una desviación estándar de 2,98, sugiriendo una baja variabilidad. SYT-1 tuvo una media de 51,76pM y una desviación estándar de 12.71, reflejando una dispersión moderada a alta. GAP-43 tuvo una media de 2.796,82pg/ml y una desviación estándar de 1.092,88, indicando una alta dispersión. Estos datos destacan la variabilidad individual en la expresión de estos biomarcadores en relación con la presencia de proteína beta amiloide en el LCR (tabla 1).
Características de pacientes con y sin presencia de proteína beta amiloide en LCR
| Mínimo | Máximo | Media | DE | |
|---|---|---|---|---|
| Neurogranina, pg (ml) | 219,30 | 2.172 | 794,80 | 321,25 |
| SNAP-25, pM | 15,55 | 31,86 | 21,57 | 2,98 |
| SYT-1, pM | 26,40 | 105,71 | 51,75 | 12,714 |
| GAP-43, pg/ml | 738,42 | 7.170 | 2.796,81 | 1.092,87 |
DE: desviación estándar; GAP-43: proteína asociada al crecimiento-43; pg/ml: picogramos por mililitro; pM: picomoles; SNAP-25: proteína asociada a sinaptosomas-25; SYT-1: sinaptotagmina-1.
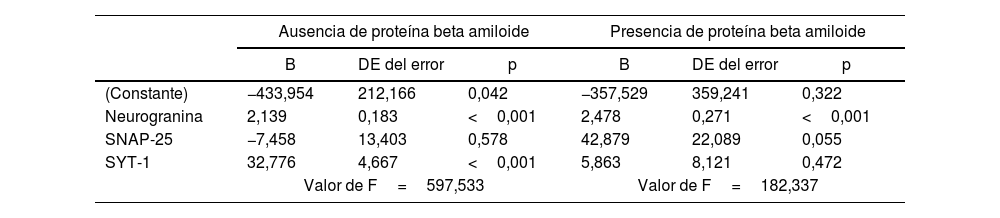
Se calculó la regresión lineal múltiple con modelo intro para la determinación del tamaño del efecto de los biomarcadores sinápticos neurogranina, SYT-1 y SNAP-25 sobre las concentraciones de GAP-43 en presencia y ausencia de proteína beta amiloide. En ausencia de proteína beta amiloide, la ecuación tuvo un valor de F=597,533, donde GAP-43 aumenta 2,139 por cada unidad de neurogranina, y aumenta 32,776 por cada unidad de SYT-1. En presencia de beta amiloide, el valor de F fue 182,337, donde GAP-43 aumentó 2,478 por cada unidad de neurogranina (tabla 2).
Modelo de regresión lineal múltiple entre biomarcadores sinápticos y GAP-43 en presencia y ausencia de proteína beta amiloide en LCR
| Ausencia de proteína beta amiloide | Presencia de proteína beta amiloide | |||||
|---|---|---|---|---|---|---|
| B | DE del error | p | B | DE del error | p | |
| (Constante) | −433,954 | 212,166 | 0,042 | −357,529 | 359,241 | 0,322 |
| Neurogranina | 2,139 | 0,183 | <0,001 | 2,478 | 0,271 | <0,001 |
| SNAP-25 | −7,458 | 13,403 | 0,578 | 42,879 | 22,089 | 0,055 |
| SYT-1 | 32,776 | 4,667 | <0,001 | 5,863 | 8,121 | 0,472 |
| Valor de F=597,533 | Valor de F=182,337 | |||||
DE: desviación estándar; SNAP-25: proteína asociada a sinaptosomas-25; SYT-1: sinaptotagmina-1.
En ausencia de proteína beta amiloide en LCR, el valor de R2 fue de 0,896, lo que indica que el 90% del cambio en GAP-43 puede ser explicado por el modelo basado en neurogranina y SYT-1. En presencia de proteína beta amiloide en LCR, el valor de R2 fue 0,844, lo que indica que el 84% del cambio en GAP-43 pudo ser explicado por el modelo basado en neurogranina (fig. 1)
DiscusiónLos resultados del modelo de regresión lineal múltiple proporcionan una visión detallada sobre la posible influencia de los biomarcadores sinápticos neurogranina, SYT-1 y SNAP-25 en las concentraciones de GAP-43 en el LCR, tanto en presencia como en ausencia de proteína beta amiloide.
En ausencia de proteína beta amiloide, el modelo muestra que GAP-43 aumenta significativamente con los niveles de neurogranina y SYT-1, con coeficientes de 2,139 y 32,776, respectivamente, y ambos efectos son altamente significativos (p<0,001). El valor de R2 de 0,896 indica que el 90% de la variabilidad en GAP-43 puede ser explicada por este modelo, lo que sugiere una fuerte relación entre estos biomarcadores sinápticos y GAP-43 en este contexto. En presencia de proteína beta amiloide, el modelo revela que GAP-43 sigue aumentando significativamente con los niveles de neurogranina, con un coeficiente de 2,478 (p<0,001). Sin embargo, los efectos de SYT-1 y SNAP-25 no son significativos en este contexto, lo que podría indicar que la presencia de beta amiloide altera la relación entre estos biomarcadores y GAP-43. El valor de R2 de 0,844 sugiere que el 84% de la variabilidad en GAP-43 puede ser explicada por el modelo en presencia de beta amiloide, lo que sigue siendo un alto nivel de explicación, aunque ligeramente menor que en su ausencia.
La relación entre neurogranina y GAP-43 se mantuvo en los grupos con y sin presencia de proteína beta amiloide. Ambos biomarcadores comparten la vía de señalización de la proteína quinasaC, habiéndose observado experimentalmente que la elevación intracelular de AMP cíclico provoca una regulación negativa de las concentraciones de estos biomarcadores12. Los hallazgos de esta investigación sugieren la relación entre ambas proteínas mediante la interacción en sus funciones, involucradas en la plasticidad sináptica (neurogranina) y la capacidad del cerebro para adaptarse a nuevas condiciones (GAP-43). En ese sentido, es posible que la disminución de neurogranina pueda indicar una pérdida de función sináptica, mientras que los cambios en GAP-43 pueden reflejar intentos del cerebro por compensar la pérdida neuronal y sináptica.
Respecto a la relación entre SYT-1 y GAP-43, un estudio in vitro ha encontrado que la expresión de GAP-43 se incrementa conforme se desarrolla una mayor plasticidad sináptica, principalmente en terminales axónicas inmaduras y en crecimiento, observándose que los cambios en GAP-43 se correlacionan con los cambios en SYT-1 tras la realización de estudios de inmunofluorescencia13.
Se observó que no hubo asociación entre SNAP-25 y GAP-43 tanto en presencia como en ausencia de proteína beta amiloide. Esto podría atribuirse a que ambos biomarcadores tienen roles distintos en la sinapsis: SNAP-25 es una proteína de la vesícula sináptica involucrada en la liberación de neurotransmisores14, mientras que GAP-43 está más relacionada con la plasticidad sináptica y la regeneración axonal. Estas diferencias funcionales pueden hacer que sus niveles no estén directamente relacionados en el contexto de este estudio.
Estos hallazgos destacan la importancia de la neurogranina como un biomarcador robusto para GAP-43, independientemente de la presencia de beta amiloide. La variabilidad en la significancia de SYT-1 y SNAP-25 sugiere que la beta amiloide podría estar modulando sus efectos sobre GAP-43, lo que podría tener implicaciones importantes para la comprensión de los mecanismos subyacentes en enfermedades neurodegenerativas como la enfermedad de Alzheimer. La alta capacidad explicativa de los modelos (valores de R2 elevados) refuerza la relevancia de estos biomarcadores en el estudio de la función sináptica y la salud neuronal.
Este estudio tuvo limitaciones. El diseño transversal del estudio limita la capacidad de establecer causalidad de forma robusta entre los biomarcadores analizados y GAP-43, por lo que se requieren estudios longitudinales para investigar relaciones causales y cambios durante el tiempo. El tamaño de la población de la base de datos (n=396) requiere de un mayor número de pacientes para una mejor generalización de los datos. La existencia de la variabilidad biológica de los pacientes, en relación a comorbilidades, uso de medicamentos, accidentes, entre otros, podría afectar la expresión de estos biomarcadores, lo cual también guarda relación con la presencia de posibles factores confusores no incluidos en la base de datos, como el sexo biológico, hábitos nutricionales y de estilo de vida, así como otros posibles biomarcadores. Asimismo, debido a que los contextos clínicos pueden variar en diferentes poblaciones, es necesario replicar el modelo en diferentes cohortes para determinar la similitud o las diferencias en las relaciones entre estos biomarcadores según presencia de beta amiloide en LCR.
En conclusión, los biomarcadores sinápticos neurogranina y SYT-1 tuvieron una relación significativa con GAP-43 en ausencia de proteína beta amiloide en el LCR, mientras que en presencia de beta amiloide, solo la neurogranina mantuvo una relación significativa con GAP-43. Estos resultados subrayan la relevancia y la interrelación de estos biomarcadores en la función sináptica. La diferencia en la significancia de SYT-1 en presencia de beta amiloide sugiere que esta proteína puede modular las interacciones sinápticas de manera compleja. Estos hallazgos tienen importantes implicaciones para la comprensión de los mecanismos subyacentes en enfermedades neurodegenerativas y destacan la potencial utilidad de estos biomarcadores en el diagnóstico y el seguimiento de estas condiciones. Sin embargo, es necesario replicar el modelo en diferentes cohortes con mayor número de participantes, para interpretar los resultados con cautela y guiar futuras investigaciones.
FinanciamientoFinanciado por el autor.
Contribución de autorAGT es responsable por el contenido de esta investigación.
Conflicto de interesesSin conflicto de intereses.