En una población cautiva, analizamos el riesgo de recurrencia y de hemorragia en pacientes con FANV luego de un primer evento cerebrovascular isquémico (ECVi).
Material y métodosSe revisaron las historias clínicas de pacientes con ECVi y FANV paroxística o permanente, asistidos entre diciembre del 2008 y mayo del 2013. Se evaluaron las indicaciones de anticoagulación (AC) o antiagregación (AG), y se aplicaron las escalas CHADS2, CHA2DS2-VASc, HEMORR2AGES y HAS-BLED para estimar los riesgos de recurrencia y hemorragia.
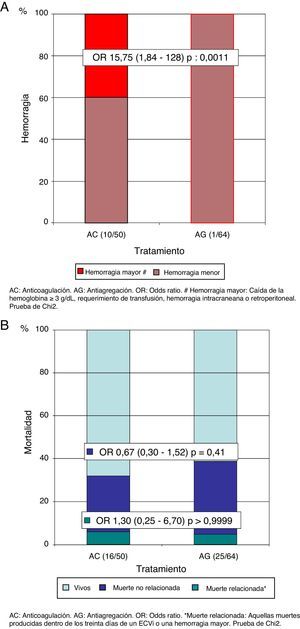
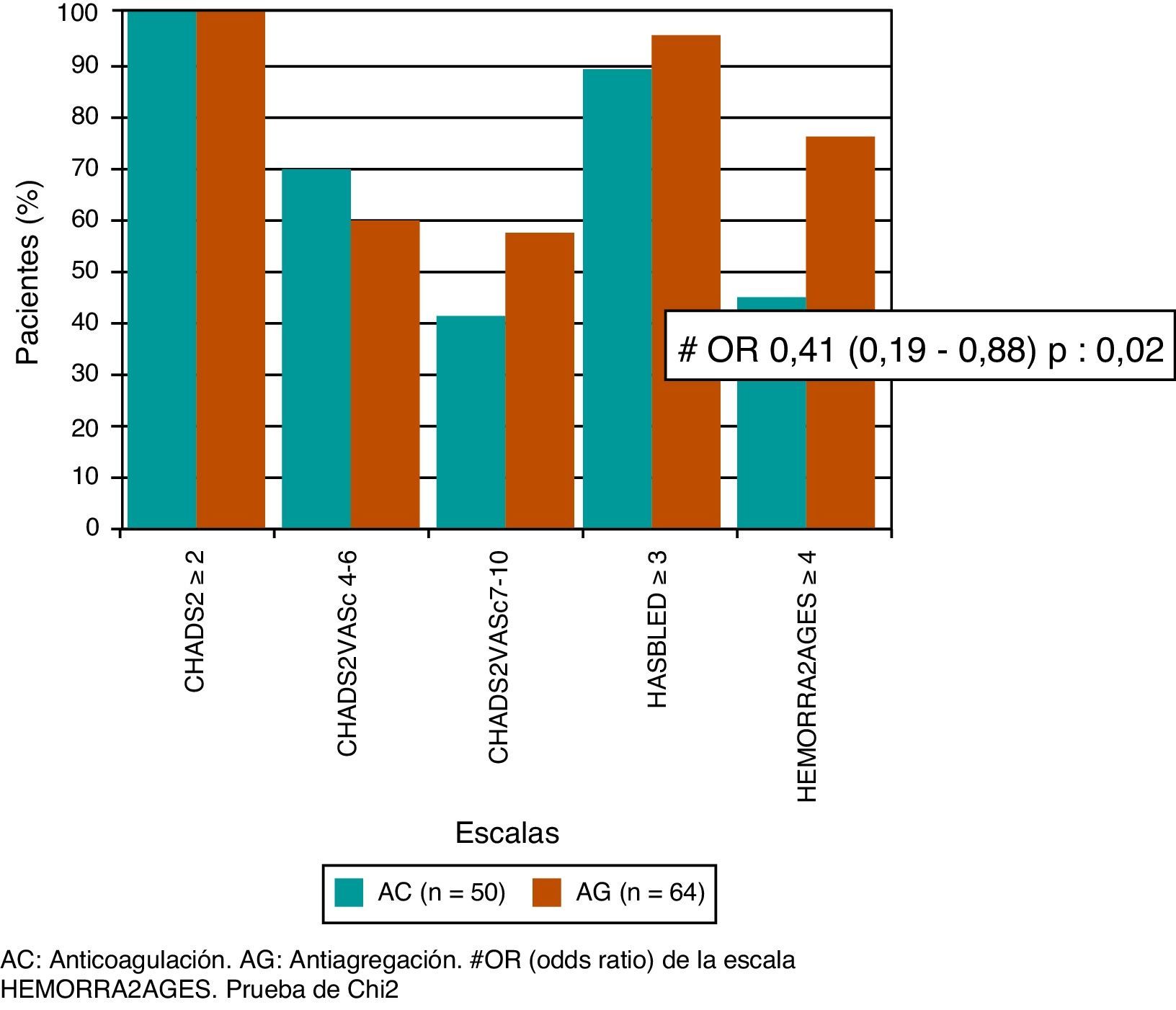
ResultadosSe incluyó a 114 pacientes, con una mediana de edad 84 años, 71% sexo femenino y mediana de tiempo de seguimiento 17 meses. Luego del primer ECVi, 50 pacientes recibieron AC y 64 AG. Observamos mayor tendencia a indicar AC en accidente isquémico transitorio (p=0,0003), eventos de menor severidad y menor discapacidad, según las escalas de NIHSS (p=0,0134) y Rankin modificada (p=0,02). Todos los pacientes tenían indicación de AC según el CHADS2 y CHA2DS2-VASc, mientras que el 88% del grupo AC y el 94% del grupo AG tenían riesgo de sangrado elevado según la escala HAS-BLED (p=0,33), y el 44 y el 66%, respectivamente, según HEMORR2AGES (OR=0,41; IC del 95%, 0,19-0,88; p=0,02). La recurrencia de ECVi fue 16% (n=8) en AC y 33% (n=21) en AG (OR=0,39; IC del 95%, 0,15-0,97; p=0,05). La tasa de hemorragia global fue del 20% (8% hemorragias mayores) en AC y el 1,5% en AG (OR=15,75; IC del 95%, 1,84-128; p=0,0011). No observamos diferencias en la mortalidad.
ConclusionesLa AC tiene mayor efectividad que la AG para la prevención secundaria de un ECVi y su beneficio supera los riesgos de hemorragia.
In a captive population, we analyzed the risk of recurrence and bleeding in patients with NVAF after a first ischemic stroke.
Material and methodsMedical records of patients assisted between December 2008 and May 2013 with an stroke and paroxysmal or permanent NVAF were reviewed. Indications for anticoagulation (AC) or antiaggregation (AG) were evaluated and the CHADS2, CHA2DS2- VASc, HAS-BLED and HEMORR2AGES scales were applied to estimate the risk of recurrence and bleeding.
Results114 patients, median age 84 years, 71% female, and median follow-up time of 17 months were included. After the first stroke, 50 patients received AC and 64 AG. We observed a high tendency to indicate AC in TIA (p=0.0003), less severe events and less disability, based on NIHSS (P=0.0134) and modified Rankin scale (P=0.02). All patients had an indication for AC according to CHADS2 and CHA2DS2- VASc, while 88% of the AC group and 94% AG group had high risk of bleeding according to the HAS- BLED scale (P=0.33); and 44% and 66% respectively, according with the HEMORR2AGES scale (OR=0.41, 95%CI 0.19-0.88, P=0.02). Stroke recurrence was 16% (n=8) in AC and 33% (n=21) in AG (OR=0.39, 95%CI 0.15-0.97, P=0.05). The overall bleeding rate was 20% (8% major bleeding) in AC and 1.5% AG (OR=15.75, 95%CI 1.84-128, P=0.0011). We observed no difference in mortality.
ConclusionsAC is more effective than the AG for the secondary prevention of stroke and benefit outweighs the risk of bleeding.
La fibrilación auricular no valvular (FANV) es una arritmia frecuente que aumenta de 4 a 5 veces el riesgo de presentar un evento cerebrovascular isquémico (ECVi)1. Su prevalencia aumenta desde menos de un 1% en menores de 60 años hasta un 10% aproximadamente en mayores de 80 años2. En estudios de pacientes con ECVi, se observó que aquellos asociados a FA presentaban internaciones más prolongadas, mayor discapacidad y una tasa de recurrencia y mortalidad mayor que los pacientes sin FA3. En estudios metaanalíticos, se observó que los pacientes que recibían tratamiento con anticoagulantes orales antagonistas de la vitamina K y con antiagregantes plaquetarios presentaban una reducción del riesgo relativo de un ECVi del 64 y el 22%, respectivamente, en comparación con los controles. Por otra parte, el tratamiento anticoagulante se asoció a una reducción del riesgo relativo del 39% en relación con el tratamiento antiagregante. La reducción del riesgo relativo observada en estos estudios fue similar al analizar por separado los estudios de prevención primaria y secundaria (el 59 y el 68%, respectivamente) e incluso se observó una mayor reducción del riesgo absoluto en la prevención secundaria (un 8,4% anual contra un 2,7% anual)4,5.
Sin embargo, a pesar de toda la evidencia publicada a favor del tratamiento anticoagulante, en la práctica diaria la elección terapéutica frecuentemente es difícil debido al riesgo de hemorragias asociada al tratamiento. Esto puede verse reflejado en numerosos estudios, en los cuales se observó una tasa baja de anticoagulación en pacientes con FA6,7. En la elección terapéutica, se realiza un balance entre los beneficios de la reducción del riesgo de tromboembolismo con los potenciales riesgos del tratamiento. Para este tipo de análisis, se desarrollaron diferentes modelos de estratificación de riesgo basados en estudios de tratamiento antitrombótico8. Algunas de las guías de práctica clínica de mayor relevancia9-12 recomiendan la toma de decisión terapéutica en pacientes con FA sobre la base del riesgo de tromboembolia valorado con las escalas CHADS213 y CHA2DS2-VASc14. Por otro lado, se publicaron diferentes escalas que resultan útiles para la evaluación del riesgo de hemorragia, entre las cuales se encuentran las conocidas bajo los acrónimos de HEMORR2AGES15 y HAS-BLED16.
En una población cautiva de pacientes atendidos en el Hospital Privado de Comunidad (HPC) de Mar del Plata, analizamos el riesgo de recurrencia y el riesgo de hemorragia en los pacientes con FA no valvular (FANV) luego de un primer ECVi.
Objetivo primario del estudio- 1.
Comparación de la efectividad y seguridad de la anticoagulación oral (AC) y antiagregación (AG) para la prevención secundaria de un ECVi.
- 1.
Ponderación del riesgo de recurrencia y de hemorragia en pacientes con FANV y un primer ECVi.
- 2.
Evaluación de la aplicabilidad de las escalas de riesgo de tromboembolismo (TE) (CHADS2 y CHA2DS2-VASc) y hemorragia (HEMORR2AGES y HAS-BLED) en nuestros pacientes.
En el HPC de Mar del Plata se atiende una población cautiva (cobertura médica completa y exclusiva) de aproximadamente 64.904 individuos, más pacientes con cobertura no capitada. Se revisaron las historias clínicas de los pacientes del Registro Cerebrovascular HPC (ReC-HPC) con diagnóstico de ECV (isquémicos o hemorrágicos) y diagnóstico de FANV paroxística o permanente en el momento del evento. Por otra parte, se cruzaron los registros de los pacientes con diagnóstico de FANV codificados en la historia clínica electrónica, con los datos de la base Rec-HPC a fin de detectar a los pacientes a quienes se les realizó el diagnóstico de FANV en la internación (luego de que los pacientes son codificados en el registro ReC-HPC). Posteriormente, se revisaron retrospectivamente las historias clínicas electrónicas de cada uno de los pacientes identificados para completar los datos necesarios para la estratificación y ponderación de los riesgos de recurrencia de ECVi y hemorragia. Se incluyó a todos los pacientes capitados o con atención exclusiva en nuestro hospital, que habían presentado un ECV isquémico con diagnóstico de FANV paroxística o permanente y que fueron evaluados por el Servicio de Neurología entre el 1 de diciembre del 2008 y el 31 mayo del 2013. Si el evento registrado en el periodo consignado era una recurrencia, se lo incluyó en el estudio solo si se obtenían los datos del primer evento en la historia clínica del paciente (fuera este un ECVi o un accidente isquémico transitorio [AIT]), y si dicho evento había ocurrido concomitantemente o luego del diagnóstico de la FA. En estos casos, el segundo evento fue considerado como una recurrencia.
Escalas- –
CHADS2: insuficiencia cardíaca congestiva (1 punto), hipertensión arterial (definida por presión arterial>140/90mmHg o tratamiento farmacológico antihipertensivo) (1 punto), edad>74 años (1 punto), diabetes mellitus (1 punto) y antecedente de ECVi, AIT o TE (2 puntos).
- –
CHA2DS2-VASc: insuficiencia cardíaca congestiva (disfunción moderada a severa del ventrículo izquierdo) (1 punto), hipertensión arterial (definida por presión arterial>140/90mmHg o tratamiento farmacológico antihipertensivo) (1 punto), edad>74 años (2 puntos), diabetes mellitus (1 punto), antecedente de ECVi, AIT o TE (2 puntos), enfermedad vascular (p. ej., arteriopatía periférica, infarto agudo de miocardio y placa aórtica) (1 punto), edad 65-74 años (1 punto) y sexo femenino (1 punto).
- –
HEMORR2HAGES: enfermedad renal o hepática (1 punto), consumo de alcohol severo (1 punto), enfermedad oncológica (1 punto), edad>75 años (1 punto), disminución del recuento o función plaquetaria (1 punto), antecedente de sangrado (2 puntos), hipertensión arterial (1 punto), anemia (1 punto), factores genéticos (polimorfismo del CYP 2C9) (estaba variable no estuvo disponible en ninguno de nuestros pacientes), riesgo excesivo de caídas (incluidos pacientes con demencia y trastornos neuropsiquiátricos severos) y antecedente de un ECV (1 punto).
- –
HAS-BLED: hipertensión arterial (1 punto), función renal y/o hepática anormal (1 o 2 puntos), ECV (1 punto), antecedente o predisposición al sangrado (1 punto), labilidad en la razón internacional normalizada (RIN) (definida por tiempo en rango menor del 60%) (1 punto), edad avanzada (> 65 años) (1 punto) y consumo de alcohol y/o drogas (incluidos los antiinflamatorios no esteroides) (1 o 2 puntos).
Los pacientes con puntuación mayor o igual a 2 en las escalas CHADS2 y CHA2DS2-VASc se consideran de riesgo elevado de TE, por lo que se recomienda como tratamiento la anticoagulación. Mientras que puntuación mayor o igual a 3 y 4 en las escalas de HEMORR2AGES y HAS-BLED, respectivamente, indican riesgo elevado de hemorragia y, por lo tanto, se recomienda tomar mayores precauciones en el momento de indicar AC.
Análisis estadísticosComprende estadística descriptiva de los pacientes con ECVi y FANV (medianas, cuartiles y límites superior e inferior). Chi al cuadrado para comparar frecuencias de variables categoriales. Mann-Whitney para comparar diferencias entre ambos grupos (AC y AG) en las mediciones con variables ordinales y variables interválicas sin distribución normal. Se efectuó un análisis de regresión logística univariable para cada una de las variables independientes registradas y un análisis de regresión logística multivariable para aquellas variables con un valor de p<0,15; estimándose las razones de productos cruzados (odds ratio [OR]) con los intervalos de confianza (IC del 95%) para comparar las características basales de los pacientes y análisis retrospectivo de la indicación terapéutica. Para variables con error alfa mayor del 5% se aplicó el procedimiento de eliminación progresiva paso a paso de Wald hasta la obtención de las covariables con asociación significativa (p<0,05). Se consideró como variable dependiente para la evaluación de la efectividad terapéutica, la recurrencia de un AIT o ECVi. Para el análisis de la seguridad del tratamiento indicado, las variables dependientes consideradas fueron hemorragia global y hemorragia mayor (definida como las hemorragias que producen una caída de la hemoglobina ≥ 3g/dl, requerimiento de transfusión, hemorragia intracraneana o retroperitoneal), la mortalidad relacionada (aquellas muertes producidas dentro de los 30 días de un nuevo ECVi o de una hemorragia mayor) y no relacionada con los desenlaces. Se realizó un análisis actuarial de supervivencia mediante el método de Kaplan-Meier y se comparó cada una de las variables independientes categoriales dicotómicas mediante el método de Log-Rank (Peto-Prentice). En los casos en los que se observó que los riesgos no eran proporcionales a lo largo del tiempo en las curvas de supervivencia, se utilizó el método de Wilcoxon para el análisis de diferencia. Se utilizó para el análisis el programa estadístico Statsdirect (versión 2.7.2).
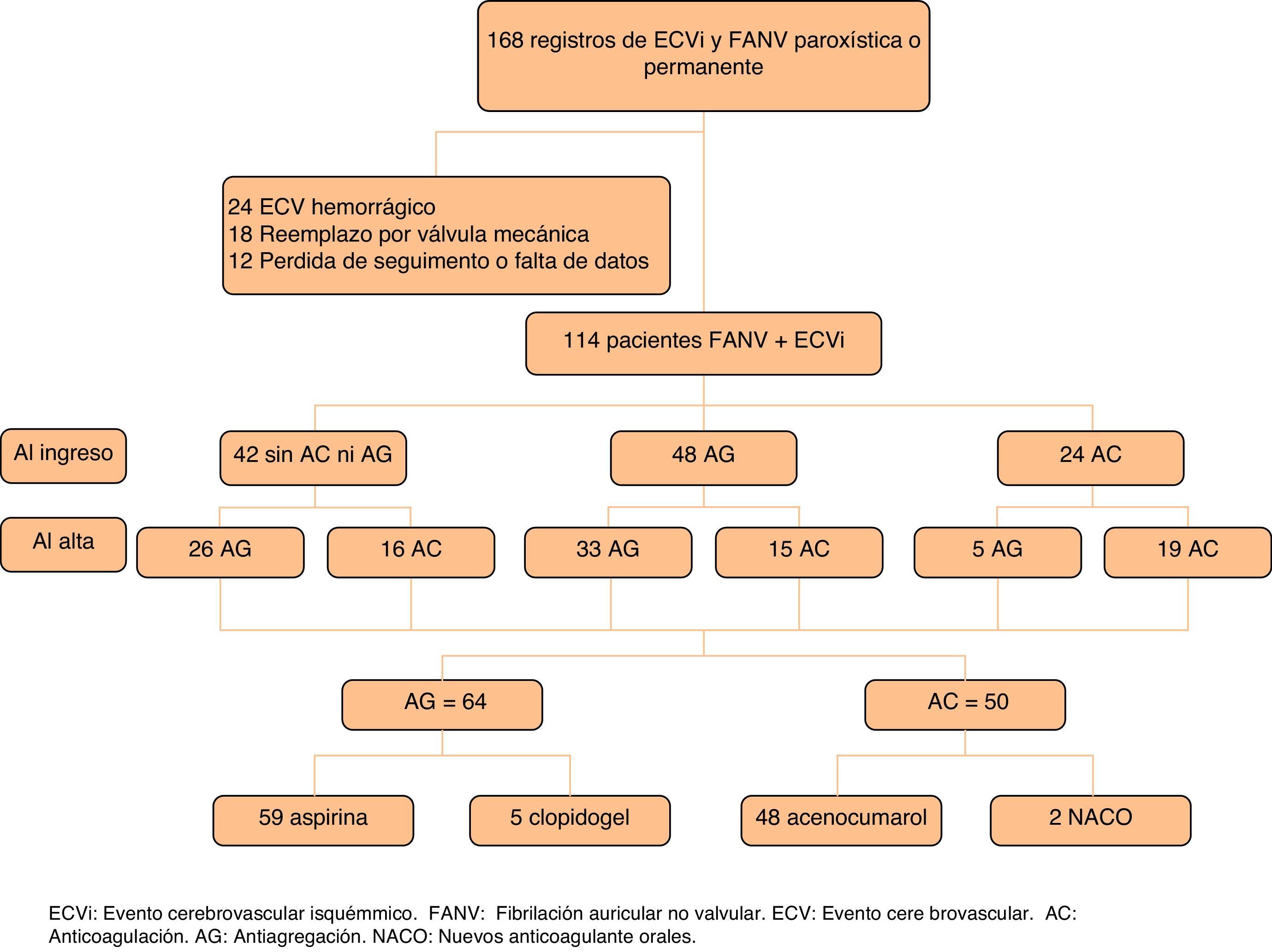
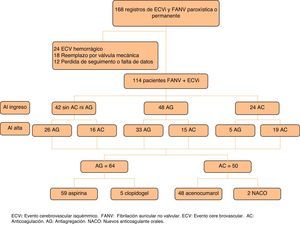
ResultadosSe revisaron las historias clínicas de 168 pacientes. Se excluyó del estudio a 24 pacientes, en los cuales el primer evento registrado era de tipo hemorrágico, 18 pacientes con FA y reemplazo valvular, 8 pacientes con pérdida en el seguimiento y 4 pacientes por falta de datos relevantes para el estudio. En el análisis final se incluyó a 114 pacientes que presentaron un primer ECVi o AIT y diagnóstico de FANV paroxística o permanente (fig. 1). La mediana de edad fue de 84 años (cuartiles: 79-88), el 71% eran mujeres (n=81) y la mediana de tiempo de seguimiento fue 17 meses (cuartiles: 6-32).
Luego del primer ECVi, 50 pacientes fueron medicados con AC (48 con acenocumarol, uno con rivaroxabán y uno con dabigatrán) y 64 pacientes con tratamiento de AG (59 con ácido acetilsalicílico y 5 con clopidogrel) al egreso hospitalario. Las características basales de la población general y de cada grupo se presentan en la tabla 1. Mediante un análisis de regresión logística multivariable observamos en nuestro hospital una mayor tendencia a indicar AG en los pacientes de mayor edad (mediana de edad 86 años vs. 79,5 años; p=0,0002), en los pacientes con riesgo de caídas (53% vs. 9,2%; p=0,0013) y en los pacientes con diagnóstico de ECVi establecido (74% vs. 92%; p<0,0001). Por otra parte, se indicó con mayor frecuencia AC a los pacientes que presentaban eventos menores según la puntuación de la escala de NIHSS al ingreso (4 vs. 10; p=0,0134), menor discapacidad al egreso según la escala de Rankin modificada (2 vs. 3; p=0,02) y a los pacientes con diagnóstico de AIT (26% vs. 8%; p=0,0003) (tabla 1).
Características basales de los pacientes con FANV y ECVi. Análisis de regresión logística univariable y multivariable de la indicación de AC y AG al egreso
| Total | AC al alta | AG al alta | Regresión logística | |||
|---|---|---|---|---|---|---|
| n=114 | n=50 | n=64 | Univariable | Multivariable | ||
| OR | p | p | ||||
| Sexo femenino (%) | 81 (71,1) | 28/81 (35) | 53/81 (65) | |||
| Sexo masculino (%) | 33 (28,9) | 22/33 (66,67) | 11/33 (33,33) | |||
| Indicación AC sexo femenino/masculino | 0,26 (0,10-0,67) | 0,0032 | – | |||
| Edad (años)-mediana (cuartiles) | 84 (79-88) | 79,5 (75 - 85) | 86 (83-90) | – | < 0,0001a | 0,0002 |
| Edad ≥ 75 años (%) | 98 (86) | 38 (76) | 60 (94) | 0,21 (0,06-0,70) | 0,012 | – |
| HTA (%) | 102 (89) | 44 (88) | 58 (91) | – | – | |
| DBT (%) | 18 (16) | 10 (20) | 8 (12,5) | – | – | |
| DLP (%) | 25 (22) | 12 (24) | 13 (20,3) | – | – | |
| ICC (%) | 39 (34,2) | 16 (32) | 23 (36) | – | – | |
| Insuficiencia renal (%) | 20 (17,7) | 12 (24) | 8 (12,5) | 2,21 (0,74-6,83) | 0,14 | – |
| Insuficiencia hepática (%) | 0 | 0 | 0 | – | - | |
| IAM (%) | 14 (12) | 8 (16) | 6 (9,4) | – | – | |
| Arteriopatía periférica (%) | 9 (7,9) | 3 (6) | 6 (9,4) | – | – | |
| EP o TEP (%) | 4 (3,5) | 3 (8,3) | 1 (1,6) | – | – | |
| Alcohol moderado-severo (%) | 3 (2,6) | 1 (2) | 2 (3,1) | – | – | |
| Antecedentes de hemorragia (%) | 10 (8,9) | 6 (12) | 4 (6,3) | – | – | |
| Enfermedad oncológica (%) | 17 (15) | 11 (22) | 6 (9,4) | 2,72 (0,83-9,68) | 0,069 | – |
| TBQ activo (%) | 6 (5,3) | 3 (6) | 3 (4,7) | – | – | |
| Ex TBQ (%) | 13 (11,7) | 7 (14) | 6 (9,4) | – | – | |
| Estenosis carotídea moderada-severa (%) | 6 (5,3) | 3 (6) | 3 (4,7) | – | – | |
| Anemia (%) | 24 (21) | 11 (22) | 13 (20) | – | – | |
| Trombocitopenia (%) | 5 (4,4) | 4 (8) | 1 (1,6) | – | – | |
| Tratamiento AG previoa (%) | 48 (42) | 15 (30,6) | 33 (52) | 0,4 (0,17-0,94) | 0,023 | – |
| Tratamiento AC previoa (%) | 24 (21,4) | 19 (39) | 5 (7,9) | 7,23 (2,29-26,72) | 0,0001 | 0,0007 |
| Labilidad INR (%) | 13 (11,5) | 9 (18) | 4 (6,3) | 3,29 (0,84-15,47) | 0,074 | – |
| Riesgo de caídas (%) | 39 (34,2) | 5 (9,2) | 34 (53) | 0,1 (0,03-0,29) | < 0,0001 | 0,0013 |
| ECVi (índice) (%) | 96 (84) | 37 (74) | 59 (92) | 0,24 (0,06-0,80) | 0,0102 | < 0,0001 |
| AIT (índice) (%) | 18 (16) | 13 (26) | 5 (7,8) | 4,15 (1,24-16) | 0,0102 | 0,0003 |
| Tratamiento trombolítico (%) | 3 (2,7) | 1 (2) | 2 (3,2) | – | – | |
| NIHSS al ingreso-mediana (cuartiles) | 5 (3-12) | 3,5 (0-7) | 10 (4-16) | – | < 0,0001a | 0,0134 |
| ERm al egreso | 2 (1-4) | 2 (1-2) | 3 (2-5) | – | < 0,0001a | 0,0198 |
AC: anticoagulación; AG: antiagregación; AIT: accidente isquémico transitorio; DBT: diabetes mellitus; DLP: dislipidemia; ECVi: evento cerebrovascular isquémico; EP: embolia periférica; ERm: escala de Rankin modificada; HTA: hipertensión arterial; IAM: infarto agudo de miocardio; ICC: insuficiencia cardíaca congestiva; NIHSS: puntaje de la Escala de Evento Cerebrovascular de los Institutos Nacionales de la Salud; OR: odds ratio; RIN: razón internacional normalizada; TBQ: tabaquismo; TEP: tromboembolismo pulmonar.
OR: > 1 AC y < 1 AG. Prueba de la chi al cuadrado.
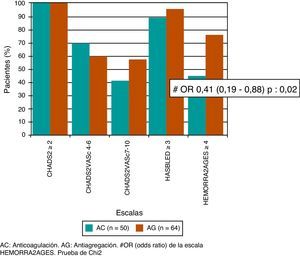
Al aplicar las escalas CHADS2 y CHA2DS2-VASc, observamos que tanto los 50 pacientes que recibieron AC como los 64 pacientes que recibieron AG tenían una puntuación mayor o igual a 2 en ambas escalas, por lo que todos tenían indicación de AC. Tampoco se observaron diferencias en un análisis realizado posteriormente, en los cuales se subdividieron a los pacientes de alto riesgo con puntuación en la escala CHA2DS2-VASc de 4 a 6 puntos (p=0,45) y los de muy alto riesgo con puntuación en la escala CHA2DS2-VASc de 7 a 10 (p=0,45). Mientras que el 88% de los pacientes del grupo AC y el 94% del grupo AG tenían riesgo elevado de sangrado según la escala de HAS-BLED (p=0,33), y el 44% del grupo AC y el 66% del grupo AG, según la escala de HEMORR2AGES, siendo esta última, la única escala que presentaba correlación con nuestra indicación de AG en los pacientes de mayor riesgo de sangrado (OR=0,41; IC del 95%, 0,19-0,88; p=0,02) (fig. 2).
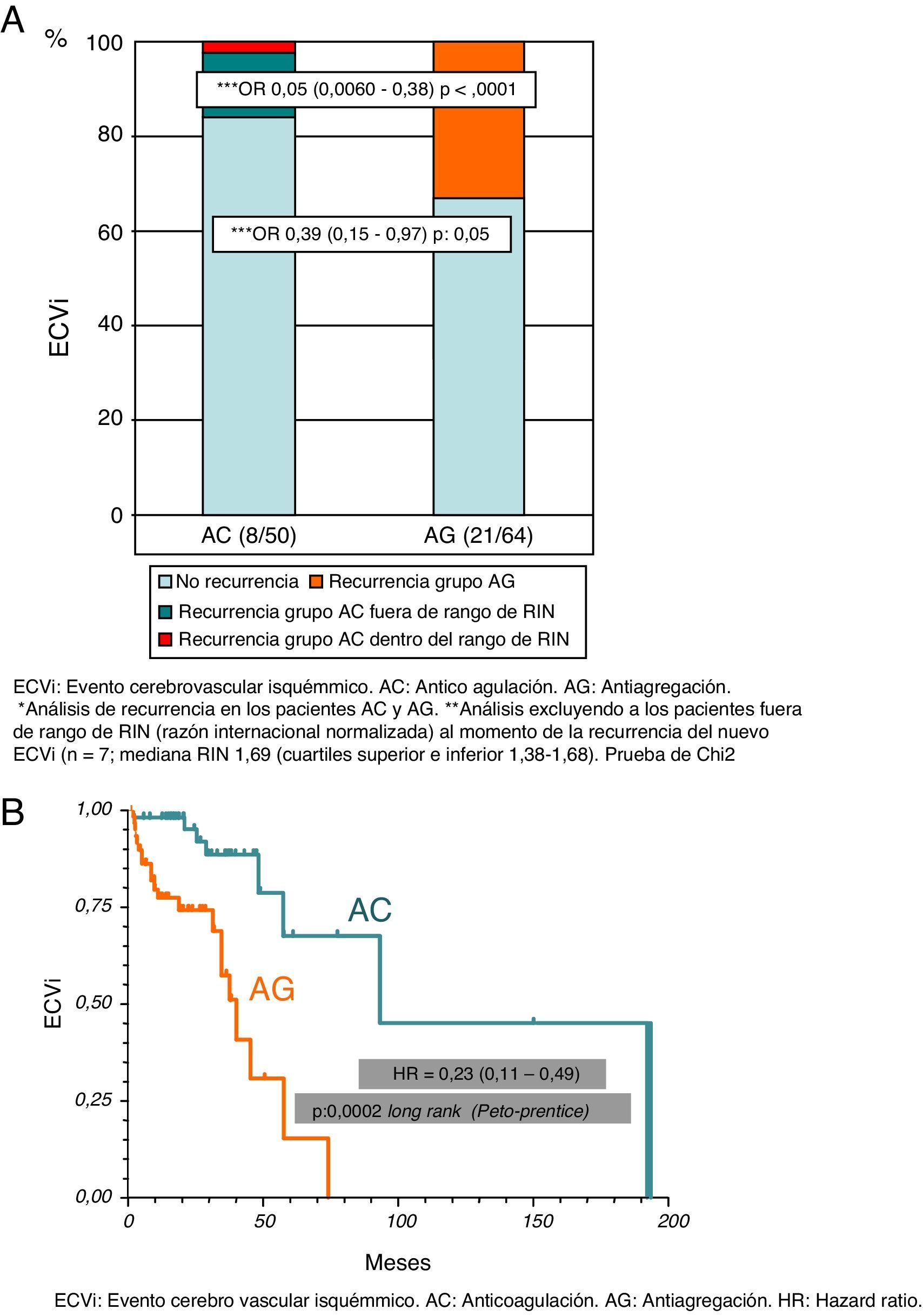
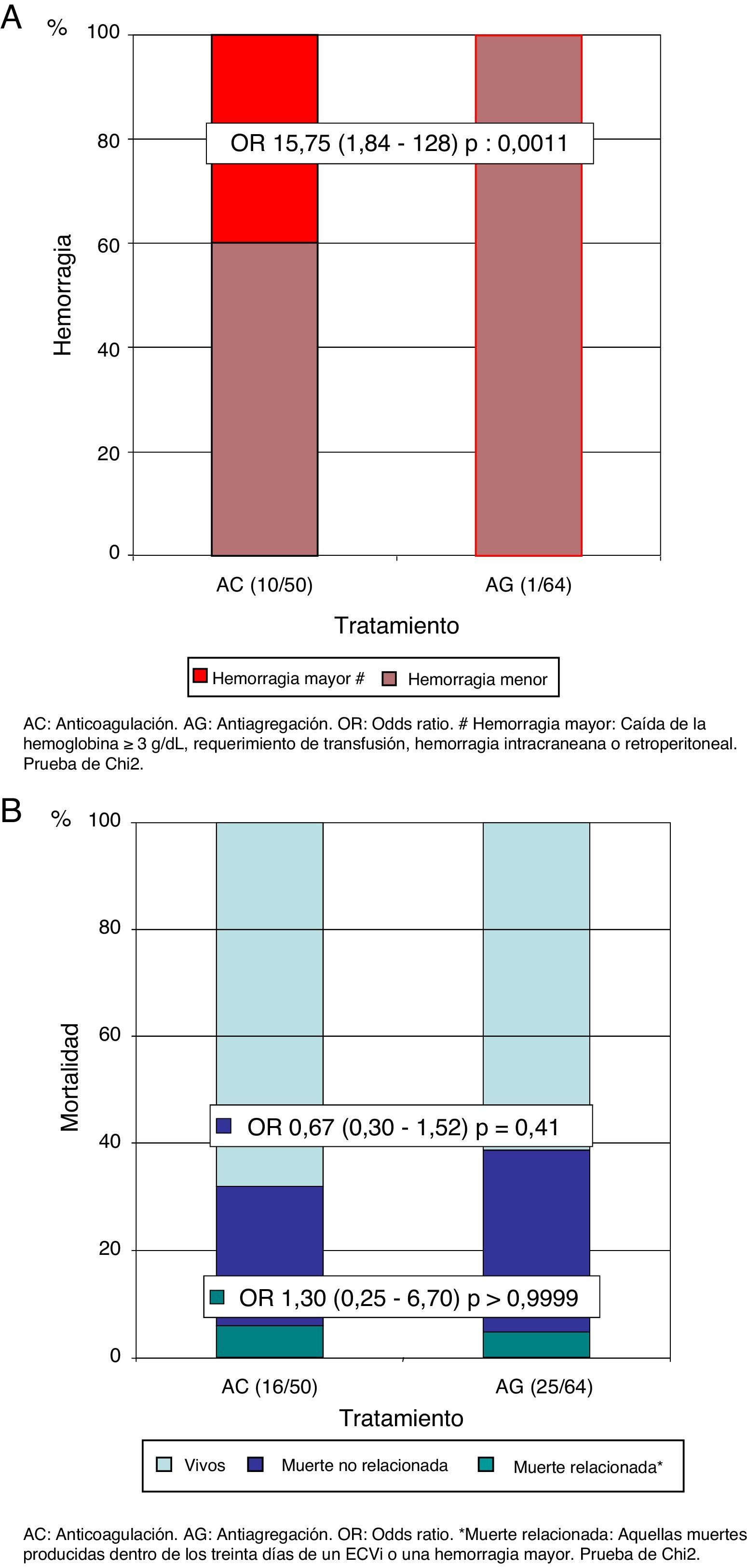
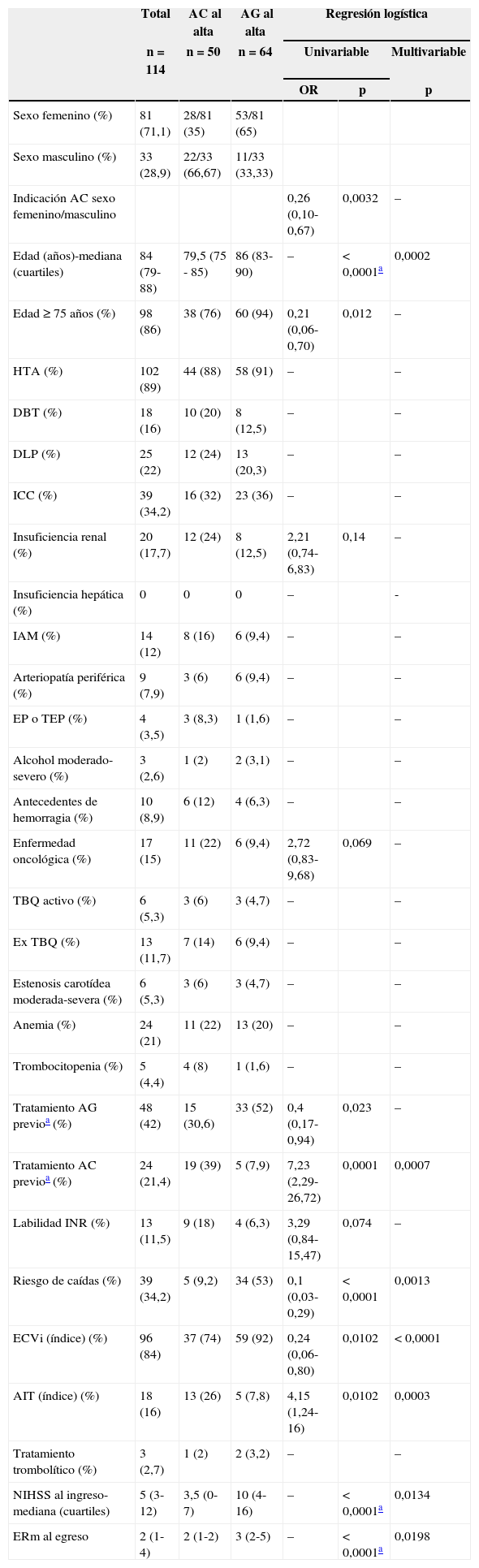
El 16% (n=8) de los pacientes del grupo AC y el 33% (n=21) de los pacientes del grupo AG presentaron un nuevo ECVi (OR=0,39; IC del 95%, 0,15-0,97; p=0,05). El 87,5% (n=7) de los pacientes del grupo AC que presentaron un nuevo ECVi no se encontraban dentro de un rango de anticoagulación adecuado en el momento de la recurrencia (mediana RIN 1,69; cuartiles: 1,38-1,68). En un subanálisis excluyendo a los pacientes por debajo del rango de RIN, observamos que el beneficio de la AC era notablemente superior (OR=0,05; IC del 95%, 0,006-0,38; p<0,0001) (fig. 3 A). En el análisis de Kaplan-Meier durante el tiempo de seguimiento, también presentaba una reducción del riesgo de recurrencia de un nuevo ECVi el grupo AC en comparación con el grupo AG (HR=0,23; IC del 95%, 0,11-0,49; p=0,0002) (fig. 3 B). En cuanto a la tasa de hemorragia global, en los pacientes del grupo AC fue del 20% (n=10) y del 1,5% en el grupo AG (n=1) (OR=15,75; IC del 95%, 1,84-128; p=0,0011); sin embargo, hubo una tasa menor de hemorragias mayores (3 del tracto genitourinario y una hemorragia intracraneana), que se presentó en el 8% de los pacientes del grupo AC y en ningún paciente con AG (fig. 4 A). Por último, no observamos diferencias estadísticamente significativas en cuanto a la mortalidad relacionada con los desenlaces de recurrencia de ECVi o hemorragia, presentes en el 6% (n=3) del grupo AC y en el 4,7% (n=3) del grupo AG (OR=1,30; IC del 95%, 0,25-6,70; p>0,99) ni con la mortalidad no relacionada con los desenlaces analizados, observados en el 26% del grupo AC (n=13) y en el 34% (n=22) del grupo AG (OR=0,67; IC del 95%, 0,30-1,52; p=0,41) (fig. 4 B).
A) Riesgo de recurrencia de un evento cerebrovascular isquémico. B) Riesgo de recurrencia de evento cerebrovascular isquémico en el tiempo (estimador de Kaplan-Meier).
AC: anticoagulación; AG: antiagregación; ECVi: evento cerebrovascular isquémico; HR: hazard ratio.
*Análisis de recurrencia en los pacientes AC y AG.
**Análisis excluyendo a los pacientes fuera de rango de RIN (razón internacional normalizada) en el momento de la recurrencia del nuevo ECVi (n = 7; mediana RIN 1,69 [cuartiles superior e inferior 1,38-1,68]). Prueba de la chi al cuadrado.
Es claro que la FANV está asociada a un riesgo mayor de un ECVi debido a tromboembolismo y que este riesgo podría reducirse con el tratamiento antitrombótico4,5. Nuestra población presenta características similares a la mayoría de los pacientes con los que se enfrenta el neurólogo en la práctica diaria por su riesgo elevado de tromboembolismo (ponderado según las escalas de CHADS2 y CHA2DS2-VASc) y, al mismo tiempo, con riesgo de hemorragia aumentado (estimado según las escalas de HEMORR2AGES y HAS-BLED). En este contexto, observamos que la AC disminuyó significativamente el riesgo de recurrencia de un ECVi en comparación con la AG. Una limitación del trabajo es que no evaluamos el tiempo total en rango de anticoagulación de los pacientes que recibieron acenocumarol; sin embargo, un dato relevante de nuestro análisis fue que el 87,5% de los pacientes del grupo AC que presentaron recurrencia de un nuevo ECVi presentaban una RIN por debajo de 1,8 en el momento del ingreso hospitalario. Esto estaría asociado a que los AC que actúan como antagonistas de la vitamina K tienen ciertas limitaciones y dificultades para su uso debido a su rango terapéutico estrecho, requerimiento de controles de RIN e interacciones que presentan con alimentos y otros fármacos17. De estos resultados podemos hacer 2 observaciones; la primera es que los pacientes anticoagulados con antagonistas de la vitamina K necesitan controles estrictos del rango de anticoagulación y advertencias sobre los riesgos de interacciones con otros fármacos y con los alimentos, además de las precauciones que deben tener los médicos al momento de indicar otros fármacos asociados. La segunda es que los nuevos anticoagulantes orales podrían ser una alternativa terapéutica válida en estos pacientes, ya que presentan farmacocinética más predecible y que demostraron ser, al menos, no inferiores a la warfarina para la prevención de TE18–20. En nuestro estudio no hubo suficientes pacientes que recibieran los nuevos anticoagulantes orales (n=2) para realizar un subanálisis con este tipo de tratamiento. El beneficio mencionado de la AC en la prevención de recurrencia de un ECVi se acompañó de un incremento en el riesgo de hemorragia global y un incremento menor del riesgo de hemorragia mayor; y a pesar de que la tasa de hemorragias mayores fue baja en ambos grupos (4/50 grupo AC y 0/64 grupo AG), es similar a lo descrito en estudios previos sobre el riesgo aumentado con la AC21–23. En dichos estudios, se describió un aumento del riesgo de hemorragia global del 26% y de hemorragia mayor entre un 12 y un 14% (en pacientes de riesgo intermedio), comparable con la tasa de hemorragia global del 20% y de hemorragia mayor del 8% observada en nuestros pacientes. No pudimos observar en nuestro análisis diferencias estadísticamente significativas entre ambos grupos en la mortalidad relacionada con los desenlaces desfavorables (recurrencia de un ECVi o hemorragia) ni con la mortalidad no relacionada a estos desenlaces.
Si bien nuestro trabajo presenta ciertas limitaciones, inherentes a los trabajos de cohorte retrospectiva, presenta aspectos relevantes. En primer lugar, es un estudio realizado en una población de riesgo elevado tanto de tromboembolia como de hemorragia, que es lo que sucede frecuentemente luego de un ECVi y dificulta la elección terapéutica. En segundo lugar, si bien es un estudio abierto y retrospectivo, está basado en pacientes de la «vida real» que tienen una validez externa mayor, por lo cual los resultados podrían ser extrapolables a otras poblaciones de características similares. Otro punto a destacar del trabajo es que se realizó en una población cautiva y con pacientes que se atienden exclusivamente en el HPC, lo que permitió tener acceso, a través de las historias clínicas electrónicas, a todos los datos necesarios para la ponderación de los riesgos utilizando las escalas CHADS2, CHA2DS2-VASc, HEMORR2AGES y HAS-BLED; además, permitió que se realice el análisis de recurrencia en función al tiempo de seguimiento.
La puntuación en las escalas CHADS2, CHA2DS2-VASc y HAS-BLED no se asoció con nuestra elección del tratamiento. Sin embargo, las variables incluidas en la escala de HEMORR2AGES parecerían ser las que más influyen en nuestra decisión de no indicar AC a un paciente por su mayor riesgo de hemorragia, principalmente en los pacientes de mayor edad y con riesgo aumentado de caídas. Aun así, en pacientes cuidadosamente seleccionados, el tratamiento AC es más efectivo que el tratamiento AG para la prevención secundaria de un ECVi en pacientes con FANV. Si bien el tratamiento AC aumenta el riesgo de hemorragias mayores, consideramos que la frecuencia de recurrencia de un ECVi y sus consecuencias exceden el riesgo de hemorragia asociada al tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El trabajo fue presentado y recibió el premio «Vocación» en el 50.° Congreso Argentino de Neurología 2013.





![A) Riesgo de recurrencia de un evento cerebrovascular isquémico. B) Riesgo de recurrencia de evento cerebrovascular isquémico en el tiempo (estimador de Kaplan-Meier). AC: anticoagulación; AG: antiagregación; ECVi: evento cerebrovascular isquémico; HR: hazard ratio. *Análisis de recurrencia en los pacientes AC y AG. **Análisis excluyendo a los pacientes fuera de rango de RIN (razón internacional normalizada) en el momento de la recurrencia del nuevo ECVi (n = 7; mediana RIN 1,69 [cuartiles superior e inferior 1,38-1,68]). Prueba de la chi al cuadrado. A) Riesgo de recurrencia de un evento cerebrovascular isquémico. B) Riesgo de recurrencia de evento cerebrovascular isquémico en el tiempo (estimador de Kaplan-Meier). AC: anticoagulación; AG: antiagregación; ECVi: evento cerebrovascular isquémico; HR: hazard ratio. *Análisis de recurrencia en los pacientes AC y AG. **Análisis excluyendo a los pacientes fuera de rango de RIN (razón internacional normalizada) en el momento de la recurrencia del nuevo ECVi (n = 7; mediana RIN 1,69 [cuartiles superior e inferior 1,38-1,68]). Prueba de la chi al cuadrado.](https://static.elsevier.es/multimedia/18530028/0000000700000001/v4_201503070050/S1853002814000822/v4_201503070050/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)