Cefalea (especialmente la migraña) y epilepsia son entidades con elevada comorbilidad que pueden confundirse desde el punto de vista clínico. Existe una relación bidireccional entre ambas, conocida desde hace siglos, pero aún no bien comprendida. Describimos las distintas modalidades de asociación existentes entre ellas, los mecanismos fisiopatológicos y genéticos subyacentes y los tratamientos recomendados.
MétodoHemos revisado las publicaciones más relevantes sobre la asociación entre migraña/cefalea y epilepsia utilizando la base de datos de PubMed.
DescripciónEn un mismo individuo, la epilepsia puede coexistir con algún tipo de cefalea (sobre todo migraña) por azar o a través de una etiología subyacente común. En ambos casos, los ataques de una y otra se presentan en diferentes momentos temporales («cefalea interictal»). Cuando la cefalea es parte de la propia crisis, estamos ante una hemicránea epiléptica o ante una cefalea epiléptica ictal. La cefalea que aparece tras la crisis, define una cefalea post-ictal. La cefalea que la precede se denomina cefalea preictal. Un tipo especial de esta última es la migralepsia, término que hace referencia a las crisis que aparecen durante o poco después del aura migrañosa.
ConclusionesLa terminología y los conceptos que definen las posibles asociaciones entre cefalea/migraña y epilepsia han ido evolucionando a lo largo del tiempo, en virtud del mayor conocimiento clínico y fisiopatogénico. Se ha propuesto suprimir el término de migralepsia y utilizar de forma restringida y uniforme los términos cefalea epiléptica ictal y hemicránea epiléptica en todos los sistemas de clasificación.
Headaches (including migraines) and epilepsy have a high level of comorbidity and may be confused during diagnosis. Although physicians have known for centuries that these two conditions are somehow linked, their relationship remains poorly understood. Herein we describe the known associations between them, their underlying physiopathologic and genetic mechanisms, and the treatments recommended for them.
MethodWe have reviewed the most relevant publication of headache/migraine and epilepsy by using the PubMed data base.
DescriptionAn individual can suffer both from headaches (either migraine and/or other type of headache) and epilepsy, either by chance or because of a common underlying pathology. In these cases, the headache usually occurs at a different moment than the seizure (“interictal headache”). However, headaches sometimes occur simultaneously with, or very close in time to, the seizure: one that occurs at the same time as an epileptic seizure is known as an “ictal epileptic headache” or as “hemicrania epileptica”; one that precedes a seizure is known as a “pre-ictal headache”; and one that follows a seizure is known as a “post-ictal headache”. There is a particular type of pre-ictal headache, known as “migralepsy”, which occurs during or just after a migraine aura.
ConclusionsThe terminology and concepts employed to describe possible associations between headaches (mainly migraines) and epilepsy have evolved over time with increasing clinical and physiopathogenic knowledge. Some researchers have suggested eliminating the term migralepsy and using the terms ictal epileptic headache and hemicrania epileptica exclusively and uniformly in all classification systems.
La relación entre migraña (o cefalea en general) y epilepsia es conocida desde hace siglos, pero sigue sin comprenderse en su totalidad. En 1898, un editorial en la Revista de la Asociación Médica Americana señalaba la necesidad de encontrar «una explicación plausible a las afinidades reconocidas desde hace tiempo entre migraña y epilepsia»1. Más de 100 años después, estas afinidades mantienen su relevancia clínica y científica. Migraña y epilepsia son ambos trastornos episódicos, caracterizados por ataques paroxísticos de disfunción cerebral transitoria. Presentan una elevada comorbilidad, y en ocasiones se confunden desde el punto de vista clínico2-4.
El término comorbilidad no implica dirección o causalidad, sino la coexistencia de enfermedades en una proporción no explicable sólo por azar. La asociación entre migraña (u otro tipo de cefalea) y epilepsia es bidireccional: una puede preceder o suceder a la otra o incluso aparecer simultáneamente5. Además, ambas comparten mecanismos fisiopatológicos y factores de riesgo genéticos y/o ambientales.
Para llevar a cabo este trabajo, hemos realizado una búsqueda de la literatura médica en PubMed con la palabra clave «migralepsia» o combinando los términos «epilepsia o crisis epilépticas» con «cefalea, migraña o aura». No se ha puesto límite temporal, salvo el inherente a la propia base de datos usada. Posteriormente, hemos seleccionado las publicaciones originales y de revisión consideradas como más relevantes para redactar esta revisión.
Epidemiología e interrelación entre cefalea (con especial énfasis en la migraña) y epilepsiaLa frecuencia de epilepsia en la población migrañosa oscila entre el 1 y el 17%, con una mediana de 5,9%6, que es significativamente mayor que la frecuencia de epilepsia en la población general (0,5-1%)7. La frecuencia de migraña en la población epiléptica es también elevada, oscilando entre el 8,4 y el 23%3. Un estudio retrospectivo islandés, llevado a cabo en niños de edades entre 5 y 15 años con epilepsia, mostró un riesgo cuatro veces mayor de tener migraña, especialmente migraña con aura8.
Ottman y Lipton estudiaron la comorbilidad migraña-epilepsia mediante una encuesta telefónica estructurada. La incidencia acumulada de migraña en los sujetos con epilepsia fue del 24%. Entre sus parientes con epilepsia, el 23% también tenían historia de migraña frente al 12% de los parientes sin epilepsia. La epilepsia incrementó el riesgo relativo de migraña por 2,4 (riesgo instantáneo proporcional de Cox) y ello tanto en probandos como en sus parientes en comparación con familiares sin epilepsia9.
Leniger et al.10 resaltaron que la cefalea es a menudo ignorada como síntoma en las crisis epilépticas. En un período de 15 meses estudiaron 341 pacientes consecutivos con epilepsia. Un 34% (n=115) de ellos experimentaron cefalea asociada a las crisis, siendo preictal en el 3%, periictal en el 27% y postictal en el 70%. En el 55,7% de los 115, la cefalea se clasificó como migraña y en un 36,5% como tensional. No se demostró asociación significativa con el sexo, tipo de crisis o síndrome epiléptico. Sí hubo asociación entre la presencia de una cefalea migrañosa asociada a las crisis y una historia de migrañas.
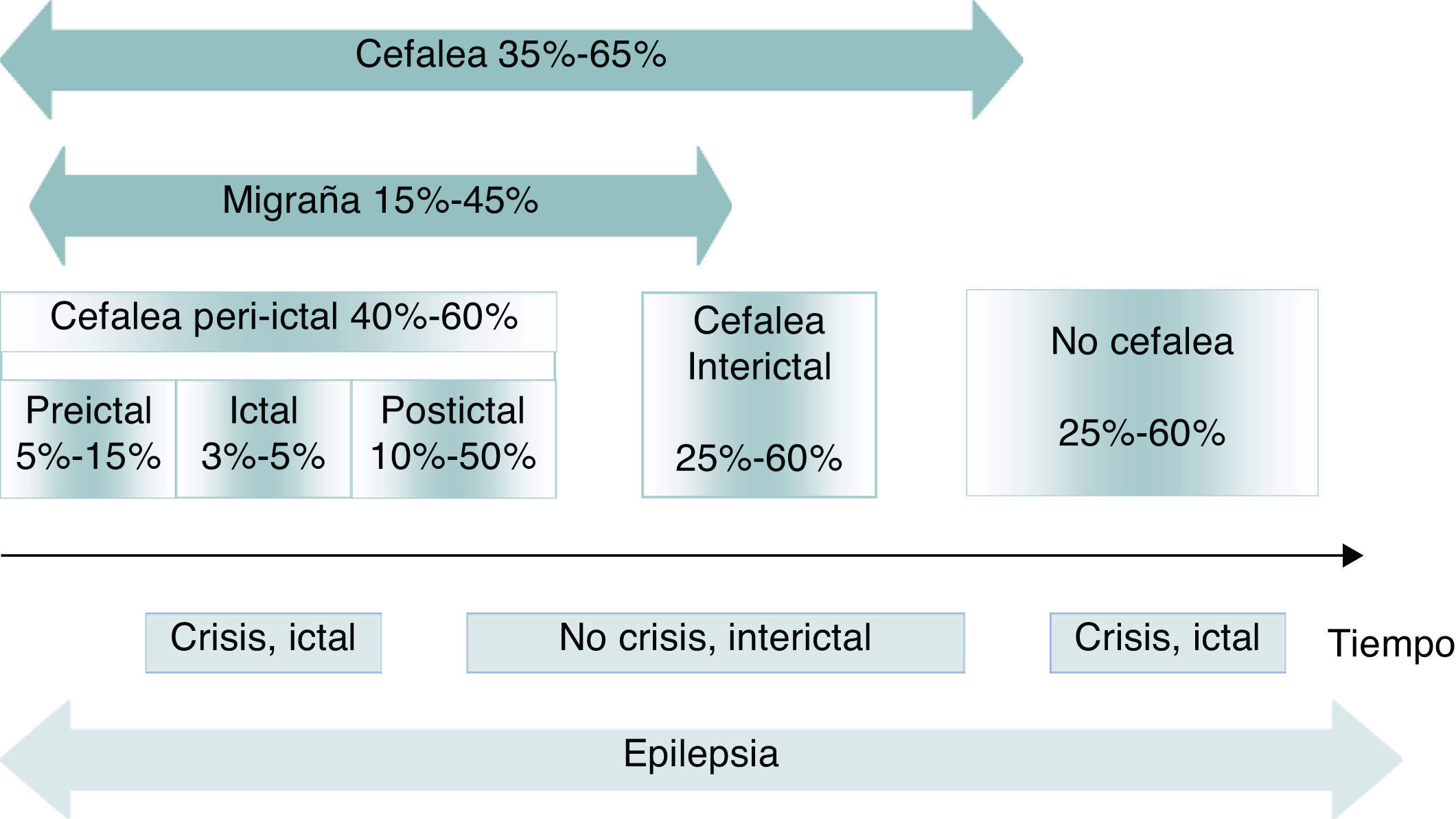
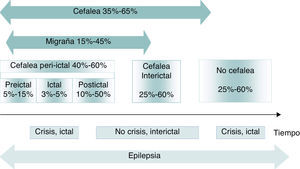
Existen varias modalidades de asociación entre la cefalea y la epilepsia, resultando en diferentes relaciones temporales entre ellas (fig. 1)11,12:
- 1.
Coexistencia por azar en un mismo individuo.
- 2.
Etiología subyacente común que explique ambos trastornos (tabla 1).
Tabla 1.Patologías que pueden presentarse con cefalea y epilepsia
□ Trastornos metabólicos□ Enfermedad de Alexander□ Síndromes neurocutáneos□ Síndrome de Sturge-Weber□ Complejo de esclerosis tuberosa□ Malformaciones vasculares (MAV, cavernomas)□ Infección□ Encefalitis□ Abscesos cerebrales□ Síndromes posmeningitis□ Hidrocefalia □ Tumores cerebrales□ Traumatismo craneoencefálico□ Síndromes postraumáticos□ MELAS□ Epilepsia occipital idiopática (variante de Gastaut)□ Epilepsia occipital idiopática fotosensible□ Epilepsia idiopática con paroxismos centrotemporales□ Migraña hemipléjica familiar□ Ataxia episódica tipo 2 En estos dos casos, hablamos de cefalea interictal, ya que los ataques de una y otra entidad se presentan en diferentes momentos temporales.
- 3.
La cefalea es parte de la propia crisis (menos frecuentemente su única manifestación): hemicrania epiléptica y cefalea epiléptica ictal. La cefalea y la crisis se presentan simultáneamente.
- 4.
La cefalea aparece tras la crisis (secuencia crisis-cefalea/migraña): cefalea post-ictal. En estos casos, las manifestaciones epilépticas pueden simular el aura de una migraña, como ocurre en la epilepsia benigna de la infancia. La crisis y la cefalea aparecen sucesivamente.
- 5.
La crisis epiléptica aparece durante o tras el aura de una migraña (secuencia migraña/cefalea-crisis): migralepsia. La migraña y la crisis aparecen sucesiva o simultáneamente.
Distribución en el tiempo de cefalea y migraña en epilepsia. Los números representan la prevalencia de cefalea en epilepsia. Modificado de Bianchin et al.11, 2010.
Estos tres últimos tipos de cefalea que se presentan en relación temporal próxima con las crisis se detallan a continuación.
Cefalea en relación con las crisis epilépticasUn 40-60% de los pacientes con epilepsia presenta cefalea peri-ictal en algún momento evolutivo. Estas se subdividen en preictal, ictal y postictal. Sin embargo, no son excluyentes entre sí y un mismo paciente puede presentar más de un tipo de cefalea peri-ictal e incluso cefaleas interictales concurrentes. Las cefaleas peri-ictales pueden tener importancia diagnóstica; por ejemplo, en la epilepsia del lóbulo temporal, la localización de la cefalea se correlaciona con el lado del foco epileptógeno, constituyendo un signo de lateralización13.
Cefalea preictalSe define como aquella que precede a una crisis epiléptica sin ser parte propiamente de la misma, es decir, más de 5 minutos antes del inicio de la crisis14. A pesar de que los estudios sistemáticos sobre esta cefalea son raros, se ha descrito en el 5-15% de los pacientes con epilepsia15,16. Yankovsky et al. encontraron 11 casos de cefalea preictal al estudiar a 100 pacientes con epilepsia parcial refractaria al tratamiento. En 7 de ellos la cefalea aparecía en los 30 min previos a la crisis (cefalea preictal temprana) y en los 4 restantes entre 30 min y 24 h antes, manteniéndose irregularmente a lo largo de ese período (cefalea prodrómica). Estos pacientes sufrían una epilepsia temporal, excepto uno con epilepsia frontal. De localización frontotemporal en todos los casos, esta cefalea era ipsolateral al lado del foco epileptógeno en la mayoría de los casos de epilepsia temporal16. El 75% de las crisis epilépticas de estos pacientes estaban precedidas de cefalea. En el 36%, la cefalea era de características migrañosas, aunque su intensidad menor que en los ataques de migraña típica. Cuando la cirugía de la epilepsia eliminó las crisis, también desaparecieron los episodios de cefalea.
Una forma distinta de cefalea preictal hace referencia a las crisis desencadenadas por la migraña (migralepsia): las crisis aparecen durante o poco después del aura migrañosa. Su prevalencia es desconocida, pero se ha asociado a migraña basilar y migrañas menstruales en particular2. El término migralepsia se utilizó por primera vez por Lennox y Lennox17 para describir una entidad donde «una migraña oftálmica con quizá náuseas y vómitos era seguida de síntomas característicos de epilepsia».
La migralepsia es una entidad controvertida. La ICHD-II (2.a edición de la International Classification of Headache Disorders) la incluye entre las complicaciones de la migraña (epígrafe 1.5.1), estableciendo criterios diagnósticos para ella (tabla 2)18; en cambio, este término no aparece en la clasificación de la ILAE (International League against Epilepsy) ni en las recientes recomendaciones de la ILAE Commission on Classification and Terminology19.
Criterios diagnósticos de migralepsia (ICHD-II)18
| 1.5.1 Crisis desencadenada por la migraña (migralepsia): una crisis desencadenada por un aura de migraña. Se han de cumplir los siguientes: |
| A. Migraña que cumple criterios de «migraña con aura» |
| B. Una crisis que cumple criterios para un tipo de ataque epiléptico que ocurre durante el aura de la migraña o hasta una hora después del mismo |
En realidad, hoy en día se considera muy improbable la existencia de una secuencia clínica como la descrita en la migralepsia (aura de migraña-crisis epiléptica o migraña-crisis epiléptica)20,21. Actualmente, se pone en duda su existencia como entidad nosológica. Varias razones han conducido a ello:
- 1.
En un estudio de más de 1.500 individuos con epilepsia, ninguno de ellos tuvo crisis tras el aura de una migraña o concomitantemente con dicho aura22.
- 2.
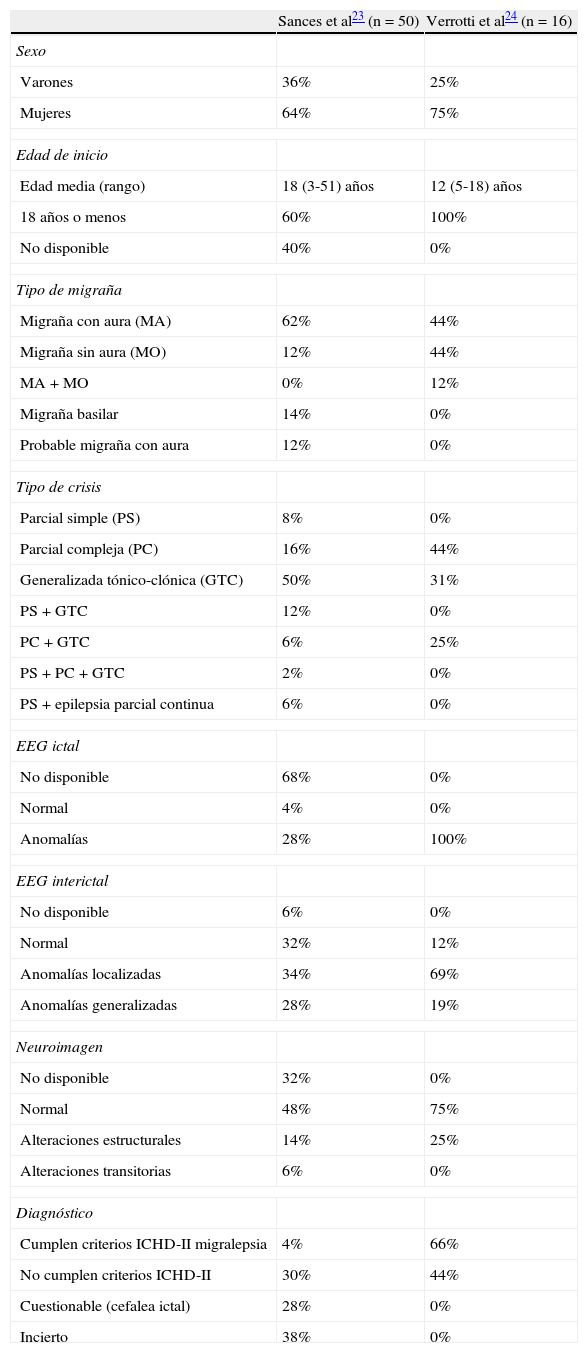
De los poco más de 50 casos de migralepsia publicados en la literatura anteriormente al año 2010 (tabla 3), el diagnóstico es bastante dudoso en la mayoría de ellos y en casi ninguno es evidente, de forma inequívoca, la secuencia migraña-epilepsia23. Sólo dos pacientes de los 50 (4%) cumplen sensu estrictu los criterios admitidos por la ICHD-II para su diagnóstico; en este sentido, algunos de los casos descritos se han asociado a migraña sin aura y en otros la crisis epiléptica ha sucedido más allá de una hora tras el ataque de migraña con aura23.
Tabla 3.Datos de los casos de migralepsia publicados en la literatura23,24
Sances et al23 (n=50) Verrotti et al24 (n=16) Sexo Varones 36% 25% Mujeres 64% 75% Edad de inicio Edad media (rango) 18 (3-51) años 12 (5-18) años 18 años o menos 60% 100% No disponible 40% 0% Tipo de migraña Migraña con aura (MA) 62% 44% Migraña sin aura (MO) 12% 44% MA+MO 0% 12% Migraña basilar 14% 0% Probable migraña con aura 12% 0% Tipo de crisis Parcial simple (PS) 8% 0% Parcial compleja (PC) 16% 44% Generalizada tónico-clónica (GTC) 50% 31% PS+GTC 12% 0% PC+GTC 6% 25% PS+PC+GTC 2% 0% PS+epilepsia parcial continua 6% 0% EEG ictal No disponible 68% 0% Normal 4% 0% Anomalías 28% 100% EEG interictal No disponible 6% 0% Normal 32% 12% Anomalías localizadas 34% 69% Anomalías generalizadas 28% 19% Neuroimagen No disponible 32% 0% Normal 48% 75% Alteraciones estructurales 14% 25% Alteraciones transitorias 6% 0% Diagnóstico Cumplen criterios ICHD-II migralepsia 4% 66% No cumplen criterios ICHD-II 30% 44% Cuestionable (cefalea ictal) 28% 0% Incierto 38% 0% - 3.
Aunque sólo se dispone de EEG ictal durante la fase de migraña en el 32% de estos 50 casos previamente mencionados, se ha visto una elevada prevalencia de trastornos puramente epilépticos entre ellos23. La RM mostró anomalías cerebrales transitorias en un 6% de los pacientes con migralepsia, probablemente por la alteración de la barrera hematoencefálica con el consiguiente edema, que explicaría la naturaleza reversible de estas alteraciones. Además, varios de los pacientes descritos con este diagnóstico tuvieron una respuesta rápida a la administración de diazepam por vía intravenosa, tanto clínica como electrográfica23.
- 4.
En el 2011, se han publicado las características clínicas y de EEG de una serie de pacientes con el diagnóstico de migralepsia. Se trata de 16 pacientes seleccionados retrospectivamente de entre 4.600 niños epilépticos que habían tenido una crisis en un periodo de tiempo no superior a una hora tras un ataque de migraña sin o con aura. Se incluyeron solo aquellos sujetos que tenían además un registro EEG realizado durante la fase de migraña24 (tabla 3). El 69% de estos niños tuvieron crisis parciales complejas; el otro 31% presentó una epilepsia generalizada primaria. El 56% presentó síntomas visuales, tipo amaurosis, o bien alucinaciones visuales, elementales o complejas. Un 44% tuvo migraña sin aura, 44% migraña con aura y 12% ambas. Los estudios de neuroimagen (RM) fueron normales en el 75%, mientras que en el otro 25% se encontraron algunas anomalías como trastorno de la migración neuronal, hidrocefalia, leucoencefalopatía y gliosis periventricular. Los 16 pacientes incluidos tenían anomalías EEG focales o generalizadas durante sus ataques de migraña, en forma de anomalías punta-onda, solo puntas o bien ondas theta en distintas topografías. La mayoría de ellos (88%) también tenían anomalías en el EEG interictal24. No se ha encontrado correlación entre el tipo y/o localización cortical de las anomalías EEG ictales y el inicio síncrono de una migraña, como tampoco con la presencia específica, bien de ataques de migraña sin aura o de migraña con aura.
Se ha sugerido, por tanto, que la secuencia migraña-epilepsia definida como «migralepsia» posiblemente sea una crisis epiléptica que se inicia con una cefalea ictal (la cefalea es parte de la propia crisis) seguida o no de una crisis parcial sensitivo/motora/autonómica o generalizada24.
Cefalea ictalLa cefalea como manifestación de una crisis epiléptica ha sido documentada en menos del 5% de los pacientes con epilepsia y no cumple los criterios diagnósticos de migraña10. En esta escasa frecuencia puede influir el hecho de que, al coincidir con la crisis, la cefalea pasa desapercibida, especialmente en pacientes con alteraciones cognitivas o del nivel de conciencia. Cuando aparece, además, la duración suele ser de escasos minutos5.
La cefalea ictal se manifiesta con sintomatología múltiple y diversa, como sensación opresiva bifrontal, dolor cefálico vago, dolor retroorbitario punzante o sensación eléctrica de intensidad y localización variables25. Habitualmente, se acompaña de otros síntomas26 y es excepcional su aparición como síntoma único de la crisis o de un estado epiléptico focal27, siendo más improbable aún que se de en todas las crisis de un mismo paciente. Para algunos autores es una manifestación similar al dolor de otra parte del organismo, postulando que estaría en relación con un origen parietal (dolor cefálico ictal)28. Sin embargo, en la práctica clínica este síntoma es excepcional en las epilepsias parietales.
De las cefaleas ictales, la ICHD-II18 describe sólo la «hemicránea epiléptica», incluida en el epígrafe 7 («cefalea atribuida a trastorno intracraneal no vascular»), apartado 7.6 («cefalea atribuida a crisis epiléptica»). Es extremadamente rara y, cuando se da, es improbable que cumpla todos los criterios diagnósticos propuestos18 (tabla 4). La «hemicránea epiléptica» no aparece en las recomendaciones nosológicas o terminológicas de la ILAE Commission on Classification and Terminology19. En un primer artículo, Isler et al.29 estudiaron a 91 pacientes con epilepsia refractaria a tratamiento: 18 de los 91 presentaron cefalea hemicraneal con características migrañosas de segundos-minutos de duración coincidiendo con la actividad epiléptica, todos ellos con crisis parciales; en casos raros, la cefalea ictal podía durar horas.
Criterios diagnósticos de hemicránea epiléptica y cefalea postictal (ICHD-II)18
| Hemicránea epiléptica |
| A. Cefalea que dura segundos o minutos, con características de migraña, y que cumple criterios C y D |
| B. El paciente está teniendo una crisis epiléptica parcial |
| C. La cefalea se desarrolla síncronamente con la crisis y es ipsolateral a la descarga ictal |
| D. La cefalea se resuelve inmediatamente tras la crisis |
| Este diagnóstico requiere que el inicio de la cefalea sea simultáneo con la descarga ictal demostrada en el EEG. |
| Cefalea postictal |
| A. Cefalea con características de cefalea de tipo tensión o, en un paciente con migraña, de cefalea tipo migraña, y que cumple criterios C y D |
| B. El paciente ha tenido una crisis epiléptica parcial o generalizada |
| C. La cefalea se desarrolla dentro de 3 h tras la crisis |
| D. La cefalea se resuelve dentro de 72 h tras la crisis |
Desde 1988 hasta la fecha, se han descrito en la literatura cinco casos de estado epiléptico/migrañoso27,30-33. Ninguno cumplía los criterios actuales para hemicránea epiléptica de la ICHD-II (tabla 5)18,34. En todos ellos, la cefalea parecía ser la única manifestación de un estado epiléptico no convulsivo parcial30-33 o generalizado27, cuya naturaleza solo ha podido dilucidarse mediante registro EEG32-36. No se ha visto ningún patrón ni localización específicos de las descargas epilépticas. De forma interesante, la RM de difusión ha mostrado alteraciones en la región de la actividad crítica, lo que confirma su utilidad a la hora de poner de manifiesto la naturaleza epiléptica del evento32,33. Por otro lado, también se ha visto que la remisión completa de la cefalea y de las anomalías epilépticas en la mayoría de estos pacientes se consiguió con antiepilépticos y no con antimigrañosos32,33.
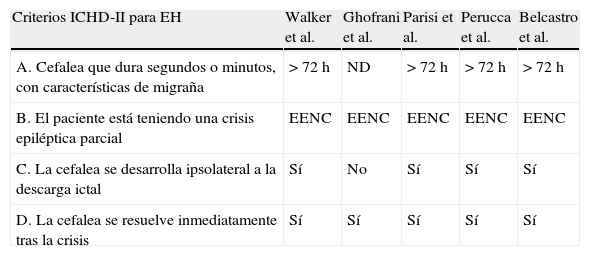
Revisión de cinco casos de cefalea epiléptica ictal descritos en la literatura y su comparación con los criterios actuales de la ICHD-II para hemicránea epiléptica (EH)
| Criterios ICHD-II para EH | Walker et al. | Ghofrani et al. | Parisi et al. | Perucca et al. | Belcastro et al. |
| A. Cefalea que dura segundos o minutos, con características de migraña | > 72h | ND | > 72h | > 72h | > 72h |
| B. El paciente está teniendo una crisis epiléptica parcial | EENC | EENC | EENC | EENC | EENC |
| C. La cefalea se desarrolla ipsolateral a la descarga ictal | Sí | No | Sí | Sí | Sí |
| D. La cefalea se resuelve inmediatamente tras la crisis | Sí | Sí | Sí | Sí | Sí |
EH hemicránea epiléptica; EENC estatus epiléptico no convulsivo; ND: no disponible.
Adaptado de Belcastro et al.34, 2011.
Existe una dificultad diagnóstica inherente al hecho de que una crisis epiléptica se presente con dolor ictal. Las siguientes situaciones contribuyen a complicar aún más el panorama diagnóstico:
- 1.
Si la cefalea ictal se asocia con otras manifestaciones epilépticas ictales, sobre todo visuales o sensitivas, sin generalización de la crisis, es fácil creer que estamos ante una migraña con aura.
- 2.
Si la cefalea ictal es la única manifestación epiléptica, sólo el hecho de considerar esta rara posibilidad y la detección de anomalías epileptiformes en un EEG ictal nos ayudarían en el diagnóstico. No obstante, hemos de tener en cuenta la especial dificultad que conlleva conseguir un registro ictal.
Esta cefalea está incluida también en el apartado 7.6 de la ICHD-II18 (tabla 4). Se presenta en el 50% de los pacientes con epilepsia37 y constituye el tipo de cefalea más frecuente relacionada con las crisis epilépticas. Una serie de circunstancias actúan como factores de riesgo o favorecedores de su presentación: adultos jóvenes con historia previa de cefaleas, sobre todo migrañas (en cuyo caso la cefalea postictal es típica migrañosa); pacientes que inician sus crisis epilépticas a una edad temprana; pacientes que llevan mayor tiempo de evolución de la epilepsia; epilepsia fármaco-resistente; crisis epilépticas generalizadas tónico-clónicas y epilepsias occipitales, tanto idiopáticas como sintomáticas38. En un estudio, Ito et al. encontraron que un 41% de pacientes con epilepsia del lóbulo temporal tenían cefalea postictal, un 40% en las epilepsias frontales y un 59% en las occipitales39.
La cefalea postictal suele aparecer 3-15 min después de la crisis epiléptica18,22 y puede acompañarse de vómitos y fotofobia. Su duración es variable, en general inferior a las 12 h, y la intensidad moderada, por lo que suele ser necesario indicar analgésicos14,40. La cefalea postictal que se presenta tras una crisis occipital requiere diagnóstico diferencial con la migraña con aura típica o la migraña basilar.
En general, la cefalea postictal es infraestimada e infratratada. Esto sucede porque desde el punto de vista sintomatológico es mucho más elocuente la manifestación epiléptica que el dolor. No obstante, limita de forma importante la calidad de vida de los pacientes que la presentan.
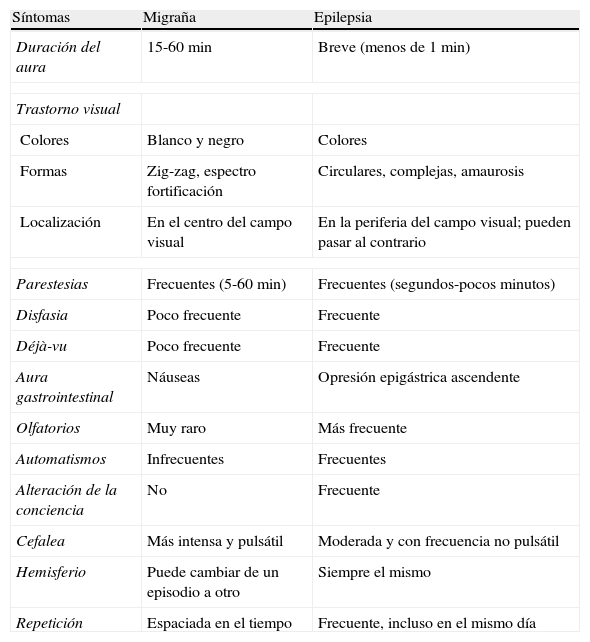
Diagnóstico diferencial entre crisis epilépticas y migraña: características clínicas y electroencefalográficasAspectos clínicosLos síntomas visuales de las crisis occipitales se confunden con auras visuales de migraña, a pesar de que en la mayoría de los casos existen características diferenciadoras relevantes (tabla 6). Las auras visuales de la migraña consisten en luces parpadeantes, no coloreadas, a menudo como líneas en zigzag que se inician en el centro del campo visual y progresan en 4-30 minutos hacia la periferia de un hemicampo y se siguen, frecuentemente, de un escotoma20. La duración total del aura suele ser igual o inferior a 60 min. En cambio, las alucinaciones visuales elementales de la epilepsia del lóbulo occipital son principalmente coloreadas y circulares, se desarrollan de forma rápida en cuestión de segundos y son de breve duración (2-3 min). Con frecuencia aparecen en la periferia de un hemicampo temporal, se ensanchan y multiplican durante la crisis y frecuentemente se mueven horizontalmente hacia el lado contralateral22. Sin embargo, no siempre es fácil distinguir entre migraña y epilepsia basándose en los criterios anteriores. El «síndrome de Alicia en el país de las maravillas», que puede presentarse como macro o micropsias, metamorfopsias o fenómenos de visión en zoom, se ha descrito tanto en epilepsias temporooccipitales como en migraña41.
Datos clínicos orientativos para el diagnóstico diferencial del aura en la migraña y en la epilepsia
| Síntomas | Migraña | Epilepsia |
| Duración del aura | 15-60 min | Breve (menos de 1 min) |
| Trastorno visual | ||
| Colores | Blanco y negro | Colores |
| Formas | Zig-zag, espectro fortificación | Circulares, complejas, amaurosis |
| Localización | En el centro del campo visual | En la periferia del campo visual; pueden pasar al contrario |
| Parestesias | Frecuentes (5-60 min) | Frecuentes (segundos-pocos minutos) |
| Disfasia | Poco frecuente | Frecuente |
| Déjà-vu | Poco frecuente | Frecuente |
| Aura gastrointestinal | Náuseas | Opresión epigástrica ascendente |
| Olfatorios | Muy raro | Más frecuente |
| Automatismos | Infrecuentes | Frecuentes |
| Alteración de la conciencia | No | Frecuente |
| Cefalea | Más intensa y pulsátil | Moderada y con frecuencia no pulsátil |
| Hemisferio | Puede cambiar de un episodio a otro | Siempre el mismo |
| Repetición | Espaciada en el tiempo | Frecuente, incluso en el mismo día |
Adaptado de Panayiotopoulos20, 1999.
El EEG no es útil en la evaluación rutinaria de una cefalea, pero el vídeo-EEG de 24 horas puede tener un papel en casos concretos. Marks y Ehrenberg3 emplearon esta técnica en dos pacientes con migralepsia; observaron cambios electrográficos atípicos para epilepsia durante el aura migrañosa, con actividad en salva de puntas que se asemejaba al EEG de una crisis epiléptica; pero en la mayoría de los casos esta actividad no mostraba la evolución temporal típica de la actividad epileptiforme ictal, con aumento y disminución progresivos en la frecuencia y amplitud42,43. El EEG durante el aura migrañosa puede también mostrar patrones «alternantes», separados por una actividad completamente normal a pesar de la persistencia de los síntomas clínicos44.
En los casos de cefalea epiléptica ictal publicados en la literatura27,30-33, el EEG durante la cefalea no ha mostrado un patrón específico, pudiendo consistir, bien en una actividad rítmica a 11-12Hz de alto voltaje con puntas intercaladas en la región témporo-occipital derecha32,33; bien en una actividad theta de alto voltaje intercalada con ondas agudas en la región occipital30,31 o en descargas de puntas y ondas lentas continuas bilaterales27. Durante la estimulación fótica intermitente, se han evocado respuestas fotoparoxísticas30 junto con cefalea pulsátil de intensidad leve31. En algunas ocasiones, podemos no encontrar anomalías en un EEG de superficie durante la cefalea ictal. Este hecho es frecuente en ciertos tipos de epilepsias, como en aquellas que se originan en un foco epiléptico profundo, por ejemplo de la región frontal órbitomesial2,36,45-47 o en síndromes epilépticos con manifestaciones autonómicas, como el síndrome de Panayiotopoulos20. Es decir, la ausencia de una clara actividad epiléptica punta-onda no descarta un diagnóstico de epilepsia. En estos casos, el uso de electrodos profundos mejora mucho la sensibilidad diagnóstica2.
Mecanismos patogénicos y genéticos comunes de migraña y epilepsiaSe desconocen en su totalidad las causas que explican la comorbilidad elevada entre cefalea (migraña en particular) y epilepsia. A pesar de que la fisiopatología de la secuencia migraña-epilepsia no está todavía bien esclarecida, se ha hipotetizado que el umbral de excitación cortical en migrañosos es menor que en sujetos sanos, favoreciendo por tanto, la aparición de crisis. Esta hiperexcitabilidad cerebral podría ser debida a varios factores, solos o en combinación, como alteraciones mitocondriales, trastornos en el metabolismo del magnesio o anomalías de los canales iónicos48.
La depresión cortical propagada (DCP) podría ser el nexo de unión entre migraña y epilepsia35,49. Este fenómeno consiste en una onda de despolarización neuronal y glial que, iniciándose en la corteza occipital, se propaga a una velocidad entre 2-5mm/min hacia regiones corticales anteriores. Durante la misma, se liberan mediadores químicos al espacio extra y perivascular, glutamato entre otros48. La DCP es capaz de activar el sistema trigémino-vascular (STV), induciendo la liberación de péptidos vasoactivos (CGRP y substancia P) en el área leptomeníngea, con lo que se produce la vasodilatación y la inflamación estéril causantes del dolor migrañoso48,50. El glutamato y los receptores NMDA también participan de forma activa en las crisis epilépticas5. Por otro lado, el mecanismo bioquímico de la DCP (pérdida transitoria de los gradientes iónicos de membrana y aumento de potasio extracelular, neurotransmisores y calcio intracelular) da lugar a un estado de hiperexcitabilidad local51.
Sin embargo, la mayoría de los casos de asociación temporal de la migraña con la epilepsia son, en realidad, crisis epilépticas occipitales genuinas. Se postula que las descargas críticas en los lóbulos occipitales desencadenan una migraña genuina poniendo en marcha el fenómeno de la DCP y activando el STV, así como otros mecanismos mediados por núcleos troncoencefálicos45.
La explicación fisiopatológica más plausible para la presencia de una migraña ictal es que el foco epiléptico que activa el STV posiblemente sea un foco puramente vegetativo cuya descarga se manifiesta con el desarrollo de una migraña35,45. O bien que sea un foco subclínico que pone en marcha la DCP activando el STV, pero cuyas descargas no alcanzan el umbral sintomático requerido para inducir manifestaciones sensitivo-motoras al no propagarse la despolarización subyacente a estas otras zonas corticales. En estos casos, la migraña sería la única manifestación epiléptica. Se ha postulado que el umbral requerido para el inicio de la DCP posiblemente sea más bajo que el requerido para el inicio de una crisis epiléptica35,45. De hecho, se sabe que las redes vegetativas centrales tienen un umbral más bajo de activación epileptogénica que aquellas que producen semiología cortical focal sensitivo-motora4,35. Esto explica por qué, en un contexto clínico, es más probable observar pacientes epilépticos con migraña peri/interictal que migrañosos con crisis epilépticas.
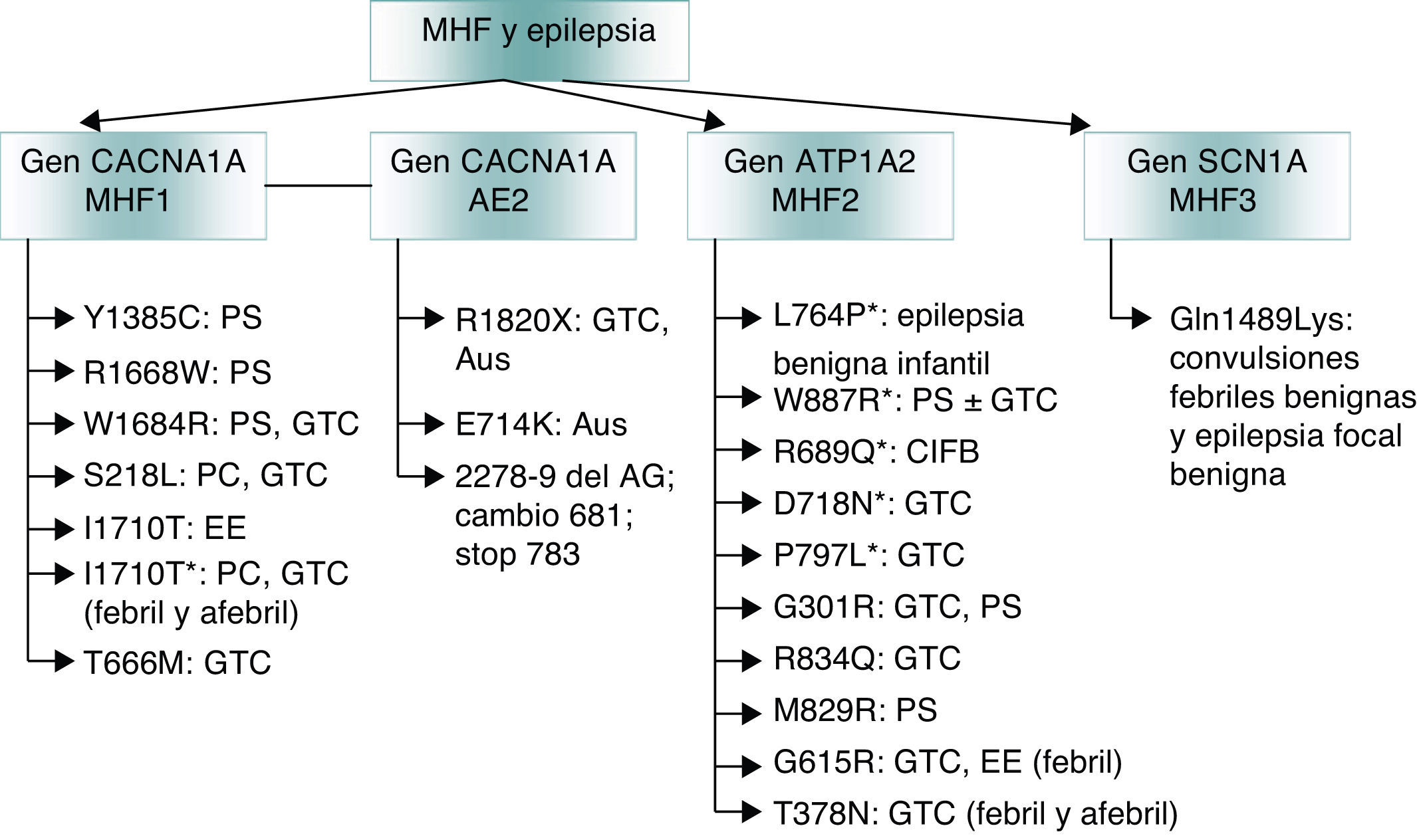
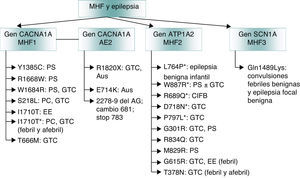
Finalmente, las mutaciones que originan canalopatías alteran la homeostasis iónica neuronal o glial, o afectan a los sistemas GABA-érgico o glutamatérgico o a las funciones mitocondriales, y pueden explicar la relación entre migraña y epilepsia. En el caso de la migraña hemipléjica familiar (MHF)52, una forma autosómica dominante de migraña con aura, se ha descrito la coexistencia de epilepsia en los tres subtipos genéticos de la misma (fig. 2)53:
- a)
El gen MHF1 CACNA1A (cromosoma 19p) codifica la subunidad formadora de poros Cav2.1 de los canales de calcio tipo P/Q54. Estas mutaciones podrían influir en la DCP, debido a que los canales de calcio tipo P/Q median la liberación de glutamato en las neuronas corticales55.
- b)
El gen MHF2 ATP1A2 (cromosoma 1q)56 codifica la subunidad α2 de una Na+/K+ ATPasa, responsable de bombear los iones de K+ al interior de la célula y los iones de Na+ al exterior57. La alteración del balance Na+/K+ desencadena la DCP.
- c)
El gen MHF3 SCN1A (cromosoma 2q24) se asocia con epilepsia58. Sus mutaciones pueden causar epilepsia genética con convulsiones febriles, síndrome de Dravet y otros raros síndromes epilépticos59. Se han descrito más de 150 mutaciones en este gen en familias con epilepsia60.
Mutaciones genéticas implicadas en la migraña hemipléjica familiar (MHF) asociadas a epilepsia. Adaptado de Haan J53.
*Crisis epilépticas independientes de los ataques de migraña hemipléjica.
AE2: ataxia episódica tipo 2; Aus: crisis de ausencia; CIFB: convulsiones infantiles familiares benignas; EE: estatus epiléptico; GTC: crisis generalizadas tónico-clónicas; MHF: migraña hemipléjica familiar; PC: crisis parciales complejas; PS: crisis parciales simples.
Además, se han descrito otras mutaciones genéticas que sugieren una relación entre migraña y epilepsia: mutaciones en SLC1A3, un miembro de la familia portadora de solutos que codifica el transportador 1 de aminoácidos excitatorios61, y POLG62 y C10orF263, genes que codifican la DNA polimerasa mitocondrial y la helicasa Twinkle, respectivamente.
TratamientoCuando un paciente tiene algún tipo de cefalea, sobre todo migrañas, y epilepsia es preferible elegir un fármaco eficaz para ambas enfermedades. Diversos estudios doble ciego controlados con placebo han demostrado la eficacia de fármacos antiepilépticos como el valproato sódico, el topiramato y la gabapentina, los dos primeros aprobados por la FDA para la profilaxis de migraña. Las dosis efectivas para migraña son habitualmente más bajas que para epilepsia; 500mg/día de valproato64,65, 1.200mg/día de gabapentina66 o 100mg/día de topiramato67,68 a menudo son suficientes. La lamotrigina es especialmente eficaz en el aura de los pacientes migrañosos, pero menos eficaz en la cefalea69. Otros antiepilépticos, como la pregabalina, el levetiracetam y la zonisamida han demostrado su eficacia en algunos estudios abiertos70-72. Los antiepilépticos son efectivos en el tratamiento de la migraña probablemente debido a su acción sobre la excitabilidad cerebral: el topiramato reduce la DCP en el cerebro de las ratas73 y en un estudio magnetoencefalográfico la excitabilidad neuronal se redujo tras 30 días de tratamiento con valproato sódico74. Sin embargo, un estudio de pacientes epilépticos con migrañas interictales no encontró superioridad de ningún antiepiléptico sobre otro para la prevención de las migrañas75. Por otra parte, la cefalea es uno de los efectos adversos más comunes de los antiepilépticos.
Algunos tratamientos preventivos para la migraña u otras cefaleas, como los antidepresivos tricíclicos y los neurolépticos, deberían evitarse pues disminuyen el umbral epileptógeno76. En los últimos años, también se ha sugerido que la estimulación del nervio vago puede tener un efecto preventivo sobre la migraña en pacientes epilépticos. En 2 estudios de 4 y 10 pacientes epilépticos con migraña, el 75 y el 80%, respectivamente, presentaron una mejoría en la frecuencia de sus migrañas tras la implantación de los estimuladores77,78.
Por último, entre un 66-90% de pacientes con cefalea poscrítica pueden beneficiarse del tratamiento con analgésicos15,16,79. Además, se han utilizado triptanes con eficacia en algunos pacientes con cefalea poscrítica migrañosa80,81.
ConclusionesSe necesitan más estudios que aclaren la asociación entre cefalea/migraña y epilepsia. De momento, se propone suprimir el término de migralepsia, al no quedar claro que refleje un concepto con entidad nosológica propia. Es necesario también llegar a un acuerdo respecto a la terminología más apropiada que todos deberíamos usar. Mientras tanto, Verrotti et al.24 hacen la siguiente propuesta para inclusión en las próximas clasificaciones, tanto por parte de la IHS como por parte de la ILAE.
- –
El término de cefalea epiléptica ictal debería ser usado para clasificar episodios en los cuales la cefalea representa la única manifestación epiléptica ictal. La cefalea epiléptica ictal sería un tipo de «epilepsia vegetativa».
- –
El término hemicránea epiléptica debería de mantenerse en las clasificaciones para todos aquellos casos en los cuales una cefalea epiléptica ictal coexiste y se asocia con otros eventos ictales sensitivo-motores que se presentan síncrona o secuencialmente.
Se aconseja realizar, de forma ideal, un EEG ictal durante el ataque de migraña ante todo paciente que presente características clínicas de migraña y de epilepsia, para demostrar (incluso aunque no siempre sea posible) el mecanismo patogénico subyacente de estos episodios2,47. No obstante, a menudo nos enfrentamos con que lo ideal no es lo posible.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.