En la práctica clínica la evaluación del paciente con enfermedad de Parkinson (EP) es compleja y lleva tiempo. El presente estudio pretende comparar de forma rigurosa y objetiva la evaluación motora del paciente con EP realizada por el neurólogo experto frente a la enfermera especializada de la Unidad de Parkinson.
MétodosEstudio observacional, transversal, monocéntrico en el que se incluyó a 50 pacientes con EP (52% varones, 64,7±8,7 años), que fueron evaluados entre el 05 de enero del 2016 y el 20 de julio del 2016. El neurólogo y la enfermera evaluaron a los pacientes desde el punto de vista motor mediante el uso de las escalas de Hoehn&Yahr (H&Y) modificada, Unified Parkinson's Disease Rating Scale part-iii (UPDRS-III) y part-iv (UPDRS-IV) en el mismo estado motor (48 en OFF y 2 en ON) de forma protocolizada a primera hora de la mañana. Se utilizó el coeficiente de correlación intraclase (CCI) para medir la variabilidad.
ResultadosEl H&Y fue el mismo según ambos evaluadores en 49 de los 50 casos. No hubo grandes diferencias entre el tiempo empleado por ambos evaluadores. El CCI para la UPDRS-IV fue de 0,955 (p<0,0001) y para la UPDRS-III de 0,954 (p<0,0001). La mayor variabilidad en la UPDRS-III fue para el ítem 29 (marcha) con un CCI de 0,746 (p<0,0001) y la menor para el ítem 30 (reflejos posturales) con un CCI de 0,918 (p<0,0001).
ConclusiónLa evaluación motora de los pacientes con EP realizada por una enfermera entrenada es superponible a la del neurólogo experto y empleando un tiempo similar.
In clinical practice, assessing patients with Parkinson's disease (PD) is a complex, time-consuming task. Our purpose is to provide a rigorous and objective evaluation of how motor function in PD patients is assessed by neurologists specialising in movement disorders, on the one hand, and by nurses specialising in PD management, on the other.
MethodsWe conducted an observational, cross-sectional, single-centre study of 50 patients with PD (52% men; mean age: 64.7 ± 8.7 years) who were assessed between 5 January 2016 and 20 July 2016. A neurologist and a nurse evaluated motor function in the early morning hours using the Unified Parkinson's Disease Rating Scale (UPDRS) parts III and IV and Hoehn & Yahr (H&Y) scale. Tests were administered in the same PD periods (in 48 patients during the ‘off’ time and in 2 patients during the ‘on’ time). Inter-rater variability was estimated with the intraclass correlation coefficient (ICC).
ResultsForty-nine patients (98%) were classified in the same H&Y stage by both raters. Assessment times were similar for both raters. ICC for UPDRS-IV and UPDRS-III total scores were 0.955 (P<.0001) and 0.954 (P<.0001), respectively. The greatest variability was found for UPDRS-III item 29 (gait; ICC=0.746; P<.0001) and the lowest, for item 30 (postural stability; ICC=0.918; P<.0001).
ConclusionsMotor function assessment of PD patients by a trained nurse is equivalent to that made by an expert neurologist and takes the same time to complete.
La enfermedad de Parkinson (EP) es un trastorno frecuente y muchas veces complejo, siendo fundamental un buen conocimiento de la misma para poder tomar las mejores decisiones en cuanto al diagnóstico y tratamiento en la práctica clínica habitual. Los pacientes con EP presentan muchos síntomas y el grado de afectación y la evolución así como la respuesta al tratamiento puede ser muy variable. Actualmente, hay muchas escalas validadas disponibles que nos permiten poder conocer con mayor detalle el grado de afectación del paciente con respecto a diferentes síntomas como pueden ser los síntomas motores (temblor, rigidez, bradicinesia, etc.), síntomas no motores (fatiga, dolor, trastornos del sueño, síntomas cognitivos, depresión, ansiedad, apatía, trastorno del control de impulsos, psicosis, etc.) o bien su grado de autonomía y calidad de vida1,2. Sin embargo, uno de los problemas en la práctica clínica es la falta de tiempo para poder llevar a cabo dichas evaluaciones, siendo lo ideal el poder disponer de un equipo multidisciplinar que evalúe al paciente y que así se vea facilitado el trabajo de cada una de las partes con el objetivo de poder tomar en conjunto las mejores decisiones3,4. En este aspecto, la labor del personal de enfermería especializado en la EP debe considerarse fundamental y se piensa que dicho personal debe desempeñar una función clave en el manejo asistencial integral de pacientes con Parkinson5,6.
Mientras que la evaluación no motora se basa muchas veces en escalas subjetivas (respuesta del paciente sobre la base de su percepción sobre una pregunta alusiva a un síntoma que se le plantea), la evaluación motora es objetiva y se puntúa lo que se observa en la exploración en ese momento. Dicha evaluación puede resultar muy compleja, siendo útil el uso de escalas, como la parte iii de la Unified Parkinson's Disease Rating Scale (UPDRS-III; parte motora) y la parte iv (UPDRS-IV; complicaciones motoras)7. Una evaluación motora bien realizada (conocer a lo largo del día cuánto tiempo OFF, tiempo ON o tiempo con discinesias discapacitantes presenta el paciente, el grado de afectación motora durante el OFF y/o ON, signos axiales, etc.) nos ayuda en la toma de decisiones con respecto al tratamiento y, sin duda, disponer de personal que pueda llevar a cabo esta evaluación facilitaría al neurólogo la consulta y le permitiría disponer de más tiempo con otros fines (explicar al paciente, preguntar por otros síntomas, etc.). Sin embargo, es absolutamente prioritario estar seguros de que esa evaluación es correcta si vamos a tomar decisiones a partir de la misma.
El objetivo del presente trabajo es comparar de forma rigurosa y objetiva la evaluación motora del paciente con EP realizada por el neurólogo experto en Parkinson frente a la realizada por la enfermera especialista de la Consulta de Trastornos del Movimiento (CTM).
Material y métodosSe trata de un estudio observacional, descriptivo, no intervencionista, transversal, en el cual se incluyó a pacientes con EP participantes del estudio COPPADIS-20158 que fueron evaluados en la CTM del Hospital Arquitecto Marcide del Complejo Hospitalario Universitario de Ferrol (CHUF) entre enero y julio del 2016. Los criterios de inclusión fueron: 1) diagnóstico de EP según los criterios del Banco de Cerebros de Londres9; 2) edad comprendida entre los 18 y los 75 años; 3) capacidad para poder responder a los cuestionarios, y 4) deseo de participar de forma voluntaria. Se excluyó a los pacientes con bomba de infusión (levodopa enteral y/o apomorfina) y cirugía (estimulación cerebral profunda), otras causas de parkinsonismo y con demencia según criterios de la Movement Disorder Society (MMSE<26/30)10.
El neurólogo experto en Parkinson (DSG; evaluación de entre 60 y 90 pacientes al mes con EP en la CTM desde el año 2009) realizaba una primera evaluación motora que incluía por este orden: 1) UPDRS-IV7; 2) UPDRS-III7 y clasificación del estadio motor modificado de Hoehn&Yahr (H&Y)11. Una vez que el neurólogo acababa la exploración, en el menor tiempo posible (con intención de que el estado motor fuera el mismo) la enfermera experta de la CTM (TdDF; enfermera especialista de la CTM del CHUF desde el 2013) realizaba la evaluación motora con la misma secuencia en la aplicación de las escalas. Se calculó el tiempo de evaluación en aplicar la UPDRS-IV y UPDRS-III, tanto por parte del neurólogo como por parte de la enfermera. La evaluación de uno y otra fue ciega, de tal forma que ni el neurólogo ni la enfermera conocían la valoración de su compañero. Se recogieron variables epidemiológicas, sobre la enfermedad y el tratamiento.
El estudio (titulado Motor Evaluation Comparison bEtween Neurologist and speziAliced nurSe [MECENAS]) fue clasificado por la AEMPS como no estudio postautorización (no EPA), fue aprobado por el Comité Ético de Investigación Clínica de A Coruña-Ferrol y por la gerencia de nuestro centro. Todos los pacientes participantes firmaron el correspondiente consentimiento informado. Aunque los pacientes incluidos fueron participantes del estudio COPPADIS-2015, no había incompatibilidades por protocolo entre un estudio y otro. El estudio MECENAS fue específicamente diseñado para evaluar su objetivo «a priori» y los pacientes incluidos cumplían los criterios con esta finalidad.
Los datos fueron analizados con el programa estadístico SPSS 21.0. El análisis estadístico fue llevado a cabo por DSG. Las variables cuantitativas se expresan como media±desviación estándar. Las variables cualitativas se expresan como porcentaje (%). Se utilizó el coeficiente de correlación intraclase (CCI)12 para estudiar la variabilidad entre las evaluaciones en sus diferentes ítems. Se compararon puntuaciones globales de las escalas y sumatorios de diferentes ítems para valorar variabilidad en diferentes signos o complicaciones: UPDRS-IV.32 a UPDRS-IV.35, discinesias; UPDRS-IV.36 a UPDRS-IV.39, fluctuaciones motoras; UPDRS-IV.40 a UPDRS-IV.42, otras complicaciones; UPDRS-III.18, lenguaje; UPDRS-III.19, hipomimia; UPDRS-III.20 y UPDRS-III.21, temblor; UPDRS-III.22, rigidez; UPDRS-III.23 a UPDRS-III.27, cinesia fina; UPDRS-III.28, postura; UPDRS-III.29, marcha; UPDRS-III.30, estabilidad postural; UPDRS-III.31, cinesia global. Se utilizó el cálculo del índice Kappa de Cohen13 para comparar la concordancia en la clasificación de la EP de acuerdo con el estadio modificado de H&Y y en la identificación de pacientes con fluctuaciones motoras y/o discinesias frente a aquellos sin ellas. Fueron considerados como significativos aquellos valores para una p<0,05.
ResultadosSe incluyó a 50 pacientes con EP (52% varones; edad media de 64,7±8,7 años) entre el 5 de enero y el 20 de julio del 2016. Por meses, los pacientes incluidos fueron: 8 en enero, 6 en febrero, 8 en marzo, 6 en abril, 8 en mayo, 11 en junio y 3 en julio. De los 50 pacientes, 48 fueron evaluados en estado OFF medicación (todos a primera hora, entre las 8 y 9 h, sin tomar medicación en las 12 h previas) y 2 en estado ON medicación (por la mañana, en su mejor ON después de recibir medicación). El tiempo medio entre la evaluación realizada por el neurólogo (inicio) y la enfermera (inicio) fue de 30,8±14,3 min.
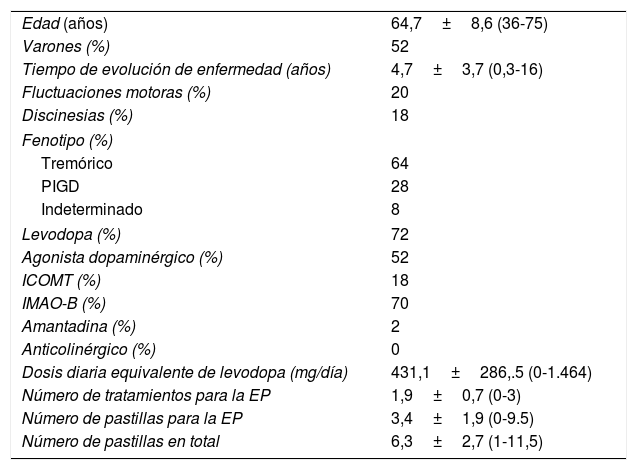
El tiempo medio de evolución de enfermedad fue algo menor de 5 años y aproximadamente uno de cada 5 pacientes tenían complicaciones motoras (20% fluctuaciones motoras y 18% discinesias). El fenotipo14 tremórico fue el más frecuente y la medicación más frecuentemente recibida levodopa (72%), seguida de un inhibidor de la monoanminooxidasa B (IMAO-B) (70%). La tabla 1 muestra algunas características relacionadas con la enfermedad y medicación recibida.
Características de la muestra de pacientes (n=50); valores expresados en porcentaje y/o media±desviación estándar (rango)
| Edad (años) | 64,7±8,6 (36-75) |
| Varones (%) | 52 |
| Tiempo de evolución de enfermedad (años) | 4,7±3,7 (0,3-16) |
| Fluctuaciones motoras (%) | 20 |
| Discinesias (%) | 18 |
| Fenotipo (%) | |
| Tremórico | 64 |
| PIGD | 28 |
| Indeterminado | 8 |
| Levodopa (%) | 72 |
| Agonista dopaminérgico (%) | 52 |
| ICOMT (%) | 18 |
| IMAO-B (%) | 70 |
| Amantadina (%) | 2 |
| Anticolinérgico (%) | 0 |
| Dosis diaria equivalente de levodopa (mg/día) | 431,1±286,.5 (0-1.464) |
| Número de tratamientos para la EP | 1,9±0,7 (0-3) |
| Número de pastillas para la EP | 3,4±1,9 (0-9.5) |
| Número de pastillas en total | 6,3±2,7 (1-11,5) |
DE: desviación estándar; EP: enfermedad de Parkinson; ICOMT: inhibidor de la catecol-orto-metiltransferasa; IMAO-B: inhibidores de la monoanminooxidasa B.
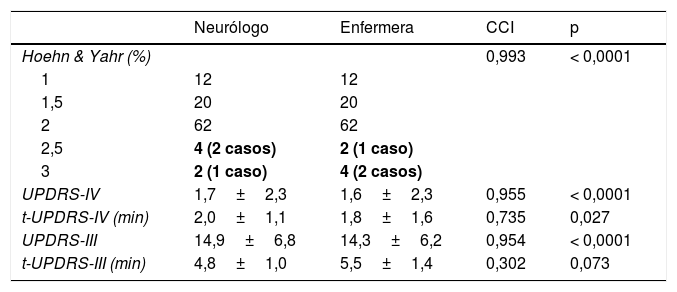
En 49 de los 50 casos (98%) el paciente fue clasificado en el mismo estadio de H&Y, tanto por parte del neurólogo como de la enfermera, siendo el índice Kappa de Cohen de 0,964 (p<0,0001). El caso no coincidente fue clasificado por parte del neurólogo como estadio 2,5 y en cambio como estadio 3 por la enfermera (tabla 2). El valor medio de la UPDRS-IV y UPDRS-III fue muy similar en ambos casos (neurólogo vs. enfermera): UPDRS-IV, 1,7±2,3 vs. 1,6±2,3; UPDRS-III, 14,9±6,8 vs. 14,3±6,2 (tabla 2). La variabilidad fue mínima en el cálculo del H&Y, UPDRS-IV y UPDRS-III, siendo en todos los casos el CCI superior a 0,950 (p<0,0001). Con respecto al tiempo de evaluación, el tiempo en aplicar la UPDRS-IV fue significativamente mayor en el caso del neurólogo (en minutos, 2,0±1,1 vs. 1,8±1,6; p=0,027) y no hubo diferencias significativas en el caso de la UPDRS-III (en minutos, 4,8±1,0 vs. 5,5±1,4; p=0,073) (tabla 2).
Variabilidad entre neurólogo y enfermera en la clasificación de Hoenh&Yahr y las puntuaciones totales de la UPDRS-III y UPDRS-IV y tiempos de evaluación
| Neurólogo | Enfermera | CCI | p | |
|---|---|---|---|---|
| Hoehn & Yahr (%) | 0,993 | < 0,0001 | ||
| 1 | 12 | 12 | ||
| 1,5 | 20 | 20 | ||
| 2 | 62 | 62 | ||
| 2,5 | 4 (2 casos) | 2 (1 caso) | ||
| 3 | 2 (1 caso) | 4 (2 casos) | ||
| UPDRS-IV | 1,7±2,3 | 1,6±2,3 | 0,955 | < 0,0001 |
| t-UPDRS-IV (min) | 2,0±1,1 | 1,8±1,6 | 0,735 | 0,027 |
| UPDRS-III | 14,9±6,8 | 14,3±6,2 | 0,954 | < 0,0001 |
| t-UPDRS-III (min) | 4,8±1,0 | 5,5±1,4 | 0,302 | 0,073 |
CCI: coeficiente de correlación intraclase; t: tiempo; UPDRS: Unified Parkinson's Disease Rating Scale.
En negrita, los únicos casos no coincidentes.
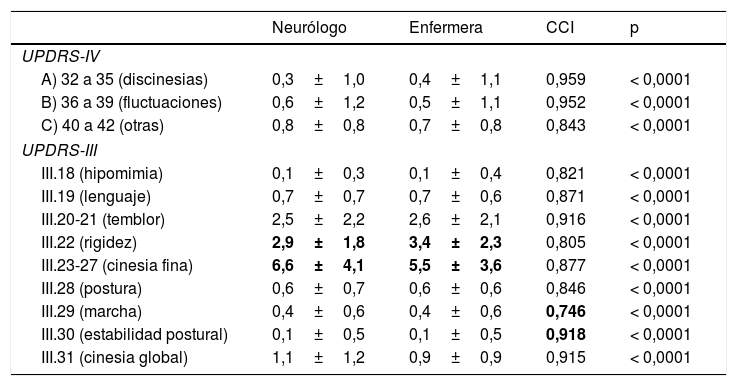
Finalmente, analizando de forma individualizada los ítems de las escalas UPDRS-IV y UPDRS-III con respecto a los diferentes signos o complicaciones que evalúan, observamos que la variabilidad en todos los casos fue baja, habiendo un CCI mayor de 0,740 en todos los casos (p<0,0001 en todos los casos). En el caso de la UPDRS-IV la mayor variabilidad fue para los ítems 40 a 42, que evalúan «otras complicaciones» (náuseas, alteraciones del sueño y ortostatismo) diferentes de las fluctuaciones y discinesias (ICC mayor de 0,950 en ambos casos; p<0,0001), donde el CCI fue de 0,843 (p<0,0001) (tabla 3). Hubo poca variabilidad en la identificación de los pacientes como fluctuantes y/o discinéticos (índice Kappa de Cohen de 0,875 y 0,703, respectivamente; p<0,0001 para ambas). Con respecto a la UPDRS-III, las mayores diferencias en cuanto a las puntuaciones medias entre ambas evaluaciones fueron observadas en rigidez y cinesia fina, con una mayor puntuación de la rigidez por la enfermera y de la cinesia fina por el neurólogo (tabla 3). Sin embargo, la mayor variabilidad fue observada en la marcha (UPDRS-III.29) (CCI 0,746; p<0,0001) y la menor en la estabilidad postural (UPDRS-III.30) (CCI 0,918; p<0,0001) (tabla 3).
Variabilidad entre neurólogo y enfermera en las puntuaciones de la UPDRS-III y UPDRS-IV por síntomas y/o signos (puntuaciones parciales de las escalas)
| Neurólogo | Enfermera | CCI | p | |
|---|---|---|---|---|
| UPDRS-IV | ||||
| A) 32 a 35 (discinesias) | 0,3±1,0 | 0,4±1,1 | 0,959 | < 0,0001 |
| B) 36 a 39 (fluctuaciones) | 0,6±1,2 | 0,5±1,1 | 0,952 | < 0,0001 |
| C) 40 a 42 (otras) | 0,8±0,8 | 0,7±0,8 | 0,843 | < 0,0001 |
| UPDRS-III | ||||
| III.18 (hipomimia) | 0,1±0,3 | 0,1±0,4 | 0,821 | < 0,0001 |
| III.19 (lenguaje) | 0,7±0,7 | 0,7±0,6 | 0,871 | < 0,0001 |
| III.20-21 (temblor) | 2,5±2,2 | 2,6±2,1 | 0,916 | < 0,0001 |
| III.22 (rigidez) | 2,9±1,8 | 3,4±2,3 | 0,805 | < 0,0001 |
| III.23-27 (cinesia fina) | 6,6±4,1 | 5,5±3,6 | 0,877 | < 0,0001 |
| III.28 (postura) | 0,6±0,7 | 0,6±0,6 | 0,846 | < 0,0001 |
| III.29 (marcha) | 0,4±0,6 | 0,4±0,6 | 0,746 | < 0,0001 |
| III.30 (estabilidad postural) | 0,1±0,5 | 0,1±0,5 | 0,918 | < 0,0001 |
| III.31 (cinesia global) | 1,1±1,2 | 0,9±0,9 | 0,915 | < 0,0001 |
CCI: coeficiente de correlación intraclase; UPDRS: Unified Parkinson's Disease Rating Scale.
En negrita se muestran los datos con mayor diferencia entre las puntuaciones medias (neurólogo respecto a enfermera) así como el valor de la p más alto y bajo indicativos de en que ítems hubo la menor y mayor variabilidad, respectivamente.
El presente trabajo demuestra que una enfermera especializada en la EP puede realizar la evaluación motora del paciente de forma similar a como la realiza un neurólogo experto en trastornos del movimiento. En este caso, la variabilidad fue mínima, siendo ambas evaluaciones superponibles en lo referente a la clasificación del estadio motor de H&Y y las puntuaciones en las escalas UPDRS-III y UPDRS-IV e invirtiendo un tiempo similar. Sobre la base de estos hallazgos, podría considerarse en determinados casos que la enfermera asumiera ciertas funciones complementarias a su labor habitualmente establecida15,16 con intención de facilitar el trabajo al neurólogo especialista y permitirle, entre otras cosas, disponer de más tiempo que pueda dedicar al paciente. En otras palabras, en la práctica podría implementarse esta función por parte de la enfermera, tanto en la labor asistencial diaria como en las valoraciones dentro de estudios de investigación.
El personal de enfermería especializado en EP tiene una función activa y reconocida en algunos países como Reino Unido desde los años 9017,18 y ha ido cobrando mayor importancia en otros países16. Además de la función que le compete como personal de enfermería, la enfermera especializada en Parkinson debe llevar a cabo otras funciones muy importantes, como informar y educar sobre la enfermedad y terapias al paciente y cuidador, asegurarse de la adecuada adherencia al tratamiento, resolver dudas o problemas que puedan surgir, o un adecuado manejo de dispositivos en pacientes con terapias de segunda línea (estimulación cerebral profunda y bombas de infusión)19-22. La labor de la enfermería especializada permite reducir tiempos de espera, evitar hospitalizaciones innecesarias o reducir los tiempos poscirugía, y así programas de teleconsulta con la enfermera experta como primer contacto están siendo desarrollados con éxito23,24. Incluso ensayos aleatorizados han demostrado un coste-efectividad similar por parte del personal de enfermería al de los médicos generalistas25. En este sentido, en España se han elaborado recientemente propuestas sobre un Plan de Atención Integral al paciente con EP que recoge la función capital de la enfermera como gestora de casos26. Sin embargo, el número de enfermeras especializadas en EP es deficitario con respecto a las recomendaciones23, a pesar de que se haya demostrado que su presencia reduce a la larga costes en el sistema y sobrecarga del neurólogo23, siendo necesarias el desarrollo de iniciativas para que los enfermos puedan acceder a este tipo de atención27-29.
Una enfermera entrenada puede llevar a cabo la evaluación de aspectos no motores, que generalmente consiste en recoger la respuesta subjetiva del paciente a diferentes preguntas sobre síntomas concretos8,30,31, pero también de la parte motora, que es objetiva sobre la base de una exploración en un momento dado. Los resultados de nuestro trabajo en general coinciden con publicaciones previas32-34. Bennet et al.32 observaron mínima variabilidad entre 3 enfermeras que evaluaron con la UPDRS-III a 75 pacientes con EP (CCI>0,97 en todos los casos) y también entre ellas y un neurólogo experto (CCI>0,90 en la puntuación total, variando según el dominio entre el 0,76 y 0,95). Post et al.33 estudiaron la variabilidad en las puntuaciones de la UPDRS-III administrada a 50 pacientes con EP por 2 enfermeras y 2 residentes de Neurología con respecto a un especialista en trastornos del movimiento, observado un CCI de 0,91 (enfermera 1) y 0,90 (enfermera 2), que fue similar al de los residentes (0,90 y 0,86). Finalmente, Palmer et al.34 observaron en 46 pacientes con enfermedad de Alzheimer una moderada concordancia entre la exploración motora con la UPDRS-III por parte de la enfermera y el neurólogo, siendo el valor del CCI de 0,65 y del índice Kappa (normalidad al pasar la escala vs alguna alteración) de 0,53, lo cual sugiere que puede resultar en ocasiones en pacientes menos afectados o sin EP conocida difícil distinguir entre lo que es normal y lo que no (p. ej., bradicinesia)34,35. En nuestro estudio la mayor variabilidad se encontró con la marcha (UPDRS-III.29) y la menor con los reflejos posturales (UPDRS-III.30), habiendo baja variabilidad en rigidez y bradicinesia fina (CCI>0,80 en ambos casos) pero con puntuaciones medias algo diferentes que indican una mayor tendencia por parte de la enfermera a puntuar la rigidez y por parte del neurólogo a hacer lo propio con la bradicinesia fina. En otros estudios también parece que la menor variabilidad la observan en los reflejos posturales33, siendo esto importante porque es algo fundamental a la hora de clasificar al paciente en el estadio motor de H&Y. En general, todos estos datos son similares a la variabilidad que puede existir entre evaluaciones realizadas por neurólogos expertos en trastornos del movimiento36.
Con respecto a todos los trabajos previos, el presente estudio no solo evalúa la variabilidad en la parte motora de la UPDRS, sino también por primera vez la parte iv, referente a las complicaciones motoras y también los tiempos de evaluación, observando que hay una concordancia máxima entre neurólogo y enfermera a la hora de detectar a pacientes con fluctuaciones motoras y/o discinesias, y que en general la administración de la UPRDS-III supone unos 5 min de tiempo y la parte iv unos 2 min; aunque hubo una tendencia a un mayor tiempo empleado por la enfermera en administrar la UPDRS-III, no fue significativo y es cierto que fue muy variable dependiendo del paciente porque el CCI fue bajo (CCI 0,302); por contra, el menor tiempo (p=0,027) empleado para la UPDRS-IV por su parte probablemente tuvo que ver con que antes el neurólogo había interrogado al paciente y sus respuestas estaban más claras y resultaron más rápidas. Estos datos son fundamentales ya que indican que una enfermera entrenada no solo puede calcular el grado de afectación motora del paciente, sino identificar las complicaciones motoras y con diarios que se usan en la práctica clínica podría proporcionar toda la información al especialista capital para decidir ajustes del tratamiento: tiempo y horas del día en OFF y ON, y con discinesias discapacitantes, grado de afectación durante el OFF y el ON, y horario de las tomas.
El presente estudio tiene algunas limitaciones. No se calculó la variabilidad intraobservador. Las evaluaciones se realizaron con una diferencia en el tiempo de menos de 30 min pero en diferentes salas (una a 10 m de la otra pero con diferente distribución física). Aunque el neurólogo (DSG) ha obtenido competencias para administrar el uso de la UPDRS (en el contexto de su participación en estudios internacionales fase iv), no se puede descartar un sesgo en la evaluación de la enfermera debido al aprendizaje adquirido con el neurólogo. Finalmente, este estudio no permite asegurar la capacidad de la enfermera en la evaluación motora de pacientes en ensayos clínicos o estudios longitudinales. Por contra, se diseñó y ejecutó específicamente con el objetivo propuesto y aporta novedades como la variabilidad en cuanto a la administración de la parte iv de la UPDRS (complicaciones motoras).
En conclusión, el presente trabajo demuestra que la evaluación motora de los pacientes con EP realizada por una enfermera entrenada puede ser superponible a la del neurólogo experto y empleando para ello un tiempo similar, algo que se debería tener en cuenta a la hora de planificar la actividad asistencial y el manejo de los pacientes en las UTM, dándole más peso participativo a la enfermera en beneficio de reducir la carga de trabajo del neurólogo para disponer este de más tiempo y poder atender a otros aspectos de la enfermedad y/o atención de los pacientes.
AutoríaTeresa de Deus Fonticoba: evaluación de pacientes; revisión y crítica del manuscrito.
Diego Santos García, MD, PhD: evaluación de pacientes; concepción, organización y ejecución del proyecto; escritura del primer manuscrito.
Mercedes Macías Arribí: evaluación de pacientes; revisión y crítica del manuscrito.
Conflicto de interesesLos autores no reportamos conflicto de intereses. No hemos recibido ningún honorario por la realización del presente trabajo.