Estudiar la influencia de diversos factores en la calidad de vida relacionada con la salud (CVRS) de los pacientes tras un infarto cerebral (IC), con especial atención a los trastornos psicopatológicos (TP).
Pacientes y métodosEstudio observacional prospectivo sobre 45 pacientes ingresados por IC, evaluados a las 4, 12 y 26 semanas del evento agudo. Se recogieron antecedentes y datos sociodemográficos previos, se utilizó la escala SF-36 para la valoración de la CVRS, para la valoración psicopatológica, cognitiva, neurológica y funcional se utilizó el inventario neuropsiquiátrico (NPI), MMSE, escala de Canadá, escala de Rankin modificada y otras escalas. Para determinar los posibles factores predictivos de las puntuaciones del SF-36 a las 26 semanas se realizó un estudio de regresión lineal, introduciendo como variables independientes los antecedentes médicos y psiquiátricos, las características sociodemográficas y la evaluación funcional, neuropsicológica y psicopatológica a las 4 semanas.
ResultadosSe obtuvieron modelos predictivos válidos para todos los índices del SF-36, en los que el antecedente de depresión, las puntuaciones más altas en el NPI y la escala de Rankin, y más baja en la escala canadiense fueron los principales indicadores predictivos de una peor CVRS a largo plazo. El distrés del cuidador asociado a la psicopatología del paciente (medido a través del NPI) tuvo una influencia negativa sobre el índice de función social.
ConclusionesLos TP y la situación funcional fueron los principales determinantes de la CVRS de los pacientes tras un IC.
To study the influence of various factors on the health related quality of life (HRQOL) of patients who have suffered a brain infarction (BI), with special attention to psychopathological disorders (PD).
Patients and methodsProspective observational study on 45 patients admitted due to a BI, evaluated at 4, 12 and 26 weeks of the acute event. Social and demographic data, and medical history were collected; the SF-36 scale was used for the assessment of HRQOL, and the Neuropsychiatric Inventory (NPI), MMSE, Canadian Neurological Scale, Modified Rankin Scale and other instruments for assessing psychopathological, cognitive, neurological and functional status. A linear regression analysis was performed to identify potential predictors of the SF-36 scores at 26 weeks, introducing, as independent variables, medical and psychiatric history, demographic characteristics and the functional, neuropsychological and psychopathological assessments at 4 weeks.
ResultsValid predictive models for all the SF-36 domains were obtained, in which a history of pre-morbid depression, higher scores in the NPI and Rankin Scale, and lowest in the Canadian Neurological Scale were the main predictors of a worse HRQOL in the long term. Psychopathology related caregiver's distress (assessed with the NPI) was associated with a lower score in the social function index.
ConclusionsPDs and functional status were the main determinants of HRQOL in patients with BI.
La calidad de vida relacionada con la salud (CVRS) es una medida fundamental para valorar la repercusión real sobre el individuo de una enfermedad. El infarto cerebral (IC) es una dolencia neurológica aguda y grave, que puede dar lugar a deficiencias sensorio-motoras, cognitivas y psicopatológicas que, junto con las circunstancias personales y sociales del paciente, determinarán su CVRS1.
La medición de la CVRS es compleja, ya que está influida por aspectos como las experiencias previas, expectativas, creencias y percepciones subjetivas; sin embargo, existe un consenso en que deben valorarse al menos 4 dimensiones: física (síntomas físicos), funcional (actividades básicas e instrumentales), psicológica (funcionamiento cognitivo, emocional, satisfacción vital, percepción de la salud) y social (interacción del sujeto con su entorno)2. El cuestionario de salud Short Form 36 (SF-36)3 es un instrumento genérico que contempla todos estos aspectos y ha sido ampliamente utilizado para el estudio de la CVRS en el ictus; además, su difusión entre la comunidad científica permite la comparación de sus resultados.
La CVRS de los pacientes con ictus ha sido relacionada en estudios previos con múltiples factores, como las características del IC (localización, extensión o etiología)4–6, la depresión post-ictus7–9, el deterioro cognitivo (DC)4,6,10 o las estrategias de afrontamiento utilizadas por el paciente11. Sin embargo, en la mayor parte de los estudios el factor más determinante de la CVRS es la situación funcional del paciente5,9,12–14.
Existen pocos estudios en los que se analice la influencia conjunta sobre la CVRS de las distintas áreas afectadas tras un ictus: cognitiva, sensorio-motora, funcional y psicopatológica; ni de qué forma es posible predecir, a partir de los antecedentes del paciente y su situación clínica inicial, como será la evolución de su CVRS a largo plazo15. En cuanto a los trastornos psicopatológicos (TP), la mayor parte de los estudios que han abordado este tema se han centrado en los trastornos afectivos, principalmente en la depresión7,8,13. Aunque este es sin duda el TP más común en pacientes con ictus, existen otros también frecuentes y con gran influencia sobre la recuperación post-ictus, como la apatía16, y la repercusión de la situación psicopatológica global sobre la CVRS no ha sido estudiada. Finalmente, la mayor parte de los estudios sobre CVRS en el ictus incluyen pacientes con diferentes tipos de ictus, incluidos infartos y hemorragias cerebrales, e incluso accidentes isquémicos transitorios13, a pesar de su diferente pronóstico17.
Los objetivos de este estudio fueron analizar la evolución de la CVRS en los 6 meses siguientes al IC, así como la detección de posibles indicadores predictivos de la CVRS a las 26 semanas del evento vascular, tomando como referencia los antecedentes del paciente, la localización del IC y la situación funcional, cognitiva y psicopatológica a las 4 semanas del ictus.
Pacientes y métodosParticipantesSe realizó un estudio prospectivo sobre una muestra de 45 pacientes de raza caucasiana ingresados consecutivamente por probable ictus isquémico, a cargo de la unidad de neurología de nuestro centro, y evaluados en cuatro momentos diferentes: al ingreso, y a las 4, 12 y 26 semanas del evento. Los pacientes fueron reclutados entre mayo de 2007 y diciembre de 2008, a partir de una muestra de 55 pacientes incluidos en un estudio sobre TP en el IC18, de los cuales 45 pacientes no cumplían ningún criterio de exclusión.
Criterios de inclusión/exclusiónSe incluyó a todos los pacientes consecutivos con IC —con o sin transformación hemorrágica— que disponían de un cuidador responsable, aceptaron participar en el estudio y no cumplían ninguno de los siguientes criterios de exclusión: hemorragia cerebral o sospecha de otro proceso como causa de la lesión cerebral (tumor u otros); accidente isquémico transitorio; situación de coma o alteración grave del estado de conciencia transcurridas 4 semanas desde el ictus; defunción antes de las 26 primeras semanas después del ictus; ausencia de lesión vascular isquémica identificable en las pruebas de neuroimagen transcurridas 4 semanas desde el ictus; aparición de una nueva lesión cerebral antes de las 26 semanas desde el ictus (recurrencia de IC, hemorragia cerebral o traumatismo cráneo-encefálico); antecedentes de demencia o sospecha de DC previo al ictus; incapacidad para contestar el cuestionario de CVRS o realizar las pruebas neuropsicológicas, a juicio del examinador, debido a padecer graves alteraciones auditivas y/o visuales, ser iletrados, o presentar afasia o DC post-ictus, ambos en grado grave.
InstrumentosSe utilizaron los siguientes instrumentos de evaluación: a) cuestionario de recogida de datos: variables clínicas (antecedentes médicos y psiquiátricos), demográficas y sociales; b) valoración cognitiva: Mini-Mental State Examination (MMSE)19, batería breve de evaluación frontal (FAB)20, prueba del informador21; c) valoración psicopatológica: inventario neuropsiquiátrico (NPI)22, escalas de depresión23 y ansiedad de hamilton24; d) valoración funcional y neurológica: escala de Rankin modificada25, índice de Barthel26, índice de Lawton27 y escala neurológica canadiense28, y e) valoración de la CVRS: SF-363, del que se obtuvieron las puntuaciones en cada uno de los 8 índices (función física, rol físico, dolor, salud general, vitalidad, función social, rol emocional, salud mental), y las puntuaciones resumen de los componentes físico y mental. La puntuación en cada uno de estos apartados va de 0 a 100, siendo 100 la mejor posible. El componente físico agrupa las puntuaciones en los índices de función física, rol físico, dolor y salud general, y el componente mental la de los índices restantes.
ProcedimientosEn el momento de ingreso, se valoraron los criterios de inclusión y exclusión, y se pidió consentimiento informado al paciente o familiar. Antes de las 48h posteriores al ictus, se le administró al cuidador el cuestionario de recogida de datos, NPI, test del informador (para descartar DC previo y evitar la inclusión de pacientes con psicopatología asociada a enfermedad neurodegenerativa, lo que podría introducir sesgos en el estudio) e índices de Barthel y Lawton. A las 4, 12 y 26 semanas del evento se aplicaron todas las pruebas cognitivas, psicopatológicas y funcionales indicadas en el apartado instrumentos.
Para la localización del IC se utilizó la tomografía computarizada o resonancia magnética cerebral. Los infartos se definieron como hemisféricos cerebrales derechos, hemisféricos cerebrales izquierdos o localizados en tronco-cerebelo, distinguiendo si se trataba de infartos lacunares o no en el caso de los infartos hemisféricos cerebrales. El diagnóstico clínico y la localización radiológica del IC fueron realizadas por un neurólogo y un radiólogo, respectivamente.
Análisis estadísticoLos datos fueron analizados mediante el programa estadístico SPSS v11.0. Se efectuó: a) análisis descriptivo a través de distribución de frecuencias y estadísticos de resumen; b) estudio de diferencia de medias mediante la t de Student; c) estudio de correlaciones mediante el coeficiente de correlación de Pearson, y d) análisis multivariado mediante análisis de regresión lineal. Las variables cualitativas fueron recodificadas como variables dummy para su inclusión en los diferentes modelos. Se estableció un nivel de significación estadística de 0,05.
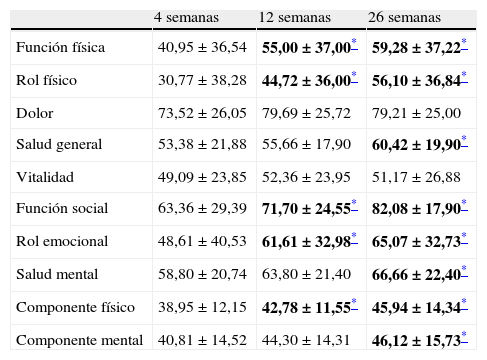
ResultadosDatos descriptivosEn la tabla 1 se muestran los datos descriptivos (demográficos y clínicos) de la muestra. En la tabla 2 se muestra el análisis de diferencia de medias entre las puntuaciones del SF-36 a las 4, 12 y 26 semanas. Tomando como referencia la semana 4, se observó una mejoría significativa (p<0,05) en la semana 12 en los índices de función física, rol físico, función social, rol emocional y en el componente físico, y a las 26 semanas en los índices de función física, rol físico, salud general, función social, rol emocional, salud mental, componente físico y componente mental. Cuando se valoraron las diferencias de puntuaciones medias entre las semanas 12 y la 26, se encontraron diferencias estadísticamente significativas (p<0,05) sólo en las variables rol físico, salud general y función social.
Características demográficas y clínicas de la muestra (n=45)
| Variable | |
| Sexo, n (%) | |
| Varón | 21 (46,7) |
| Mujer | 24 (53,3) |
| Edad media±desviación típica | 69,6±10,9 |
| Años escolaridad, n (%) | |
| < 3 | 18 (40,0) |
| 4-8 | 22 (48,9) |
| > 8 | 5 (11,1) |
| Localización ictus, n (%) | |
| Hemisferio derecho | 14 (31,1) |
| Hemisferio izquierdo | 21 (46,7) |
| Tronco-cerebelo | 10 (22,2) |
| Antecedentes, n (%) | |
| HTA | 28 (62,2) |
| Diabetes | 16 (35,6) |
| Colesterol | 19 (42,2) |
| Tabaco | 12 (26,7) |
| Alcohol | 14 (31,1) |
| Depresión | 5 (11,1) |
| Ansiedad | 2 (4,4) |
| Evaluación basala, media±desviación típica | |
| Escala canadiense | 7,64±1,74 |
| Rankin | 2,27±1,38 |
| NPI (FxG) | 9,73±11,14 |
| MMSE | 21,81±5,61 |
| FAB | 9,67±4,64 |
FAB: batería breve de evaluación frontal; FxG: puntuación global del NPI (frecuencia por gravedad); MMSE: Mini-mental State Examination; NPI: inventario neuropsiquiátrico.
Puntuaciones en los distintos dominios del SF-36 a las 4, 12 y 26 semanas del ictus (n=45)
| 4 semanas | 12 semanas | 26 semanas | |
| Función física | 40,95±36,54 | 55,00±37,00* | 59,28±37,22* |
| Rol físico | 30,77±38,28 | 44,72±36,00* | 56,10±36,84* |
| Dolor | 73,52±26,05 | 79,69±25,72 | 79,21±25,00 |
| Salud general | 53,38±21,88 | 55,66±17,90 | 60,42±19,90* |
| Vitalidad | 49,09±23,85 | 52,36±23,95 | 51,17±26,88 |
| Función social | 63,36±29,39 | 71,70±24,55* | 82,08±17,90* |
| Rol emocional | 48,61±40,53 | 61,61±32,98* | 65,07±32,73* |
| Salud mental | 58,80±20,74 | 63,80±21,40 | 66,66±22,40* |
| Componente físico | 38,95±12,15 | 42,78±11,55* | 45,94±14,34* |
| Componente mental | 40,81±14,52 | 44,30±14,31 | 46,12±15,73* |
Valores expresados como puntuación media±desviación típica.
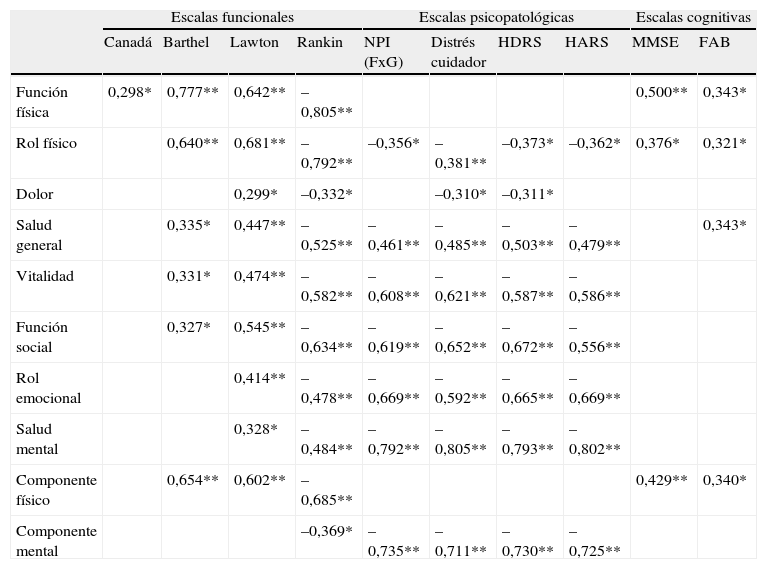
En la tabla 3 se muestran las correlaciones existentes, a las 26 semanas del IC, entre las puntuaciones de las escalas del SF-36 y las escalas funcionales, psicopatológicas y cognitivas. En términos generales se apreciaron correlaciones moderadas o altas con las escalas funcionales y psicopatológicas y bajas o moderadas con las escalas cognitivas.
Correlación entre los índices de calidad de vida del SF-36 y las puntuaciones en las escalas funcionales, psicopatológicas y cognitivas (n=45)
| Escalas funcionales | Escalas psicopatológicas | Escalas cognitivas | ||||||||
| Canadá | Barthel | Lawton | Rankin | NPI (FxG) | Distrés cuidador | HDRS | HARS | MMSE | FAB | |
| Función física | 0,298* | 0,777** | 0,642** | –0,805** | 0,500** | 0,343* | ||||
| Rol físico | 0,640** | 0,681** | –0,792** | –0,356* | –0,381** | –0,373* | –0,362* | 0,376* | 0,321* | |
| Dolor | 0,299* | –0,332* | –0,310* | –0,311* | ||||||
| Salud general | 0,335* | 0,447** | –0,525** | –0,461** | –0,485** | –0,503** | –0,479** | 0,343* | ||
| Vitalidad | 0,331* | 0,474** | –0,582** | –0,608** | –0,621** | –0,587** | –0,586** | |||
| Función social | 0,327* | 0,545** | –0,634** | –0,619** | –0,652** | –0,672** | –0,556** | |||
| Rol emocional | 0,414** | –0,478** | –0,669** | –0,592** | –0,665** | –0,669** | ||||
| Salud mental | 0,328* | –0,484** | –0,792** | –0,805** | –0,793** | –0,802** | ||||
| Componente físico | 0,654** | 0,602** | –0,685** | 0,429** | 0,340* | |||||
| Componente mental | –0,369* | –0,735** | –0,711** | –0,730** | –0,725** | |||||
Valores expresados como coeficiente de correlación de Pearson. No se muestran los valores no significativos.
FAB: batería breve de evaluación frontal; FxG: puntuación global del NPI (frecuencia por gravedad); HARS: escala de ansiedad de Hamilton; HDRS: escala de depresión de Hamilton; MMSE: Mini-mental State Examination; NPI: inventario neuropsiquiátrico.
*p < 0,05.
**p < 0,001.
De forma más específica, el estudio de las relaciones existentes entre las escalas neurológicas y funcionales con los distintos índices de CVRS mostró unas correlaciones altas de las escalas funcionales con los índices físicos de CVRS y bajas o moderadas con los índices mentales. La escala de Rankin se correlacionó significativamente con todos los índices del SF-36.
Con respecto a las variables psicopatológicas, se apreció una correlación moderada o alta con los aspectos mentales y sociales de la CVRS, y baja o moderada con los aspectos físicos. La puntuación global del NPI —frecuencia por gravedad (FxG)— y las escalas de Hamilton de depresión y ansiedad fueron las variables más relacionadas. Las subescalas de depresión, apatía y ansiedad del NPI también presentaron correlaciones bajas o moderadas con los índices de CVRS (datos no mostrados en la tabla 3). Igualmente, se apreciaron correlaciones moderadas o altas entre el distrés del cuidador asociado a los TP (NPI) y los índices mentales de CVRS.
Por último, las escalas cognitivas se correlacionaron con un menor número de índices del SF-36, con una correlación moderada del MMSE con la escala de función física y el componente físico, correlaciones bajas de la FAB con el componente físico y 3 de los índices físicos de la SF-36 (función física, rol físico y salud general), y ausencia de correlación significativa de ambas escalas con los índices mentales de CVRS.
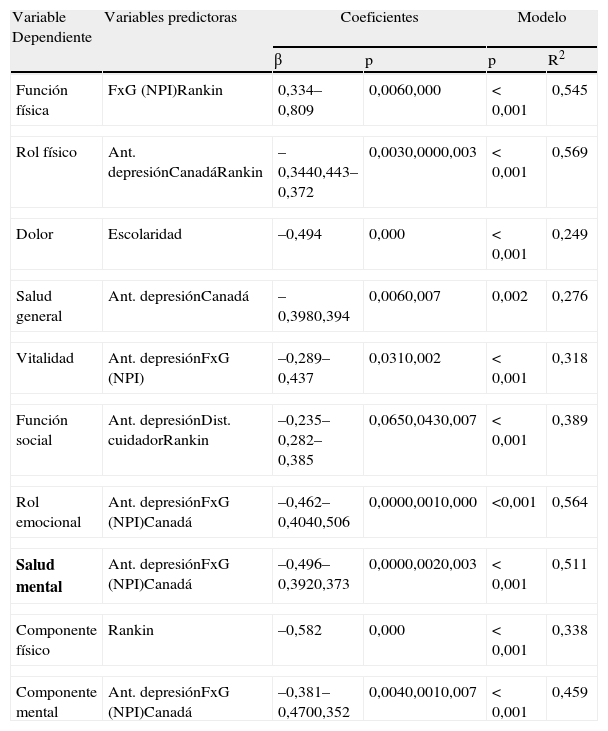
Factores predictivos de la calidad de vidaSe utilizó el estudio de regresión lineal con el método por pasos (stepwise) para obtener los indicadores predictivos de los distintos índices de CVRS a las 26 semanas del IC, tomando como referencia la situación del paciente a las 4 semanas. Se incluyeron como variables dependientes las puntuaciones del SF-36 a las 26 semanas, y como variables independientes o predictoras las siguientes: antecedentes demográficos (edad, sexo y años de escolaridad), antecedentes médicos (HTA, hipercolesterolemia, diabetes, alcohol, tabaco) y psicopatológicos (depresión, ansiedad), localización del ictus, y las puntuaciones obtenidas a las 4 semanas en el MMSE, puntuación global (FxG) del NPI y sus diferentes subescalas, y escalas de Canadá y de Rankin.
Se obtuvieron modelos predictivos válidos para todos los índices y componentes del SF-36 (tabla 4). El antecedente de depresión fue la variable predictora que apareció en más modelos: rol físico, salud general, vitalidad, función social, rol emocional, salud mental y componente mental. Otras variables predictoras presentes en varios modelos fueron: la puntuación más alta en el NPI y escala de Rankin, y más baja en la escala neurológica canadiense a las 4 semanas. Los modelos predictivos explicaron entre el 24 y el 56% de la varianza de las distintas variables estudiadas. La puntuación en el NPI y en la escala neurológica canadiense a las 4 semanas, junto con el antecedente de depresión, explicaban más del 50% de la varianza de los índices de rol emocional y salud mental, y el 45% de la varianza del componente mental a las 26 semanas.
Modelos de regresión para los índices de calidad de vida del SF-36 (n=45)
| Variable Dependiente | Variables predictoras | Coeficientes | Modelo | ||
| β | p | p | R2 | ||
| Función física | FxG (NPI)Rankin | 0,334–0,809 | 0,0060,000 | < 0,001 | 0,545 |
| Rol físico | Ant. depresiónCanadáRankin | –0,3440,443–0,372 | 0,0030,0000,003 | < 0,001 | 0,569 |
| Dolor | Escolaridad | –0,494 | 0,000 | < 0,001 | 0,249 |
| Salud general | Ant. depresiónCanadá | –0,3980,394 | 0,0060,007 | 0,002 | 0,276 |
| Vitalidad | Ant. depresiónFxG (NPI) | –0,289–0,437 | 0,0310,002 | < 0,001 | 0,318 |
| Función social | Ant. depresiónDist. cuidadorRankin | –0,235–0,282–0,385 | 0,0650,0430,007 | < 0,001 | 0,389 |
| Rol emocional | Ant. depresiónFxG (NPI)Canadá | –0,462–0,4040,506 | 0,0000,0010,000 | <0,001 | 0,564 |
| Salud mental | Ant. depresiónFxG (NPI)Canadá | –0,496–0,3920,373 | 0,0000,0020,003 | < 0,001 | 0,511 |
| Componente físico | Rankin | –0,582 | 0,000 | < 0,001 | 0,338 |
| Componente mental | Ant. depresiónFxG (NPI)Canadá | –0,381–0,4700,352 | 0,0040,0010,007 | < 0,001 | 0,459 |
Ant. depresión: antecedentes de depresión; Dist. cuidador: distrés del cuidador; FxG: producto de frecuencia por gravedad (puntuación global del NPI); NPI: inventario neuropsiquiátrico.
En este estudio se ha analizado la evolución de los distintos índices de CVRS tras un IC y se ha evaluado la influencia de las diversas áreas de afectación (sensorio-motora, cognitiva, psicopatológica y funcional) sobre la CVRS de los pacientes. Nuestros resultados confirman la importancia de los TP en la CVRS de los pacientes que han sufrido un IC, así como el hecho de que es posible predecir, en cierta medida, la CVRS a largo plazo a partir de los antecedentes del paciente y de su situación a las 4 semanas del ictus, lo que puede permitir una planificación más ajustada de la atención que deben recibir estos pacientes.
En el estudio evolutivo de la CVRS, se ha observado una mejoría significativa en la mayoría de las escalas entre las 4 y las 26 semanas tras el IC, con excepción de las escalas de dolor y vitalidad. Esta mejoría de la CVRS en los 6 primeros meses de evolución también ha sido descrita por Rønning y Stavem15.
El análisis de las correlaciones entre los distintos índices de CVRS estudiados y las variables neurológicas, funcionales, psicopatológicas y cognitivas a las 26 semanas del IC indican que la percepción de la CVRS se relaciona, en primer lugar, con el deterioro funcional, y en segundo lugar, con los TP, especialmente con la depresión y la ansiedad; siendo importante también en este sentido el distrés del cuidador en relación con la psicopatología del paciente (evaluado con el NPI). Por último, el DC es el factor que presenta, en este estudio, menor grado de correlación con la CVRS. Llama además la atención que exista correlación de las escalas cognitivas con los índices físicos de la SF-36, pero no con los mentales. Todos estos factores han sido relacionados igualmente en otros estudios con la CVRS, si bien el orden de importancia de cada uno de ellos difiere según los autores1,13.
El estudio de regresión lineal obtuvo modelos predictivos válidos para todas las escalas del SF-36, en los que la situación neurológica y funcional a las 4 semanas, el antecedente de depresión y la psicopatología post-ictus a las 4 semanas, evaluada por el NPI, fueron los principales indicadores predictivos de la CVRS a las 26 semanas del IC.
En el análisis más detallado de los distintos modelos predictivos cabe destacar algunos hallazgos. En primer lugar, los principales factores predictivos de una peor CVRS percibida en relación con los aspectos físicos a las 26 semanas del IC fueron el antecedente de depresión y, sobre todo, el grado de discapacidad a las 4 semanas, siendo la puntuación en la escala de Rankin el único factor predictivo del componente físico. Por otro lado, la CVRS asociada a la salud mental pudo predecirse por el antecedente de depresión, junto con la situación neurológica (escala neurológica canadiense) y psicopatológica (FxG) a las 4 semanas. En este análisis, no pudimos demostrar una influencia independiente sobre la CVRS de factores como la edad, el sexo o la localización del IC, aunque otros autores han descrito peores resultados en pacientes de mayor edad6,8, mujeres1,4 o con lesiones hemisféricas izquierdas6.
Es destacable el hecho de que el antecedente de depresión fuera el factor independiente que más frecuentemente apareció en los modelos predictivos (en 7 de 10), siendo éste un dato fácilmente obtenible a través de la historia clínica desde el primer contacto con el paciente.
Por otro lado, el nivel educativo más alto se reveló como un factor predictivo de una peor valoración en la calidad de vida relacionada con el dolor en nuestros pacientes, siendo este hallazgo contradictorio con la literatura previa, dado que este factor suele asociarse, en general, a una mejor CVRS percibida29.
Por último, el distrés del cuidador asociado a la psicopatología del paciente (evaluado por el NPI) predijo una peor puntuación en la escala de función social, lo que pone de manifiesto la interferencia que los TP suponen en la relación del paciente con su entorno familiar y social. Este dato está en consonancia con los obtenidos en el estudio de Haley et al30, en el que los trastornos afectivos de los pacientes con ictus fueron considerados por sus cuidadores como el problema más estresante para ellos mismos, por encima del grado de discapacidad o de otros factores.
Entre las limitaciones de nuestro estudio, cabe destacar el reducido número de la muestra y que, debido a los instrumentos escogidos, no se pudo incluir a pacientes iletrados ni a pacientes con afasia o DC graves. No podemos descartar que este hecho haya influido en los resultados, especialmente en la ausencia de relación de la CVRS con la localización hemisférica izquierda o con el DC. Además, el MMSE, aunque es un test útil para la detección del DC moderado-grave post-ictus, puede ser inadecuado para la valoración de DC en grado leve31. Finalmente, otra limitación del estudio es el hecho de no haber abordado otros factores que pueden estar asociados a la CVRS tras el ictus, como las estrategias de afrontamiento y el grado de apoyo social1,6,11,32.
En conclusión, según los datos obtenidos en este estudio, los pacientes con peor situación funcional y psicopatología más grave al mes de un IC tienen mayor riesgo de presentar peor CVRS percibida a los 6 meses del ictus. La situación funcional influye tanto en los aspectos físicos como mentales de la CVRS. El antecedente de depresión y los TP post-ictus influyen en los aspectos de la CVRS relacionados con la salud mental pero también, aunque en menor medida, en la esfera física.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los resultados de este trabajo han sido presentados en la LXII Reunión Anual de la Sociedad Española de Neurología (Barcelona, 16-20 de noviembre de 2010).