La epilepsia es uno de los trastornos neurológicos más frecuentes de la infancia, presentándose en un 0,5-1%. Aproximadamente un 20-30% de los pacientes son farmacorresistentes. El objetivo de este trabajo es describir en 30 pacientes el impacto sobre las crisis y la calidad de vida del estimulador del nervio vago (ENV).
MétodosSe trata de un estudio descriptivo, retrospectivo, mediante revisión de las historias clínicas de todos los pacientes a quienes se les colocó el ENV entre el 2008 y 2013 en nuestro centro. La calidad de vida fue valorada mediante la escala de calidad de vida en el niño con epilepsia (CAVE), obtenida por medio de una entrevista telefónica.
ResultadosSe incluyeron 19 niños (64%) y 11 niñas (36%) con una mediana de comienzo de las crisis de 21 meses (1-144 meses). La edad promedio de colocación del ENV fue de 11,89 años. El tiempo de seguimiento fue de 6-36 meses. A los 6 meses la reducción de las crisis en promedio fue del 38%, a los 12 meses del 43%, a los 24 meses del 42% y a los 36 meses del 54%. De todos los pacientes evaluados al menos un 50% se catalogaron como respondedores. Según la CAVE un 54% de las familias encontró el efecto del ENV como bueno o muy bueno y un 39% como regular.
ConclusionesEl ENV es un tratamiento paliativo, generalmente bien tolerado, parcialmente efectivo para el control de la epilepsia refractaria en pediatría y con repercusiones positivas sobre la calidad de vida.
Epilepsy, which is present in 0.5% to 1% of the paediatric population, is one of the most frequent childhood neurological disorders. Approximately 20% to 30% of these cases will be drug-resistant. The objective of this study is to describe the impact of vagal nerve stimulation (VNS) on seizures and quality of life in a sample of 30 patients.
MethodsDescriptive, retrospective study of all patients with a VNS device implanted between 2008 and 2013 in a single paediatric hospital, based on patients’ medical records. Quality of life was assessed using the Spanish scale for quality of life in children with epilepsy, completed by means of a telephone interview.
ResultsWe describe a population of 19 boys (64%) and 11 girls (36%) with a mean age at seizure onset of 21 months (1-144 months). The mean age of VNS implantation was 11.89 years. Follow-up periods ranged from 6 to 36 months. Mean reduction in seizures at 6 months was 38%, with a reduction of 43% at 12 months, 42% at 24 months, and 54% at 36 months. At least half of all patients were classified as responders. According to the quality of life scale, 54% of the families rated the effect of VNS as either very good or good while 39% rated it as fair.
ConclusionsVNS is a safe palliative treatment that is generally well tolerated. It is partially effective for controlling drug-resistant epilepsy and exerts a positive effect on quality of life.
La epilepsia es uno de los trastornos neurológicos más frecuentes de la infancia, presentándose en un 0,5-1%, sin embargo en un 20-30% de los pacientes no se logra un control adecuado con fármacos antiepilépticos (FAE)1,2. Se cataloga como epilepsia refractaria cuando no hay respuesta a 2 FAE de primera elección en monoterapia, o a la combinación de 2 FAE de primera línea a la dosis máxima tolerada, y apropiados al tipo de crisis epilépticas y síndrome epiléptico3. La epilepsia farmacorresistente constituye un reto para los médicos, con repercusiones negativas importantes sobre el desarrollo, el aprendizaje, el comportamiento y la calidad de vida de los pacientes y sus familias1,2. Dentro de los tratamientos alternativos que se plantean en pacientes con epilepsia refractaria se encuentran la dieta cetógena, el estimulador del nervio vago (ENV) y la cirugía funcional de la epilepsia.
A partir de la década de 1980 se utiliza el ENV de forma experimental documentando una buena tolerancia y reducción de las crisis epilépticas4–6. El mecanismo de acción antiepiléptico del ENV no está completamente claro, pero se cree que la estimulación eléctrica intermitente del nervio vago izquierdo desincroniza los circuitos tálamo-corticales involucrados en la propagación de las crisis5,7. El nervio vago termina en el núcleo solitario, que tiene proyecciones a otros núcleos del tronco cerebral, cuya activación podría controlar la actividad epiléptica8.
El ENV fue aprobado por la agencia estadounidense FDA en 1997 como tratamiento neuromodulador adyuvante para pacientes mayores de 12 años con epilepsia parcial farmacorresistente9,10. En pacientes con epilepsia refractaria grave, que no son candidatos a cirugía funcional de la epilepsia, se propone la colocación del ENV como tratamiento paliativo, dado que es seguro y eficaz3,7.
El primer estudio en pediatría (60 pacientes) se publicó en 1999 por el grupo de estudio pediátrico del ENV, revelando una reducción en las crisis8. A partir de entonces diversos estudios han demostrado una eficacia y seguridad comparable en niños y adultos con crisis de distintos tipos y en síndromes epilépticos de diversas etiologías. La eficacia mejora cuando se utiliza el ENV por un período prolongado. La media de reducción de crisis en población pediátrica con el ENV varía entre un 30-62% y el porcentaje de respondedores entre un 26-77%8,11.
El objetivo de este trabajo es describir en nuestra serie de 30 pacientes el impacto de la colocación del ENV sobre las crisis y la calidad de vida. Hasta donde llega nuestro conocimiento este es el primer estudio que evalúa los resultados de la colocación del ENV en un hospital pediátrico en España.
Pacientes y métodosEste es un estudio retrospectivo, descriptivo, en un solo centro, basado en la revisión de historias clínicas y llamadas telefónicas a las familias para la obtención de la escala de calidad de vida en epilepsia (CAVE).
Se incluyeron los datos de todos los pacientes a quienes se les colocó un ENV en el Hospital Sant Joan de Déu en el periodo comprendido entre abril de 2008 y mayo de 2013. El tiempo mínimo de seguimiento fue de 6 meses. Se consideraron candidatos a ENV los pacientes con epilepsia refractaria (según la definición mencionada en la introducción), que no fueran candidatos a cirugía funcional de la epilepsia. En todos los pacientes se obtuvo el consentimiento informado de las familias para el procedimiento. Se han excluido los niños afectos de enfermedades progresivas. Todos los pacientes se evaluaron de forma exhaustiva previa a la colocación del ENV incluyendo: examen neurológico completo, un estudio neuropsicológico completo, monitorización vídeo-electroencefalográfica continua, de 2 a 5 días de duración y resonancia magnética cerebral. Todos los pacientes fueron valorados en la unidad de epilepsia mediante una discusión del paciente por parte de los distintos especialistas del equipo.
Con respecto a las variables recogidas de las historias clínicas se incluyeron: sexo, fecha de nacimiento, alteraciones del examen neurológico, edad de comienzo de la epilepsia, tipo de crisis, etiología de la epilepsia y frecuencia de las crisis. La frecuencia de las crisis fue calculada con el número total de crisis, de todos los tipos, que presentó un paciente durante un mes. Asimismo se recogieron los FAE utilizados (incluyendo únicamente aquellos administrados al menos 2 meses, a dosis terapéuticas), el resultado del electroencefalograma y de la resonancia magnética. Con respecto al estudio neuropsicológico se clasificó el resultado según el cociente intelectual en: normal mayor a 84, limítrofe entre 70-84, retardo mental leve de 50-70, moderado de 35-49, grave de 20 a 34 y profundo menor a 20.
La colocación del ENV se realizó por parte del servicio de neurocirugía de nuestro hospital (GG). Se realizó una incisión a nivel cervical izquierdo aproximadamente a la altura de C5-C6. Por disección interfascial se expone el paquete vasculonervioso del cuello, se localiza el nervio vago entre la arteria carótida y la vena yugular y se diseca el nervio en una longitud aproximada de 4-5cm. El electrodo bipolar se coloca alrededor del nervio vago y se conecta al generador de impulsos, que se implanta de forma subcutánea a nivel torácico izquierdo. Antes de cerrar las incisiones se comprueba el buen funcionamiento del sistema. El ENV queda sin funcionamiento hasta que transcurren 2-3 semanas, momento en el que se inicia la estimulación de forma ambulatoria. Los parámetros establecidos inicialmente fueron: corriente de 0,25mA, pulso 0,5ms, frecuencia de 30Hz y tiempo on/off 30seg/5min y se aumentó de forma paulatina 0,5mA cada 7 días, hasta un máximo de 2 o 2,5mA según tolerancia y respuesta.
El seguimiento a largo plazo y ajuste de los parámetros del ENV fue realizado por el mismo neurólogo pediátrico (FS). Se registró la fecha de la colocación del ENV, los efectos adversos, la frecuencia de las crisis mensuales en los controles posteriores al procedimiento a los 6, 12, 24 y 36 meses y los efectos favorables a nivel global. Se consideró un paciente respondedor cuando la reducción de crisis fue≥50%. Cuando el control de las crisis no fue óptimo se realizaron cambios en el tipo de estimulación (por ejemplo ciclo corto) y en los FAE administrados.
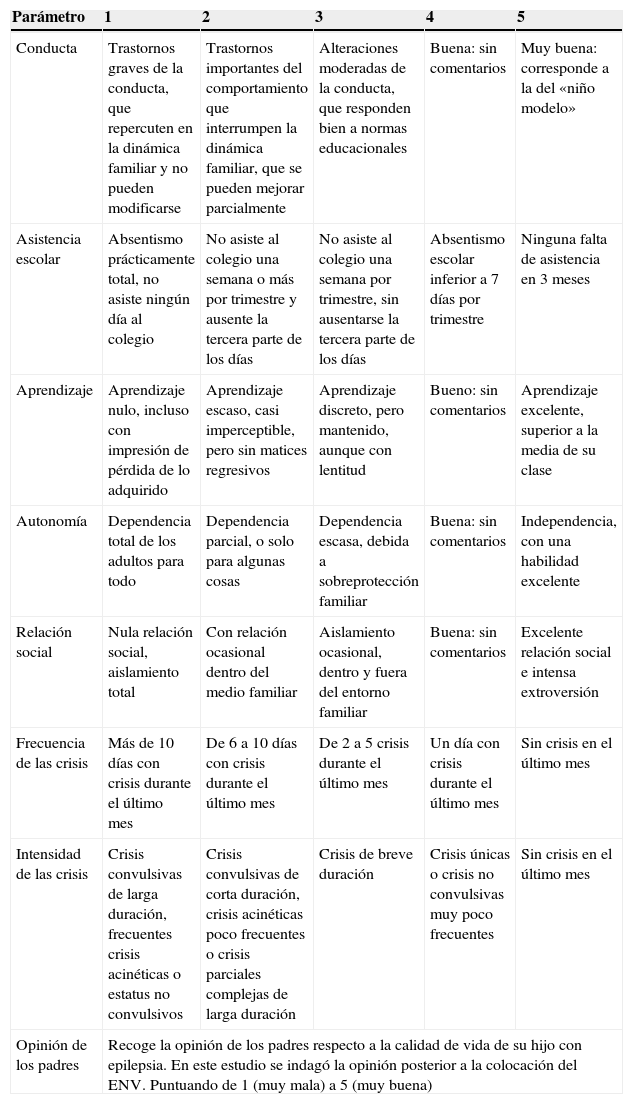
Se obtuvo la CAVE por medio de una llamada a las familias por 2 entrevistadores (AUC y LCC). Se preguntó a las familias por los siguientes aspectos contemplados en la CAVE: conducta, asistencia escolar, aprendizaje, autonomía, relación social, frecuencia e intensidad de las crisis, intensidad de las crisis y opinión global de los padres del ENV. Cada una de estas variables se clasificó como: 5 muy bueno, 4 bueno, 3 regular, 2 malo y 1 muy malo, de acuerdo a lo definido para cada una de ellas en la CAVE, y de manera subjetiva la opinión de los padres respecto a la calidad de vida de su hijo con epilepsia después del ENV (tabla 1).
Resumen de la escala de calidad de vida en el niño con epilepsia (CAVE)
| Parámetro | 1 | 2 | 3 | 4 | 5 |
|---|---|---|---|---|---|
| Conducta | Trastornos graves de la conducta, que repercuten en la dinámica familiar y no pueden modificarse | Trastornos importantes del comportamiento que interrumpen la dinámica familiar, que se pueden mejorar parcialmente | Alteraciones moderadas de la conducta, que responden bien a normas educacionales | Buena: sin comentarios | Muy buena: corresponde a la del «niño modelo» |
| Asistencia escolar | Absentismo prácticamente total, no asiste ningún día al colegio | No asiste al colegio una semana o más por trimestre y ausente la tercera parte de los días | No asiste al colegio una semana por trimestre, sin ausentarse la tercera parte de los días | Absentismo escolar inferior a 7 días por trimestre | Ninguna falta de asistencia en 3 meses |
| Aprendizaje | Aprendizaje nulo, incluso con impresión de pérdida de lo adquirido | Aprendizaje escaso, casi imperceptible, pero sin matices regresivos | Aprendizaje discreto, pero mantenido, aunque con lentitud | Bueno: sin comentarios | Aprendizaje excelente, superior a la media de su clase |
| Autonomía | Dependencia total de los adultos para todo | Dependencia parcial, o solo para algunas cosas | Dependencia escasa, debida a sobreprotección familiar | Buena: sin comentarios | Independencia, con una habilidad excelente |
| Relación social | Nula relación social, aislamiento total | Con relación ocasional dentro del medio familiar | Aislamiento ocasional, dentro y fuera del entorno familiar | Buena: sin comentarios | Excelente relación social e intensa extroversión |
| Frecuencia de las crisis | Más de 10 días con crisis durante el último mes | De 6 a 10 días con crisis durante el último mes | De 2 a 5 crisis durante el último mes | Un día con crisis durante el último mes | Sin crisis en el último mes |
| Intensidad de las crisis | Crisis convulsivas de larga duración, frecuentes crisis acinéticas o estatus no convulsivos | Crisis convulsivas de corta duración, crisis acinéticas poco frecuentes o crisis parciales complejas de larga duración | Crisis de breve duración | Crisis únicas o crisis no convulsivas muy poco frecuentes | Sin crisis en el último mes |
| Opinión de los padres | Recoge la opinión de los padres respecto a la calidad de vida de su hijo con epilepsia. En este estudio se indagó la opinión posterior a la colocación del ENV. Puntuando de 1 (muy mala) a 5 (muy buena) | ||||
Se utilizaron los programas Excel y SPSS para el análisis estadístico. Se realizó una regresión lineal multivariable de la reducción de crisis a los 6, 12, 24 y 36 meses sobre las siguientes variables independientes: sexo, foco (focal o multifocal), tipo de epilepsia (sintomática o criptogénica), edad de colocación del ENV (menor o mayor de 12 años) y tiempo de evolución de las crisis previo al ENV (menos de 6 años desde el comienzo de las crisis o más de 6 años). Se emplearon intervalos de confianza (IC) al 95%, considerando estadísticamente significativa una p<0,05.
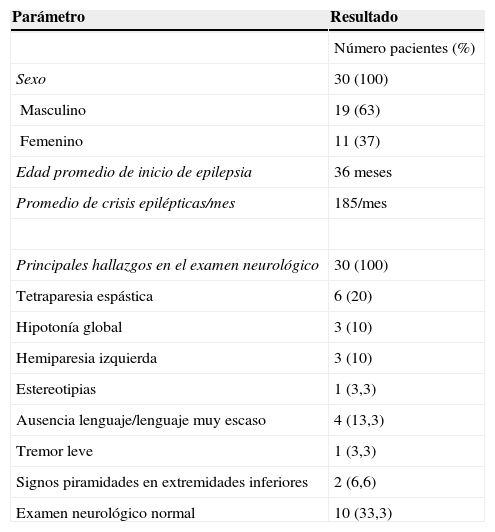
ResultadosDurante el periodo comprendido entre abril de 2008 y mayo de 2013 a 30 pacientes se les colocó el ENV: 19 niños (63%) y 11 niñas (37%). Los principales hallazgos patológicos descritos en el examen neurológico previo al ENV se detallan en la tabla 2; 10 pacientes (33%) presentaron un examen neurológico normal.
Características epidemiológicas y clínicas de los pacientes (n=30)
| Parámetro | Resultado |
|---|---|
| Número pacientes (%) | |
| Sexo | 30 (100) |
| Masculino | 19 (63) |
| Femenino | 11 (37) |
| Edad promedio de inicio de epilepsia | 36 meses |
| Promedio de crisis epilépticas/mes | 185/mes |
| Principales hallazgos en el examen neurológico | 30 (100) |
| Tetraparesia espástica | 6 (20) |
| Hipotonía global | 3 (10) |
| Hemiparesia izquierda | 3 (10) |
| Estereotipias | 1 (3,3) |
| Ausencia lenguaje/lenguaje muy escaso | 4 (13,3) |
| Tremor leve | 1 (3,3) |
| Signos piramidades en extremidades inferiores | 2 (6,6) |
| Examen neurológico normal | 10 (33,3) |
La edad promedio de comienzo de las crisis fue a los 36 meses (mediana 21 meses, rango 1-144 meses). En 25 pacientes (83%) la epilepsia fue catalogada como multifocal, en un paciente (3,3%) temporal y en 4 pacientes (13,7%) extratemporal. De las 4 epilepsias extratemporales una fue parietal derecha, otra frontal izquierda, otra centro-parietal derecha y la última de cuadrante posterior izquierdo.
El número de crisis promedio previo a la colocación del ENV fue de 185/mes (rango de 3-1.140 crisis/mes). El promedio de FAE utilizados previo al ENV fue de 8 (rango de 5-12 FAE). El estudio neuropsicológico tuvo los siguientes resultados: 17 pacientes con retardo mental grave, 9con retardo mental moderado, 2 con retardo mental leve, uno con CI limítrofe y uno con CI normal (tabla 3).
Resultados de los exámenes complementarios de los pacientes (n=30)
| Número pacientes (%) | |
|---|---|
| Resultados del electroencefalograma | 30 (100) |
| Focal | 5 (17) |
| Multifocal | 25 (83) |
| Estudio neuropsicológico | 30 (100) |
| Normal | 1 (3,3) |
| CI limítrofe | 1(3,3) |
| RM leve | 2 (6,6) |
| RM moderado | 9 (30) |
| RM grave | 17 (56,7) |
| Principales hallazgos patológicos en la resonancia magnética | 15 (100) |
| Adelgazamiento difuso del cuerpo calloso | 1 (6,6) |
| Atrofia hipocampal izquierda | 1 (6,6) |
| Encefalomalacia (supratentorial, bifrontal, temporal) | 3 (20) |
| Tuberomas y nódulos subependimarios | 2 (13,4) |
| Displasia cortical (paquigiria, heterotopias nodulares) | 5 (33,4) |
| Secuelas de lesión isquémica | 3 (20) |
La RM cerebral se consideró patológica en 15 pacientes (50%); los hallazgos encontrados se delimitan en la tabla 3. La epilepsia se clasificó como sintomática en 15 pacientes (50%) y criptogénica en la mitad restante. Dentro de las epilepsias sintomáticas se presentaron: 2 pacientes con síndromes neurocutáneos (complejo esclerosis tuberosa), 4 con etiología infecciosa (2 encefalitis herpéticas, uno con meningoencefalitis neumocóccica y uno sin germen identificado), 5 con malformación del desarrollo cortical (uno con mutación en Lis-1), 3 con secuelas de lesión isquémica y uno con cromosoma 20 en anillo.
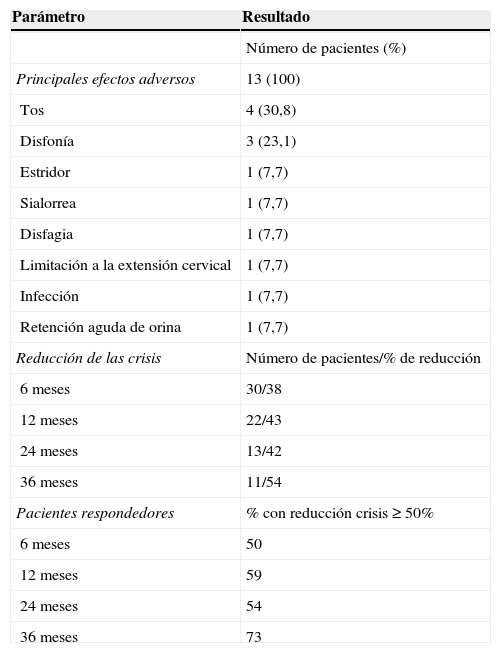
La edad promedio de colocación del ENV fue de 11,89 años (rango de 3,91 a 24,33 años). El rango de seguimiento fue de 6 hasta 36 meses y ningún paciente falleció durante este periodo. Se objetivaron efectos adversos en 13 pacientes (43,3%). Dentro de estos se encontraron: estridor, disfagia, disfonía, tos, sialorrea, retención urinaria y cierta limitación a la extensión cervical, pero todos fueron mínimos (tabla 4). Solo se presentó infección superficial de la herida quirúrgica en un paciente, que se manifestó como enrojecimiento en la herida quirúrgica y fue manejada con antibiótico durante 7 días, con resolución posterior. Los efectos adversos fueron transitorios en la mayoría de los pacientes y en ningún caso se retiró el dispositivo. Un paciente tuvo que ser reintervenido debido a malfuncionamiento del ENV, a pesar de que en el quirófano funcionó correctamente. Una paciente catalogada como respondedora presentó al cabo de unos meses de estimulación retenciones agudas de orina que fueron empeorando hasta requerir sondajes. Este efecto se consideró como secundario a una hiperestimulación vagal, por lo cual tuvieron que manipularse los parámetros hasta que finalmente se consiguió una buena tolerancia del sistema y la sintomatología cedió; esta paciente sigue llevando el ENV funcionante con reducción del 90% de las crisis.
Resultados de la colocación del ENV (n=30)
| Parámetro | Resultado |
|---|---|
| Número de pacientes (%) | |
| Principales efectos adversos | 13 (100) |
| Tos | 4 (30,8) |
| Disfonía | 3 (23,1) |
| Estridor | 1 (7,7) |
| Sialorrea | 1 (7,7) |
| Disfagia | 1 (7,7) |
| Limitación a la extensión cervical | 1 (7,7) |
| Infección | 1 (7,7) |
| Retención aguda de orina | 1 (7,7) |
| Reducción de las crisis | Número de pacientes/% de reducción |
| 6 meses | 30/38 |
| 12 meses | 22/43 |
| 24 meses | 13/42 |
| 36 meses | 11/54 |
| Pacientes respondedores | % con reducción crisis≥50% |
| 6 meses | 50 |
| 12 meses | 59 |
| 24 meses | 54 |
| 36 meses | 73 |
A los 6 meses el promedio de reducción de las crisis en 30 pacientes fue del 38%; un 50% de los pacientes se consideraron respondedores. A los 12 meses el promedio de reducción de las crisis en 22 pacientes fue del 43%, con un 59% de respondedores. A los 24 meses en 13 pacientes la reducción fue del 42%, con un 53% de respondedores. A los 36 meses la reducción de crisis en 11 pacientes fue de un 54%, con un 72% de respondedores. Ninguno de nuestros pacientes quedó libre de crisis. Durante el último control posterior a la colocación del ENV 14 pacientes (47%) mantenían el mismo esquema que tenían previo al ENV. Veinte pacientes se mantuvieron con el mismo número de FAE, 5 estaban con un FAE menos, uno con 2 FAE menos y 4 con un FAE más.
Al realizar una regresión lineal multivariable de la reducción de crisis a los 6 meses no se encontró un efecto estadísticamente significativo de las siguientes variables independientes: sexo (IC: –78 a 37, p=0.48), foco (IC: –26 a 97, p=0,25), edad de colocación del ENV (IC: –43 a 64, p=0,70), etiología de la epilepsia (IC: –72 a 34, p=0,47), tiempo de evolución de la epilepsia previo al ENV (IC: –70 a 38, p=0,54). La disminución del número de pacientes a los cuales se les hizo seguimiento a los 12, 24 y 36 meses generó un aumento en los errores estándar y dificultó la obtención de resultados significativos, por lo que a estos tiempos evolutivos se les realizó el mismo análisis, pero los datos no se presentan aquí.
Los resultados promedio de la CAVE en 28 pacientes fueron los siguientes: en conducta un 3 (alteraciones moderadas de la conducta pero que responden bien a normas educacionales), en asistencia escolar 4 (absentismo escolar inferior a 7 días por trimestre), en aprendizaje 3 (aprendizaje discreto, pero evidente y mantenido, aunque con lentitud en las adquisiciones), en autonomía 2 (dependencia parcial o solo en algunas cosas), en relación social 3 (aislamiento ocasional, tanto dentro como fuera del entorno familiar), en frecuencia de las crisis 2 (de 6 a 10 días con crisis durante el último mes) y en intensidad de las crisis 2 (crisis convulsivas de corta duración, crisis acinéticas poco frecuentes o crisis parciales complejas de larga duración, con o sin generalización secundaria). Estos parámetros en opinión de los padres fueron mejores con respecto al estado de sus hijos previo al ENV. Sin embargo, no se pudo comparar de forma precisa, ya que la mayoría de los padres fue incapaz de responder a preguntas tan específicas sobre el estado previo de sus hijos (algunos llevan más de 60 meses con el ENV). Con respecto a la opinión de los padres un 25% encontraron el efecto del ENV como muy bueno, un 28,6% como bueno, 39,3% como regular, un 3,6% como malo y un 3,6% como muy malo. Los padres informaron con frecuencia de la mejoría en la atención de sus hijos, muchos los notaron más activos, más comunicativos, más despiertos, más autónomos y más alegres. Algunos describieron que aunque el número de crisis se mantuvo similar, al ser estas menos intensas o sin caída al suelo esto les permitió más autonomía, con oportunidad de salir del hogar.
DiscusiónEl presente trabajo es el primero realizado en una serie de pacientes españoles en un hospital pediátrico, evaluando la respuesta del ENV y valorando la opinión de las familias.
Las variables epidemiológicas descritas en esta población previa al ENV son comparables a lo descrito en otros estudios. La edad de inicio de convulsiones fue a los 3 años; Klinkenberg et al. y Elliot et al. han incluido pacientes con epilepsias refractarias con promedios de inicio de crisis a los 2 años y 4 meses y a los 2 años y 8 meses respectivamente, lo que permite una mejor comparación de los resultados obtenidos1,7. La población en que se coloca el ENV es farmacorresistente, por lo que la mayoría han recibido múltiples FAE. Este estudio, con un promedio de 8, es comparable con otros que refieren entre 7 y 8 FAE previo al ENV7. La población descrita de pacientes con epilepsia refractaria presenta un alto porcentaje de retardo mental grave y moderado (87%). A pesar de que el estudio neuropsicológico no se realizó en todos los pacientes en el mismo momento de evolución de su epilepsia, los hallazgos concuerdan con el estudio de Chen et al., que también documenta retardo mental o cociente intelectual limítrofe en los 8 pacientes con epilepsia refractaria que evalúan9. Estos resultados similares refuerzan el concepto de que las convulsiones tienen efectos adversos a nivel cognitivo, y cuanto mayor sea la duración de la epilepsia y peor su control mayor es el deterioro, de ahí la necesidad de encontrar nuevos tratamientos eficaces en esta población1,12.
En este estudio 13 de 22 pacientes seguidos durante 12 meses (59%) lograron una reducción de crisis mayor del 50%, similar a los resultados de Elliot et al., que consiguen una reducción del 50% en el 64,8% de los pacientes1. Parker et al. describen una serie de 16 pacientes pediátricos con edad promedio de 11 años y una reducción media de crisis del 17% a los 12 meses13.
Además el control de la epilepsia en nuestros pacientes fue progresivamente mejor, desde un 38% a los 6 meses hasta un 54% a los 36 meses. Previamente se ha sugerido que a largo plazo un mayor número de pacientes son respondedores, siendo la reducción hasta de un 42% a los 18 meses8. Por tanto es muy importante seguir a estos pacientes para comprobar esta tendencia. De nuestros pacientes un 33% (10 pacientes) precisó algún cambio en el número de FAE y en un 60% de estos (6 pacientes) se pudo reducir el número de los mismos.
El ENV fue aprobado para epilepsias focales, sin embargo se ha demostrado su eficacia en diversos síndromes epilépticos. En esta población casi todos los pacientes presentaron epilepsias multifocales (83%) y se lograron buenos resultados, además no hubo una diferencia estadísticamente significativa entre la reducción de crisis a los 6 meses del ENV en pacientes con epilepsia multifocal o focal. Thompson et al. demostraron que pacientes pediátricos con el ENV se beneficiaban tanto si su epilepsia era generalizada como parcial10.
En este estudio la reducción de crisis a los 6 meses de la colocación del ENV fue similar en pacientes con epilepsias sintomáticas y criptogénicas, al igual que lo demostrado por Chen et al9.
Se ha sugerido que la implantación en pacientes menores de 12 años puede mejorar la respuesta al ENV. Sin embargo, en este estudio no hubo diferencia estadísticamente significativa en la reducción de las crisis a los 6 meses del ENV si se colocó antes o después de los 12 años. Otros estudios tampoco han encontrado una relación estadísticamente significativa entre la colocación del ENV antes de los 12 años y un mejor control de la epilepsia, por lo que la evidencia sugiere que la edad de colocación no es un factor decisivo de eficacia con el ENV1,4,14. La menor duración de la epilepsia en el momento de la colocación del ENV no se ha logrado correlacionar con una mayor reducción de las crisis, tal y como lo apoyan nuestros resultados, aunque sí con una mejor calidad de vida14,15.
La mayoría de los estudios describen efectos positivos del ENV sobre calidad de vida, principalmente sobre el estado de alerta, la interacción global y el sueño nocturno4,9, hallazgos que fueron frecuentemente mencionados por las familias de nuestros pacientes. No está claro si estos efectos se deben directamente a la estimulación o a la reducción de las crisis. En este estudio un 53,6% de las familias calificó la respuesta del ENV sobre la calidad de vida de sus hijos como buena o muy buena. Esta técnica se plantea como una alternativa para mejorar de forma global la vida de los pacientes con indicación del ENV y sus familias.
Se ha demostrado una reducción de los gastos totales de salud en población pediátrica con ENV, principalmente en hospitalizaciones y visitas al servicio de urgencias8. Este no fue uno de los aspectos evaluados en este trabajo, pero la mayoría de las familias mencionaron una reducción en el número de sus visitas al servicio de urgencias y de ingresos posterior al ENV.
Un 43,3% de los pacientes presentó efectos adversos, todos fueron transitorios, leves y relacionados con la estimulación, siendo los 3 más frecuentes tos, disfonía y estridor. Debe mencionarse que en esta población con afectación cognitiva importante los pacientes pueden no haber sido capaces de describir algunos de los efectos adversos provocados por el ENV. Las infecciones asociadas con el procedimiento quirúrgico oscilan de un 3 a un 5%4,11, aunque en esta serie solo se presentó en una ocasión.
Dentro de las limitaciones de este estudio debemos citar que se trató de un estudio retrospectivo, de una población pequeña y con disminución en el número de los pacientes durante el seguimiento a los 12, 24 y 36 meses. Asimismo nuestra población es heterogénea en cuanto a edad de colocación. Los resultados pueden haber estado influenciados por cambios concomitantes en FAE (10 pacientes). Sin embargo, dado que la prioridad fue el mejor control de los pacientes, consideramos que estos cambios fueron necesarios.
Este estudio confirma que el ENV es un tratamiento seguro, con pocos y transitorios efectos adversos y un impacto favorable sobre la frecuencia, la duración de las crisis y la calidad de vida que justifican su indicación.
Conflicto de interesesEste trabajo ha sido presentado como comunicación oral en la Reunión Anual de la SENEP.