En la actualidad, no existe una indicación formal de profilaxis anticomicial en neurocirugía oncológica. Tampoco existen recomendaciones específicas sobre el uso de fármacos antiepilépticos (FAE) en pacientes portadores de meningiomas y libres de crisis que van a ser intervenidos. En general, se prescriben FAE de forma discrecional, teniendo en cuenta diversos factores de riesgo clínico-radiológicos. Presentamos una revisión sistemática y metaanálisis sobre la efectividad de la profilaxis anticomicial en meningiomas sin historia previa de crisis.
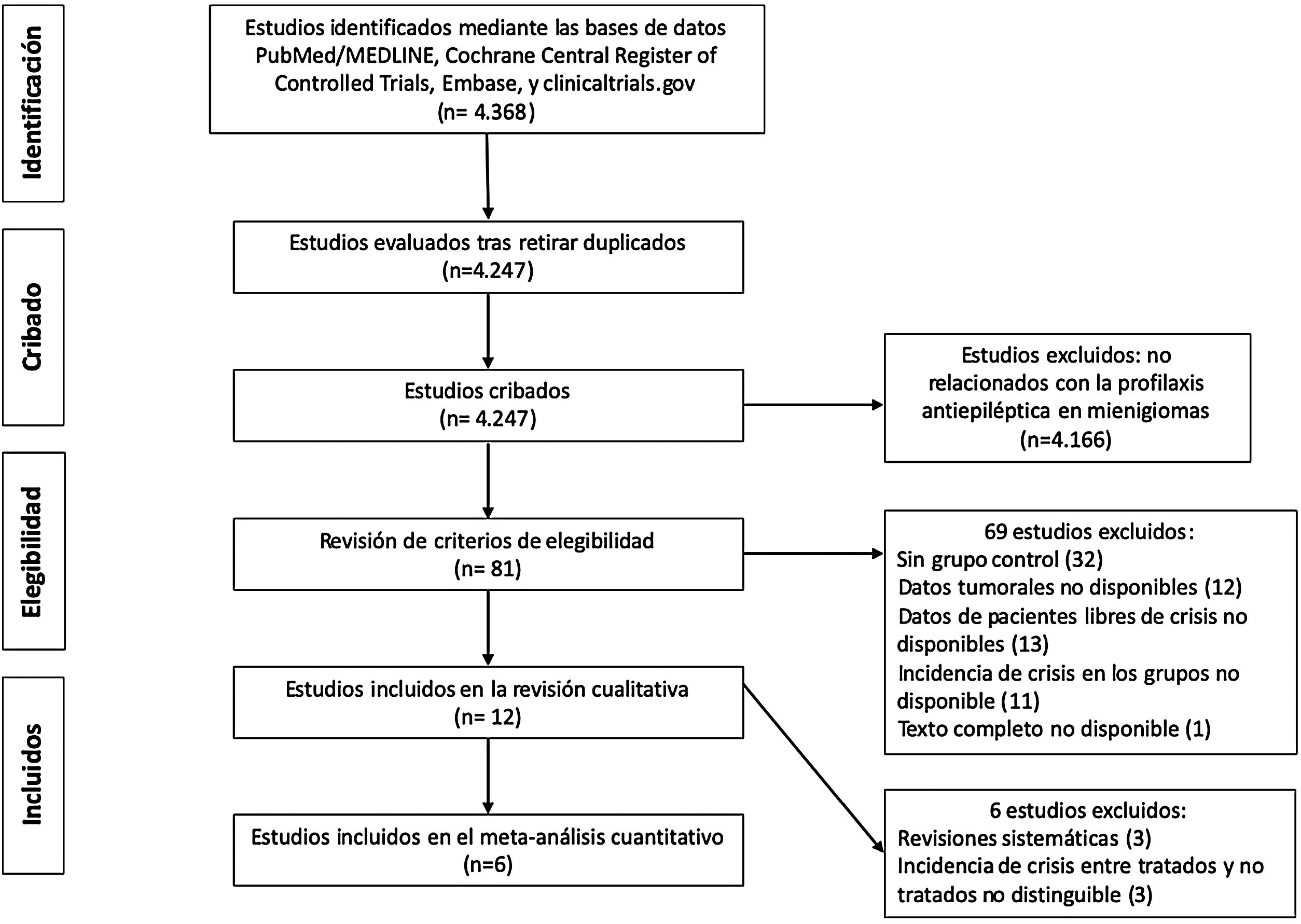
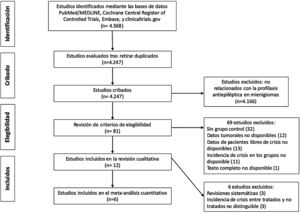
MétodosSe realizó una búsqueda sistemática en las bases de datos PubMed/MEDLINE, Cochrane Central Register of Controlled trials, Embase y clinicaltrials.gov. De los 4.368 estudios inicialmente identificados, finalmente se incluyeron 12 para la extracción de datos y análisis cualitativo. Los datos clínicos permitieron incluir únicamente 6 estudios en el metaanálisis. Se realizaron estudios de heterogeneidad, cálculo de OR combinada, evaluación del sesgo de publicación y análisis de sensibilidad.
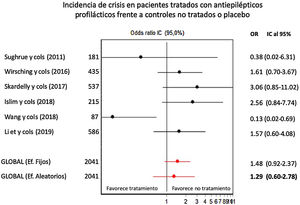
ResultadosLa profilaxis con FAE en meningiomas sin crisis previas no redujo de forma significativa la incidencia de crisis postoperatorias respecto a los controles (OR combinada de Mantle-Haenszel, efectos aleatorios, de 1,26, IC del 95%, 0,60-2,78, sobre 2.041 pacientes). Sin embargo, la ausencia de estudios prospectivos, la presencia de sesgo de selección en los estudios, una probable infraestimación del número de crisis durante el seguimiento y la influencia marcada de un estudio sobre el efecto global impiden establecer una recomendación sólida en contra de la profilaxis anticomicial.
ConclusionesDentro de las limitaciones de esta revisión, los resultados del metaanálisis no apoyan el uso rutinario de la profilaxis antiepiléptica en pacientes con meningiomas sin historia previa de crisis.
No formal indication currently exists for seizure prophylaxis in neurosurgical oncology patients. Neither have specific recommendations been made on the use of antiepileptic drugs (AED) in seizure-free patients with meningiomas scheduled for surgery. AEDs are generally prescribed on a discretionary basis, taking into consideration a range of clinical and radiological risk factors. We present a systematic review and meta-analysis exploring the effectiveness of antiepileptic prophylaxis in patients with meningioma and no history of seizures.
MethodsWe performed a systematic review of the PubMed/MEDLINE, Cochrane Central Register of Controlled Trials, Embase, and clinicaltrials.gov databases. Of a total of 4368 studies initially identified, 12 were selected for extraction of data and qualitative analysis. Based on the clinical data presented, we were only able to include 6 studies in the meta-analysis. We performed heterogeneity studies, calculated a combined odds ratio, evaluated publication bias, and conducted a sensitivity analysis.
ResultsAED prophylaxis in patients with meningioma and no history of seizures did not significantly reduce the incidence of post-operative seizures in comparison to controls (Mantel-Haenszel combined odds ratio, random effects model: 1.26 [95% confidence interval, 0.60-2.78]; 2041 patients). However, we are unable to establish a robust recommendation against this treatment due to the lack of prospective studies, the presence of selection bias in the studies reviewed, the likelihood of underestimation of seizure frequency during follow-up, and the strong influence of one study on the overall effect.
ConclusionsDespite the limitations of this review, the results of the meta-analysis do not support the routine use of seizure prophylaxis in patients with meningioma and no history of seizures.
Las crisis epilépticas son eventos comunes en la historia natural de los pacientes portadores de meningiomas intracraneales. Entre un 20 y un 40% de los pacientes presentan crisis en el momento del diagnóstico y otro 20-30% las desarrollarán más adelante en el curso de la enfermedad1,2. Las crisis epilépticas son una fuente potencial de morbilidad, impactan negativamente en la calidad de vida, pueden conducir a deterioro neurocognitivo y dificultan o impiden ciertas actividades de la vida diaria como la conducción3-7.
Un mayor tamaño, la localización fronto-parietal, en convexidad craneal o parasagital y un marcado edema cerebral peritumoral son factores de riesgo conocidos que predisponen a desarrollar crisis epilépticas preoperatorias en los pacientes con meningiomas cerebrales7-9. Así mismo, existe mayor riesgo de crisis postoperatorias cuando estas se presentaron de forma preoperatoria, en presencia de complicaciones quirúrgicas, tras resecciones parciales, en tumores de mayor grado histológico, o en pacientes con tumores recidivantes o en progresión1,3,7-9. Entre los pacientes sin historia previa de crisis, la localización en convexidad fronto-parietal y la desviación de línea media predisponen a crisis posquirúrgicas3.
Entre los pacientes con crisis previas, la resección quirúrgica del meningioma consigue que un 60 a un 90% queden libres de crisis a medio y largo plazo10-12. Sin embargo, la propia cirugía provoca crisis de nueva aparición en el 12 al 19% de los pacientes sin crisis previas, la mayoría en los primeros días o semanas tras la cirugía12. Por tanto, es importante conocer si la profilaxis con fármacos antiepilépticos (FAE) es eficaz en pacientes sin historia previa de crisis. Algunas revisiones, metaanálisis y guías de instituciones oficiales han publicado recomendaciones en contra de la utilización rutinaria de FAE como profilaxis anticomicial en pacientes que se van a intervenir de meningiomas, aunque reconocen una ausencia de evidencia sólida en contra1-3,8,9,13,14. Dada la escasez de estudios prospectivos y la inexistencia de ensayos aleatorizados sobre el tema, la práctica habitual se basa en una indicación discrecional de dicha profilaxis, a juicio del médico responsable, teniendo en cuenta los diversos factores de riesgo de crisis perioperatorias antes mencionados15.
Dos recientes revisiones sistemáticas1,9 han analizado el papel de la profilaxis anticomicial en neurocirugía oncológica general y otra revisión15 evalúa el efecto específicamente sobre meningiomas, aunque no proporciona un análisis cuantitativo debido a la falta de datos. En este trabajo, realizamos una revisión sistemática de la literatura respecto a la eficacia de la profilaxis antiepiléptica en pacientes portadores de meningiomas sin historia previa de crisis.
Material y métodosDiseño del estudio y criterios de búsqueda bibliográficaSe realiza una revisión sistemática de la literatura y un metaanálisis siguiendo los criterios Preferred Reporting Items for Systematic Review and Meta-Analysis (PRISMA)16. El objetivo del estudio era evaluar la eficacia de la profilaxis antiepiléptica en la prevención de crisis postoperatorias en pacientes sin historia previa de crisis portadores de meningiomas craneales. La revisión sistemática de la literatura se realizó por 2autores de forma independiente (PDL y SOC) mediante las bases de datos PubMed/MEDLINE, Cochrane Central Register of Controlled Trials, Embase, y clinicaltrials.gov, el día 16 de marzo del 2020. Los términos de búsqueda (palabras clave) fueron: prohylaxis, prophylactic, prevention, preventive, AED, AEDs, seizures, epilepsy, epileptic fit, antiepileptic, anticonvulsant, phenytoin, levetiracetam, valproic, carbamazepine, gabapentin, meningioma, benign meningioma, atypical, anaplastic, malignant, grade II, grade II, grade III, brain tumor, extraaxial, craniotomy, resection, biopsy, surgery, postoperative, y perioperative. Se emplearon combinaciones de estos términos mediante los operadores booleanos necesarios para hacer la búsqueda lo más extensiva y completa posible. Así mismo, se revisaron los artículos relacionados y las listas de referencias de los trabajos más destacados. En principio, no se impusieron limitaciones en términos de idioma, tipo de publicación o período. Una vez eliminados los trabajos duplicados, se emplearon los títulos y los resúmenes en un cribado inicial (véase la gráfica PRISMA de la figura 1) para seleccionar trabajos específicamente relacionados con la profilaxis antiepiléptica en meningiomas intervenidos. Las discrepancias entre los 2revisores se solventaron por consenso. Finalmente, 81 trabajos fueron revisados a texto completo y tratados mediante los criterios de inclusión.
Criterios de inclusión y extracción de datosSe incluyeron todos los estudios referentes a cualquier tipo de FAE empleado como profilaxis antiepiléptica en pacientes con meningiomas intervenidos sin historia previa de crisis. El estudio cuantitativo (metaanálisis) se realizó con datos provenientes de series exclusivamente de meninigomas, no de series oncológicas mayores dentro de las cuales se incluían meningiomas además de otros tumores cerebrales. Se incluyeron series con al menos un 50% de los pacientes libres de crisis antes de la cirugía y que fueron intervenidos mediante craneotomía como tratamiento primario. Se excluyeron todos los estudios sin grupo control (placebo o no tratamiento), aquellos que comparaban 2o más FAE y los estudios en los que no se disponía de datos respecto a la incidencia de crisis postoperatorias. También se excluyeron del metaanálisis los trabajos en los que no se pudo distinguir la incidencia de crisis entre los pacientes tratados mediante profilaxis y los controles. De los estudios finalmente seleccionados, se registró el tipo de estudio, el año de publicación, el número de pacientes, la medicación empleada, el esquema y la duración del tratamiento, la incidencia de crisis tempranas o tardías, la duración del seguimiento, las complicaciones, las conclusiones generales y la calidad y las limitaciones del estudio.
Evaluación de la calidad y análisis estadísticoSe calcularon las odds ratio (OR) combinadas para la efectividad de la profilaxis antiepiléptica frente a los controles con intervalos de confianza (IC) del 95%. Dado que no se identificaron ensayos aleatorizados, la calidad de los estudios observacionales (prospectivos o retrospectivos) se evaluó mediante la versión revisada y validada de la escala Methodological Items for Non-Randomized Studies (MINORS)17. Para el cálculo de riesgos combinados se empleó el modelo de efectos aleatorios de Mantle-Haenszel. La heterogeneidad entre estudios se estimó mediante el gráfico de Galbraith y se cuantificó con el estadístico Q mediante el test de heterogeneidad de Dersimonian-Laird. El sesgo de publicación se estimó mediante diagramas de embudo y las pruebas de Begg y Egger. Se realizó un estudio de sensibilidad (repetición del metaanálisis omitiendo un estudio cada vez) para detectar la influencia de cada uno de los estudios en la estimación global del efecto. Para el análisis estadístico y la composición de gráficos se empleó el paquete estadístico libre Epidat 3.1 (SERGAS, Servicio Gallego de Salud, España).
ResultadosRevisión de los estudios seleccionadosSe identificaron inicialmente un total de 4.368 estudios (fig. 1). Una vez descartados los estudios duplicados, se cribaron 4.247 trabajos mediante el título y el resumen. Se realizó un examen detallado del texto completo de 81 estudios que cumplieron los criterios de elegibilidad. Para el estudio cuantitativo se excluyeron los trabajos no estrictamente relacionados con la profilaxis anticomicial en meningiomas sin crisis previas. La tabla 1 muestra las características principales de los 12 estudios seleccionados para el análisis cualitativo1,3,7,15,18-26. Únicamente 6 estudios aportaban datos clínicos sobre la incidencia de crisis en pacientes con y sin tratamiento profiláctico y pudieron incluirse en el metaanálisis3,7,19-21,23.
Resumen de las características más relevantes de los estudios incluidos en la revisión sistemática
| Autor, año | Diseño del estudio | Pacientes, uso de FAE | Resultado: incidencia de crisis | Comentarios y limitaciones |
|---|---|---|---|---|
| Youngerman et al.1, 2020 | Revisión retrospectiva de pacientes con masas cerebrales que se someten a cirugía, de la base de datos norteamericana MarketScan. De 1 de julio del 2009 a 30 de junio del 2013 | 5.895 masas intracraneales; 4.110 pacientes libres de crisis; 1.671 recibieron profilaxis con FAE (40.7%). Empleada en el 61,9% de los meningiomas. Levetiracetam empleado en el 78,5% y fenitoína en el 20,5% | Las lesiones malignas fueron más frecuentemente tratadas con FAE (42-52%) comparadas con las benignas (23%). La duración pico de profilaxis fue de 30 días. No aporta datos de incidencia de crisis diferenciados por tratamiento o control. No evidencia de beneficio de la profilaxis ni guías de consenso disponibles | Empleo muy variable de la profilaxis. No se menciona la toxicidad de la medicación. No se distingue el tratamiento postoperatorio de crisis de nueva aparición de la profilaxis. Estudio basado en aseguradora privada. Detección subóptima de crisis postoperatorias |
| Li et al.19, 2019 | Estudio unicéntrico retrospectivo. Entre 2011 y 2012 | 778 meningiomas supratentoriales; 678 sin crisis previas; 661 recibieron profilaxis con FAE (97,5%). Tipo y duración de FAE no descritos | 60/586 crisis postoperatorias en pacientes libres de crisis; 55/515 con FAE y 5/71 controles. Mayor riesgo de crisis preoperatoria si localizado en corteza motora, edema de> 1 cm. Mayor riesgo de crisis postoperatoria si diámetro>3,5 cm, crisis durante el ingreso, recidiva o progresión | Libre de crisis a 5 años el 59% si crisis previas y del 87% si no. La profilaxis fue ineficaz. Considerar FAE en casos de alto riesgo. Probable sesgo de infraestimación de crisis a largo plazo, sesgo de recuerdo. Duración del tratamiento no descrita |
| Islim et al.3, 2018 | Estudio unicéntrico retrospectivo. Entre 2010 y 2015 | 283 meningiomas; 215 sin crisis previas; 19 recibieron FAE (8,1%), 196 controles. Fenitoína 48%, levetiracetam 26%. Duración de la profilaxis muy variable (1-1.092 días) | 5/19 crisis postoperatorias en tratados y 24/196 en no tratados. Factores de riesgo en pacientes libres de crisis: convexidad frontal y desviación línea media. Tiempo medio hasta primera crisis: 58 días | Profilaxis con FAE disminuye el riesgo a 1 año en un 40% (no significativo). Profilaxis recomendada en pacientes con más de 1 factor de riesgo. Tipo y duración del FAE variable. No se comunican efectos adversos |
| Wang et al.7, 2018 | Estudio unicéntrico retrospectivo. Solo meningiomas atípicos y anaplásicos intervenidos. De junio del 2001 a noviembre del 2009 | 102 meningiomas; 87 sin crisis previas; 51 recibieron FAE (58,6%), 36 controles. Duración profilaxis: 5-7 días | 8/36 crisis tempranas and 13/36 tardías en tratados; sin crisis en no tratados (0/51). Mayor riesgo: si crisis preoperatoria, convexidad, parasagital, edema, no uso de FAE y lesión en recidiva | La profilaxis con FAE previno crisis tempranas, pero no tardías. Mayor impacto en atípicos que en anaplásicos. La resección radical aumentó el riesgo de crisis postoperatoria. Sesgo de selección evidente. Solo se contabilizan crisis diagnosticadas clínicamente |
| Xue et al.18, 2018 | Estudio unicéntrico retrospectivo. Seis años de seguimiento. Entre 2006 y 2008 | 113 meningiomas; 92 sin crisis previas; solo 3 recibieron profilaxis con FAE (3,3%)Carbamacepina la más empleadaDuración FAE no especificada | 13/92 crisis de nueva aparición tras la cirugía (14%).Factores de riesgo de crisis preopeatoria: diámetro> 3,5; para crisis postoperatoria: diámetro> 3,5 cm e historia de crisis previas | Un tercio de los pacientes con crisis previas quedaron libres de crisis a largo plazo, mientras que un 14% tuvo crisis de novo tras la cirugía. Incidencia de crisis entre tratados y no tratados no distinguible. Probable sesgo de recuerdo en las entrevistas |
| Islim et al.15, 2017 | Revisión sistemática sin metaanálisis cuantitativo. Incluye 11 estudios | 1.143 pacientes con meningiomas sin crisis previas; en 10 estudios, el 100% recibió profilaxis. Globalmente, 776 recibieron profilaxis con FAE (67,9%). Fenitoína, levetiracetam, valproico, otros. Duración FAE descrita en un único estudio | Crisis postoperatorias tempranas en 20/766 de los tratados y 10/377 de controles. Crisis postoperatorias tardías en 52/766 de tratados y 29/377 de controles; diferencias no significativas | No realizan metaanálisis por falta de datos. No recomiendan profilaxis rutinaria en meningiomas sin historia previa de crisis. Grupos de tratamiento y controles no equilibrados. Solo 2 estudios aportan datos de incidencia de crisis en tratados frente controles |
| Skardelly et al.20, 2017 | Estudio unicéntrico retrospectivo. De 2007 a 2012 | 634 meningiomas; 537 sin crisis previas; 23 recibieron profilaxis con FAE (4,3%). Levetiracetam en 18, otros en 5 pacientes | Crisis postoperatorias tempranas en 3/23 de los tratados y en 24/514 de los controles. Mayor riesgo de crisis preop: varón, no base de cráneo,> 8 cc | La profilaxis con FAE no redujo la incidencia de crisis postoperatorias tempranas. Sin datos sobre timing y duración de FAE. Sin protocolo de detección de crisis postoperatorias, probable infraestimación |
| Wirsching et al.21, 2016 | Estudio unicéntrico retrospectivo. De 2000 a 2013 | 779 meningiomas; 535 sin crisis previas; 244 recibieron profilaxis con FAE (41,8%). Fenitoína la más prescrita. Analizan el seguimiento del primer año | Crisis postoperatorias tempranas en 18/244 de los tratados y en 9/291 de los controles. Crisis postoperatorias tardías en 48/244 y 29/291, respectivamente. Mayor riesgo de crisis postoperatorias: si crisis preoperatoria, complicaciones quirúrgicas, menor edad y progresión tumoral | El 59% de los pacientes con crisis previas quedaron libres de crisis tras la cirugía. El 19,4% de los pacientes sin crisis previas tuvieron crisis de novo tras la cirugía. La profilaxis con FAE no resultó eficaz. Los pacientes en grados ii y iii y que presentaron más complicaciones recibieron más FAE |
| Englot et al.22, 2016 | Revisión sistemática y metaanálisis. Incluye 6 estudios en metaanálisis. Publicaciones entre enero de 1980 y septiembre del 2014 | 39 estudios observacionales, no ensayos clínicos; 4.709 meningiomas supratentoriales, crisis previas en 29,2%; 1.085 sin crisis previas; 402 recibieron profilaxis con FAE (75,7%, 402/531) | Crisis postoperatorias en 55/402 de los tratados y en 17/129 de los controles (datos de 6 estudios). Mayor riesgo de crisis preoperatoria: varón, edema, no base de cráneo, no cefalea. Mayor riesgo de crisis postoperatoria: edema, crisis preoperatoria | En pacientes sin crisis previas, el 69,3% quedó libre de crisis tras la cirugía. Crisis de novo en pacientes sin crisis previas en 12,3%. Timing y duración de los FAE no especificados. Sesgo de selección de estudios. Sesgo de recuerdo y heterogeneidad entre estudios |
| Sughrue et al.23, 2011 | Estudio unicéntrico retrospectivo. Solo meningiomas de convexidad. Entre 1991 y 2009 | 180 meningiomas sin crisis previas; 129 recibieron profilaxis con FAE (71,7%). Duración profilaxis: 7 días postoperatorios | Ninguno de 129 tratados y 1/51 controles desarrollaron crisis postoperatorias tempranas. No se detectaron crisis tardías | No recomienda profilaxis en meningiomas de convexidad dada la baja incidencia de crisis postoperatoria. Probable infraestimación de crisis subclínicas |
| Komotar et al.24, 2011 | Revisión sistemática de estudios entre 1979 y 2010. Incluye 19 estudios | 19 estudios con 698 meningiomas supratentoriales. Todos sin crisis previas. Profilaxis con FAE en 19 estudios; controles no tratados en 6 estudios | Crisis postoperatorias tempranas en 8/553 de los tratados y 2/145 de los controles. Crisis postoperatorias tardías en 42/475 de los tratados y en 13/145 de los controles | Sin diferencias significativas en la incidencia de crisis postoperatorias tempranas y tardías entre tratados y controles. En las cohortes no tratadas no se proporciona el diámetro tumoral. Resecciones más amplias en los no tratados. Sesgo de recuerdo. Heterogeneidad interestudios considerable |
| Chozick et al.25, 1996 | Estudio unicéntrico retrospectivo. De enero de 1980 a noviembre de 1992 | 158 meningiomas supratentoriales; 95 sin crisis previas; 63 con crisis previas. Todos los pacientes con crisis previas recibieron FAE antes de la cirugía. Globalmente, el 88,9% de los pacientes con crisis previas quedaron libres de crisis a largo plazo | Crisis postoperatorias en 24/63 y 8/95 de los pacientes con y sin crisis previas, respectivamente. El 40% de pacientes con crisis previas quedaron libres de crisis tras la cirugía. Mayor riesgo de crisis postoperatorias: si crisis preoperatoria, localización parietal | La cirugía influye positivamente en la incidencia de crisis postoperatoria. Los pacientes con crisis de novo presentaban en mayor medida histología atípica, secuelas permanentes postoperatorias, resecciones subtotales, recidivas y localización parietal |
Todas las series incluyeron meningiomas supratentoriales de diversas localizaciones intervenidos mediante craneotomía (no se incluyó a pacientes tratados mediante biopsia estereotáctica). No se identificaron ensayos aleatorizados ni series prospectivas. Nueve estudios presentaban series retrospectivas unicéntricas1,3,7,19-21,23-25 y 3 eran revisiones sistemáticas15,22,24. Globalmente, las series incluyeron una mediana de 634 pacientes (rango 102 a 4.709 pacientes) y una proporción relevante de meningiomas libres de crisis, entre el 68,7 y el 100%, con la excepción de la extensa revisión sistemática de Englot et al.22. El porcentaje de pacientes libres de crisis que recibieron profilaxis con FAE fue variable, con 3 series de tan solo el 3,3, el 4,3 y el 8,1%, y el resto, en general, por encima del 50%, desde el 41,8 al 97,5%.
Los FAE más empleados fueron levetiracetam y fenitoína. La duración de la profilaxis fue muy variable, no descrita en todos los estudios y mayoritariamente restringida al período postoperatorio inicial. La incidencia de crisis postoperatorias en tratados y no tratados estaba disponible en 6 estudios3,7,19-21,23. Se evidenció un alto consenso respecto a los factores de riesgo prequirúrgicos de crisis y a los factores de riesgo de aparición de nuevas crisis tras la cirugía. Casi todos los estudios indicaron limitaciones en sus conclusiones respecto a la posibilidad de extrapolar los resultados, debido a la naturaleza retrospectiva de los mismos y a la posible infraestimación de la incidencia de crisis posquirúrgicas durante el seguimiento de los pacientes.
Ningún estudio recomendó la profilaxis antiepiléptica de forma rutinaria en meningiomas libres de crisis, en general aludiendo a una relativamente baja incidencia de crisis postoperatorias15,20,21,23,24. Sin embargo, los diversos autores coincidieron en la necesidad de tener en cuenta diversos factores de riesgo de cara a la prescripción de FAE de forma discrecional y particularizando en cada caso, especialmente en pacientes con meningiomas de convexidad fronto-parietal, con marcado edema perilesional, en resecciones parciales, en tumores de mayor grado histológico, en pacientes que desarrollan complicaciones perioperatorias y en tumores recidivantes3,7,18-20. La mayoría de los estudios identificaron las crisis preoperatorias como factor de riesgo importante de crisis postoperatorias y coincidieron en la eficacia de la cirugía para reducir la probabilidad de persistencia de crisis a largo plazo15,24,25. Los estudios incluidos en el metaanálisis no analizaron de forma específica la posible morbilidad o toxicidad asociada a la medicación.
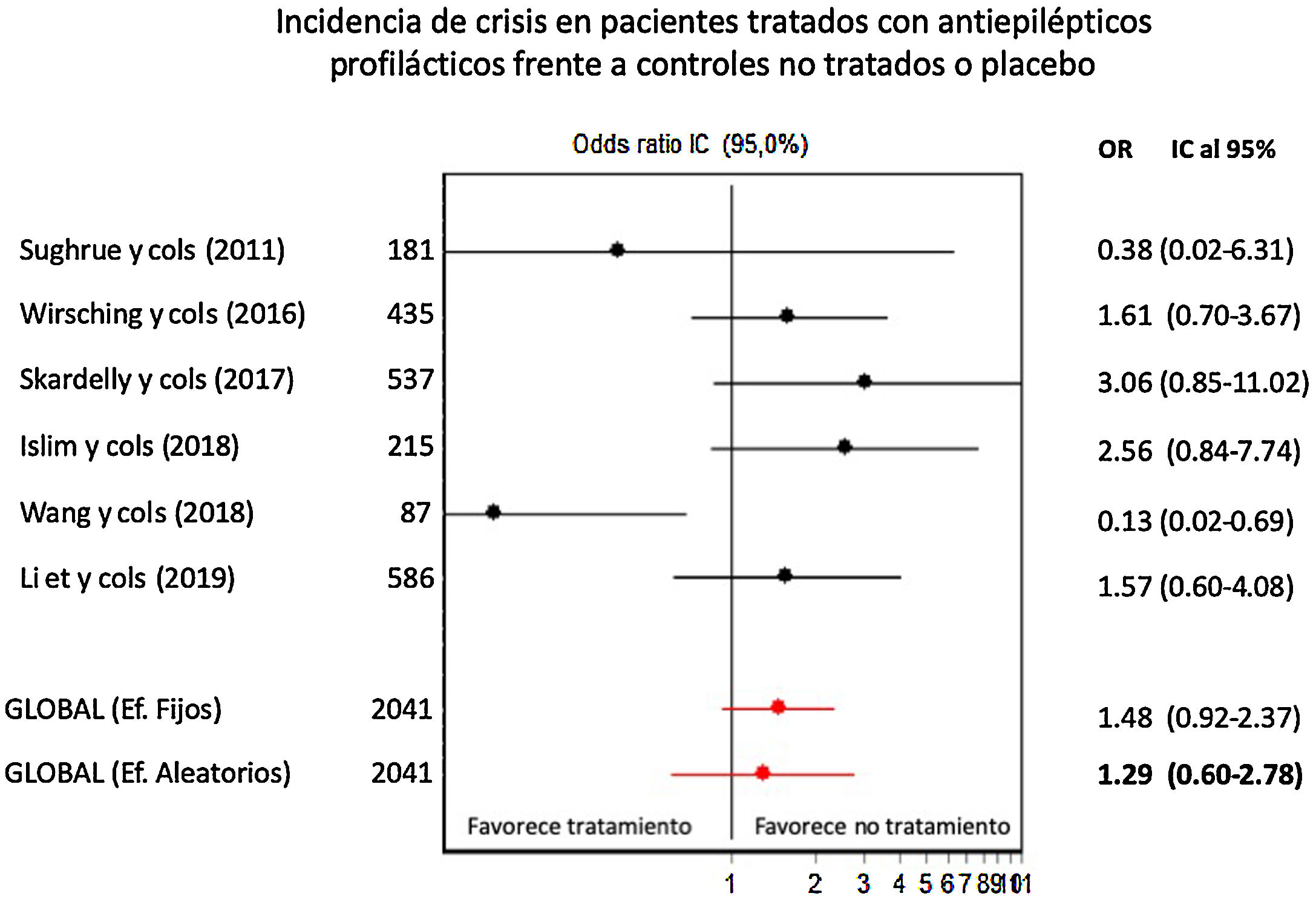
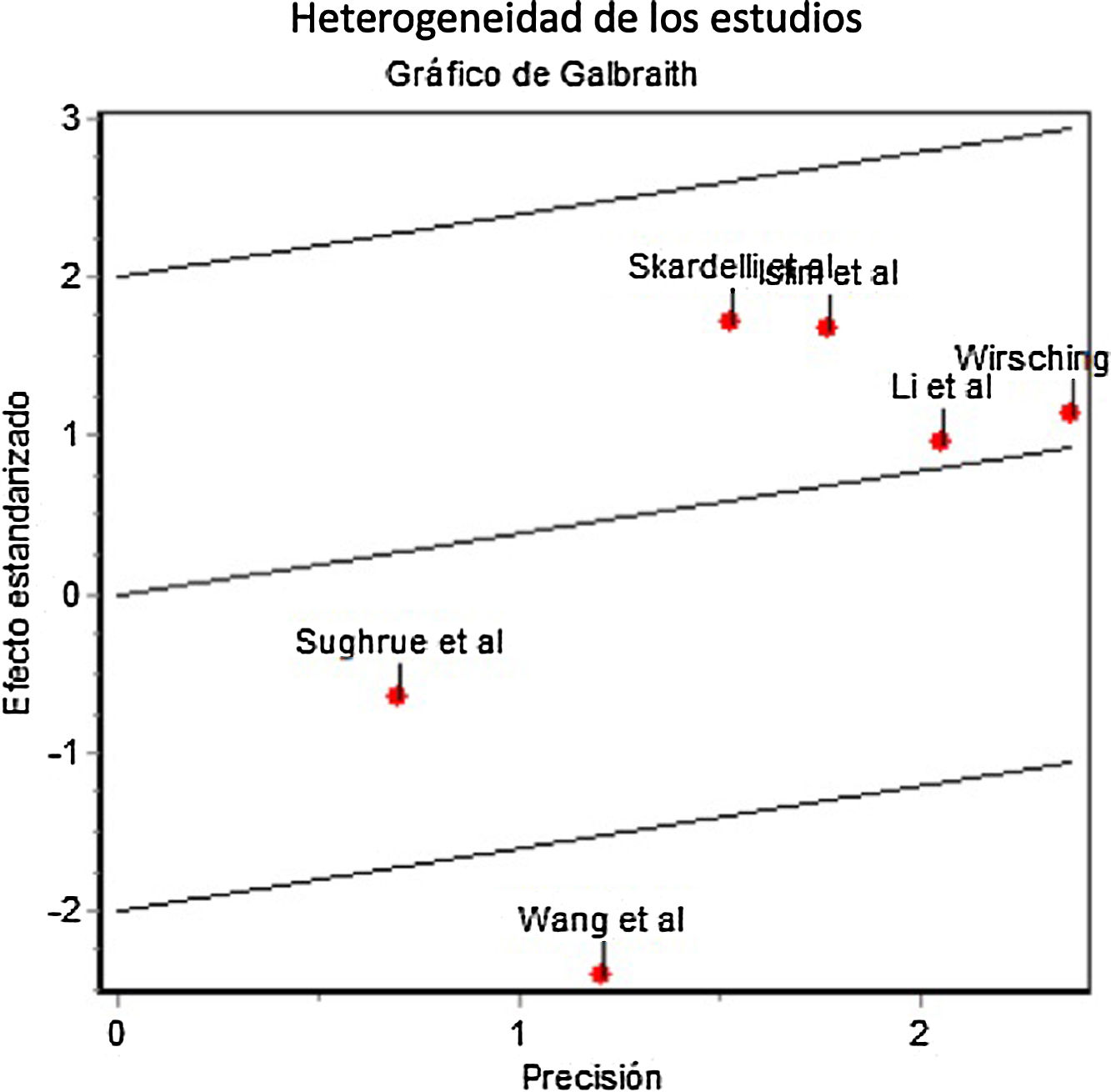
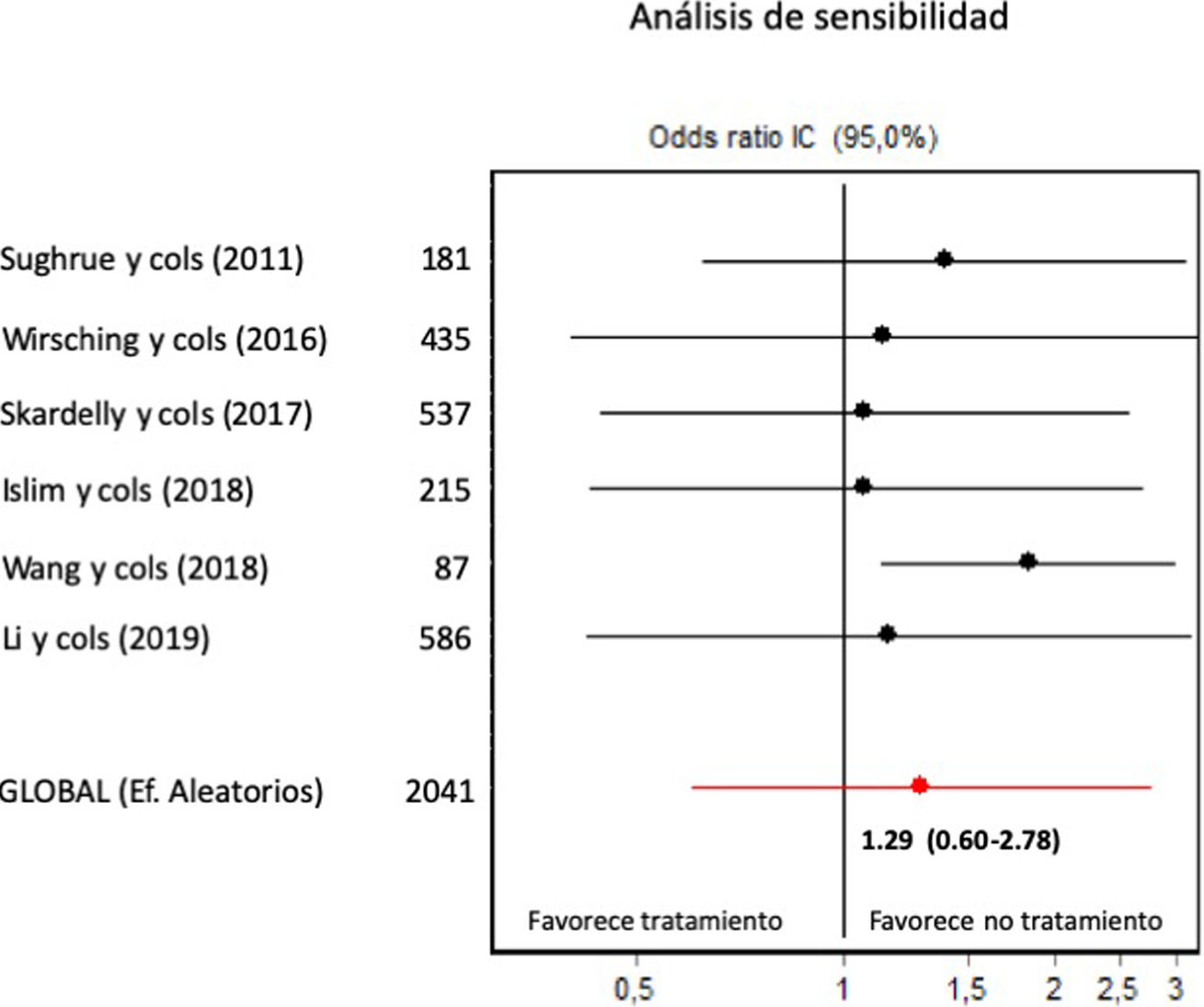
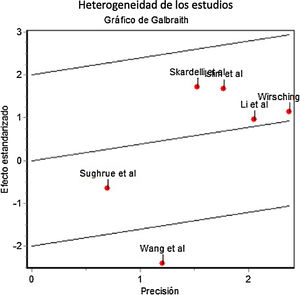
Profilaxis antiepiléptica en pacientes con meningiomas sin crisis previasSe calculó el riesgo de crisis postoperatorias en pacientes tratados con profilaxis antiepiléptica frente a los controles, sobre una muestra de 2.041 pacientes provenientes de 6 estudios. La profilaxis antiepiléptica no redujo de forma significativa la incidencia de crisis postoperatorias en pacientes con meningiomas previamente libres de crisis (OR combinada de Mantle-Haenszel, efectos aleatorios, de 1,26, IC del 95%, 0,60-2,78). La figura 2 muestra los cálculos de OR individuales y combinada de los estudios y su representación gráfica. Se evidenció cierta heterogeneidad entre estudios no significativa (test de Dersimonian-Laird, Q=11,43, p=0,043). La varianza interestudios fue 0,47 y la proporción de la varianza total atribuible a la varianza interestudios fue del 58%. El gráfico de Galbraith (que muestra la precisión de cada estudio, esto es, la inversa del error estándar frente al efecto estandarizado) mostró que un único estudio contribuía significativamente a la heterogeneidad global (fig. 3).
Gráfico de efectos combinados (forest plot) indicando OR individuales y combinada, con IC del 95%, de la eficacia de la profilaxis antiepiléptica en la prevención de crisis postoperatorias en pacientes portadores de meningiomas craneales sin historia previa de crisis. Las OR por encima de 1 indican mayor incidencia de crisis en pacientes tratados.
Gráfico de Galbraith que muestra la precisión de los estudios frente al efecto estandarizado. Nótese que el estudio de Wang et al.7 se encuentra más allá de los límites de confianza, lo que sugiere una contribución relevante a la heterogeneidad entre estudios.
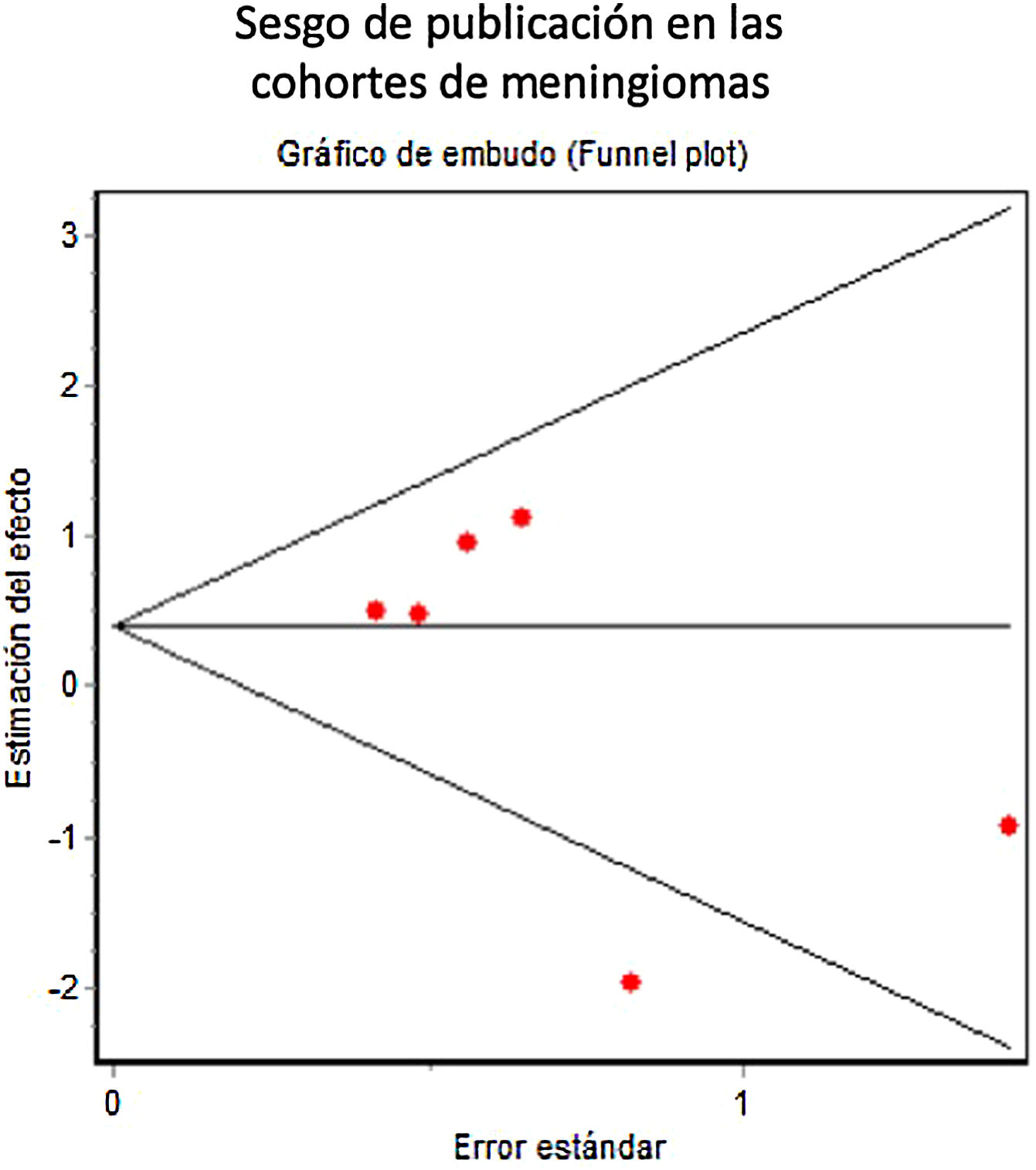
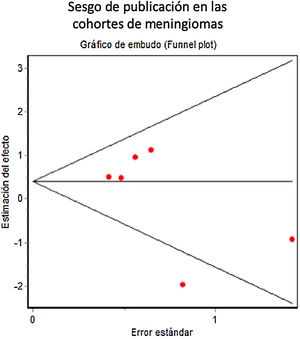
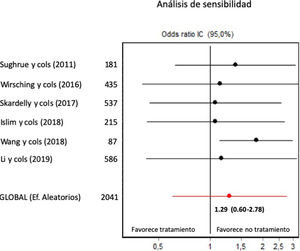
No se incluyó ningún ensayo aleatorizado en la revisión. En los estudios observacionales retrospectivos, se constató una puntuación mediana de 17 en la escala MINORS (rango 13 a 20, sobre un máximo posible para estudios comparativos de 24). El gráfico de embudo mostró una ausencia de sesgo de publicación significativa (fig. 4). Los coeficientes de Begg y Egger (0,37, p=0,70 y –1,24, p=0,28, respectivamente) también sugirieron ausencia de sesgo de publicación significativo. Sin embargo, el análisis de sensibilidad (fig. 5) mostró que el efecto global se influía sustancialmente por el efecto particular del estudio de Wang et al.7. Al eliminar dicho estudio (de tendencia contraria al efecto global), la OR combinada de los 5 estudios restantes fue de 1,84 (IC del 95%, 1,12-3,01, sobre 1.954 pacientes, Q=2,34, p=0,67, coeficiente de Begg=0,24, p=0,80, coeficiente de Egger=–0,66, p=0,55), lo que sugería un efecto contraproducente de los FAE sobre la aparición de crisis postoperatorias.
El análisis de sensibilidad (repetición del metaanálisis omitiendo un estudio cada vez) muestra que el estudio de Wang et al.7 produce una marcada influencia, en sentido contrario, sobre el efecto global.
Los resultados de esta revisión sistemática apoyan la idea extendida de que la profilaxis anticomicial, en pacientes portadores de meningiomas y libres de crisis, no está indicada de forma sistemática, y subraya la importancia de ciertos factores de riesgo prequirúrgico para desarrollar crisis postoperatorias. De hecho, el resultado del metaanálisis sugiere un impacto nulo o incluso negativo de la medicación antiepiléptica en la prevención de crisis. Este efecto paradójico podría explicarse en parte por la naturaleza retrospectiva de los estudios incluidos, que llevan a 2tipos de sesgos. En primer lugar, existe un sesgo de selección reconocido por diversos autores de los trabajos, en los que se tendió a dar profilaxis preferentemente a los pacientes más graves. En todas las cohortes, recibieron más FAE los pacientes con mayor riesgo de crisis postoperatorias, es decir, aquellos con tumores de mayor tamaño, de localización cortical frontal o parietal y de mayor grado histológico. En segundo lugar, casi todos los trabajos incluyeron entre sus limitaciones la posibilidad real de haber infraestimado la incidencia de crisis a lo largo del período de seguimiento postoperatorio.
Nuestro estudio cuantitativo se realizó sobre la base de series exclusivamente de pacientes con meningiomas intervenidos, y no pertenecientes a series oncológicas más amplias que incluían otros tipos de tumores cerebrales primarios o secundarios, en los que el efecto global de la profilaxis podría haber estado enmascarado por la influencia del tratamiento en el resto de tumores. Algunos autores han cuestionado la validez de los metaanálisis basados exclusivamente en series retrospectivas, a pesar de realizarse con criterios de selección, inclusión y análisis estadístico adecuados26. La calidad global de los estudios incluidos en nuestro metaanálisis podría considerarse intermedia, de acuerdo con la puntuación media referida. Los estudios de sensibilidad y de sesgo de publicación mostraron, sin embargo, que un estudio7 influía significativamente en sentido contrario al efecto global combinado. Es interesante resaltar que dicho estudio solo incluía meningiomas de grado ii y ii (atípicos y anaplásicos), subgrupo que parece beneficiarse más del tratamiento profiláctico que los meningiomas benignos, mucho más frecuentes. De hecho, cuando se retiró este estudio del análisis, la OR combinada alcanzó la significación estadística, sugiriendo la ineficacia del tratamiento antiepiléptico preventivo. Así mismo, algunos autores sugieren que la evaluación del sesgo de publicación es también cuestionable cuando se incluyen menos de 10 estudios en el análisis9.
Por tanto, esta revisión apoya la práctica habitual de prescribir FAE de forma discrecional según la opinión del neurocirujano, neurólogo u oncólogo responsable del paciente. Dado que la presencia de crisis postoperatorias tiene implicaciones físicas, emocionales y legales relevantes, es preciso encontrar un equilibrio, para cada paciente en particular, entre el posible efecto deletéreo de tener crisis repetidas frente a la toxicidad de los FAE y su coste. Hasta que estudios futuros diluciden esta cuestión, es necesario tener en cuenta diversos factores de riesgo clínicos y radiológicos. Por otro lado, dado que los FAE empleados son generalmente bien tolerados y no excesivamente costosos, algunos autores propugnan administrar profilaxis antiepiléptica de forma sistemática a todos los pacientes a pesar de una ausencia de evidencia sólida a favor8,27.
Los pacientes con meningiomas cuyo diámetro es mayor de 3-3,5cm y con amplia expresión cortical conllevan un riesgo de crisis postoperatorias muy significativo, según varios estudios y revisiones sistemáticas3,19-21. Antes de disponer del estudio anatomopatológico, ciertas características radiológicas sugieren un comportamiento biológico más agresivo y, por tanto, mayor riesgo de crisis postoperatorias. Estos hallazgos radiológicos son: mayor volumen tumoral, contorno tumoral irregular y no esférico, ausencia de cola dural, captación heterogénea de contraste, afectación ósea o extraósea evidente, cambios quísticos intratumorales, edema cerebral perilesional y disminución del coeficiente de difusión aparente y aumento del volumen sanguíneo cerebral en las secuencias específicas de resonancia28,29.
La presencia de crisis preoperatorias es un factor de riesgo reconocido de crisis postoperatorias3 y la profilaxis anticomicial en pacientes con crisis previas es una opción razonable y ampliamente utilizada. Tras la cirugía, el grado histológico, el grado de resección y el comportamiento biológico de los posibles restos tumorales condicionan la necesidad de retratamiento y el uso de FAE. Según la extensa serie de Islim et al.3, la localización cortical frontal o parietal y la presencia de una marcada desviación de línea media correlacionan con la incidencia de crisis postoperatorias en pacientes sin crisis previas y los FAE administrados a estos pacientes parecen reducir la incidencia de crisis en un 40% aproximadamente a lo largo del primer año tras la cirugía. Con relación al timing y la duración del tratamiento profiláctico, no existen protocolos estandarizados y algunos autores recomiendan una retirada precoz de la medicación si no ocurren crisis tempranas, mientras que otros abogan por mantener los FAE de forma prolongada, incluso de por vida3,7,15,23. El coste y los efectos secundarios de la medicación son cuestiones a tener en cuenta. En general, levetiracetam se compara favorablemente respecto a fenitoína u otros FAE en cuanto a toxicidad y coste30. Se precisan estudios que evalúen el efecto de los nuevos FAE, como lacosamida, frente a levetiracetam en este contexto.
A nuestro juicio, la cuestión planteada en este metaanálisis podría ser objeto de estudio mediante un ensayo aleatorizado, controlado y ciego, preferentemente multicéntrico. En principio, no creemos que existan condicionantes éticos que impidan su realización, muchos pacientes potencialmente elegibles, el diagnóstico histopatológico está bien estandarizado, el seguimiento clínico y radiológico ya se realiza de forma rutinaria en todos los casos y una evaluación prospectiva de la incidencia de crisis es perfectamente factible. Idealmente, precisaría estratificar por posibles factores de confusión como la localización tumoral, el grado histológico, el grado de resección tumoral, la presencia de edema perilesional, la presencia de complicaciones quirúrgicas y el tipo y la dosis de FAE empleado. Esto implicaría reclutar un número relativamente elevado de participantes, por lo que la colaboración entre centros sería aconsejable. Para minimizar los sesgos, sería necesario definir perfectamente el evento crisis, quién debe confirmar su presencia (paciente, médico, enfermera, familiar) y qué marco temporal se considera antes de iniciar el ensayo.
Tal y como ya ocurre en gliomas31 o ependimomas32, es probable que las futuras clasificaciones de tumores cerebrales incluyan parámetros moleculares para el diagnóstico y la estratificación de los meningiomas, según las diversas mutaciones genéticas y perfiles epigenéticos ya descritos en la literatura. Estos factores correlacionan con la agresividad biológica de los tumores y podrían condicionar la indicación y uso de FAE preventivos. Los actuales análisis de metilación de ADN parecen haber simplificado los 15 subtipos histológicos actuales, divididos en 3 grados histológicos, en únicamente 6 clasesde metilación, que correlacionan con el pronóstico y el comportamiento biológico mejor que la anatomía patológica33. Es probable que dichos test moleculares lleguen a ser importantes factores de riesgo subrogados del comportamiento biológico de los meningiomas, a tener en cuenta a la hora de decidir sobre una eventual profilaxis anticomicial.
Esta revisión sistemática comparte varias de las limitaciones reconocidas en los estudios que la componen. Se emplea un número relativamente reducido de estudios en los cálculos combinados, no se ha podido incluir ningún estudio prospectivo, todos los estudios son retrospectivos con probable sesgo de recuerdo, la mayoría de los autores reconocen un posible sesgo de infraestimación del número de crisis postoperatorias y se emplean varios tipos de medicaciones, esquemas terapéuticos y dosis. Sin embargo, todos los pacientes incluidos son meningiomas confirmados histológicamente y pertenecientes a cohortes con proporciones comparables de pacientes tratados.
ConclusionesEsta revisión sistemática no apoya el uso sistemático de la profilaxis antiepiléptica en pacientes con meningiomas sin historia previa de crisis. Los datos acumulados de varias series retrospectivas no avalan la prescripción rutinaria de FAE preventivos, aunque diversas cuestiones metodológicas y sesgos impiden una recomendación firme en contra. Es preciso contrapesar la eficacia de los FAE frente a su toxicidad, teniendo en cuenta diversos factores clínico-radiológicos que aumentan el riesgo de crisis postoperatorias. La eficacia de la profilaxis antiepiléptica en este contexto puede ser objeto de estudio mediante un ensayo aleatorizado y controlado que tenga en consideración potenciales factores de confusión clínicos, radiológicos y, eventualmente, genéticos.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de interés con relación a la redacción de este manuscrito.
Este estudio no ha recibido financiación alguna pública, privada o de ningún otro tipo.
No se han empleado datos específicos de pacientes en la realización del estudio.