La congelación de la marcha (CDM) es uno de los fenómenos más incapacitantes y menos comprendido de la enfermedad de Parkinson idiopática (EPI). Las lesiones vasculares, objetivadas mediante resonancia magnética nuclear (RMN), podrían contribuir a la aparición o empeoramiento de este síntoma.
Pacientes y métodoSe estudió un grupo de 22 pacientes con EPI avanzada, 12 con episodios de CDM y 10 sin dichos episodios. Se realizó RMN en todos los pacientes y se analizaron, mediante la escala de Fazekas modificada, las lesiones vasculares existentes.
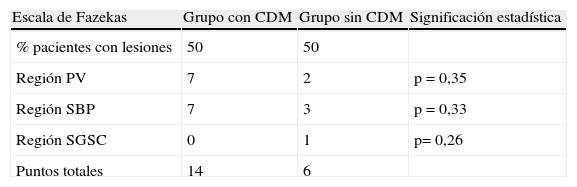
ResultadosLos pacientes con CDM obtuvieron puntuaciones superiores en la escala de Fazekas modificada. Aunque el porcentaje de pacientes que presentaban lesiones vasculares fue el mismo en ambos grupos (50% en los 2 grupos), la carga lesional fue superior en el grupo de pacientes con CDM. Las lesiones vasculares en la región periventricular y en la sustancia blanca profunda son las que parecen estar más implicadas en la aparición de la CDM.
ConclusionesLas lesiones vasculares podrían contribuir a la aparición o al empeoramiento de la CDM en los pacientes con EPI, con este estudio se sugiere que la afección vascular cerebral debe ser considerada en los pacientes con CDM.
Freezing of gait (FOG) is one of the most disabling and enigmatic symptoms in Parkinson's disease. Vascular lesions, observed in magnetic resonance imaging (MRI) scans, may produce or exacerbate this symptom.
Patients and methodsThe study includes 22 patients with Parkinson's disease subjects, 12 with freezing of gait and 10 without. All patients underwent an MRI scan and any vascular lesions were analysed using the modified Fazekas scale.
ResultsPatients with FOG scored higher on the modified Fazekas scale than the rest of the group. Although the two groups contained the same percentage of patients with vascular lesions (50% in both groups), lesion load was higher in the group of patients with FOG. Vascular lesions in the periventricular area and deep white matter seem to be the most involved in the development of FOG.
DiscussionVascular lesions may contribute to the onset or worsening of FOG in patients with PD. This study suggests that cerebral vascular disease should be considered in patients with FOG.
La alteración de la marcha en la EPI, que llamamos «freezing», bloqueo de la marcha o congelación de la marcha (CDM), empezó a describirse de forma más explícita a partir de 1970, cuando el beneficio motor conseguido con la levodopa en otros síntomas de la EP no era tan evidente para este peculiar trastorno1.
Diferentes aspectos de los trastornos de la marcha, como la marcha a pequeño paso, la pérdida de los reflejos posturales y la festinación, eran bien conocidos en la época prelevodopa; en cambio, la CDM, aunque también ha sido mencionado en la literatura clásica, parece ser mucho más evidente tras el tratamiento crónico con levodopa2.
Los episodios de CDM se caracterizan por su aparición episódica (al inicio de marcha, con los obstáculos, con el giro…) y su breve duración. Los pacientes los describen como una sensación de «quedarse pegados al suelo»3.
La CDM puede ocurrir al inicio de la EPI, pero siempre de forma leve; de hecho, la aparición precoz de este síntoma es un signo de alarma que puede cuestionar el diagnóstico de EPI; se suele observar este fenómeno tras años de enfermedad y de tratamiento, cuando los pacientes presentan también complicaciones motoras tras el tratamiento crónico, como fluctuaciones motoras y discinesias4,5.
La CDM no es exclusiva de la EPI, pudiendo aparecer en otros parkinsonismos, incluido el parkinsonismo vascular (PV)5.
El concepto de PV es uno de los más controvertidos en el ámbito de la neurología; clásicamente se denominó «parkinsonismo arterioesclerótico»6, pero este término fue sustituido por el de PV7,8. Aunque clínicamente el PV y la EPI son entidades distintas, a veces no es fácil distinguir si un paciente presenta una EPI, un PV o una EPI con enfermedad vascular cerebral asociada que de alguna manera agrave alguno de los síntomas parkinsonianos9,10.
Nuestro estudio pretende analizar la posible relación de las lesiones vasculares cerebrales con los episodios de CDM, en una serie de pacientes con EPI.
Pacientes y métodoEl estudio se ha llevado a cabo en el Hospital General Universitario de Ciudad Real a lo largo del año 2011. Todos los pacientes firmaron un consentimiento informado para entrar en el estudio.
Se estudió a un grupo de 22 pacientes con EPI avanzada y con complicaciones motoras (fluctuaciones motoras y discinesias), 12 de ellos con episodios de CDM (grupo i) y 10 sin episodios de CDM (grupo ii).
El grupo i presentaba CDM en «off». En todos los pacientes los bloqueos desaparecían o mejoraban en número y/o tiempo de duración en el «on».
Se evaluó cognitivamente a todos los pacientes mediante un MMST y un test del reloj, descartando para el estudio a aquellos pacientes con criterio de demencia según estas escalas.
Las características de los pacientes quedan recogidas en la tabla 1.
Características de los pacientes
| Pacientes | Grupo con CDM, n=12 | Grupo sin CDM, n=10 | Significación estadística |
| Sexo, mujer/Varón | 7/5 | 4/6 | |
| Edad (años) | 63,5 (48-74) | 67,2 (54-80) | |
| Tiempo evolución enfermedad (años) | 9 (2-20) | 8,8 (2-19) | |
| Dosis L-dopa (mg) | 1.266,14 (762,85-1.602,85) | 957,39 (315-1.562,85) | p=0,033 |
| Fenotipo AR/T | 12/0 | 9/1 | |
| UPDRS iii off | 38,6 (24-48) | 29,5 (22-41) | p=0,018 |
| UPDRS iii on | 24,08 (7-39) | 19,5 (13-28) | |
| HyY off | 3,42 (3-5) | 2,95 (2’5-3) | |
| HyY on | 2,57 (2-3) | 2,25 (2-3) |
AR: acinético-rígido; CDM: congelación de la marcha; HyY: Hoenh y Yarh; T: tremórico.
Calculamos la dosis diaria equivalente de levodopa para todas las dosis de levodopa en las diferentes formulaciones (levodopa-carbidopa, levodopa-benseracida, levodopa retardada, levodopa-carbidopa-entacapona) y la dosis diaria total equivalente de levodopa para los agonistas dopaminérgicos, según descripciones previas11 (100mg de levodopa=130 de levodopa retardada=70 de levodopa+entacapona=1mg de pramipexol=5mg de rotigotina=5mg de ropirinol=10mg de apomorfina). Otras medicaciones antiparkinsonianas (amantadina, selegilina o rasagilina) no fueron incluidas en el análisis11.
Los pacientes fueron estudiados después de estar 12h sin tomar la medicación para la EP y una hora después de tomarla, así evaluamos a los pacientes en situación «off» y «on». Se exploraron, desde el punto de vista motor, mediante la UPDRS iii y la escala de Hoenh y Yarh (HyY), ambas en situación «off» y «on». La prueba que utilizamos para explorar la marcha y cuantificar los episodios de CDM consistió en recorrer una distancia de 7 m; los pacientes volvían de nuevo al punto de salida, pasaban, tanto en el trayecto de ida como en el de vuelta, por una puerta entornada y sorteaban un obstáculo. En el camino de vuelta llevaban un vaso de agua. Cuantificamos el tiempo invertido en realizar la prueba en «off» y «on», y los episodios de CDM que presentaron los pacientes.
Se realizó una RM cerebral completa en los 22 pacientes. Dos neurólogos por separado analizaron las secuencias potenciadas en T2 y fluid-attenuated inversion recovery (FLAIR) para cuantificar las lesiones, uno de ellos «a ciegas», sin conocer a los pacientes, con una concordancia en el 85% de los resultados; se tomó como resultado final en los que no había concordancia la decisión del neurorradiólogo de nuestro hospital.
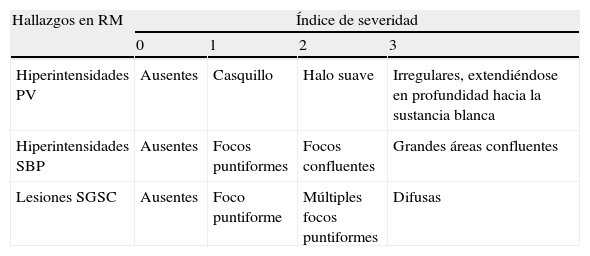
Se utilizó para el análisis de la enfermedad vascular la escala de Fazekas modificada. Esta escala describe las hiperseñales detectadas mediante RM en 3 regiones cerebrales siguiendo un orden ascendente de severidad y frecuencia de los hallazgos: se valoran las hiperseñales periventriculares (P), de la sustancia blanca profunda (SBP) y las lesiones de la sustancia gris subcortical (SGSC)13, tal y como se detalla en la tabla 2.
Escala de Fazekas modificada
| Hallazgos en RM | Índice de severidad | |||
| 0 | 1 | 2 | 3 | |
| Hiperintensidades PV | Ausentes | Casquillo | Halo suave | Irregulares, extendiéndose en profundidad hacia la sustancia blanca |
| Hiperintensidades SBP | Ausentes | Focos puntiformes | Focos confluentes | Grandes áreas confluentes |
| Lesiones SGSC | Ausentes | Foco puntiforme | Múltiples focos puntiformes | Difusas |
PV: periventricular; SBP: sustancia blanca profunda; SGSC: sustancia gris subcortical.
Además, se descartó, mediante el índice de Evans, la existencia de hidrocefalia en todos los pacientes.
Para el estudio de la inferencia estadística de los resultados, se utilizó la prueba de la t de Student para variables cuantitativas normales y la prueba de Mann-Whitney para variables no normales y cuantitativas ordinales. Para la comparación de proporciones se utilizó el test de la chi al cuadrado de Pearson. Cuando no se cumplieron las condiciones de aplicación, se utilizaron la razón de verosimilitud y el test exacto de Fisher.
ResultadosLos 22 pacientes tuvieron puntuaciones superiores a 24 en el MMST y realizaron el test del reloj adecuadamente.
Los pacientes del grupo i tenían una edad media de 63,5 años (rango 48-74, DT 8,67); el tiempo medio de evolución de la EP era de 9 años (rango 2-20, DT 5,56). La dosis media de levodopa fue de 1.266,14mg (rango: 762,85-1.602,85 mg, DT 253,81). Presentaban un estadio medio de HyY en «off» de 3,42 (rango 3-5, DT 0,66), y en «on» de 2,57 (rango 2-3, DT 0,53). Una UPDRS iii media en «off» de 38,6 (rango 24-48, DT 9,34) y en «on» de 24,08 (rango 7-39, DT 11,1). Todos los pacientes de este grupo presentaban complicaciones motoras y tenían un fenotipo acinético-rígido (tabla 1).
Los pacientes del grupo 2 tenían una edad media de 67,2 años (rango 54-80, DT 7,65); el tiempo medio de evolución de la enfermedad era de 8,8 años (rango 2-19, DT 7,65). La dosis media de levodopa fue de 957,39 mg (rango: 315-1.562,85, DT 377,05). Presentaban un estadio medio de HyY en «off» de 2,95 (rango 2,5-3, DT 0), y en «on» de 2,25(rango 2-3, DT 0,5). Una UPDRS iii media en «off» de 29,5 (rango 22-41, DT 6,78) y en «on» de 19,5 (rango 13-28, DT 4,99). Todos los pacientes presentaban fluctuaciones motoras y el 90% de los pacientes tenían un fenotipo acinético-rígido (tabla 1).
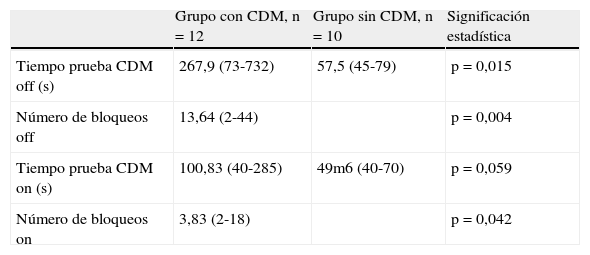
En el grupo i el tiempo medio en segundos empleado en realizar la prueba de la marcha en «off» fue de 267,9 (rango 73-732, DT 237,11) y en «on» 100,83 (rango 40-285, DT 83,72). Presentaron en «off» 13,64 bloqueos de media (rango 2-44, DT 12,11). Durante el «on» presentaron una media de 3,83 bloqueos (rango 2-18, DT 5,76) (tabla 3).
Prueba de congelación de la marcha
| Grupo con CDM, n=12 | Grupo sin CDM, n=10 | Significación estadística | |
| Tiempo prueba CDM off (s) | 267,9 (73-732) | 57,5 (45-79) | p=0,015 |
| Número de bloqueos off | 13,64 (2-44) | p=0,004 | |
| Tiempo prueba CDM on (s) | 100,83 (40-285) | 49m6 (40-70) | p=0,059 |
| Número de bloqueos on | 3,83 (2-18) | p=0,042 |
CDM: congelación de la marcha.
En el grupo 2, el tiempo medio en segundos empleado en realizar la prueba de la marcha en «off» fue de 57,5 (rango 45-79, DT 10,96) y en «on» 49,6 (rango 40-70, DT 10,34) (tabla 3).
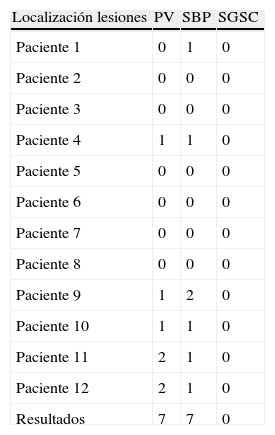
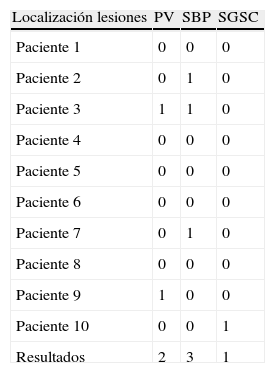
En cuanto al análisis de la RM mediante la escala de Fazekas modificada, el 50% de los pacientes de ambos grupos presentaban lesiones vasculares, aunque la carga lesional (considerándose el número y la extensión de las lesiones) fue mayor en los pacientes del grupo i, aunque no se encontraron diferencias estadísticamente significativas. Las lesiones se detallan en las tablas 4-6.
Resumen puntuación obtenida en RM según escala de Fazekas
| Escala de Fazekas | Grupo con CDM | Grupo sin CDM | Significación estadística |
| % pacientes con lesiones | 50 | 50 | |
| Región PV | 7 | 2 | p=0,35 |
| Región SBP | 7 | 3 | p=0,33 |
| Región SGSC | 0 | 1 | p=0,26 |
| Puntos totales | 14 | 6 |
CDM: congelación de la marcha; PV: periventricular; SBP: sustancia blanca profunda; SGSC: sustancia gris subcortical.
Lesiones halladas en la RM según escala de Fazekas grupo con CDM
| Localización lesiones | PV | SBP | SGSC |
| Paciente 1 | 0 | 1 | 0 |
| Paciente 2 | 0 | 0 | 0 |
| Paciente 3 | 0 | 0 | 0 |
| Paciente 4 | 1 | 1 | 0 |
| Paciente 5 | 0 | 0 | 0 |
| Paciente 6 | 0 | 0 | 0 |
| Paciente 7 | 0 | 0 | 0 |
| Paciente 8 | 0 | 0 | 0 |
| Paciente 9 | 1 | 2 | 0 |
| Paciente 10 | 1 | 1 | 0 |
| Paciente 11 | 2 | 1 | 0 |
| Paciente 12 | 2 | 1 | 0 |
| Resultados | 7 | 7 | 0 |
CDM: congelación de la marcha; PV: periventricular; SBP: sustancia blanca profunda; SGSC: sustancia gris subcortical.
Lesiones halladas en la RM según escala de Fazekas grupo sin CDM
| Localización lesiones | PV | SBP | SGSC |
| Paciente 1 | 0 | 0 | 0 |
| Paciente 2 | 0 | 1 | 0 |
| Paciente 3 | 1 | 1 | 0 |
| Paciente 4 | 0 | 0 | 0 |
| Paciente 5 | 0 | 0 | 0 |
| Paciente 6 | 0 | 0 | 0 |
| Paciente 7 | 0 | 1 | 0 |
| Paciente 8 | 0 | 0 | 0 |
| Paciente 9 | 1 | 0 | 0 |
| Paciente 10 | 0 | 0 | 1 |
| Resultados | 2 | 3 | 1 |
CDM: congelación de la marcha; PV: periventricular; SBP: sustancia blanca profunda; SGSC: sustancia gris subcortical.
Se descartó mediante, un índice de Evans inferior a 0,3, la presencia de hidrocefalia normotensiva en todos los pacientes de los 2 grupos, así como otras lesiones que pudieran contribuir a la aparición de los bloqueos de la marcha.
DiscusiónLos factores de riesgo que se han relacionado con la CDM incluyen: tiempo de evolución12 y gravedad de la EPI13–17, edad18, complicaciones motoras13,14, deterioro cognitivo19,20, tratamiento crónico con levodopa21–24, fenotipo acinético-rígido13,14 y enfermedad vascular asociada25–27.
En nuestros pacientes, no encontramos diferencias significativas en el tiempo de evolución de la EP.
Sin embargo, en el grupo i, la UPDRS iii y el estadio de HyY eran mayores, apoyando la teoría de que la gravedad de la enfermedad es el factor de riesgo más importante para desarrollar CDM y que el desarrollo de la CDM se asocia a un empeoramiento del balance postural.
En cuanto al envejecimiento, en nuestra serie son más ancianos los pacientes sin CDM; además, 2 de los 4 pacientes que presentaban más de 20 bloqueos eran los más jóvenes del grupo, con edades de 48 y 51 años.
Aunque todos los pacientes del estudio eran fluctuantes, es interesante observar cómo la mitad de los del grupo i aún no presentaban complicaciones motoras graves, solo leves deterioros de fin de dosis (DFD), no existía en todos los pacientes correlación entre la intensidad de las fluctuaciones motoras y el número de episodios de CDM, apoyando estos hallazgos la hipótesis de distinta fisiopatología para ambos fenómenos.
Los pacientes que estudiamos no presentaban demencia, pero diversos autores han discutido la posibilidad de un posible compromiso apráxico en el desarrollo de la CDM, indicando un componente de disfunción frontal en su aparición20. No se realizó para este estudio una evaluación cognitiva más detallada que nos permita una conclusión al respecto en nuestros pacientes.
En cuanto al tratamiento, en la mayoría de nuestros pacientes los episodios de CDM disminuían significativamente con la levodopa; sin embargo, 2 de nuestros pacientes presentaron el mismo número de bloqueos, aunque mejoraban las escalas motoras, así como el tiempo en realizar la prueba de la marcha y la duración de los bloqueos con el tratamiento.
Se ha discutido recientemente la distinta fisiopatología de la CDM que aparece en el «off» y aquella observada durante el «on», que empeora al aumentar la medicación y llevar al paciente a una situación de «supra-on»21–24. En nuestra serie, ningún paciente empeora al dar la medicación, aunque a todos ellos se les dio su medicación habitual y no dosis superiores.
Tal y como se recoge en la literatura13,14, predomina el fenotipo acinético-rígido en el grupo con CDM frente al tremórico (100%), aunque en nuestro grupo de pacientes sin CDM casi todos presentan también este fenotipo (90%).
Por otro lado, un 50% del total de nuestros pacientes presentaban lesiones vasculares en la RM craneal, con mayor puntuación en la escala de Fazekas en el grupo i; indicamos que estas lesiones pueden contribuir a la aparición de la CDM o a agravarla.
El término PV hace referencia, según una reciente investigación anatomopatológica, a la presencia de un parkinsonismo que se relaciona cronológicamente con la presencia de encefalopatía vascular (aguda o crónica), demostrada mediante tomografía computarizada (TC) o RM, y ausencia de otras causas que puedan explicar un síndrome de Parkinson25.
La prevalencia de encefalopatía vascular en pacientes con EP oscila entre el 6 y el 44% según diversas series26–28.
Indudablemente, el fenómeno de la CDM es complejo. Aunque los factores de riesgo vascular son más frecuentes en el PV (81%) que en la EPI (32%)29, ambas entidades pueden coexistir.
En principio, cualquier lesión vascular puede ser causa de parkinsonismo, siempre y cuando sea lo suficientemente extensa o afecte a estructuras relevantes. La capacidad de una lesión vascular de producir síntomas parkinsonianos o agravarlos estriba en una interrupción de las vías que conectan los ganglios basales y la corteza motora30,31; de la misma manera, lesiones vasculares que afectan a ganglios basales y al tálamo pueden reducir el metabolismo cerebral en el lóbulo frontal ipsolateral por desaferentación, pudiendo agravar la disfunción frontal de los pacientes parkinsonianos32,33, con el consiguiente impacto en aspectos cognitivos, de la marcha, etc.
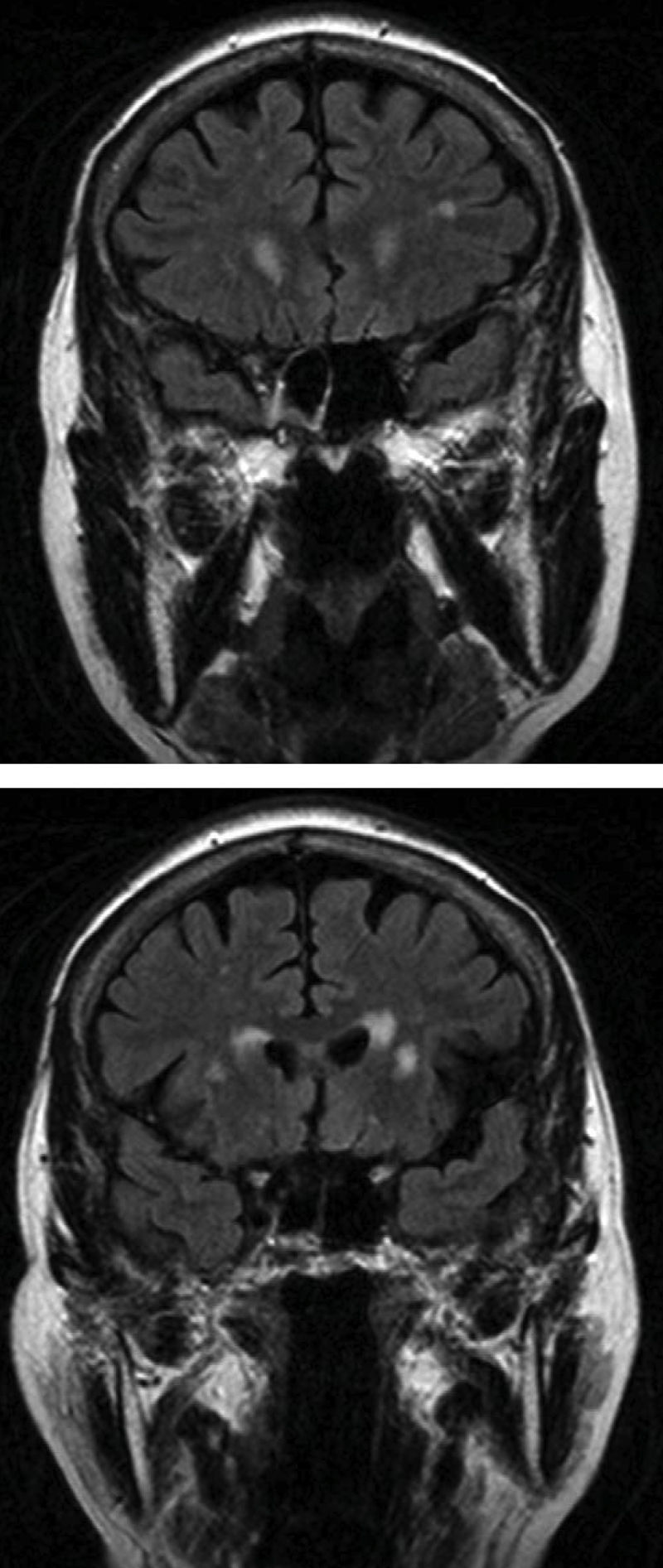
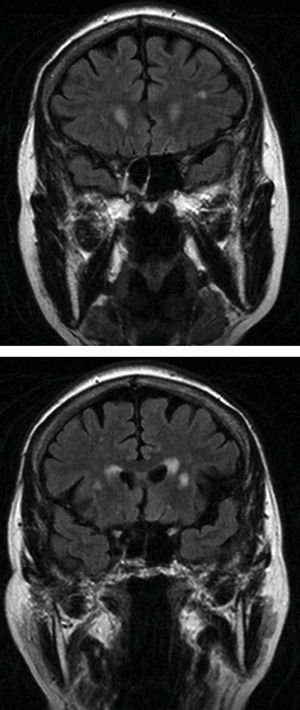
En el grupo i, 6 de nuestros 12 pacientes presentaban alguna lesión significativa en la resonancia, las lesiones vasculares se encontraron exclusivamente en la región PV y la SBP. Analizando los 3 pacientes que mayor carga lesional presentaron en RM, con puntuaciones de 3 en la escala de Fazekas, en 2 de ellos había escasa mejoría en el número de bloqueos de la marcha tras el tratamiento; estos pacientes tenían el mayor número de lesiones en la región PV (fig. 1); sin embargo, en el tercer paciente con 3 puntos en la escala (principalmente con lesiones en SBP) desaparecían los bloqueos al tomar levodopa. Estos hallazgos indican que quizá las lesiones en el área PV contribuyen más a la aparición de la CDM. No se observaron lesiones vasculares en el tronco encéfalo que apoyasen el posible compromiso del núcleo pedúnculo pontino, que parece estar implicado en la fisiopatología de la CDM34.
Aunque hay estudios de prevalencia de enfermedad cerebral en la EP26,28, no se ha detallado el impacto de esta afección en el desarrollo o agravamiento de la CDM en pacientes parkinsonianos. La observación en nuestros pacientes de mayor carga lesional vascular en el grupo de parkinsonianos con CDM sugiere que la enfermedad vascular cerebral debe ser considerada en estos pacientes con CDM, analizando su posible impacto fisiopatológico y nuevas dianas terapéuticas para un trastorno de muy difícil control en los pacientes y con gran impacto en su calidad de vida35,36.
Limitaciones del estudioEn cuanto a las limitaciones de nuestro estudio, podemos decir que se necesitaría un mayor número de pacientes para poder obtener resultados significativos.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El trabajo ha sido presentado como póster en la Reunión Nacional de Neurología del 2011 de la SEN.