El cáncer y las enfermedades degenerativas constituyen trastornos con algunos mecanismos compartidos que actúan en sentido opuesto, produciendo un fenómeno incontrolado de proliferación o pérdida de células. Observaciones diversas apuntan que los pacientes con enfermedad de Alzheimer tienen menor riesgo de desarrollar tumores y viceversa. En este artículo se expone la prevalencia de tumores (activos o superados) en pacientes de neurología cognitiva con y sin una enfermedad degenerativa demenciante.
Pacientes y métodoEn 1.164 pacientes se analizó la frecuencia y topografía de tumores y la presencia o ausencia de enfermedad neurodegenerativa, que se clasificó en 4 grupos (enfermedad de Alzheimer, sinucleinopatía, enfermedad del complejo Pick y del complejo de poliglutamina). Se comparó la frecuencia de tumor en los subgrupos con y sin enfermedad degenerativa, y de esta en los pacientes con y sin trastorno tumoral.
ResultadosSe registró proceso tumoral en el 12,1% de los pacientes con enfermedad neurodegenerativa y en el 17,3% del resto del grupo. En el grupo del estudio, un 14,8% de los que tienen antecedente tumoral fue diagnosticado de enfermedad neurodegenerativa, frente al 20,8% entre los que no tienen ese antecedente. Estas diferencias y las observadas en la comparación de subgrupos (tipo de enfermedad degenerativa y topografía del tumor) no alcanzaron significación estadística, excepto al contrastar enfermedades neurodegenerativas con tumores del sistema nervioso central y sinucleinopatías con neoplasias.
ConclusionesLas enfermedades neoplásicas y las neurodegenerativas demenciantes no son excluyentes, aunque muestran menor asociación de la esperada por su respectiva prevalencia.
Cancer and degenerative diseases share some pathogenic mechanisms which act in opposition to one another to produce either uncontrolled cell proliferation or cell death. According to several studies, patients with Alzheimer disease have a lower risk of neoplasia, and vice versa. This study describes the prevalence of tumours (active or successfully treated) in a series of patients with and without a dementing degenerative disease treated at a cognitive neurology unit.
Patients and methodWe analysed the frequency and topography of tumours and the presence or absence of a neurodegenerative disease in a group of 1,164 patients. Neurodegenerative diseases were classified in 4 groups: Alzheimer disease, synucleinopathies, Pick complex, and polyglutamine complex. We subsequently compared tumour frequency in patients with and without a degenerative disease, and prevalence of neurodegenerative diseases in patients with and without tumours.
ResultsTumours were detected in 12.1% of the patients with a neurodegenerative disease and in 17.3% of the remaining patients. Around 14.8% of the patients with a history of neoplasia and 20.8% of the patients with no history of neoplasia were diagnosed with a neurodegenerative disease. Except for these differences and the differences between subgroups (type of degenerative disease and tumour location) were not statistically significant, except when comparing neurodegenerative diseases to central nervous system tumours, and synucleinopathies to neoplasms.
ConclusionDementing degenerative diseases and neoplastic disorders are not mutually exclusive. Nevertheless, the rate of co-occurrence is lower than would be expected given the prevalence rate for each group.
Así como en el siglo xx se dio un paso gigante para atenuar el grave problema de las infecciones, el gran reto de la medicina en el siglo xxi se encuentra en la investigación de las enfermedades degenerativas y neoplásicas. Para hacernos una idea de la dimensión del problema, podemos referir que, según estimaciones de la International Agency for Research on Cancer (de la Organización Mundial de la Salud), en 2015 habría habido 15.206.036 nuevos casos de cáncer (excluyendo los cutáneos no melanoma) en el mundo (2.753.183 en la Unión Europea, 227.076 en España) y 8.885.195 muertes por esa causa (1.341.938 en la Unión Europea, 108.390 en España)1. En cuanto a las enfermedades degenerativas, en este trabajo nos hemos concentrado en las que producen demencia. A pesar de la acotación, la incidencia de estos procesos es alta. Los datos epidemiológicos publicados permiten estimar que en 2015 aparecieron entre 7 y 15 millones de nuevos casos en el mundo (1,6 millones en Europa y unos 100.000 en España)2–5, siendo la tercera causa de discapacidad moderada o grave en las personas mayores de 60 años en los países desarrollados, solo por detrás de los trastornos sensoriales y las enfermedades osteoarticulares6. Además, las entidades más frecuentes de ambos procesos (tumorales y neurodegenerativos) tienen mayor incidencia al avanzar la edad7,8, lo cual significa que, debido al aumento progresivo de la esperanza de vida, cada año habrá más casos si no se descubren tratamientos que permitan revertir esta tendencia.
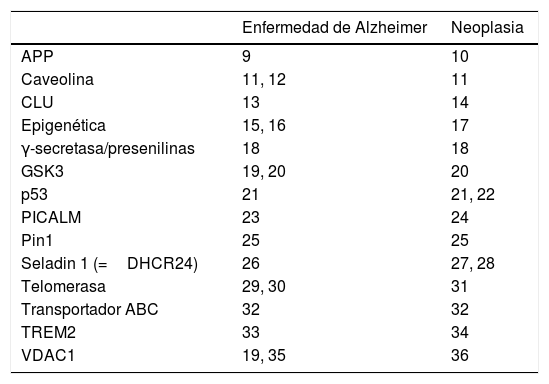
Mientras que el cáncer cursa con una proliferación celular incontrolada, la enfermedad degenerativa se asocia a una pérdida espontánea de células, más rápida de lo que se espera por efecto del envejecimiento fisiológico. El carácter opuesto de estos acontecimientos induce a pensar en la posibilidad de que haya mecanismos biológicos subyacentes comunes a ambos procesos. Si esos mecanismos reguladores se alteran en un sentido, se precipita la muerte celular, mientras que si se alteran en el contrario se promueve la proliferación celular. Actualmente ya se conocen múltiples circunstancias fisiopatólógicas que podrían intervenir tanto en las enfermedades degenerativas como en las neoplásicas. En la tabla 1 se refieren algunas de las relacionadas con la enfermedad de Alzheimer9–36, aunque la lista podría ampliarse con otras enfermedades degenerativas37.
Selección de elementos proteínicos o genéticos que intervienen en la patogenia de la enfermedad de Alzheimer y del cáncer (sección izquierda de la tabla). En las columnas adyacentes figuran algunas referencias bibliográficas en las que se explica su mecanismo de acción
| Enfermedad de Alzheimer | Neoplasia | |
|---|---|---|
| APP | 9 | 10 |
| Caveolina | 11, 12 | 11 |
| CLU | 13 | 14 |
| Epigenética | 15, 16 | 17 |
| γ-secretasa/presenilinas | 18 | 18 |
| GSK3 | 19, 20 | 20 |
| p53 | 21 | 21, 22 |
| PICALM | 23 | 24 |
| Pin1 | 25 | 25 |
| Seladin 1 (=DHCR24) | 26 | 27, 28 |
| Telomerasa | 29, 30 | 31 |
| Transportador ABC | 32 | 32 |
| TREM2 | 33 | 34 |
| VDAC1 | 19, 35 | 36 |
ABC: ATP-binding cassette; APP: proteína precursora de amiloide; CLU: clusterina; Epigenética: metilación de ADN, acetilación de histonas, ARN no codificantes; GSK3: glucógeno sintasa cinasa 3; PICALM: proteína de ensamblaje de clatrina y fosfatidilinositol; Pin1: peptidil-prolil cis-trans isomerasa 1; Seladin 1: 24-dehidrocolesterol-reductasa; TREM2: (receptor activador expresado en células mieloides)-2; VDAC: canales aniónicos dependientes de voltaje.
En los últimos años se han publicado varias observaciones de una menor frecuencia de tumores en pacientes con enfermedad de Alzheimer, y de esta enfermedad en las personas con antecedente neoplásico38–44, lo cual incide a favor de la existencia de mecanismos etiopatogénicos compartidos45–47. Aunque la mayoría de las publicaciones se centran en la enfermedad de Alzheimer, algunas describen el mismo fenómeno en personas con demencias degenerativas no Alzheimer48–50. Todo esto abre campo para la investigación de tratamientos que prevengan o modulen la progresión, tanto de los procesos degenerativos como de los proliferativos.
En este artículo se expone la prevalencia de procesos tumorales diversos (activos o superados), en un grupo de pacientes que acudió a una consulta de neurología cognitiva. En este grupo hay personas con deterioro cognitivo de diferente grado y de causa variada (incluyendo enfermedades neurodegenerativas), lo que permite calcular si padecer un proceso tumoral (genérico o específico) puede modificar el riesgo de desarrollar otro proceso de tipo neurodegenerativo, y viceversa.
Pacientes y métodoSe analizaron datos de un archivo de pacientes que acudieron a una consulta de neurología, en la que se atiende mayoritariamente a personas con quejas de la esfera cognitiva. Aparte del sexo y la edad (en la consulta inicial), se registró el diagnóstico etiológico establecido. Además, se anotó cualquier antecedente de proceso neoplásico, aún activo o ya superado. Este dato se pregunta sistemáticamente en la consulta. Se eliminaron los casos en los que el diagnóstico etiológico permanece incierto, y aquellos en los que se ofreció información imprecisa o no fiable sobre el antecedente tumoral.
Los pacientes fueron clasificados con relación a ser diagnosticados, o no, de una enfermedad neurodegenerativa susceptible de producir demencia. Entre los que tenían este diagnóstico, se anotó también si la causa correspondía a una enfermedad de Alzheimer, a una entidad del complejo Pick (demencia frontotemporal y sus variantes, síndrome corticobasal y parálisis supranuclear progresiva), a una enfermedad por α-sinucleinopatía (demencia asociada a enfermedad de Parkinson, demencia con cuerpos de Lewy, atrofia multisistémica)51 o a una entidad del complejo de poliglutamina (enfermedad de Huntington y algunos tipos de atrofia espinocerebelosa)52. En todos los casos, los pacientes tenían las alteraciones cognitivoconductuales clave y la alteración en la neuroimagen (resonancia magnética, tomografía computarizada o/y PET con 18F-fluorodesoxiglucosa) del cerebro que son características de cada entidad en su fase sintomática.
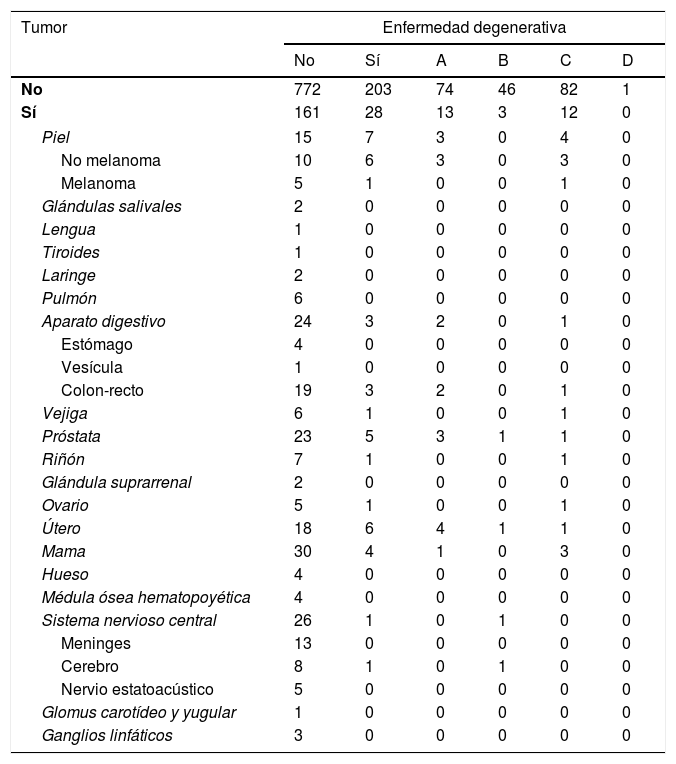
En los casos con registro de trastorno tumoral se estableció una clasificación topográfica (tabla 2). Para el agrupamiento de los tumores del sistema nervioso central se utilizó la clasificación de la Organización Mundial de la Salud de 201653.
Relación de los casos, teniendo en cuenta los diversos tipos de enfermedad neurodegenerativa y tumoral observados
| Tumor | Enfermedad degenerativa | |||||
|---|---|---|---|---|---|---|
| No | Sí | A | B | C | D | |
| No | 772 | 203 | 74 | 46 | 82 | 1 |
| Sí | 161 | 28 | 13 | 3 | 12 | 0 |
| Piel | 15 | 7 | 3 | 0 | 4 | 0 |
| No melanoma | 10 | 6 | 3 | 0 | 3 | 0 |
| Melanoma | 5 | 1 | 0 | 0 | 1 | 0 |
| Glándulas salivales | 2 | 0 | 0 | 0 | 0 | 0 |
| Lengua | 1 | 0 | 0 | 0 | 0 | 0 |
| Tiroides | 1 | 0 | 0 | 0 | 0 | 0 |
| Laringe | 2 | 0 | 0 | 0 | 0 | 0 |
| Pulmón | 6 | 0 | 0 | 0 | 0 | 0 |
| Aparato digestivo | 24 | 3 | 2 | 0 | 1 | 0 |
| Estómago | 4 | 0 | 0 | 0 | 0 | 0 |
| Vesícula | 1 | 0 | 0 | 0 | 0 | 0 |
| Colon-recto | 19 | 3 | 2 | 0 | 1 | 0 |
| Vejiga | 6 | 1 | 0 | 0 | 1 | 0 |
| Próstata | 23 | 5 | 3 | 1 | 1 | 0 |
| Riñón | 7 | 1 | 0 | 0 | 1 | 0 |
| Glándula suprarrenal | 2 | 0 | 0 | 0 | 0 | 0 |
| Ovario | 5 | 1 | 0 | 0 | 1 | 0 |
| Útero | 18 | 6 | 4 | 1 | 1 | 0 |
| Mama | 30 | 4 | 1 | 0 | 3 | 0 |
| Hueso | 4 | 0 | 0 | 0 | 0 | 0 |
| Médula ósea hematopoyética | 4 | 0 | 0 | 0 | 0 | 0 |
| Sistema nervioso central | 26 | 1 | 0 | 1 | 0 | 0 |
| Meninges | 13 | 0 | 0 | 0 | 0 | 0 |
| Cerebro | 8 | 1 | 0 | 1 | 0 | 0 |
| Nervio estatoacústico | 5 | 0 | 0 | 0 | 0 | 0 |
| Glomus carotídeo y yugular | 1 | 0 | 0 | 0 | 0 | 0 |
| Ganglios linfáticos | 3 | 0 | 0 | 0 | 0 | 0 |
A: enfermedad de Alzheimer; B: enfermedades relacionadas con sinucleinopatía; C: enfermedades del complejo Pick; D: enfermedades del complejo de poliglutamina.
Con esta información, se realizó un análisis estadístico para determinar si existían diferencias en la frecuencia de padecer o haber padecido un proceso neoplásico, o alguno de los tipos registrados, entre los pacientes que tenían o no una enfermedad neurodegenerativa demenciante (o alguna de sus variantes). Con este fin se han utilizado las pruebas de chi-cuadrado o la prueba exacta de Fisher, considerando estadísticamente significativos aquellos valores de p<0,05. Como medida de asociación se ha estimado la odds ratio con sus intervalos de confianza al 95%. El análisis de los datos ha sido realizado con el programa SPSS para windows (versión 19.0).
ResultadosEn las tablas 2 y 3 se describen los datos de la muestra de pacientes objeto de este estudio. En el conjunto total y en todos los subgrupos hay un predominio de mujeres y la edad media supera los 70 años.
Sinopsis de los casos incluidos en el estudio
| Enf. degenerativa, sí | Enf. degenerativa, no | Total | |
|---|---|---|---|
| Neoplasia sí | 28(12,1; 14,8; 60,7; 76,8) | 161(17,3; 85,2; 53,4; 77,7) | 189(16,2; 100; 54,5; 77,6) |
| Neoplasia no | 203(87,9; 20,8; 59,6; 74,6) | 772(82,7; 79,2; 63,9; 72,3) | 975(83,8; 100; 63,0; 72,8) |
| Total | 231(100; 19,8; 59,7; 74,9) | 933(100; 80,2; 62,1; 73,3) | 1.164(100; 100; 61,6; 73,6) |
Número de casos (% en columna; % en fila; % de mujeres; edad media).
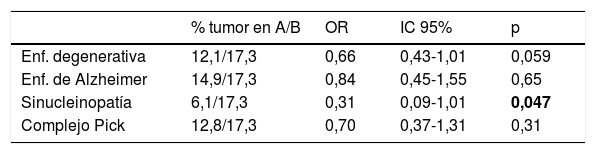
Se registró el padecimiento (activo o superado) de proceso tumoral en el 12,1% de los pacientes con enfermedad neurodegenerativa demenciante y en el 17,3% de los que no tienen este tipo de enfermedad neurológica. En el grupo de enfermos del estudio, un 14,8% de los que tienen antecedente tumoral ha sido diagnosticado de enfermedad neurodegenerativa, mientras que se aplicó este diagnóstico al 20,8% de los que no tienen ese antecedente (tabla 3). Estas diferencias no alcanzaron significación estadística (p=0,059).
Al repartir los enfermos en 4 tipos de enfermedad degenerativa y diversas localizaciones topográficas de los tumores, se alcanzó diferencia significativa al contrastar las enfermedades neurodegenerativas agrupadas y el conjunto de tumores del sistema nervioso central (p=0,028) (tabla 4), y al contrastar sinucleinopatías y neoplasias (p=0,047) (tablas 5 y 6).
Relación de casos con tumor del sistema nervioso central en los pacientes con o sin enfermedad neurodegenerativa demenciante
| Enf. degenerativa, sí | Enf. degenerativa, no | Total | |
|---|---|---|---|
| Tumor SNC Sí | 1(0,4; 3,7) | 26(2,8; 96,3) | 27(2,3; 100) |
| Tumor SNC No | 230(99,6; 20,2) | 907(97,2; 79,8) | 1137(97,7; 100) |
| Total | 231(100; 19,8) | 933(100; 80,2) | 1.164(100; 100) |
SNC: sistema nervioso central.
Número de casos (% en columna; % en fila).
Casos con neoplasia en los distintos tipos de enfermedad neurodegenerativa
| % tumor en A/B | OR | IC 95% | p | |
|---|---|---|---|---|
| Enf. degenerativa | 12,1/17,3 | 0,66 | 0,43-1,01 | 0,059 |
| Enf. de Alzheimer | 14,9/17,3 | 0,84 | 0,45-1,55 | 0,65 |
| Sinucleinopatía | 6,1/17,3 | 0,31 | 0,09-1,01 | 0,047 |
| Complejo Pick | 12,8/17,3 | 0,70 | 0,37-1,31 | 0,31 |
A: casos con la enfermedad señalada en la fila; B: casos sin enfermedad degenerativa; IC 95%: intervalos de confianza al 95%; OR: odds ratio.
En negrita, el único resultado con p menor de 0,05 (es decir, estadísticamente significativo).
Presencia de trastorno neoplásico en los enfermos con diagnóstico de sinucleinopatía o de cualquier proceso no degenerativo
| Sinucleinopatía, sí | Enf. degenerativa, no | Total | |
|---|---|---|---|
| Neoplasia sí | 3(6,1; 1,8) | 161(17,3; 98,2) | 164(16,7; 100) |
| Neoplasia no | 46(93,9; 5,6) | 772(82,7; 94,4) | 818(83,3; 100) |
| Total | 49(100; 5,0) | 933(100; 95,0) | 982(100; 100) |
Número de casos (% en columna; % en fila).
En una muestra de 1.164 personas se ha analizado si existen diferencias en la frecuencia de enfermedad tumoral entre pacientes con y sin diagnóstico de enfermedad neurodegenerativa demenciante, y en la frecuencia de este tipo de enfermedad entre los que acudieron a la consulta y refirieron tener o haber tenido un proceso tumoral y los que carecían de este antecedente.
En la muestra predomina el sexo femenino (61,6%), lo cual puede atribuirse a una mayor frecuencia de mujeres en la población de la comunidad de origen (51,8%) y al predominio femenino de las demencias2 (la muestra procede de una consulta de neurología cognitiva). No obstante, el porcentaje de mujeres difiere significativamente en los grupos con registro de proceso tumoral (54,5%) y sin este antecedente (63%). Cabe atribuir la diferencia al predominio masculino de los procesos oncológicos1,54.
En cuanto a la edad, son mayores las personas con enfermedad neurodegenerativa, en comparación con los demás (p<0,034), y los pacientes con enfermedad tumoral respecto a los que no tienen este antecedente (p<0,001). Ambos datos eran previsibles, ya que en la enfermedad de Alzheimer y demencia con cuerpos de Lewy, que representan más de la mitad de los casos de demencia, y en los tumores, la incidencia se incrementa al avanzar la edad8,55.
Los resultados evidencian una menor frecuencia de neoplasia en las personas con una enfermedad degenerativa demenciante, y de esta en quienes tienen o han tenido neoplasia (tabla 3). La diferencia no alcanza significación estadística, aunque se aproxima (p=0,059), mientras que en el análisis de los subgrupos las diferencias se alejan más del grado de significación, debido al menor tamaño de cada muestra. Únicamente fue significativa (p=0,028) la menor frecuencia de tumores del sistema nervioso central (un caso) en los 231 pacientes con enfermedad neurodegenerativa, frente a 26 casos en los 933 sin este tipo de enfermedad (tabla 4).
Los resultados no contradicen lo publicado en la bibliografía. En la mayoría de los estudios se encontró una menor incidencia de neoplasia en personas con enfermedad neurodegenerativa demenciante y menor incidencia de estas enfermedades en quienes habían tenido cáncer. Sin embargo, las cifras señalan que ambos procesos no son excluyentes y pueden acontecer simultáneamente, e incluso algunas observaciones muestran un incremento de la asociación entre ellos. No obstante, aunque los resultados son heterogéneos (entre estudios y entre tipos de tumor), al reunir casuística de múltiples trabajos en metaanálisis, la menor asociación de esos procesos alcanza diferencia significativa38–40.
Si consideramos por separado distintos tipos de enfermedad neurodegenerativa, tanto los resultados que aquí se presentan como los pocos que se encuentran en la bibliografía señalan la misma tendencia contraria de frecuencias que se observa con la enfermedad de Alzheimer48–50. En la observación que se presenta aparece una menor prevalencia de tumores en los pacientes con α-sinucleinopatías. La α-sinucleína, además de ser un elemento fundamental en las α-sinucleinopatías que producen demencia, se expresa en tumores diversos como los cerebrales con componente neuronal56, schwannomas57, melanoma y nevus benigno58, de ovario59 o síndrome mielodisplásico60. Sin embargo, la traducción de ese dato en las observaciones epidemiológicas es variable. En varias series de pacientes con enfermedad de Parkinson se aprecia mayor incidencia del melanoma50,61, mientras que otras muestran lo contrario50,62; solo en algunos estudios se ha apreciado mayor asociación con tumores cerebrales50,63 y de mama50,61, y menor riesgo de neoplasia de pulmón y de colon64. En general, se observa menor incidencia de tumores tanto en la enfermedad de Parkinson62 como en la demencia con cuerpos de Lewy48. En todo caso, como los resultados son dispares, cabe suponer que la protección cruzada no es intensa ni uniforme, probablemente porque se deba, al menos en parte, a otros factores intervinientes.
Cuando se analizan por separado los tipos de tumor, las diferencias se reducen y se muestran heterogéneas. Ou et al.42 observaron que la incidencia significativamente menor, en las personas con enfermedad de Alzheimer, se reducía al cáncer de pulmón de los varones; Realmuto et al.65 hallaron diferencia en mujeres y tumores de órganos endocrinos; para Roe et al.44 y Behrens et al.66 esta diferencia se alcanzó con los tumores cutáneos. Nuestro trabajo solo obtiene diferencia significativa al reunir los tumores del sistema nervioso central. En general, los tamaños de las muestras que se obtienen al desglosar los tumores son pequeños, lo cual impide alcanzar significación estadística si la diferencia no es muy marcada. En el presente trabajo aparecen 2 situaciones (cáncer de piel no melanoma y de útero) en que la frecuencia observada en los enfermos con demencia degenerativa (2,6% en ambos casos) fue superior (sin diferencia significativa) a la hallada en los demás participantes del estudio (1,1 y 1,9%) (tabla 2). Considerando los distintos tipos de tumor, al tratar con subgrupos de tamaño reducido, de ninguno de los resultados sin diferencia significativa se puede deducir que los respectivos tumores tengan algún tipo de interferencia con las enfermedades neurodegenerativas.
Con respecto a los tumores del sistema nervioso central, la diferencia encontrada induce una reflexión. Desde una perspectiva hipotética, parece más probable que la posible interferencia entre mecanismos que facilitan la proliferación y la muerte celular se produzca entre enfermedades que afecten a un mismo órgano o sistema, como puede ser el cerebro o el sistema nervioso central. Podría resultar más compatible el desarrollo de un proceso degenerativo en el cerebro y, a la vez, un proceso proliferativo en el pulmón u otro órgano ajeno al sistema nervioso. En este sentido, cabe mencionar que las alteraciones genéticas etiológicas conocidas (mutaciones causantes de enfermedad y genotipos de riesgo) no se solapan. En una revisión de Richterová et al. se describen más de 60 genes involucrados en el desarrollo de tumores cerebrales67, y ninguno de ellos coincide con los 30 que se relacionan actualmente con la enfermedad de Alzheimer68. En una persona pueden coexistir elementos genéticos y factores ambientales relacionados con el desencadenamiento de enfermedades degenerativas y tumorales y, por ende, pueden desarrollarse ambas. Los hallazgos de este estudio y de las publicaciones previas no señalan que un proceso excluya al otro, sino que la asociación es menos frecuente de lo esperado si fueran totalmente independientes. Es probable que esta protección relativa se deba, como ya se mencionó en la introducción, a la influencia de mecanismos patogénicos compartidos que actúan en sentido opuesto (tabla 1).
Cuando se analizan subgrupos (tipos de tumor o de enfermedad degenerativa), a las diferencias observadas no se les puede atribuir el mismo grado de certeza, puesto que los tamaños muestrales son muy diferentes. La escasez de casos con entidades del complejo de poliglutamina y la presencia mínima o ausencia de algunos tumores podrían ser consecuencia de su baja prevalencia en la edad avanzada. Lo cierto es que la poca casuística impide calcular si existe una protección cruzada intensa entre ellos. Algunos tumores de alta incidencia, como los de pulmón, hígado, estómago y esófago, podrían estar infrarrepresentados por su alta mortalidad1. Es decir, que muchas de las personas que los padecen fallecen antes de alcanzar edades en las que es máximo el riesgo de comenzar una enfermedad neurodegenerativa demenciante. Cabe pensar que, de no ser por este incremento de la mortalidad, las diferencias de asociación observadas en este estudio aun serían menores. Para atenuar este sesgo, sería deseable realizar un seguimiento de los pacientes que padecen tumores y tienen una larga supervivencia.
Algo similar ocurre en las personas con demencia degenerativa. Al establecer el diagnóstico la mortalidad se incrementa (aproximadamente 1,4-2,7 veces)69,70. Este hecho significa que en estos pacientes la incidencia de tumores propios de la edad muy avanzada (que desarrollarían años más tarde) será menor que en muchas de las personas del mismo sector de edad sin enfermedad degenerativa.
Los resultados referidos y los datos de la bibliografía señalan que las enfermedades neurodegenerativas y tumorales no son excluyentes, aunque muestran una menor frecuencia de asociación de la que se podría esperar al considerar la prevalencia de cada una. Esto significa, por una parte, que el fenómeno tiene poca utilidad en la práctica clínica, ya que la presencia de un proceso no exime al facultativo clínico de investigar si el paciente padece un trastorno del otro tipo, en el caso de que muestre síntomas o signos compatibles. Sin embargo, la reducción observada en el desarrollo combinado implica que, aparte de sesgos derivados de la mayor mortalidad asociada a ambos tipos de proceso, probablemente intervienen mecanismos patogénicos comunes que actúan en sentido contrario. Esta observación debería servir para dar prioridad a la investigación de tratamientos dirigidos a controlar esos mecanismos, porque tendrían un mayor «valor traslacional». Esto significa que de los descubrimientos podrían derivarse fármacos eficaces para combatir 2 de los grupos de trastornos (degenerativos y proliferativos) que más discapacidad y muertes producen en el mundo.
FinanciaciónEl trabajo no ha sido presentado en ninguna reunión científica ni ha sido financiado.
Conflicto de interesesNinguno de los autores tiene conflicto de intereses relacionado con el contenido del artículo.