La neuropatía periférica inducida por quimioterapia (NIQ) es la complicación neurológica más frecuente del tratamiento del cáncer, y afecta aproximadamente a una tercera parte de los pacientes. La NIQ deteriora la funcionalidad, compromete la calidad de vida y, frecuentemente, conlleva la reducción y/o suspensión del tratamiento, lo que representa un efecto adverso limitante de dosis de muchos antineoplásicos. Además de los clásicos, agentes nuevos como bortezomib y oxaliplatino presentan un marcado riesgo de neuropatía.
MétodosTras revisión de la literatura, se analizan los trabajos relevantes y los recientes avances sobre patogenia, incidencia, factores de riesgo, diagnóstico, características y manejo de la NIQ.
ResultadosEl conocimiento sobre la fisiopatología de la NIQ es creciente. La investigación incluye la identificación de los genes relacionados con un mayor o menor riesgo de NIQ. La mejor herramienta que permita diagnosticar y graduar la severidad de la NIQ no está definida. Numerosos agentes se están investigando como potenciales neuroprotectores o tratamientos sintomáticos, con resultados negativos en la mayoría de ellos.
ConclusionesEl reconocimiento precoz y posterior reducción de dosis o suspensión del agente neurotóxico es actualmente la única forma de minimizar el desarrollo de esta complicación. Ante la ausencia de tratamientos preventivos o sintomáticos eficaces en la NIQ, sería recomendable la monitorización neurológica de los pacientes candidatos a recibir quimioterapia con agentes neurotóxicos, sobre todo si presentan una neuropatía de base o subclínica. Es necesario definir e implementar la mejor medida para evaluar la NIQ.
Chemotherapy-induced peripheral neuropathy (CIPN) is the most prevalent neurological complication of cancer treatment, affecting a third of all patients who undergo chemotherapy. CIPN impairs functional capacity, compromises the quality of life and results in dose reduction or cessation of chemotherapy, representing a dose-limiting side effect of many antineoplastic drugs. In addition to classic, novel agents, bortezomib and oxaliplatin have been shown to have a significant risk of CIPN.
MethodsBy reviewing literature, this article analyses relevant issues and recent advances regarding the pathogenesis, incidence, risk factors, diagnosis, characteristics and management of CIPN.
ResultsResearch into the pathophysiology and identification of risk factors for individual patients is growing. A future avenue of investigation includes the identification of patients at lower or higher risk based on their genotype. Best tools for CIPN assessment are not defined. Many agents have been claimed to be neuroprotectors without showing significant results in large randomised clinical trials.
ConclusionsEarly recognition and subsequent dose reduction/discontinuation of the offending agent is the only way to minimise the development of this potentially debilitating complication. Due to the lack of effective prophylactic or symptomatic treatments up to now, neurological monitoring should be recommended in patient candidates to be treated with neurotoxic antineoplastic agents, mainly when they present baseline neuropathy. Development of reliable methods for CIPN assessment is essential.
La neuropatía periférica inducida por quimioterapia (NIQ) es la complicación neurológica más frecuente del tratamiento del cáncer1 y probablemente la neuropatía tóxica más común en nuestro medio. Desde el primer caso descrito de neuropatía sensitiva secundaria a cisplatino hace más de 30 años2, el problema de la neurotoxicidad en relación con estos tratamientos no ha desaparecido de la escena oncológica, y resulta uno de los efectos secundarios más frecuentes de agentes que se utilizan en primera y/o segunda línea para el tratamiento de diversas neoplasias sólidas y hemáticas. Actualmente, esquemas que contienen cisplatino y paclitaxel constituyen la base del tratamiento de tumores tan prevalentes como el de pulmón y el de mama. Además, la mayoría de las neoplasias hemáticas se tratan con esquemas que contienen vincristina, otro conocido agente neurotóxico. Entre los factores que han contribuido a aumentar la prevalencia de la NIQ están el incremento en el número de pacientes subsidiarios de recibir quimioterapia (QT) y el aumento de la supervivencia debido a la mayor eficacia de los nuevos fármacos y esquemas terapéuticos. Asimismo, la administración de factores estimulantes de colonias durante el tratamiento con citostáticos, que persigue minimizar la toxicidad hemática, permite administrar mayores dosis de QT, con lo que aumenta el riesgo de desarrollar neurotoxicidad.
Un aspecto importante a recordar es que la aparición de la NIQ es un factor limitante en el tratamiento del cáncer. Su aparición produce retrasos en la administración de un nuevo ciclo, reducciones de la dosis por ciclo o incluso suspensiones del tratamiento; esto condiciona el potencial curativo del tratamiento y el pronóstico del paciente. Si bien actualmente el reconocimiento precoz y el manejo inicial de la NIQ son la mejor y única técnica disponible para evitar su evolución a una neuropatía severa e incapacitante, en los últimos años se ha intensificado la investigación tanto clínica como experimental en aspectos sobre la fisiopatología, la prevención y su tratamiento. Son reflejo del creciente interés en la comunidad neurooncológica las revisiones que han aparecido en la literatura recientemente3–9. En el trabajo que se expone a continuación y que actualiza al publicado en esta misma revista hace casi una década10, se resumen aquellas particularidades y novedades clínicas y del manejo de estos pacientes que creemos pueden ser de interés para el neurólogo general y el neurooncólogo en particular.
Neuropatía inducida por quimioterapia. ¿Un problema cada vez más frecuente?Las tasas de NIQ disponibles en la literatura son muy variables; se han comunicado incidencias que van del 10 al 100% en función del estudio11. Entre los factores que influyen en esta variabilidad encontramos: a) tipo de agente citostático; b) esquema de tratamiento administrado (dosis total, dosis/ciclo, número de ciclos, tiempo de infusión)12–15; c) combinaciones entre distintos citostáticos16; d) tipo de tumor; e) características del paciente o toma concomitante de otros fármacos neurotóxicos, y f) criterio o técnica de diagnóstico y evaluación de la NIQ17–19.
Algunos autores sugieren que la neuropatía asociada al tratamiento con citostáticos podría estar subestimada, ya sea por los propios médicos como por los pacientes, quienes en ocasiones minimizarían sus síntomas por miedo a una potencial suspensión o reducción del tratamiento oncológico y, por lo tanto, de su beneficio20–22. Otro factor de confusión, no despreciable a la hora de conocer la verdadera incidencia de la NIQ, es el hecho de que las tasas que se describen en muchos ensayos clínicos no siempre reflejan fielmente las que realmente se observan en la práctica diaria. Fundamentalmente, esto es debido a los selectivos criterios de inclusión de la mayoría de los estudios. Así, por ejemplo, no es infrecuente encontrar trabajos en los que se excluye a los pacientes con neuropatía previa o diabéticos18,23–26, lo que indudablemente constituye un sesgo a la hora de extrapolar los resultados de seguridad sobre neurotoxicidad27.
En general, se estima que el 30-40%28–30 de todos los pacientes tratados con agentes quimioterápicos desarrollan neurotoxicidad periférica. Sin embargo, se han comunicado incidencias de hasta el 60% con cisplatino31,32, paclitaxel33–36, docetaxel37,38, vincristina39, oxaliplatino y bortezomib40–43, estos dos últimos de reciente introducción en esquemas de tratamiento de primera línea. El oxaliplatino, compuesto de tercera generación derivado del platino, utilizado ampliamente en el tratamiento del cáncer de colon, causa neurotoxicidad aguda y transitoria en casi todos los pacientes tratados; se observa neuropatía de carácter crónico o establecida en el 29-67%44–47. Con el bortezomib, compuesto que actúa inhibiendo el proteasoma e indicado para el tratamiento del mieloma múltiple, recientemente se han comunicado incidencias de hasta el 64% en los pacientes no tratados previamente48; aunque la mayoría de los estudios coinciden en que habitualmente se presenta en un tercio de los pacientes49. Con la talidomida, un fármaco inmunomodulador popularmente conocido por sus propiedades teratogénicas y que ha sido aprobado para el tratamiento del mieloma múltiple50,51, se han descrito incidencias variables en función de la duración del tratamiento y la dosis total acumulada; hasta en el 80% de los pacientes con mieloma que han recibido tratamiento durante más de 6 meses52–54. Menos conocida en nuestro país es la neurotoxicidad secundaria a la ixabepilona, que alcanza tasas del 63%55. Este fármaco, autorizado por la Food and Drugs Adminstration (FDA) en 2007 para el tratamiento del cáncer de mama avanzado, recientemente no ha sido autorizado por la European Medicines Agency (EMEA) para su uso clínico56, en parte debido a su riesgo neurotóxico57. Finalmente, la neuropatía asociada a trióxido de arsenio, actualmente poco común en los países desarrollados, es probable que aumente su incidencia en el futuro, ya que actualmente ese fármaco está indicado en el tratamiento de la leucemia aguda promielocítica y en fase de estudio para el tratamiento de diversas neoplasias58.
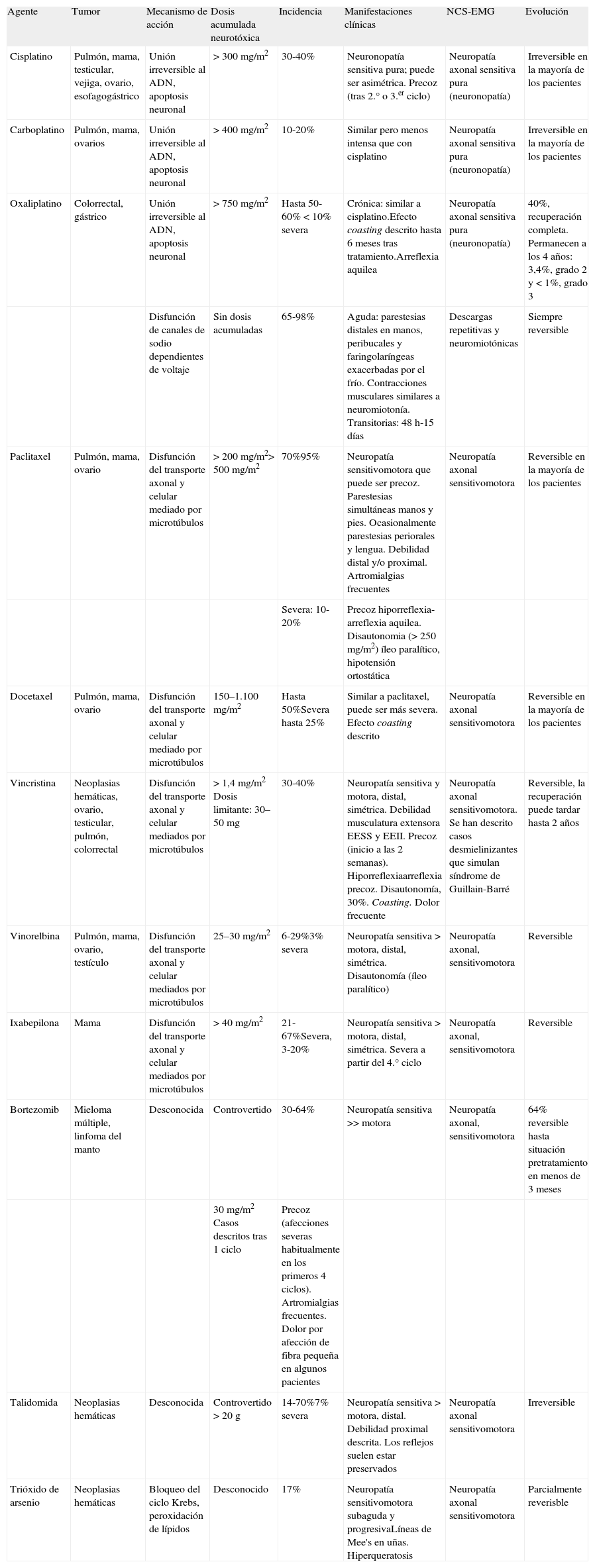
Mientras el perfil neurotóxico de los agentes quimioterápicos anteriores está claramente establecido, con otros fármacos como lenalidomida, análogo estructural de la talidomida, éste es más controvertido59. Richardson et al49 comunicaron que hasta el 23% de los pacientes con mieloma múltiple tratados desarrollaban neuropatía asociada al tratamiento, siendo severas en un 3%. Sin embargo, otros autores han observado mejoras sintomáticas con lenalidomida en pacientes con mieloma que habían desarrollado neuropatía por bortezomib60, aunque no puede descartarse una mejora espontánea en estos casos, así como que las incidencias encontradas sean las propias asociadas a la enfermedad hemática de base. En la tabla 1 se enumeran los quimioterápicos con efecto neurotóxico en el sistema nervioso periférico. En la tabla 2 se resumen los principales aspectos epidemiológicos, fisiopatológicos, clínicos, neurofisiológicos y pronósticos relacionados con la neurotoxicidad periférica asociada a los agentes citostáticos más comúnmente utilizados.
Agentes antineoplásicos que causan neuropatía periférica asociada a quimioterapia
|
Características de la neurotoxicidad periférica por los agentes antineoplásicos más frecuentemente empleados
| Agente | Tumor | Mecanismo de acción | Dosis acumulada neurotóxica | Incidencia | Manifestaciones clínicas | NCS-EMG | Evolución |
| Cisplatino | Pulmón, mama, testicular, vejiga, ovario, esofagogástrico | Unión irreversible al ADN, apoptosis neuronal | > 300 mg/m2 | 30-40% | Neuronopatía sensitiva pura; puede ser asimétrica. Precoz (tras 2.° o 3.er ciclo) | Neuropatía axonal sensitiva pura (neuronopatía) | Irreversible en la mayoría de los pacientes |
| Carboplatino | Pulmón, mama, ovarios | Unión irreversible al ADN, apoptosis neuronal | > 400 mg/m2 | 10-20% | Similar pero menos intensa que con cisplatino | Neuropatía axonal sensitiva pura (neuronopatía) | Irreversible en la mayoría de los pacientes |
| Oxaliplatino | Colorrectal, gástrico | Unión irreversible al ADN, apoptosis neuronal | > 750 mg/m2 | Hasta 50-60% < 10% severa | Crónica: similar a cisplatino.Efecto coasting descrito hasta 6 meses tras tratamiento.Arreflexia aquilea | Neuropatía axonal sensitiva pura (neuronopatía) | 40%, recuperación completa. Permanecen a los 4 años: 3,4%, grado 2 y < 1%, grado 3 |
| Disfunción de canales de sodio dependientes de voltaje | Sin dosis acumuladas | 65-98% | Aguda: parestesias distales en manos, peribucales y faringolaríngeas exacerbadas por el frío. Contracciones musculares similares a neuromiotonía. Transitorias: 48 h-15 días | Descargas repetitivas y neuromiotónicas | Siempre reversible | ||
| Paclitaxel | Pulmón, mama, ovario | Disfunción del transporte axonal y celular mediado por microtúbulos | > 200 mg/m2> 500 mg/m2 | 70%95% | Neuropatía sensitivomotora que puede ser precoz. Parestesias simultáneas manos y pies. Ocasionalmente parestesias periorales y lengua. Debilidad distal y/o proximal. Artromialgias frecuentes | Neuropatía axonal sensitivomotora | Reversible en la mayoría de los pacientes |
| Severa: 10-20% | Precoz hiporreflexia-arreflexia aquilea. Disautonomia (> 250 mg/m2) íleo paralítico, hipotensión ortostática | ||||||
| Docetaxel | Pulmón, mama, ovario | Disfunción del transporte axonal y celular mediado por microtúbulos | 150–1.100 mg/m2 | Hasta 50%Severa hasta 25% | Similar a paclitaxel, puede ser más severa. Efecto coasting descrito | Neuropatía axonal sensitivomotora | Reversible en la mayoría de los pacientes |
| Vincristina | Neoplasias hemáticas, ovario, testicular, pulmón, colorrectal | Disfunción del transporte axonal y celular mediados por microtúbulos | > 1,4 mg/m2 Dosis limitante: 30–50 mg | 30-40% | Neuropatía sensitiva y motora, distal, simétrica. Debilidad musculatura extensora EESS y EEII. Precoz (inicio a las 2 semanas). Hiporreflexiaarreflexia precoz. Disautonomía, 30%. Coasting. Dolor frecuente | Neuropatía axonal sensitivomotora. Se han descrito casos desmielinizantes que simulan síndrome de Guillain-Barré | Reversible, la recuperación puede tardar hasta 2 años |
| Vinorelbina | Pulmón, mama, ovario, testículo | Disfunción del transporte axonal y celular mediados por microtúbulos | 25–30 mg/m2 | 6-29%3% severa | Neuropatía sensitiva > motora, distal, simétrica. Disautonomía (íleo paralítico) | Neuropatía axonal, sensitivomotora | Reversible |
| Ixabepilona | Mama | Disfunción del transporte axonal y celular mediados por microtúbulos | > 40 mg/m2 | 21-67%Severa, 3-20% | Neuropatía sensitiva > motora, distal, simétrica. Severa a partir del 4.° ciclo | Neuropatía axonal, sensitivomotora | Reversible |
| Bortezomib | Mieloma múltiple, linfoma del manto | Desconocida | Controvertido | 30-64% | Neuropatía sensitiva >> motora | Neuropatía axonal, sensitivomotora | 64% reversible hasta situación pretratamiento en menos de 3 meses |
| 30 mg/m2 Casos descritos tras 1 ciclo | Precoz (afecciones severas habitualmente en los primeros 4 ciclos). Artromialgias frecuentes. Dolor por afección de fibra pequeña en algunos pacientes | ||||||
| Talidomida | Neoplasias hemáticas | Desconocida | Controvertido > 20 g | 14-70%7% severa | Neuropatía sensitiva > motora, distal. Debilidad proximal descrita. Los reflejos suelen estar preservados | Neuropatía axonal sensitivomotora | Irreversible |
| Trióxido de arsenio | Neoplasias hemáticas | Bloqueo del ciclo Krebs, peroxidación de lípidos | Desconocido | 17% | Neuropatía sensitivomotora subaguda y progresivaLíneas de Mee's en uñas. Hiperqueratosis | Neuropatía axonal sensitivomotora | Parcialmente reverisble |
La vulnerabilidad del sistema nervioso periférico a estos agentes y el predominio de la afectación sensitiva están relacionados con la ausencia de barrera hematoencefálica en el ganglio raquídeo posterior y con una mayor permeabilidad del vasa nervorum respecto a la circulación hematoencefálica9,61. Sin embargo, los mecanismos fisiopatológicos directamente implicados en la patogenia de la NIQ son parcialmente conocidos, probablemente múltiples y no siempre guardan relación con su mecanismo antitumoral.
Mediante estudios experimentales in vitro y con modelos animales, diversos trabajos han demostrado que los platinos (cisplatino, oxaliplatino) inducen la apoptosis de las neuronas sensitivas del ganglio raquídeo posterior tras su unión a las cadenas de ADN con la consecuente alteración de su estructura terciaria, lo que está relacionado, entre otros procesos, con la activación de ciclina D1 y de la vía de señalización intracelular de las mitogen-activated protein kinases (MAPK), proteínas promitóticas que inducirían la entrada de la neurona en el ciclo celular y la activación compensatoria de la apoptosis para evitar la división en una célula ya diferenciada62,63. La vincristina y los taxanos (paclitaxel y docetaxel), cuyo principal mecanismo de acción antitumoral es la alteración en la despolimerización de los microtúbulos, interfieren en el transporte axonal y el resto de las funciones básicas celulares mediadas por éstos, causando una disfunción de la neurona que conllevará la consecuente degeneración axonal64. En el caso particular de paclitaxel, un fenómeno también descrito es la activación de las calpaínas, enzimas citosólicas con actividad proteolítica que producen un daño celular mediado por calcio65. Estudios preclínicos en modelos animales con agentes inhibidores de las calpaínas han demostrado prevenir el daño axonal secundario a vincristina y paclitaxel65,66.
Por otro lado, el déficit de factores neurotróficos también ha sido implicado en la NIQ30,67. Diversos autores han objetivado una disminución de las concentraciones circulantes de nerve growth factor (NGF), tanto en animales como en series de pacientes68–70 que desarrollaban NIQ.
Recientemente, en otra línea, dos estudios experimentales de neuropatía por cisplatino y paclitaxel-talidomida han demostrado que la toxicidad en el nervio periférico podría ser, en parte, de origen vascular: estos citostáticos inducirían la apoptosis de las células endoteliales del vasa nervorum con la consecuente isquemia de las fibras nerviosas. Además, mediante terapia génica, diseñada para inducir la expresión del factor de crecimiento endotelial vascular (VEGF), consiguen la normalización de la perfusión nerviosa y la recuperación de la neuropatía71. De acuerdo con estos datos, es posible que el uso cada vez más extendido de antiangiogénicos adyuvantes al tratamiento con QT pueda aumentar la incidencia de NIQ. Así, un estudio de fase III, que comparaba el esquema convencional de oxaliplatino con o sin bevacizumab, mostró un aumento de la incidencia de NIQ severa en el grupo tratado con antiangiogénicos (el 16,3 frente al 9,2%)72. Aunque los autores lo justificaron por el mayor número de ciclos que recibió el grupo con bevacizumab, no puede descartarse el potencial efecto sinérgico neurotóxico del antiangiogénico.
Finalmente, el estrés oxidativo causado por la mayoría de antineoplásicos clásicamente se ha relacionado con la activación de los mecanismos de apoptosis neuronal. Así, por ejemplo, se ha propuesto la peroxidación de los lípidos de membrana también como un fenómeno crucial en la patogenia de la neuropatía por cisplatino y arsénico73. Diferente es el mecanismo de neurotoxicidad aguda por oxaliplatino. El oxalato liberado por éste produce una quelación del calcio extracelular que inhibe la entrada de sodio en las neuronas sensitivas mediante una disfunción transitoria y no estructural de los canales de sodio dependientes del voltaje, interfiriendo en su despolarización74, lo que se ha objetivado con estudios que muestran cambios agudos en la excitabilidad axonal75. Por último, el conocimiento sobre los fenómenos que subyacen a la neurotoxicidad secundaria a bortezomib es aún muy preliminar76–79. Recientemente, el grupo de Casafont ha demostrado que el bortezomib interfiere en los procesos de transcripción, procesamiento nuclear, transporte y traducción citoplasmática del ARN mensajero de las neuronas del ganglio raquídeo posterior79.
Aspectos clínicosEl diagnóstico de la NIQ es fácil para el clínico dado el omnipresente antecedente del tratamiento con alguno de estos agentes. Sin embargo, debemos tener muy presente que el paciente con cáncer puede tener una afección del sistema nervioso periférico debida a otros mecanismos en relación con su cáncer (compresivo, infiltrativo, inmunitarioparaneoplásico) o independientes de éste (metabólico o toxicidad por otros fármacos). Si bien es evidente que cualquier dato que se desvíe de la presentación típica obliga a descartar estas posibilidades, algunos autores recomiendan completar el cribado de posibles etiologías de neuropatía periférica aun cuando el diagnóstico de neuropatía asociada a QT sea claro80.
La NIQ aparece durante el tratamiento con el agente citostático o justo tras el último ciclo81. El paciente suele referir síntomas positivos y/o negativos a partir de un determinado ciclo, habitualmente hacia el final del tratamiento. Sin embargo, presentaciones muy precoces, incluso tras la primera dosis, se han comunicado con agentes como vincristina, cisplatino y bortezomib26,32,82. Muy infrecuente también es el denominado efecto coasting, característico de las neuropatías por cisplatino32,83 e inicialmente descrito con la vincristina84, pero que también se ha observado en pacientes tratados con docetaxel85 y que consiste en un empeoramiento progresivo de la neuropatía durante semanas o meses tras la suspensión del agente causal. Por último, no es infrecuente la exacerbación transitoria de los síntomas sensitivos en pacientes con neuropatía por oxaliplatino al someterse a una intervención quirúrgica justo tras la finalización de la QT. Este efecto se ha relacionado con la liberación de acúmulos de oxaliplatino intraeritrocitario en el plasma con la hemólisis asociada a la cirugía86.
La instauración de la NIQ suele ser subaguda, con un curso progresivo si no se procede a la reducción y/o suspensión del agente que la produce. No obstante, el oxaliplatino también produce polineuropatía aguda y transitoria. Los pacientes presentan disestesias y alodinia térmica con el frío en manos, pies y orofaringe, que empiezan durante la infusión y suelen ceder en unas 48 h, habitualmente se autolimitan antes del siguiente ciclo (15 días)5.
En general, entre los síntomas sensitivos positivos referidos por los pacientes encontramos parestesias, espontáneas o mecánicas, disestesias, alodinia e hiperalgesia. La hiperestesia en los límites del déficit sensitivo es un signo frecuente en la exploración neurológica. Se suele describir los síntomas sensitivos negativos en relación con la discapacidad que comportan, como imposibilidad para abrocharse los botones o escribir87. Se pueden observar movimientos seudoatetósicos espontáneos con los dedos de los pies y de las manos en los pacientes con severa afección propioceptiva, habitualmente asociada a tratamientos con platinos; la ataxia sensitiva, aunque frecuente, raramente llega a ser incapacitante. Otros síntomas menos comúnmente reconocidos como efecto neurotóxico de estos tratamientos son el fenómeno de Lhermitte, característico en pacientes tratados con platinos88 y el prurito, descrito con el paclitaxel9. El dolor urente en las yemas de las manos y la plantas de los pies, que aparece en algunos pacientes tratados con oxaliplatino, bortezomib y vincristina, no es un síntoma constante en todos los pacientes11,89. Las mialgias, sobre todo en pantorrillas y antebrazos, suelen presentarse con bortezomib y paclitaxel6,9, aunque no deberían incluirse en el espectro clínico de la neuropatía.
El signo clínico más precoz en la mayoría de los pacientes que desarrollan NIQ es la disminución de la sensibilidad vibratoria y la pérdida del reflejo aquíleo7. Si bien la hiporreflexia suele estar en proporción a la pérdida axonal, curiosamente con vincristina ésta suele ser muy precoz aun cuando no hay neuropatía establecida9,83,90. Contrariamente, en la neuropatía secundaria a talidomida los reflejos pueden estar preservados9,91,92. La afección de la sensibilidad artrocinética suele ser un signo tardío y sólo en los grados más severos19. La distribución de los síntomas y signos está relacionada con la naturaleza del daño. Así, mientras en las neuropatías secundarias a platinos la afección en las extremidades suele manifestarse de forma simultánea y no es infrecuente su distribución asimétrica siguiendo un patrón neuronopático93, con la mayoría de los agentes ésta suele presentarse como una polineuropatía distal de inicio en extremidades inferiores y con afección predominante de musculatura extensora cuando hay afección de fibras motoras.
Los síntomas secundarios a la neuropatía autonómica no son infrecuentes en los pacientes tratados con vincristina (30%), paclitaxel (el 29%, bradicardia asintomática) y bortezomib (el 12%, hipotensión ortostática)64,83,94,95. El íleo paralítico, la hipotensión ortostática y la disfunción vesical y eréctil son manifestaciones frecuentes, que pueden presentarse de forma aislada o habitualmente en el contexto de una NIQ ya establecida. Los estudios sistemáticos centrados en la evaluación de la fibra autonómica en pacientes tratados con QT son escasos, y la evidencia aportada por los estudios preclínicos al respecto es contradictoria, como sucede en el caso del cisplatino, comunicada de forma anecdótica la afección autonómica en pacientes y bien definida en modelos animales93,96.
Factores de riesgoLos principales factores de riesgo implicados en el desarrollo de la NIQ son la dosis y la duración del tratamiento. Además, se han propuesto factores demográficos, de comorbilidad e incluso genéticos como predisponentes a un mayor riesgo de padecer las consecuencias neurotóxicas de estos agentes. Así, los sujetos con neuropatía, aunque subclínica, parecen más vulnerables al efecto neurotóxico de la mayoría de los quimioterápicos97 y habitualmente desarrollan neuropatías más severas80,98. Con el bortezomib se ha descrito un mayor riesgo de neuropatía de alto grado en los individuos con neuropatía previa49. Aunque esos autores no observaron un aumento en la incidencia general, los estudios de Cavaletti y nuestra experiencia sí demuestran un mayor riesgo de neuropatía por bortezomib en los pacientes con neuropatía de base26. En el caso de las neuropatías hereditarias, es clásico el empeoramiento o, más frecuentemente, el desenmascaramiento de un síndrome de Charcot-Marie Tooth (CMT) en sujetos expuestos a vincristina, con más de 30 casos descritos en la literatura99,100. Habitualmente, se trata de pacientes con la forma autosómica dominante desmielinizante (CMT 1A). Mucho menos numerosos son los casos de CMT revelado por el tratamiento con cisplatino101 y paclitaxel-carboplatino102. La neuropatía asociada al tratamiento con QT en estos pacientes suele tener un carácter “catastrófico” e invalidante; se manifiesta muy precozmente, con dosis menores y un curso rápidamente progresivo. De forma anecdótica, también se ha descrito en la literatura 1 paciente con neuropatía hereditaria por labilidad a las presiones desenmascarada tras tratamiento con vincristina103. Si bien el tratamiento con QT no está formalmente contraindicado en los pacientes con neuropatía de base8, sí es práctica habitual en algunos centros, incluido el nuestro, la evaluación previa de los pacientes con historia personal o familiar de neuropatía, y la realización de un seguimiento neurológico durante el tratamiento quimioterápico104. Además, en los pacientes con neoplasias sólidas y neuropatía de base, platinos y taxanos con menor potencial neurotóxico (carboplatino y docetaxel) podrían recomendarse como primera opción102. Parcialmente relacionado con el riesgo de neuropatía de base, el papel de la diabetes mellitus como factor de riesgo neurotóxico en estos pacientes es controvertido27. Por otro lado, sobre la edad y el riesgo de NIQ también hay resultados contradictorios. Mientras el trabajo de Argyrou et al105 mostró una incidencia y una severidad similares en los pacientes menores de 65 años y de 65 años o más en un estudio prospectivo de 35 pacientes tratados con paclitaxel y cisplatino, recientemente la edad ha mostrado ser un factor de riesgo asociado a la neurotoxicidad por bortezomib106,107. Finalmente, se ha propuesto que las alteraciones de la función hepática y renal, relacionadas con la eliminación del agente tóxico, podrían ser potenciales factores de riesgo sin poderse establecer claramente su verdadera implicación8.
Actualmente, se conoce muy poco sobre cuáles son los genes o variantes genéticas (polimorfismos) que podrían predisponer a los sujetos expuestos a estos fármacos a un mayor riesgo de neurotoxicidad periférica108,109. Estudios de farmacogenética, mediante el análisis de los polimorfismos en genes que codifican enzimas implicadas en vías de metabolización (CYP450), respuesta al estrés oxidativo (glutathione S-transferases [GST]), reparación del ADN o proteínas transportadoras (glucoproteína P), intentan establecer una relación entre las diferencias interindividuales en la respuesta-toxicidad al tratamiento y la carga genética de los pacientes. Hasta el momento se han descrito algunos polimorfismos del gen de la GST en pacientes con cáncer colorrectal avanzado tratados con oxaliplatino110,111, con cáncer de ovario tratadas con cisplatino112 y neoplasia de mama tratadas con docetaxel113 que predicen el riesgo de desarrollar NIQ, y otro grupo ha encontrado asociaciones entre diferentes polimorfismos en el gen ABCB1 (que codifica glucoproteína 1) y la neurotoxicidad por paclitaxel114 y docetaxel115. Aunque aún disponemos de información muy preliminar, es probable que estos estudios contribuyan en un futuro no sólo a predecir la respuesta al tratamiento oncológico, sino que permitirán establecer el riesgo individual de neuropatía asociada al tratamiento con QT. De este modo, se evitarán esquemas terapéuticos innecesariamente tóxicos y se podrá individualizar el tratamiento, optimizar las dosis adecuadas en cada caso y mejorar así la seguridad de la administración de estos agentes.
EvaluaciónEl diagnóstico de la NIQ es clínico, la anamnesis y la exploración clínica son los métodos más fiables para su detección precoz53,80,116. El papel de los estudios neurofisiológicos convencionales con electroneurografía (ENG) con o sin electromiografía (EMG) es más controvertido; mientras algunos autores los consideran complementarios80 o inconsistentes115, otros defienden la obligada realización, como mínimo, del potencial sensitivo del nervio sural, para poder establecer el diagnóstico y un adecuado seguimiento de la NIQ118. Si bien es cierto que estas técnicas no siempre traducen la severidad de la neuropatía17, es evidente que son de un indudable valor para conocer la naturaleza (desmielinizante o axonal) y la extensión del daño116, lo que permite una cuantificación objetiva muy útil de cara al seguimiento del paciente118. Además, para algunos autores el descenso del potencial del nervio sural podría ser incluso más sensible que la exploración neurológica para detectar neuropatías de carácter subclínico, e incluso le otorgan un valor pronóstico para desarrollar NIQ25, aunque este dato no ha sido confirmado por otros autores70,91. En nuestra opinión, la falta de correlación entre el descenso del potencial sensitivo y la intensidad de la sintomatología del paciente, la afectación de fibras de distinto calibre en diferente proporción y, sobre todo, el desfase entre el inicio de los síntomas y los cambios en la neurografía son algunas de las limitaciones de la neurografía convencional, sobre todo cuando se pretende un diagnóstico precoz. Hasta el momento, la monitorización neurofisiológica no ha conseguido demostrar un claro beneficio sobre la monitorización clínica para la detección de NIQ53. Técnicas más específicas, como el test cuantitativo sensitivo (QST) o el estudio sobre fibra eferente autonómica (Simpathetic Skin Response), tampoco han resultado ser más sensibles que los datos clínicos tanto para la detección precoz como la valoración de la respuesta al tratamiento de la NIQ29,119. Más prometedoras parecen las técnicas de excitabilidad axonal recientemente empleadas para el estudio de la neuropatía por oxaliplatino. Park et al75 han demostrado una correlación positiva entre los cambios en la excitabilidad axonal en el momento de la infusión del oxaliplatino y el riesgo de desarrollar neuropatía crónica, lo que confiere un valor predictivo a estas técnicas. Finalmente, la utilización de la biopsia cutánea para el estudio de pacientes con NIQ, muy útil en neuropatías de fibra pequeña y autonómica, es probable que aumente proximamente, tal y como demuestran los trabajos recientemente publicados que incorporan esta técnica al estudio de la NIQ48,120. Actualmente está en marcha un ensayo clínico que incluye biopsia cutánea en pacientes con mieloma múltiple tratados con bortezomib (NCT00956033) para valorar la utilidad de esta técnica.
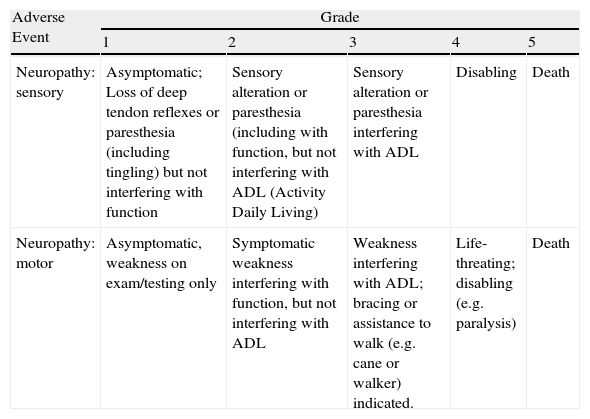
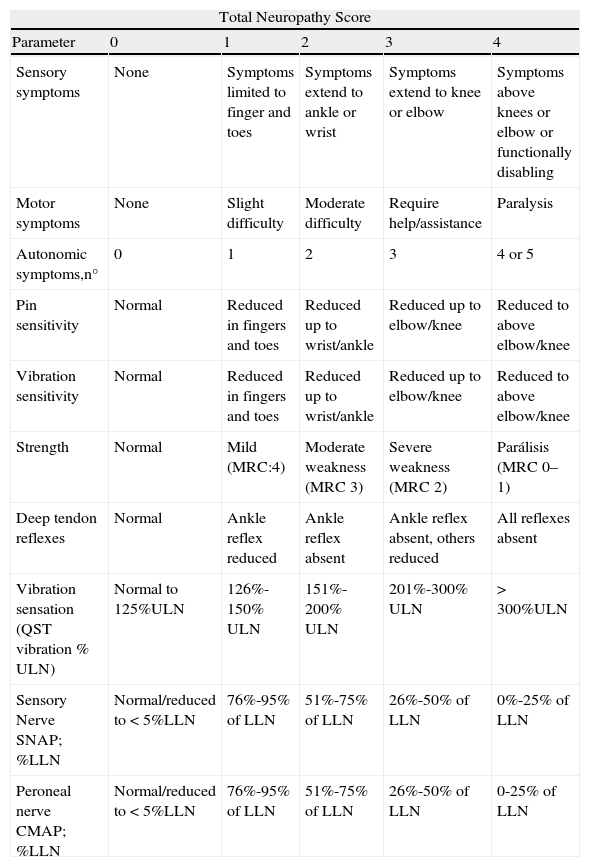
La gradación de la severidad de la NIQ es un problema no resuelto. Las escalas oncológicas, desarrolladas para facilitar la tarea del oncólogo a la hora de recoger todos los efectos secundarios de un determinado tratamiento, son las habitualmente empleadas en la práctica diaria para diagnosticar y graduar la severidad de la NIQ (tabla 3). Sin embargo, éstas resultan claramente insuficientes para poder establecer la intensidad de la neurotoxicidad periférica, sobre todo una vez establecida9,17,116. Entre sus limitaciones están la sobrestimación de los síntomas, la casi ausencia de datos objetivos o cuantificables, la falta del dolor como dato clínico y una marcada variabilidad interobservador, dado que requiere la interpretación de los síntomas para poder graduarla17. En un intento de mejorar la evaluación en este tipo de neuropatías, Cavaletti et al demostraron la correlación entre las escalas oncológicas más comúnmente empleadas y la escala Total Neuropathy Score (TNS®)121,122, que incluye síntomas, signos clínicos y parámetros neurofisiológicos (tabla 4), lo que permite una evaluación más precisa y objetiva de la NIQ. Actualmente, se está llevando a cabo en varios países, incluido el nuestro, el estudio CI-PERINOMS (Chemotherapy-Induced Peripheral Neuropathy Outcome Measures Standardisation Study), que persigue hallar el mejor modo de valoración neurológica para la NIQ, valorando la validez y la reproducibilidad al examinar la fiabilidad interobservador e intraobservador de diversas escalas, entre ellas la TNS, en la evaluación de la severidad de la NIQ establecida123. Aunque una de las limitaciones de la TNS es que no incluye el dolor neuropático, su carácter cuantificable es evidente que aporta una mejora a la hora de tipificar y graduar la NIQ, lo que, en nuestra opinión, la convierte en una herramienta muy útil para el manejo de este tipo de neuropatías.
Escala NCI-CTC v3. National Cancer Institute-Common Toxicity Criteria versión 3
| Adverse Event | Grade | ||||
| 1 | 2 | 3 | 4 | 5 | |
| Neuropathy: sensory | Asymptomatic; Loss of deep tendon reflexes or paresthesia (including tingling) but not interfering with function | Sensory alteration or paresthesia (including with function, but not interfering with ADL (Activity Daily Living) | Sensory alteration or paresthesia interfering with ADL | Disabling | Death |
| Neuropathy: motor | Asymptomatic, weakness on exam/testing only | Symptomatic weakness interfering with function, but not interfering with ADL | Weakness interfering with ADL; bracing or assistance to walk (e.g. cane or walker) indicated. | Life-threating; disabling (e.g. paralysis) | Death |
Escala TNS (Total Neuropathy Score)
| Total Neuropathy Score | |||||
| Parameter | 0 | 1 | 2 | 3 | 4 |
| Sensory symptoms | None | Symptoms limited to finger and toes | Symptoms extend to ankle or wrist | Symptoms extend to knee or elbow | Symptoms above knees or elbow or functionally disabling |
| Motor symptoms | None | Slight difficulty | Moderate difficulty | Require help/assistance | Paralysis |
| Autonomic symptoms,n° | 0 | 1 | 2 | 3 | 4 or 5 |
| Pin sensitivity | Normal | Reduced in fingers and toes | Reduced up to wrist/ankle | Reduced up to elbow/knee | Reduced to above elbow/knee |
| Vibration sensitivity | Normal | Reduced in fingers and toes | Reduced up to wrist/ankle | Reduced up to elbow/knee | Reduced to above elbow/knee |
| Strength | Normal | Mild (MRC:4) | Moderate weakness (MRC 3) | Severe weakness (MRC 2) | Parálisis (MRC 0–1) |
| Deep tendon reflexes | Normal | Ankle reflex reduced | Ankle reflex absent | Ankle reflex absent, others reduced | All reflexes absent |
| Vibration sensation (QST vibration % ULN) | Normal to 125%ULN | 126%-150% ULN | 151%-200% ULN | 201%-300% ULN | > 300%ULN |
| Sensory Nerve SNAP; %LLN | Normal/reduced to < 5%LLN | 76%-95% of LLN | 51%-75% of LLN | 26%-50% of LLN | 0%-25% of LLN |
| Peroneal nerve CMAP; %LLN | Normal/reduced to < 5%LLN | 76%-95% of LLN | 51%-75% of LLN | 26%-50% of LLN | 0-25% of LLN |
Adaptado de Cavaletti et al122 y reproducido con permiso de los autores (Dr. D. Cornblath y Dr. V. Chaudhry121). QST: Quantitative sensory test; ULN: Upper limit of normal; LLN: Lower limit of normal; SNAP: Sensory nerve action potential; CMAP: Amplitude of the compound muscular potential; MRC: Medical Research Council.
Por otro lado, la NIQ afecta a la calidad de vida y puede tener un marcado impacto negativo en la esfera funcional, social y emocional de la vida de estos pacientes20,124. En esta línea, y siguiendo el modelo americano de la escala FACT-G (Functional Assesment of Cancer Therapy)125, en 2005 la European Organisation for Research and Treatment of Cancer (EORTC) creó el cuestionario QLQ-CIPN20, dirigido a evaluar la calidad de vida en los pacientes con NIQ126. Actualmente la EORTC ya dispone de la versión española, recientemente validada en nuestro centro. Además de su obligada utilización en ensayos clínicos con agentes neurotóxicos y/o neuroprotectores, creemos, al igual que otros autores, que puede aportar una información adicional en la visita clínica, resultando útil en el seguimiento de estos pacientes.
EvoluciónLa evolución de la NIQ, aunque favorable tras la suspensión del tratamiento en la mayoría de los casos, no es siempre reversible y algunos autores defienden que probablemente en algunos casos más que una mejoría de la neuropatía se trate de una “adaptación” a los síntomas20. Un estudio italiano, que evaluaba la toxicidad a largo plazo en pacientes con cáncer de ovario tras tratamiento combinado con carboplatino y paclitaxel, demostró que el 15% de las pacientes presentaba neurotoxicidad después de 6 meses de finalizar el tratamiento127. En el caso del oxaliplatino, mientras la neuropatía aguda es siempre reversible, ya que desaparece antes del siguiente ciclo, los síntomas de neurotoxicidad establecida son parcialmente reversibles en un 80% de los pacientes, y sólo se resuelven completamente en un periodo de entre 6 y 8 meses en un 40% de ellos5, y se considera irreversible a partir de 9 meses tras la finalización del tratamiento128. La neuropatía periférica secundaria a vincristina suele ser favorable a largo plazo en la mayoría de los casos90. Más desalentadora es la neurotoxicidad por cisplatino, que suele ser irreversible en más de la mitad de los pacientes una vez establecida129. Contrariamente, Richardson et al130 han comunicado una mejora hasta la situación pretratamiento en el 64% de los pacientes que desarrollaron NIQ de grado ≥ 2 por bortezomib. El estudio demuestra una mayor tasa de neuropatías reversibles en los pacientes en que la dosis de bortezomib se ajustó en cada ciclo en función de la clínica del paciente. Los autores subrayan que la utilización de este algoritmo en el manejo no tuvo ninguna repercusión en la eficacia del tratamiento oncológico.
TratamientoEl tratamiento del paciente con NIQ debe sustentarse sobre dos pilares: la prevención (ajuste de dosis y neuroprotección) y el alivio sintomático. En los últimos años, se han realizado pruebas preclínicas y clínicas con numerosos agentes, con el objetivo de evitar la aparición de neurotoxicidad periférica28,131. Entre estos agentes neuroprotectores destacan factores tróficos, antioxidantes, antiepilépticos y agentes quelantes. Entre los agentes quelantes, las infusiones de gluconato cálcico y sulfato de magnesio, antes y después de la infusión de oxaliplatino, parecían inicialmente ser la solución contra la neurotoxicidad aguda y crónica132. Sin embargo, estos resultados no pudieron ser confirmados en un estudio prospectivo que tuvo que ser suspendido de forma prematura por sospecha de menor actividad antitumoral en los pacientes que recibían calcio y magnesio133, poniendo de relieve uno de los puntos críticos de la neuroprotección: la disminución de la eficacia antitumoral como efecto colateral.
Entre los agentes tróficos, destacamos el NGF, cuyo potencial neuroprotector en la NIQ se fundamentaría en la observación del decremento de las concentraciones circulantes en el suero de pacientes tratados con QT68,69 y la demostración experimental de que la administración exógena de NGF puede prevenir la NIQ134. Además, se dispone de experiencia clínica con resultados positivos en pacientes con neuropatía diabética135. Sin embargo, hasta el momento, los efectos secundarios locales y sistémicos de la administración exógena de NGF la convierten en una mala opción terapéutica en pacientes oncológicos83. En línea con estos datos, dada la capacidad de glutamina y glutamato para aumentar la síntesis local de NGF136 y los buenos resultados en modelos experimentales, se han desarrollado diversos ensayos clínicos pequeños y no controlados con placebo para confirmarlo23,137,138, aunque no consiguieron observar más que una mejora significativa en los parámetros subjetivos y algunos signos menores, pero no en los parámetros neurofisiológicos. Muy recientemente, un estudio a doble ciego, aleatorizado y controlado con placebo no ha conseguido reproducir este efecto beneficioso36 por lo que, actualmente, a pesar de su demostrada nula interferencia con la eficacia antitumoral, no se puede considerar la administración de glutamina/glutamato oral para prevenir la NIQ139. También, en un intento de inducir la síntesis de NGF, se ha propuesto la administración de acetil-L-carnitina (ALCAR), compuesto con eficacia neuroprotectora en modelos animales140,141, que ha demostrado no interaccionar en la citotoxicidad deseada de paclitaxel y carboplatino sobre las células neoplásicas142. Hasta el momento, sólo disponemos de dos estudios de 25 y 27 pacientes con neuropatía esablecida secundaria a cisplatino y paclitaxel, no controlados, con resultados positivos clínicos y neurofisiológicos143,144. A pesar de estos insuficientes resultados preliminares, algunos autores sugieren la administración de ALCAR para prevenir y/o tratar la NIQ145.
Por otro lado, el papel de los antioxidantes en la prevención de la NIQ sigue siendo uno de los principales campos de investigación. Entre los agentes con propiedad antioxidante o inhibidora de radicales libres encontramos la amifostina, cuya capacidad protectora en la neurotoxicidad por cisplatino en estudios in vitro146 y en una serie de pacientes147 no pudo reproducirse en un estudio de fase II148. Estos datos, asociados a su mala tolerabilidad primordialmente por hipotensión severa, han contribuido a su casi abandono en la investigación de estrategias neuroprotectoras. Por el contrario, el glutatión, antioxidante endógeno, y su precursor N-acetilcisteína están siendo intensamente evaluados como potenciales neuroprotectores de la NIQ. Algunos trabajos han demostrado su eficacia clínica, la gran mayoría diseñados a doble ciego, aleatorizados y controlados con placebo118,149,150. Entre los mecanismos propuestos están, además de su capacidad de bloquear los radicales libres, la capacidad de potenciar los efectos del NGF30, inhibir la apoptosis celular151 y disminuir la acumulación de los platinos en los núcleos de las neuronas del ganglio raquídeo posterior118. A pesar de estos favorables resultados y que no se ha observado que el glutatión disminuya la eficacia antitumoral de los citostáticos con los que se administra, sus concentraciones intracelulares elevadas se han asociado con fenómenos de resistencia a estos fármacos30, lo que obliga a disponer de más estudios de seguridad antes de poder generalizar su uso152. También interesantes son los estudios que evalúan la administración de vitamina E durante el tratamiento con QT con intención neuroprotectora. Tras la observación de la disminución de las concentraciones de vitamina E en pacientes tratados con cisplatino153 y los obligados estudios preclínicos desarrollados por Pace et al, el mismo grupo fue pionero en demostrar su eficacia como neuroprotector en una serie de 47 pacientes tratados con cisplatino154; encontraron incidencias de NIQ del 31% en el grupo que recibió vitamina E (300–400 mg/12 h/vía oral) frente al 86% del que no recibió el suplemento vitamínico. Posteriormente, tres estudios más han demostrado resultados similares155–157. Recientemente ha concluido el reclutamiento de un estudio aleatorizado, a doble ciego y controlado con placebo que debería confirmar su potencial beneficio neuroprotector (NCT00363129)158. Finalmente, en cuanto a la neuroprotección, agentes como carbamazepina159,160 y oxcarbamazepina161 ofrecen resultados contradictorios y muy preliminares. Más validada está la ausencia de efecto neuroprotector del análogo de ACTH (ORG 2766) en la NIQ, tras no poder reproducirse los favorables resultados162 en ulteriores estudios de similares diseños (aleatorizados, a doble ciego, controlados con placebo) en series más largas de pacientes163,164.
En resumen, el recientemente publicado metaanálisis sobre neuroprotección y neuropatía inducida por agentes derivados de los platinos152, cuyos resultados concluyen que hasta el momento ningún fármaco ni suplemento nutricional han demostrado su capacidad de prevenir o limitar la neuropatía por cisplatino, podría ser extensible a todos los agentes probados hasta el momento. La evidencia científica disponible es aún escasa y son necesarios más estudios que confirmen su potencial efecto neuroprotector y demuestren que no interfieren en la actividad antitumoral, antes de su implementación en la práctica clínica diaria28,80.
El tratamiento sintomático de los pacientes afectos de NIQ, centrado en el alivio de los síntomas positivos, es igualmente decepcionante. Dada su similitud con la neuropatía diabética, existe un “seguidismo” a la hora de tratar a estos pacientes con los mismos fármacos. Sin embargo, dada la variabilidad de mecanismos patogénicos implicados en la NIQ, éstos no necesariamente deben resultar eficaces en este tipo de pacientes28,80, tal y como, desgraciadamente, demuestra la escasa evidencia científica de la que disponemos. De este modo, los estudios a doble ciego, aleatorizados y controlados con placebo que se han llevado a cabo con nortriptilina165, amitriptilina166, gabapentina167 y lamotrigina168 no han demostrado ser eficaces para el tratamiento sintomático de la NIQ. En el caso de la amitriptilina, los autores, a pesar de la ausencia de eficacia en el alivio del dolor neuropático, observan un efecto positivo en cuanto a la mejora en la calidad de vida de los pacientes163. El pequeño tamaño de las muestras (habitualmente por dificultades en el reclutamiento) es uno de los argumentos en la mayoría de los estudios para justificar sus resultados negativos. Todavía muy preliminares son los resultados positivos que apuntan a un potencial beneficio terapéutico con venlafaxina169, topiramato169 y pregabalina170. Actualmente, parte de la investigación se centra en fármacos como duloxetina, con un estudio de fase III en marcha, y tratamientos tópicos que incluyen amitriptilina, ketamina y mentol (NCT00471445)28,171.
Para algunos autores el primer paso en el tratamiento sintomático de la NIQ debería ser un AINE y añadir opioides en caso necesario29,80, a pesar de la falta de trabajos que fundamenten su utilización, y proponer la rehabilitación física y la terapia ocupacional para los pacientes más severamente afectados. Finalmente, no debemos olvidar que la evolución de la NIQ es generalmente favorable y que los síntomas mejoran espontáneamente en la mayoría de los casos, por lo que serían recomendables evaluaciones periódicas de estos pacientes y suspender estos tratamientos cuando ya no sean necesarios.
ConclusionesDesde nuestro punto de vista, la falta de correlación entre la aparición de neuropatía y la respuesta al tratamiento con QT hace inadmisible aceptar la neurotoxicidad comúnmente asociada a estos fármacos como un “peaje” inherente al tratamiento oncológico, más aún en los pacientes tratados con intención paliativa, en los que el objetivo es aliviar los síntomas y mejorar la calidad de vida por un periodo limitado. Actualmente, la prevención y el reconocimiento precoz de la NIQ son cruciales para evitar neuropatías severas e incapacitantes. Es necesario definir e implementar la mejor medida para evaluar la NIQ. Ante la ausencia de tratamientos preventivos o sintomáticos eficaces en la NIQ, y en espera de identificar marcadores o factores de riesgo que permitan detectar a los pacientes en riesgo y que permitan individualizar el tratamiento oncológico, así como los futuros fármacos neuroprotectores, sería recomendable la monitorización neurológica de los pacientes candidatos a recibir QT con agentes neurotóxicos, sobre todo si presentan una neuropatía de base o subclínica.
FinanciaciónEste trabajo ha sido realizado en parte gracias a una beca del Fondo de Investigaciones Sanitarias PI070493, Madrid, España.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Srta. Ana Baños su excelente ayuda en las tareas administrativas.