La neuropatía inducida por el tratamiento de la diabetes (TIND), nueva nomenclatura de la hasta ahora denominada neuritis insulínica, es una neuropatía aguda, que aparece en pacientes diabéticos a los que se les somete a un estricto control metabólico en poco tiempo. Descrita por primera vez por Caravati en 19331 con el nombre de neuritis insulínica, al aparecer los síntomas en una paciente diabética que es sometida a un rápido control glucémico con insulina y desaparecer los síntomas tras la retirada de la misma. Pocos casos se han descrito desde entonces, desconociendo muchas veces su existencia y confundiendo el diagnóstico con otras neuropatías más frecuente en estos pacientes. Presentamos el caso de un varón diabético que ingresa con esta neuropatía aguda, no identificando los síntomas inicialmente con esta entidad, aunque con control sintomático posterior.
Se trata de un varón de 25 años, con un abuelo y un tío materno diabéticos tipo 1, y que comienza en el 2011 con una cetoacidosis diabética. Fue tratado con insulina y educación diabetológica. Durante los 2 primeros años realiza un seguimiento muy irregular ausentándose de las citas en consulta. Ingresa en endocrino en el 2014 por no administrarse el tratamiento con insulina durante 3 meses, con glucemias mayores de 500, glucosuria, anorexia, plenitud pospandrial y con pérdida de peso aunque no cuantificado por él (IMC 15,5 correspondiente a una desnutrición severa). El paciente estaba orientado y no presentaba alteraciones del nivel de conciencia. La HbA1C era 15,2% y tenía cuerpos cetónicos en orina. Tras una estricta corrección metabólica, se le remite a consultas externas. Seis semanas más tarde comienza con un dolor en la musculatura paraespinal lumbar, escapular, en rodillas, que de forma progresiva en 7-15 días se va haciendo urente, punzante a nivel proximal de MMII descrito por el «como si le arrancasen la carne» asociando disestesias en plantas de ambos pies. Por la intensidad del dolor (EVA: 8-9) se ingresa de nuevo al paciente. La exploración mostró un paciente decaído anímicamente, extrema delgadez, con un nivel de conciencia, funciones corticales y pares craneales dentro de la normalidad. La fuerza estaba de forma global preservada; los reflejos eran hipoactivos de forma universal. La sensibilidad superficial mostró una hiperestesia y alodinia en la musculatura paraespinal y de las 4 extremidades. No existía alteración de la sensibilidad profunda, ni de cerebelo, ni de la marcha. En ese momento la HbA1C era del 9%. Para el control del dolor se precisaron AINE asociados a tramadol a dosis altas, así como duloxetina con parcial control del mismo. Ingresó a cargo de endocrinología donde el diagnóstico inicial fue de lumbalgia irradiada, dolor osteomuscular y trastorno anímico reactivo. La RM lumbar mostró cambios degenerativos difusos y abombamientos discales en todos los niveles lumbares. Durante el ingreso presentó taquicardia mantenida (101-117lpm) e hipertensión diastólica (rango: 86-92mmHg) con TA sistólicas normales en torno a 105-120mmHg. Se le realizó electromiograma (EMG), que mostró datos de neuropatía desmielinizante sensitivo motora sin cumplir criterios neurofisiológicos de CIDP, y sin signos de actividad denervativa (tabla 1). Punción lumbar con hiperproteinorraquia de 89mg/dl. La analítica descartó causas sistémicas hepáticas, renales, tiroideas, déficits vitamínicos (vitamina B1, B6, B12, fólico, vitamina A, E y D); la autoinmunidad y serologías de Borrelia, Mycoplasma, CMV, VHZ, VEB, VHS, VIH, VHB y VHC fueron negativas. Las hormonas tiroideas, ACTH, cortisol y PTHi, selenio, cinc y cobre, también fueron normales. La orina mostró un cociente microalbúmina/creatinina normal. Le diagnosticamos de una polineuropatía desmielinizante multifocal, que relacionamos con la diabetes y el mal control de la misma, y se citó un EMG de control a los 7 meses (prueba que rehusó repetirse). El paciente fue dado de alta con mejoría progresiva del dolor, hasta permanecer paucisintomático en aproximadamente 6 meses. Hubo una escasa ganancia ponderal 3-4kg y un parcial control glucémico en ese tiempo. Puesto que no se sospechó esta entidad, no hay constancia de la mejoría o no de los síntomas autonómicos, nada protagonistas durante el ingreso hospitalario con relación al dolor tan severo e invalidante que motivó la interconsulta neurológica.
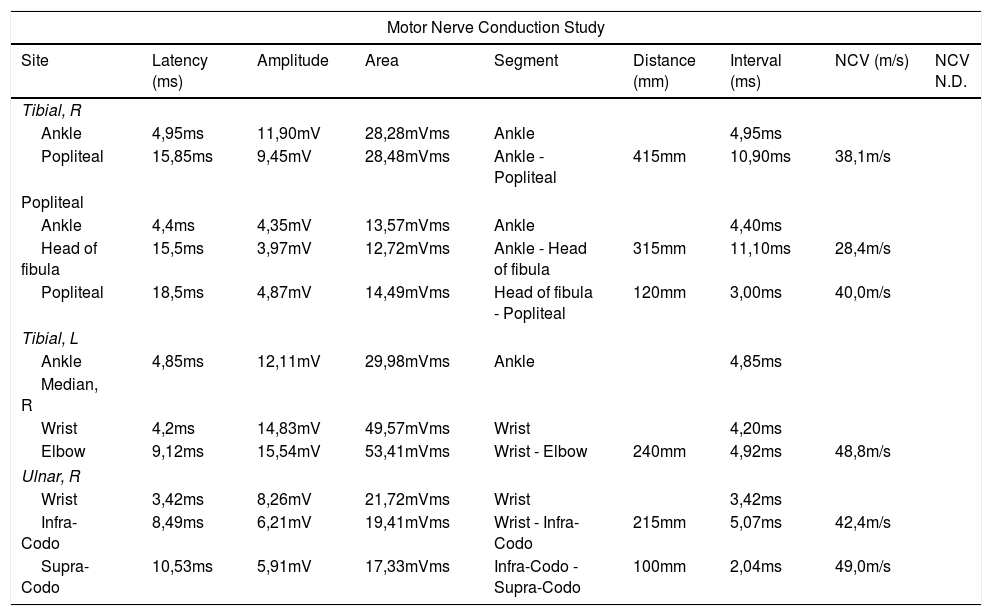
Electroneurograma del paciente mostrando enlentecimiento de la velocidad de conducción (flechas) en determinados trayectos de nervios motores de MMII (tibial 38,1m/s y peroneo en trayecto distal de 28,4m/s) y de nervio cubital derecho de 42m/s en trayecto infracodo-muñeca con normalidad de amplitud
| Motor Nerve Conduction Study | ||||||||
|---|---|---|---|---|---|---|---|---|
| Site | Latency (ms) | Amplitude | Area | Segment | Distance (mm) | Interval (ms) | NCV (m/s) | NCV N.D. |
| Tibial, R | ||||||||
| Ankle | 4,95ms | 11,90mV | 28,28mVms | Ankle | 4,95ms | |||
| Popliteal | 15,85ms | 9,45mV | 28,48mVms | Ankle - Popliteal | 415mm | 10,90ms | 38,1m/s | |
| Popliteal | ||||||||
| Ankle | 4,4ms | 4,35mV | 13,57mVms | Ankle | 4,40ms | |||
| Head of fibula | 15,5ms | 3,97mV | 12,72mVms | Ankle - Head of fibula | 315mm | 11,10ms | 28,4m/s | |
| Popliteal | 18,5ms | 4,87mV | 14,49mVms | Head of fibula - Popliteal | 120mm | 3,00ms | 40,0m/s | |
| Tibial, L | ||||||||
| Ankle | 4,85ms | 12,11mV | 29,98mVms | Ankle | 4,85ms | |||
| Median, R | ||||||||
| Wrist | 4,2ms | 14,83mV | 49,57mVms | Wrist | 4,20ms | |||
| Elbow | 9,12ms | 15,54mV | 53,41mVms | Wrist - Elbow | 240mm | 4,92ms | 48,8m/s | |
| Ulnar, R | ||||||||
| Wrist | 3,42ms | 8,26mV | 21,72mVms | Wrist | 3,42ms | |||
| Infra-Codo | 8,49ms | 6,21mV | 19,41mVms | Wrist - Infra-Codo | 215mm | 5,07ms | 42,4m/s | |
| Supra-Codo | 10,53ms | 5,91mV | 17,33mVms | Infra-Codo - Supra-Codo | 100mm | 2,04ms | 49,0m/s | |
| F-wave Study | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Nerve | Stim.Site | F-Lat. | F-Lat. N.D. | M Lat. | F-M Lat. | F-Occurr. | Distance | FWCV | N.D. | |
| Tibial | R | Ankle | 63.8ms | 5.8ms | 58ms | 9/10,90% | ||||
| Tibial | L | Ankle | 59.9ms | 8/10,80% | ||||||
| Median | R | Wrist | 31.9ms | 3.85ms | 28.05ms | 9/10,90% | ||||
| Ulnar | R | Wrist | 32ms | 10/10,100% | ||||||
| Sensory Nerve Conduction Study | ||||||||
|---|---|---|---|---|---|---|---|---|
| Site | Latency (ms) | Amplitude | Area | Segment | Distance (mm) | Interval (ms) | NCV (m/s) | NCV N.D. |
| Sural, L | ||||||||
| Sural | 3,1ms | 6,14uV | 0,33uVms | Sural | 130mm | 3,10ms | 41,9m/s | |
| Sural, R | ||||||||
| Sural | 3,18ms | 6,44uV | 0,49uVms | Sural | 130mm | 3,18ms | 40,9m/s | |
| Sural | 3,18ms | 5,82uV | 0,26uVms | Sural | 130mm | 3,18ms | 40,9m/s | |
| Median, R | ||||||||
| II dedo muñeca | 2,76ms | 14,60uV | 0,88uVms | II dedo muñeca | 140mm | 2,76ms | 50,7m/s | |
| Ulnar, R | ||||||||
| Wrist-V | 2,18ms | 24,90uV | 1,51uVms | Wrist-V | 115mm | 2,18ms | 52,8m/s | |
Gibbons y Freemann2 estudian una cohorte de 16 pacientes diagnosticados de TIND, en los que realizan un estudio meticuloso de los síntomas que aparecen en esta entidad, destacando las características del dolor y la descripción y medida de los síntomas autonómicos, biopsia intraepidérmica y seguimiento a largo plazo. Muestran como aparece tras la corrección rápida de la glucemia, tanto en pacientes tratados con insulina como en el caso que presentamos, así como en aquellos tratados con antidiabéticos orales, motivo por el que les parece más adecuado el término de TIND que el de neuritis insulínica. Estos mismos autores3, recientemente proponen unos criterios de inclusión de la TIND, entre los que se encuentran: 1) El inicio agudo de dolor neuropático o de síntomas autonómicos; 2) Un descenso en la HbA1C de más del 2% en 3 meses, y 3) El dolor neuropático y/o los síntomas autonómicos aparecen en las 8 semanas del descenso documentado de HbA1C.
El caso que presentamos cumpliría todos los criterios propuestos, presentando un inicio agudo del dolor y de síntomas autonómicos en forma de taquicardia mantenida durante todo el ingreso, hipertensión diastólica y muy probablemente también la anorexia inicial y la plenitud pospandrial. Los síntomas autonómicos más frecuentes descritos3,4 son la hipotensión ortostática y el síncope vasovagal, que en nuestro paciente no documentamos, probablemente por la baja sospecha clínica durante su ingreso hospitalario. El segundo criterio diagnóstico que cumplía nuestro paciente fue un descenso de HbA1C de 5,9 puntos en menos de 2 meses y, por último, la aparición de la clínica tras la corrección metabólica.
Habría que diferenciar la TIND de otras neuropatías agudas que pueden presentarse en estos pacientes, especialmente la neuropatía caquéxica diabética5, cuyas manifestaciones clínicas pueden parecerse: alteración sensitiva y motora simétrica en distintos grados, de presentación subaguda con disfunción autonómica. La peculiaridad de ésta última es la existencia de anorexia, pérdida involuntaria y severa de peso junto con inestabilidad emocional, síntomas que se corrigen de forma completa tras la ganancia ponderal. No se conoce con exactitud la fisiopatología de la neuropatía caquéxica, ni hay establecidos unos criterios diagnósticos claros existiendo en la literatura solo case reports. No descartamos que nuestro paciente presentara ambos procesos, dado que se constató la pérdida importante de peso involuntaria (IMC: 15) y la labilidad emocional, que en su momento fue descrita como reactiva al proceso doloroso.
Como conclusión, la TIND o neuritis insulínica es una entidad rara, poco conocida, en la que hay que pensar para poder diagnosticarla, y que probablemente podría ser evitada planteando un tratamiento menos agresivo para corregir la alteración metabólica, ya que, aunque es un proceso autolimitado, la intensidad del dolor puede llegar a ser incapacitante y precisar ingreso hospitalario como el caso que presentamos.