La enfermedad de Parkinson es un trastorno neurológico degenerativo que afecta a más de 7 millones de personas en todo el mundo. Se desconoce su etiología, aunque se acepta que existe una susceptibilidad genética a agentes ambientales. Estos agentes ambientales incluyen hongos, bacterias y virus. Tres microorganismos están directamente relacionados con un mayor riesgo estadístico de presentar enfermedad de Parkinson: el género de hongos Malassezia, la bacteria Helicobacter pylori y el virus de la hepatitis C. Estos microorganismos, si el huésped es vulnerable por susceptibilidad genética o debilidad inmunológica, pueden acceder al sistema nervioso, infectarlo y causar neuroinflamación crónica con neurodegeneración. Otros microorganismos se relacionan desde una vertiente epidemiológica con la enfermedad, destacando los virus influenza tipo A, de la encefalitis japonesa tipo B, de San Luis y del Nilo Occidental. Estos virus pueden afectar al sistema nervioso causando encefalitis, cuya consecuencia puede ser un parkinsonismo. En este artículo se hace una revisión de los mencionados agentes infecciosos y su papel en la enfermedad de Parkinson.
Parkinson's disease is a neurodegenerative disorder that affects more than 7 million people worldwide. Its aetiology is unknown, although the hypothesis of a genetic susceptibility to environmental agents is accepted. These environmental agents include fungi, bacteria, and viruses. Three microorganisms are directly associated with a significantly increased risk of developing Parkinson's disease: the fungal genus Malassezia, the bacterium Helicobacter pylori, and the hepatitis C virus. If the host is vulnerable due to genetic susceptibility or immune weakness, these microorganisms can access and infect the nervous system, causing chronic neuroinflammation with neurodegeneration. Other microorganisms show an epidemiological association with the disease, including the influenza type A, Japanese encephalitis type B, St Louis, and West Nile viruses. These viruses can affect the nervous system, causing encephalitis, which can result in parkinsonism. This article reviews the role of all these microorganisms in Parkinson's disease.
La enfermedad de Parkinson (EP) es el segundo trastorno neurodegenerativo más frecuente, que afecta a más del 1% de personas mayores de 65 años. El principal cambio patológico de la EP es la degeneración y muerte de las neuronas dopaminérgicas en la substantia nigra pars compacta, una región clave del control motor en el sistema nervioso central (SNC). Este trastorno se diagnostica a través de la tríada clásica motora: bradicinesia, rigidez y temblor en reposo1,2. Desde un punto de vista anatomopatológico, la EP se considera como una alfa-sinucleopatía, un trastorno que está relacionado con la anómala agregación intraneuronal de la proteína alfa-sinucleína (aSyn)3-6. La agregación de aSyn conduce a la formación de inclusiones de Lewy y, en consecuencia, a la muerte de células dopaminérgicas de sustancia negra5-7. La EP es un trastorno multifactorial, en el que están involucrados diversos factores como la neuroinflamación, el estrés oxidativo, infecciones y los genes. En esta revisión se trata sobre los factores infeccioso y neuroinflamatorio, de creciente importancia para explicar la patogénesis de la enfermedad, así como los agentes infecciosos involucrados en la enfermedad8-10.
La infección como factor de riesgo de enfermedad de ParkinsonMetaanálisis recientes indican que al menos 3microorganismos están directamente relacionados con un mayor riesgo estadístico de presentar EP. Estos microorganismos son el género de hongos Malassezia, la bacteria Helicobacter pylori (HP) y el virus de la hepatitis C (VHC)11,12. A nivel epidemiológico, otros microorganismos se relacionan con la aparición de EP, sobre todo virus causantes de encefalitis asociada a parkinsonismo. Entre estos destacan los virus influenza tipo A, de la encefalitis japonesa tipo B, de San Luis y del Nilo Occidental13.
Las infecciones causadas por los 3principales microorganismos comentados son muy frecuentes en la población humana, pero solo un número muy limitado de individuos desarrollan EP. ¿Por qué? Es ampliamente aceptado que los microorganismos pueden promover la aparición de EP solo en individuos altamente susceptibles y además deben ocurrir varias condiciones patológicas. En primer lugar, el microorganismo debe ser neurotropo, o sea, capaz de invadir el SNC. En segundo lugar, el agente infeccioso debe causar muerte celular aguda y una fuerte respuesta defensiva en el cerebro, lo que conduce a una «tormenta de citocinas». En tercer lugar, una vez que la «tormenta de citocinas» desaparece, deben quedar secuelas perdurables que excedan al factor iniciador. En otras palabras, se desarrolla una neuroinflamación crónica debida a la activación persistente de la microglía y astrocitos, células defensivas del SNC, por lo general facilitada por un déficit inmunológico añadido14. Este déficit se caracteriza porque los linfocitos T CD4+proliferan ante la presencia del patógeno pero su respuesta defensiva, basada en la liberación de citocinas, está debilitada14. Otros autores proponen la llamada hipótesis del «doble ataque»: el primer ataque sensibiliza el cerebro a un ataque posterior, probablemente ambiental, que activa la microglía y que no sería patógeno en ausencia de un sistema nervioso ya sensibilizado («dual-hit hypothesis»)15-17. Sea lo que fuere, un estudio exhaustivo sobre los mecanismos por los cuales las infecciones aumentan el riesgo de EP puede mejorar nuestra comprensión de la fisiopatología de la EP.
Neuroinflamación como proceso patológico en la enfermedad de ParkinsonLa neuroinflamación crónica está adquiriendo cada vez más importancia como proceso patológico en la EP18,19. Es conocido que hay una activación crónica de microglía y astrocitos que se manifiesta por un aumento de citocinas como interleucinas (IL-1β, IL-2, IL-4, IL-6), factor transformante alfa (TNF-α) e interferón gamma (IFN-γ). Ello origina una mayor inflamación e infiltración linfocitaria y la llegada al SNC de macrófagos de la sangre20,21. Aunque hay infiltración linfocitaria, hay déficit en la respuesta de linfocitos T CD4+como se ha comentado, probablemente relacionada con hiperactividad de IFN-γ14. La existencia de inflamación crónica se refleja analíticamente a nivel sanguíneo, pues los niveles séricos de proteína C reactiva, marcador clínico de inflamación, se encuentran elevados sea cual sea el grado de evolución de la EP22. Además, niveles superiores a 0,69mg/l de proteína C reactiva se correlacionan con un mayor deterioro motor y niveles muy elevados son de mal pronóstico vital23,24. La infección del sistema nervioso y la neuroinflamación crónica causante de neurodegeneración secundaria están relacionadas, como se ha dicho, con diversos patógenos que se describen a continuación.
Hongos del género MalasseziaMalassezia prolifera en la piel e intestino de enfermos de párkinsonLos hongos del género Malassezia se encuentran naturalmente en las superficies de la piel de los seres humanos, sobre todo en los folículos pilosos. Siete especies de Malassezia se han identificado en la piel humana: Malassezia globosa (M. globosa), Malassezia furfur, Malassezia slooffiae, Malassezia sympodialis, Malassezia Restricta (M. restricta), Malassezia obtusa y Malassezia japonicа. Los síntomas relacionados con la piel son muy comunes en la EP, pero hay poca literatura sobre la afectación de la piel o microorganismos residentes en la piel en la EP. Y merece recordar que el concepto de piel como «reflejo» de la EP se remonta a más de un siglo25. Además, la importancia de la piel en la EP se puso de manifiesto hace ya más de 10años con los estudios que demostraban la presencia de depósitos de aSyn en las terminales nerviosas autónomas cutáneas26-28.
Casi todos los enfermos de párkinson, sino todos, sufren de algún trastorno dermatológico como hiperhidrosis, foliculitis o dermatitis seborreica, que facilita el crecimiento del hongo. En concreto, la dermatitis seborreica afecta a más del 60% de los pacientes con EP, mientras que en la población general la prevalencia es del 3%29,30. Hay autores que niegan una relación causal entre EP, inflamaciones cutáneas y Malassezia, y sugieren que es un factor de comorbilidad31,32. De hecho, Malassezia es un patógeno oportunista y lipofílico, que prolifera si hay acumulación de sebo cutáneo, y la dermatitis seborreica o la foliculitis van acompañadas de una secreción excesiva de sebo cutáneo y alteración en su composición33-35.
Sin embargo, hay datos que sugieren una relación más directa, no oportunista, entre la EP y Malassezia. Así una de las causas de alteración de la composición del sebo en la piel es el envejecimiento, que es el principal factor de riesgo en la EP36. Las inflamaciones cutáneas comentadas suelen aparecer antes del diagnóstico de EP. Además, Malassezia se relaciona con las formas genéticas de parkinsonismo porque los polimorfismos genéticos asociados con la EP (LRRK2, GBA, PINK1, SPG11, SNCA) aumentan la disponibilidad de lípidos dentro de las células humanas, sobre todo ácidos grasos saturados de cadena larga y gangliósidos, que proporcionan un ambiente propicio al crecimiento de Malassezia35,37.
El género Malassezia, sobre todo M. restricta, se encuentra también presente en el intestino. Generalmente, es un microorganismo comensal que forma parte de la microbiota fisiológica del intestino, pero que prolifera y se hace patógeno si hay alteración de la misma. Esto ocurre en la disfunción gastrointestinal, que afecta a más del 80% de los pacientes de párkinson, y en los procesos inflamatorios intestinales como colitis, que son también muy frecuentes en la población parkinsoniana38. Al igual que sucede con las inflamaciones cutáneas, estas alteraciones intestinales suelen aparecer años antes del diagnóstico de la enfermedad. La inflamación entérica daña la barrera gastrointestinal y facilita la invasión transneuronal o hematógena de patógenos39,40. Autores como Braak et al. postulan incluso que los procesos patológicos en la EP se originan en el tracto gastrointestinal y se extienden hacia el SNC a través del nervio vago41. En este contexto, merece la pena mencionar que la vagotomía se relaciona con un menor riesgo de presentar la EP42,43.
La inflamación intestinal crónica se acompaña de una respuesta neuroinflamatoria potente en la pared intestinal, con producción de citocinas y anticuerpos tipo IgE contra Malassezia. Esto sucede de un modo más acentuado en personas con una determinada susceptibilidad genética, asociada a un polimorfismo en el gen CARD9, que sintetiza la proteína CARD9 que es un factor antifúngico específico44. Es muy interesante que el déficit de CARD9 también facilita la invasión fúngica del sistema nervioso45. En fin, no es descartable un papel patogénico de Malassezia de origen entérico en los pacientes de EP, sobre todo si se asocia una susceptibilidad por polimorfismo del gen CARD9.
Malassezia consume levodopaLos hongos Malassezia producen melanina a partir de levodopa, molécula precursora de la dopamina y fármaco principal en el tratamiento de la EP46. El hongo se puede definir como levodopa-trófico y crece más fácilmente si hay levodopa en el medio. La levodopa también facilita el crecimiento de la hifa del hongo, su forma más agresiva. Todos estos hechos plantean la posibilidad de que Malassezia, si invade el SNC, pudiera ser más invasivo en regiones ricas en levodopa, como las neuronas dopaminérgicas de la sustancia negra47. Finalmente, el consumo de levodopa por los pacientes con párkinson podría facilitar el crecimiento de Malassezia, particularmente en la piel y en el intestino, aunque este hecho no ha sido demostrado48.
Malassezia libera factores proinflamatorios y antigénicosLa inflamación producida por Malassezia se agrava y cronifica debido a la naturaleza de sus enzimas29,35. El hongo consume lípidos celulares gracias a sus lipasas y fosfatasas, con el objeto de obtener ácidos grasos libres. Su combustible fundamental son los ácidos grasos saturados de cadena larga, que abundan en el sebo y la dieta humanos, y cuya concentración cambia con la edad, condiciones inmunológicas del sujeto y la neurodegeneración. Las lipasas y fosfatasas fúngicas pueden iniciar respuestas inflamatorias porque liberan ácido oleico y ácido araquidónico desde los lípidos sebáceos. Estos ácidos originan, además de ácidos grasos libres, citocinas proinflamatorias como IL-1β, IL-2, IL-5 e IL-6.
Otras enzimas fúngicas como la beta-glucuronidasa y la leucina-arilamidasa pueden actuar como antígenos en sujetos susceptibles y son capaces de modular la respuesta inmunitaria del huésped. Facilitan la inflamación y debilitan la respuesta linfocitaria en el tejido colonizado por el hongo29,49. Las enzimas más destacadas del hongo se presentan en la tabla 1. Finalmente, si Malassezia invadiera el SNC, la infección activaría la microglía y aumentarían los niveles tisulares de factores inflamatorios de origen microglial. como TNF-α, IFN-γ e IL.
Malassezia podría invadir el sistema nerviosoAunque la presencia de Malassezia en la sustancia negra no ha sido confirmada, el hongo se encuentra en el SNC de los pacientes con EP, como han demostrado Carrasco et al.50. Estos autores del Centro «Severo Ochoa» de la Universidad Autónoma de Madrid los detectan en tejido mesencefálico, troncoencefálico y corteza motora, aunque no estudian núcleos nerviosos de un modo más detallado. Este estudio demuestra que solo Malassezia, en concreto M. globosa y M. restricta, así como Cladosporium, un hongo muy común, están presentes en el SNC de todos los pacientes estudiados.
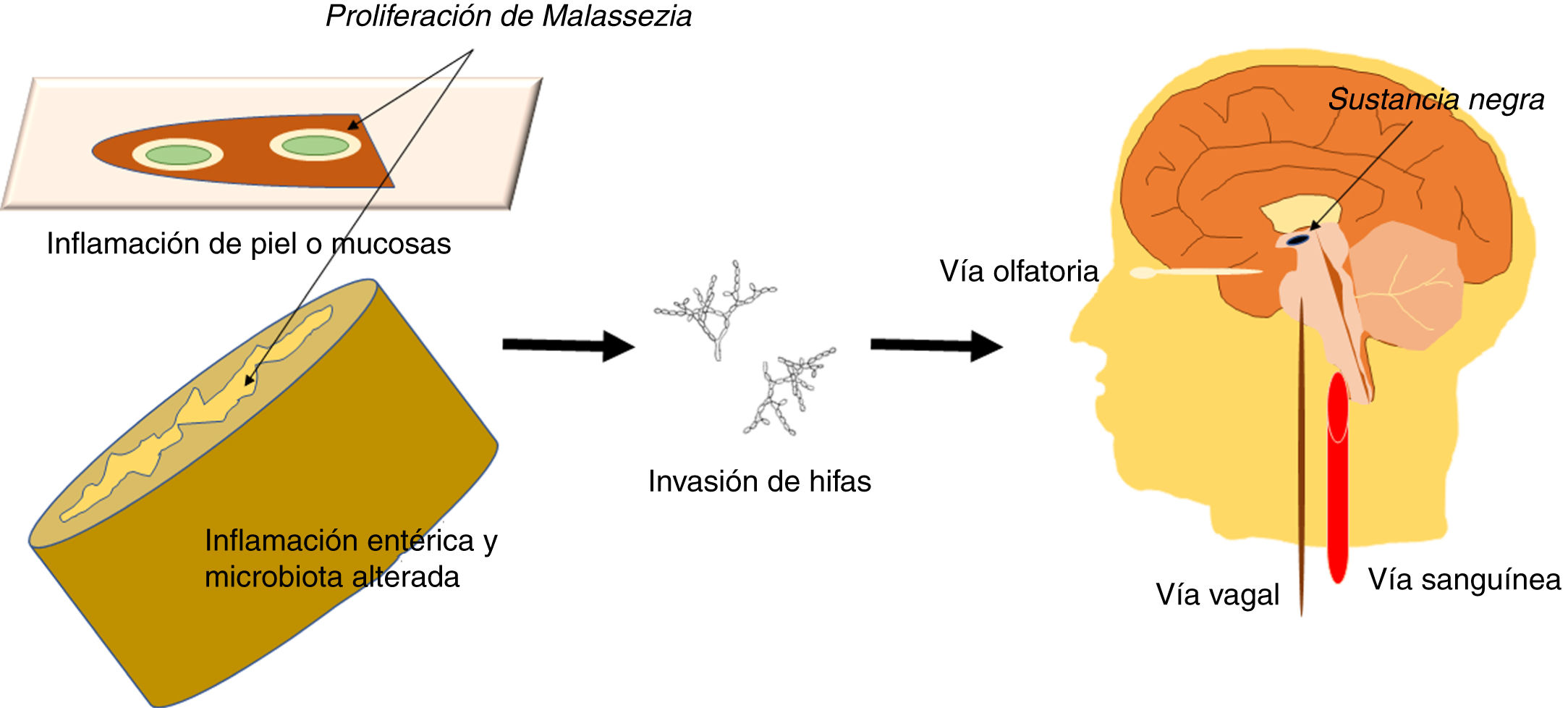
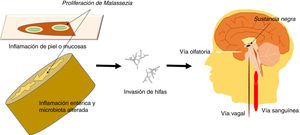
Se sabe que la infección causada por Malassezia se relaciona con un mayor riesgo de EP35,50 y, aunque dicha infección podría ser una comorbilidad como se ha comentado, un papel directo de Malassezia no es descartable. Podría plantearse que el hongo, como microorganismo oportunista que es, puede aprovechar ciertas limitaciones del huésped para acceder al sistema nervioso, quizás por vía hematógena o a través de nervios periféricos, como el vago o el olfatorio. La infección oportunista tendría lugar si hay una predisposición genética, un sistema inmunitario debilitado, inflamación intestinal con microbiota alterada o barreras cutáneas o mucosas dañadas. Un esquema de las vías de invasión del hongo se presenta en la figura 1. Generalmente, Malassezia es un organismo comensal que forma una parte natural de la piel humana y microbiota intestinal, pero puede adquirir capacidades patógenas si prolifera y se transforma en su forma hifal51. El modo como el hongo invade el sistema nervioso no se conoce actualmente52.
Esquema que muestra las vías potenciales de invasión del sistema nervioso central por Malassezia. Estos hongos son microorganismos oportunistas que aprovechan limitaciones del huésped para acceder al sistema nervioso, dañar las neuronas y causar neuroinflamación. La infección oportunista tendría lugar si hay una susceptibilidad genética, sistema inmunitario debilitado, inflamación intestinal con microbiota alterada y barreras cutáneas o mucosas dañadas. La forma más invasiva del hongo es la hifa, que podría acceder al SNC por vía transneuronal a través del nervio olfatorio o del nervio vago, o por vía hematógena. Podría alcanzar la sustancia negra donde anidaría, pues el hongo consume levodopa y tendría predilección por regiones ricas en levodopa, como las neuronas dopaminérgicas nígricas.
La bacteria HP afecta a la mitad de la población, pero en los pacientes con EP el riesgo de estar infectado con HP es unas 3 veces mayor que en la población general53, de modo que la prevalencia de infección en los pacientes se estima del 35 al 70%54. Además, si se infecta una persona con HP, el riesgo de presentar EP es 1,5 a 2 veces mayor55.
La inflamación gástrica causada por el HP origina, a su vez, inflamación entérica, que modifica la microbiota intestinal. La microbiota alterada produce factores inflamatorios, altera la respuesta inmunitaria del huésped y facilita la agregación de aSyn en el nervio vago, factores que se relacionan con la patogénesis de la EP56-58. Además, como se ha comentado con Malassezia, la inflamación entérica daña la barrera gastrointestinal y facilita la invasión transneuronal o hematógena de patógenos39,40.
Todos estos hechos se enmarcan actualmente en la llamada «interacción anómala del eje intestino-cerebro» propia de la EP. Se sabe que hay factores genéticos que subyacen a esta anómala interacción intestino-cerebro y que hacen que el sujeto sea más susceptible a presentar EP. Entre estos factores genéticos se debe destacar la sobreexpresión del gen CARD15, que se asocia a colitis y enfermedad de Crohn59, la excesiva metilación del gen SNCA que genera una αSyn anómala con mayor capacidad de agregación57, o variaciones del gen TREM2 (Triggering Receptor Expressed on Myeloid cells type 2) que se relacionan con un mayor riesgo de presentar EP60.
Helicobacter pylori reduce la eficacia de la levodopaLos pacientes con EP que muestran positividad a HP presentan respuestas motoras disminuidas a la levodopa61-63, pues la bacteria reduce la eficacia del fármaco. La erradicación de HP, de hecho, eleva los niveles de levodopa plasmáticos en los pacientes y mejora su respuesta motora64-66. La interacción de la bacteria con el fármaco parece ser que se realiza a 3niveles. Primero, el HP cambia el pH gástrico, como es bien conocido, y ello repercute en una menor absorción de levodopa67. Segundo, la bacteria consume levodopa, al menos in vitro, lo cual disminuiría la biodisponibilidad del fármaco68. Finalmente, atrapa al fármaco por medio de adhesinas de la membrana bacteriana e induce inflamación entérica, lo que en conjunto disminuye la reabsorción intestinal de levodopa67,68.
Helicobacter pylori produce factores neurotóxicos y antigénicosOtra posibilidad que ayude a explicar el mayor riesgo de EP asociado a la infección con HP es la producción de toxinas y antígenos con acción deletérea sobre neuronas. Así, el HP libera toxinas como VacA (vacuolating cytotoxin) y CagA (cytotoxin-associated gene encoding CagA), que muestran un efecto neurotóxico sobre neuronas dopaminérgicas. De hecho, todos los pacientes con EP y positividad a HP expresan CagA en los inmunoblots séricos, lo que indica que esta sustancia podría afectar al sistema nervioso69. El HP posee una enzima, la colesteril-glucosiltransferasa, que glucosila el colesterol de membrana dando 3derivados glucosilados. Estos derivados poseen acción neurotóxica sobre neuronas dopaminérgicas y muestran actividad proagregante de la aSyn en el nervio vago del estómago70-72. A este respecto, recuérdese la ya comentada hipótesis de Braak sobre que los procesos patológicos en la EP se extienden hacia el SNC a través del nervio vago41.
El HP produce proteínas fucosiladas que tienen capacidad antigénica, pues se parecen a glucoconjugados de membrana de las neuronas73. Esta acción antigénica puede generar autoanticuerpos que reaccionen con las neuronas dopaminérgicas del sistema nervioso o causen una tormenta de citocinas a nivel cerebral, que agrava la neurodegeneración, como ya se ha comentado71,74. Hay que añadir que la bacteria no se ha localizado en sustancia negra de los enfermos ni tejido cerebral, e incluso en sangre74.
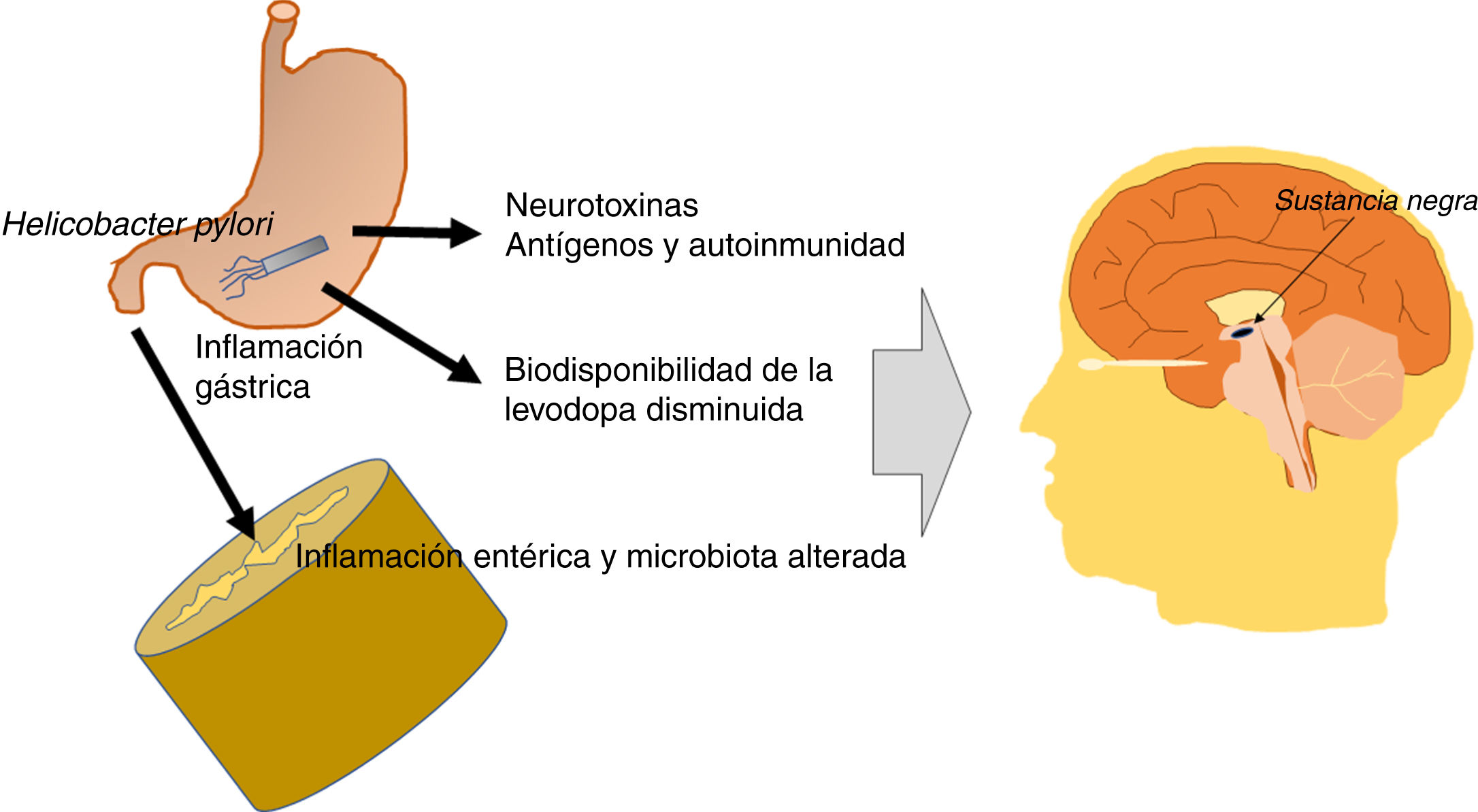
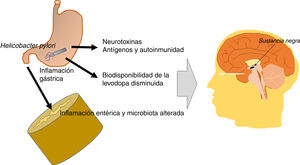
En resumen, los efectos del HP son indirectos o sobre la biodisponibilidad de levodopa. Por una parte, produce factores neurotóxicos y antigénicos con acción deletérea sobre neuronas dopaminérgicas, e induce inflamación gástrica e intestinal que modifica la microbiota del intestino, haciéndola patógena. Todo ello repercute negativamente en sujetos susceptibles genéticamente de presenta EP. Por otro lado, la eficacia terapéutica de la levodopa está disminuida en los pacientes infectados con HP. Un esquema de los posibles mecanismos de acción del HP en la EP se presenta en la figura 2.
Esquema que muestra los posibles mecanismos de acción patogénica de la bacteria Helicobacter pylori en la enfermedad de Parkinson. La bacteria Helicobacter pylori produce factores neurotóxicos y antigénicos con acción deletérea sobre neuronas dopaminérgicas de la sustancia negra. También induce inflamación gástrica e intestinal, que modifica la microbiota del intestino haciéndola patógena. Finalmente, la biodisponibilidad y la eficacia terapéutica de la levodopa están disminuidas en los pacientes infectados con Helicobacter pylori.
El VHC aumenta el riesgo de presentar EP entre 1,5 y 2 veces75-78 y dicho riesgo elevado desaparece tras una terapia antiviral efectiva79,80. Parece ser que hay individuos especialmente susceptibles, donde el VHC puede atravesar la barrera hematoencefálica, producir una tormenta de citocinas cerebral con neuroinflamación y dañar las neuronas de dopamina de la sustancia negra75. En estos individuos hay un perfil receptorial específico para el VHC, que incluye las proteínas de membrana CD81, claudina-1, LDLR y ocludina. Estos receptores se expresan sobre todo en las células endoteliales de la microvasculatura cerebral y permiten la entrada masiva del virus en el cerebro humano75,81.
Virus relacionados epidemiológicamente con la enfermedad de ParkinsonVirus influenza tipo AMuchos subtipos de virus influenza tipo A son neurotrópicos y, además de los cuadros respiratorios, pueden originar complicaciones en el SNC82,83, dando lugar a encefalitis y neuroinflamación que pueden ocasionar neurodegeneración a largo plazo83,84. Originan parkinsonismo postencefalítico, como se puso de manifiesto por la mayor incidencia de EP tras pandemias gripales como la de 1918, causada por la cepa H1N1, que causó más de 30millones de muertes85,86. Además, las personas que nacieron alrededor de 1918 tenían un riesgo 2-3 veces mayor de presentar EP que los nacidos con posterioridad a 192487,88. Experimentalmente, se sabe que los virus influenza A H1N1 infectan las neuronas dopaminérgicas de la sustancia negra y activan mecanismos celulares patológicos que subyacen a la EP, como disfunción mitocondrial, estrés de retículo endoplásmico y deficiencia autofágica89,90.
Otros subtipos de virus influenza A, como H5N3, H3N2 y H7N7, algunos causantes de pandemias de gripe como la de 1968 de la cepa H3N2, que causó un millón de fallecimientos, producen tormentas de citocinas a nivel cerebral y daño dopaminérgico, como se demuestra a nivel experimental91-94. Aunque no producen un cuadro encefalítico, la neuroinflamación crónica originada por la tormenta de citocinas podría causar parkinsonismo a largo plazo, como ya se ha comentado12. A este respecto, los virus SARS-CoV (acute respiratory syndrome coronaviruses), como el SARS-CoV-2, causante de la actual pandemia del 2019, inducen una fuerte tormenta de citocinas en el cerebro humano y alteran la función mitocondrial y la autofagia celular95-97. Todo ello se podría traducir en un mayor riesgo de presentar EP, hecho que solo se dilucidará en un futuro.
Otros virus causantes de parkinsonismo postencefalíticoComo se ha comentado, otros virus causantes de encefalitis se asocian a parkinsonismo. Entre estos destacan los virus de la encefalitis japonesa tipo B, de San Luis y del Nilo Occidental13. Estos virus son capaces de producir encefalitis cuya consecuencia puede ser un parkinsonismo atípico, que muestra la clásica sintomatología de la EP, pero que a veces no responde a levodopa y no se asocia a la presencia de cuerpos de Lewy98-102.
ConclusionesSe desconoce la etiología de la EP, pero se acepta que existe una susceptibilidad genética a agentes ambientales. Entre estos agentes ambientales destacan hongos, bacterias y virus. Tres microorganismos están directamente relacionados con un mayor riesgo estadístico de presentar EP: el género de hongos Malassezia, la bacteria HP y el VHC. Estos microorganismos, si el huésped es vulnerable por susceptibilidad genética o debilidad inmunológica, pueden acceder al sistema nervioso, infectarlo y causar neuroinflamación crónica con neurodegeneración. Otros microorganismos se relacionan desde una vertiente epidemiológica con la enfermedad, destacando los virus influenza tipo A, de la encefalitis japonesa tipo B, de San Luis y del Nilo Occidental. Estos virus pueden afectar al sistema nervioso causando encefalitis, cuya consecuencia puede ser un parkinsonismo.
FinanciaciónSin financiación.
Conflicto de interesesEl autor declara que no hay conflictos de intereses.
El autor agradece la inestimable ayuda y amistad de Fernando Rodríguez de Fonseca (Instituto de Investigación Biomédica de Málaga, IBIMA), Antonio Córdoba Fernández y Ángel Martín de Pablos (Universidad de Sevilla).