El sistema colinérgico incluye neuronas localizadas en el cerebro basal anterior y sus axones largos proyectan a la corteza cerebral e hipocampo. Este sistema modula la función cognitiva. En la enfermedad de Alzheimer (EA) y en el proceso de envejecimiento la disfunción colinérgica hay una asociación entre el deterioro cognitivo y el daño progresivo de las fibras colinérgicas, lo que conduce al postulado de la hipótesis colinérgica.
DesarrolloEn la EA se producen alteraciones en la expresión y en la actividad de la colina acetiltransferasa (ChAT) y la acetilcolinesterasa (AChE), enzimas específicas relacionadas con la función del SC. Ambas proteínas juegan un papel importante en la transmisión colinérgica mostrando variaciones en la corteza cerebral y en el hipocampo, tanto por el envejecimiento, como por la EA. En ambas estructuras, los desórdenes demenciales están asociados a la destrucción severa y desorganización de las proyecciones colinérgicas que se encuentran afectadas. Para el estudio de este sistema se han usado marcadores específicos como los anticuerpos contra ChAT y AChE que han sido empleados en las técnicas de inmuhistoquímica de luz y microscopia electrónica en algunas especies animales.
ConclusionesEn este trabajo se hace una revisión de los principales estudios inmunomorfológicos de la corteza cerebral e hipocampo de varias especies animales con énfasis en el SC y su relación con la EA.
The cholinergic system includes neurons located in the basal forebrain and their long axons that reach the cerebral cortex and the hippocampus. This system modulates cognitive function. In Alzheimer's disease (AD) and ageing, cognitive impairment is associated with progressive damage to cholinergic fibres, which leads us to the cholinergic hypothesis for AD.
DevelopmentThe AD produces alterations in the expression and activity of acetyltransferase (ChAT) and acetyl cholinesterase (AChE), enzymes specifically related to cholinergic system function. Both proteins play a role in cholinergic transmission, which is altered in both the cerebral cortex and the hippocampus due to ageing and AD. Dementia disorders are associated with the severe destruction and disorganisation of the cholinergic projections extending to both structures. Specific markers, such as anti-ChAT and anti-AChE antibodies, have been used in light immunohistochemistry and electron microscopy assays to study this system in adult members of certain animal species.
ConclusionsThis paper reviews the main immunomorphological studies of the cerebral cortex and hippocampus in some animal species with particular emphasis on the cholinergic system and its relationship with the AD.
En el cerebro de los mamíferos, los núcleos colinérgicos se localizan en el prosencéfalo basal (PB), hacia el septum medial a través de la banda diagonal de Broca, al núcleo basal de Meynert (NBM), incluyendo a la sustancia innominada. Las neuronas situadas más rostralmente, en el septum medial y rama vertical de la banda diagonal de Broca, inervan al hipocampo (vía septo hipocámpica). Las neuronas más caudales que incluyen al NBM y la sustancia innominada, inervan a la corteza cerebral y la amígdala. Los núcleos del PB reciben conexiones recíprocas de estructuras límbicas (orbitofrontal, polo temporal, región medial del lóbulo temporal y la corteza entorrinal). Los núcleos del tronco cerebral (pedúnculo pontino, tegmental y lateral dorsal tegmental, activan la corteza cerebral a través de proyecciones al tálamo. Tanto el PB como el tronco cerebral proyectan al núcleo reticular del tálamo, teniendo los núcleos colinérgicos una extensa influencia directa e indirecta sobre la actividad cortical y límbica. La neurotransmisión del sistema colinérgico (SC) está implicada en los procesos de memoria, aprendizaje y sueño, entre otras funciones1. Su carencia produce alteraciones en estas funciones, estimándose que puede ser una de las causas de demencia senil o enfermedad de Alzheimer (EA). La biosíntesis de la acetilcolina (C7H16NO2) o éster de ácido acético y colina se realiza en el citoplasma del soma y de las terminales presinápticas por medio de la actividad de la enzima colina acetiltransferasa (ChAT) y en la hendidura sináptica es degradada en acetato y colina por la enzima colina acetilcolinesterasa (AChE) para su recaptura en la neurona presináptica2,3. Tanto la ChAT como la AChE son proteínas marcadoras específicas de la actividad fisiológica de las neuronas colinérgicas, y ambas juegan un papel importante en la homeostasis de la acetilcolina neuronal4.
En la EA3,5,6 se ha reportado una disfunción en el metabolismo colinérgico, así como alteraciones neuronales de innervación, síntesis, degradación y recaptura de la acetilcolina. En el humano, la disminución de las células colinérgicas es un cambio patológico en el cerebro basal anterior7–11. Aunque no es un acontecimiento inicial en la EA, así como en el proceso de envejecimiento12, se implica una denervación cortical relacionada con la eliminación de proyecciones extrínsecas a la corteza cerebral6. Lo anterior se manifiesta como disfunción cognitiva, intelectual y social, en progresión propia de la EA con la siguiente sintomatología: agitación, psicosis, depresión, apatía, ansiedad, desórdenes de sueño y del apetito12–15. En estos pacientes hay disminución en la producción de la ChAT y de la AChE en la corteza cerebral e hipocampo, y defectos en el transporte axonal de dichas enzimas, por degeneración de neuronas colinérgicas del cerebro basal anterior (NBM)16. En estudios cuantitativos del tejido cerebral de pacientes con la EA se observó disminución de las fibras colinérgicas reactivas del 55%, en comparación con el tejido cerebral sano17. Para el estudio de la inervación colinérgica de la corteza cerebral e hipocampo y su importancia particular de los circuitos neuronales en dichas estructuras, se han utilizado una variedad de especies animales de mamíferos y una combinación específica de anticuerpos para marcadores colinérgicos como la ChAT y la AChE, con lo que se ha demostrado su relación directa en procesos de consolidación de la memoria5,6,18–20.
Marcadores colinérgicos en el cerebro humanoLa corteza cerebral del humano posee una compleja y extensa red de axones colinérgicos21–23, los cuales inervan, se originan en las neuronas colinérgicas ubicadas en los núcleos celulares del NBM (núcleo de Maynert), ambos presentan inmunorreactividad para las enzimas ChAT y AChE22,24–26; estas se tiñen y se observan con mayor densidad en las capas corticales iii y v17. La mayoría de las neuronas positivas para la AChE son piramidales y se localizan en la capa v cortical17. En técnicas de inmunohistoquímica realizadas con el anticuerpo para la ChAT muestran una alta densidad de fibras positivas y prolongaciones colinérgicas delgadas en toda la corteza cerebral17; de manera general, las fibras inmunorreactivas para la ChAT tienen una apariencia gruesa como una cadena de cuentas con terminales punteadas27. Todas las áreas corticales contienen una combinación de axones colinérgicos que se encuentran orientados en sentido horizontal, vertical y oblicuo en la superficie. Las fibras horizontales se localizan en la capa i y en menor cantidad en la capa ii. Las fibras orientadas verticalmente se localizan en la mayoría de las capas. Las capas superficiales (i, ii y iii) contienen gran densidad de inervaciones colinérgicas22.
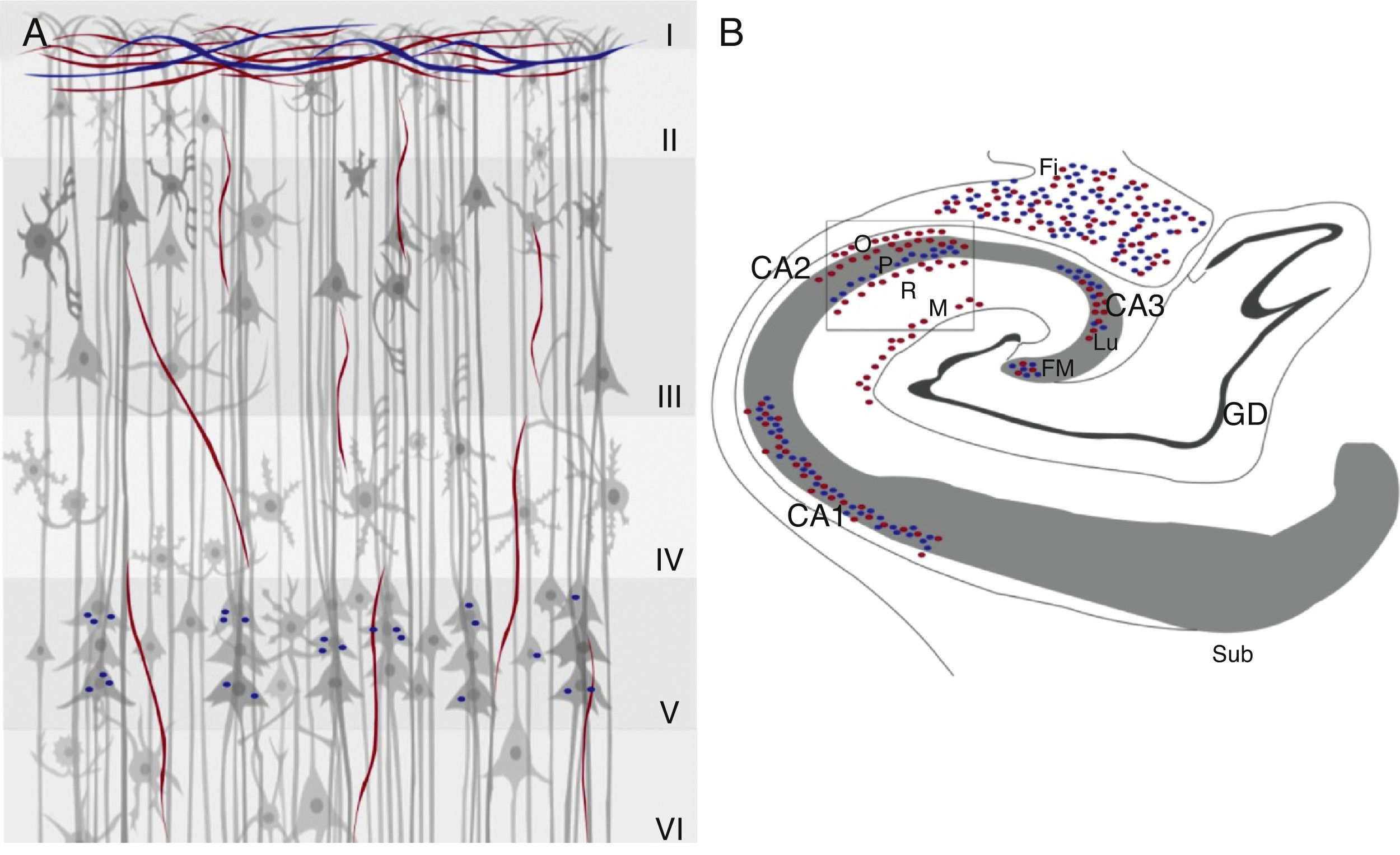
En el hipocampo humano se encuentra inmunorreactividad para la ChAT y la AChE en las fibras de la fimbria y en la sustancia blanca subcortical del giro parahipocampal adyacente a la vía alveolar. Las fibras que se orientan hacia la región CA1 y el giro parahipocampal son delgadas y tienen una distribución radial27. La inmunorreactividad para la ChAT es más intensa en el estrato radial, y en la capa de células piramidales presenta un marcaje finamente punteado, y fibras delgadas orientadas al azar con axones gruesos hacia estas células que provienen del giro parahipocampal. La inmunorreactividad de estas fibras es poco intensa en la capa CA1, así como en el estrato oriens y en el estrato lacunoso molecular27. Las fibras inmunorreactivas positivas para AChE son delgadas; tanto en el estrato oriens como en las fibras musgosas del giro dentado28 y densas en el estrato piramidal de las áreas CA2 y CA3. En el giro dentado, las fibras inmunorreactivas para la ChAT y para la AChE se localizan en 2 capas: una banda de células granulares y otra compuesta por fibras transversales con marca densa27. La capa molecular contiene una densidad uniforme de fibras reactivas para la ChAT, estas se orientan de manera paralela a la capa de células granulares. En la capa molecular, las fibras inmunorreactivas para la ChAT están orientadas en el eje rostro caudal y a este nivel el marcaje es tenue27. La inmunorreactividad para la AChE es más densa en la capa de las células granulares, como una banda delgada adyacente a esta y en la capa de células piramidales existe inervación moderada en el complejo subicular27,28. Las capas polimórfica y molecular presentan una distribución homogénea y aleatoria de la inmunorreactividad28 (fig. 1).
Marcadores colinérgicos ChAT (rojo) y AChE (azul) en la corteza cerebral (A) e hipocampo (B) de humano. Se indican en A, las 6 capas celulares (i-vi) y en B, las 3 áreas de células piramidales en los campos, CA1, CA2 y CA3 con sus respectivos estratos (O) oriens, (P) piramidal (R) radial y molecular (M), así como el giro dentado (GD), de donde emergen las fibras musgosas (FM), que hacen sinapsis con el estrato lucidum (CA3), la fimbria (Fi) y el subiculum (Sub).
En la corteza cerebral del primate se observa la inervación inmunorreactiva para la ChAT distribuida de manera heterogénea con fibras y terminales que provienen del NBM29. En las regiones motoras, la AChE tiene un patrón característico en las capas v y vi, donde las fibras se encuentran orientadas de forma radial y los cuerpos celulares reactivos en la capa vi30.
En el hipocampo de algunas especies de primates no se observan neuronas positivas a la ChAT en la formación hipocampal, ya que el marcaje está restringido a fibras y varicosidades, y estas fibras se han clasificado por tipos, según su distribución y sus características morfológicas (tabla 1).
Fibras colinérgicas en primates
| Tipo i | Son espesas y tienen pocas varicosidades, tienen trayectorias rectas y poseen numerosas fibras positivas a ChAT |
| Tipo ii | Se observan fibras tipo i difusas y numerosas varicosidades |
| Tipo iii | Son delgadas, poseen numerosas varicosidades con trayectorias ramificadas |
ChAT: colina acetiltransferasa.
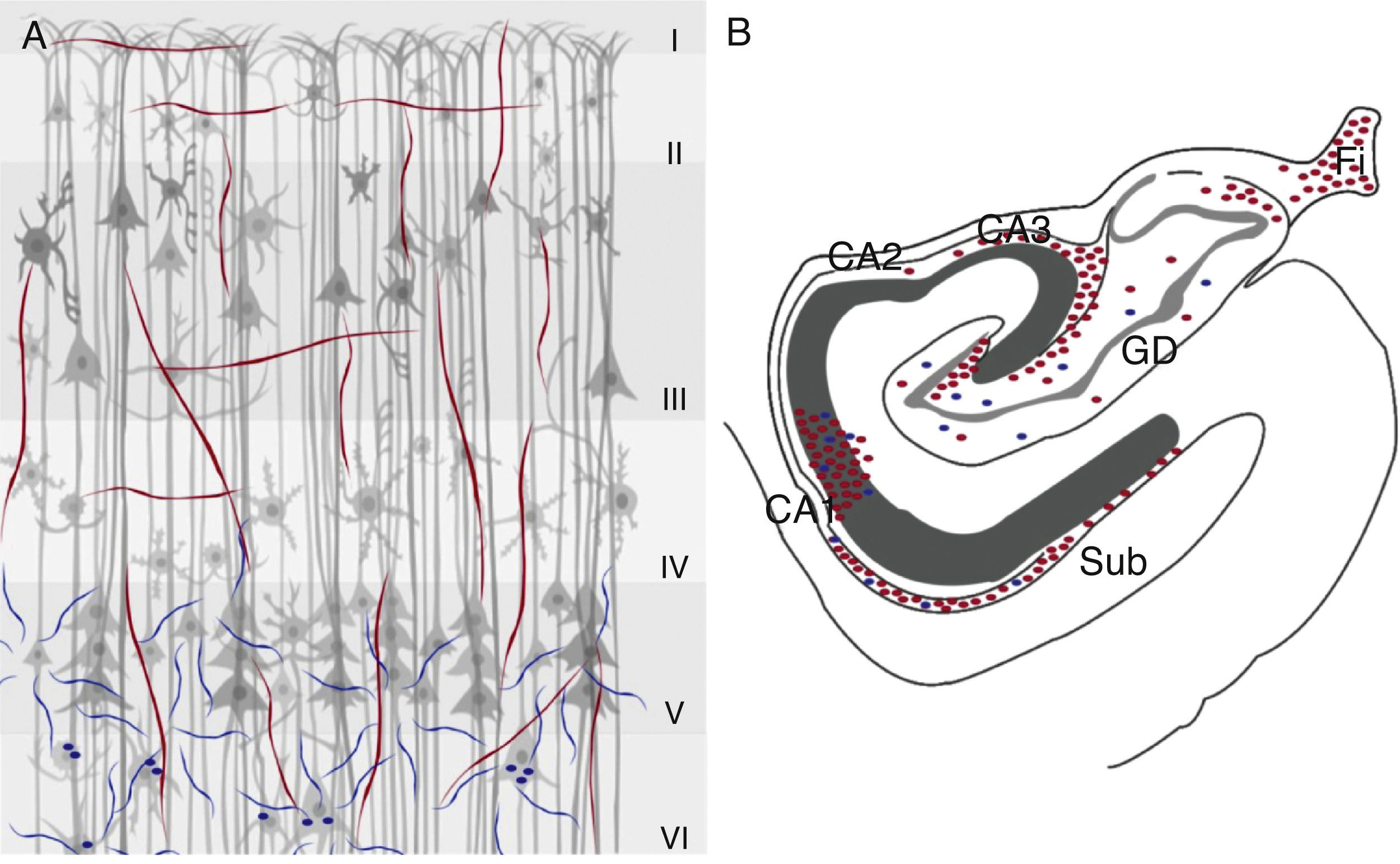
La inmunorreactividad para la ChAT se localiza en el área CA3 hasta el giro dentado y disminuye la densidad de fibras en el área CA231, y fibras positivas para la ChAT en el subiculum y por encima de CA1 en la región de células piramidales hasta la capa molecular. Este marcaje es continuo con las fibras localizadas en el estrato lacunoso molecular y la mayoría de las fibras inmunorreactivas son horizontales y de tipo ii. El marcaje de las fibras positivas para la AChE se encuentra disminuido en el área CA1 y el subiculum31. En el giro dentado se localiza una variación en la densidad de fibras positivas para la ChAT según su orientación, así en la capa molecular de la región antero-dorsal, las fibras se distribuyen de manera difusa, en cambio en las regiones más caudales y en la porción medial adyacente a la fimbria la intensidad se incrementa y disminuye en las porciones laterales32. Con respecto al marcaje para la enzima AChE en el giro dentado, se observa reducción de fibras en todas las capas en comparación con la ChAT32 (fig. 2).
Marcadores colinérgicos ChAT (rojo) y AChE (azul) en la corteza cerebral (A) e hipocampo (B) de primate. En la corteza cerebral se muestran las 6 capas celulares (i-vi) y en la región del hipocampo sus 3 áreas (CA1, CA2 y CA3), así como el giro dentado (GD), la fimbria (Fi) y el subiculum (Sub).
Las técnicas histoquímicas revelan la inervación en áreas corticales provenientes del NBM ya que ahí se ubican las neuronas magnocelulares que son la fuente primaria de inervación colinérgica33.
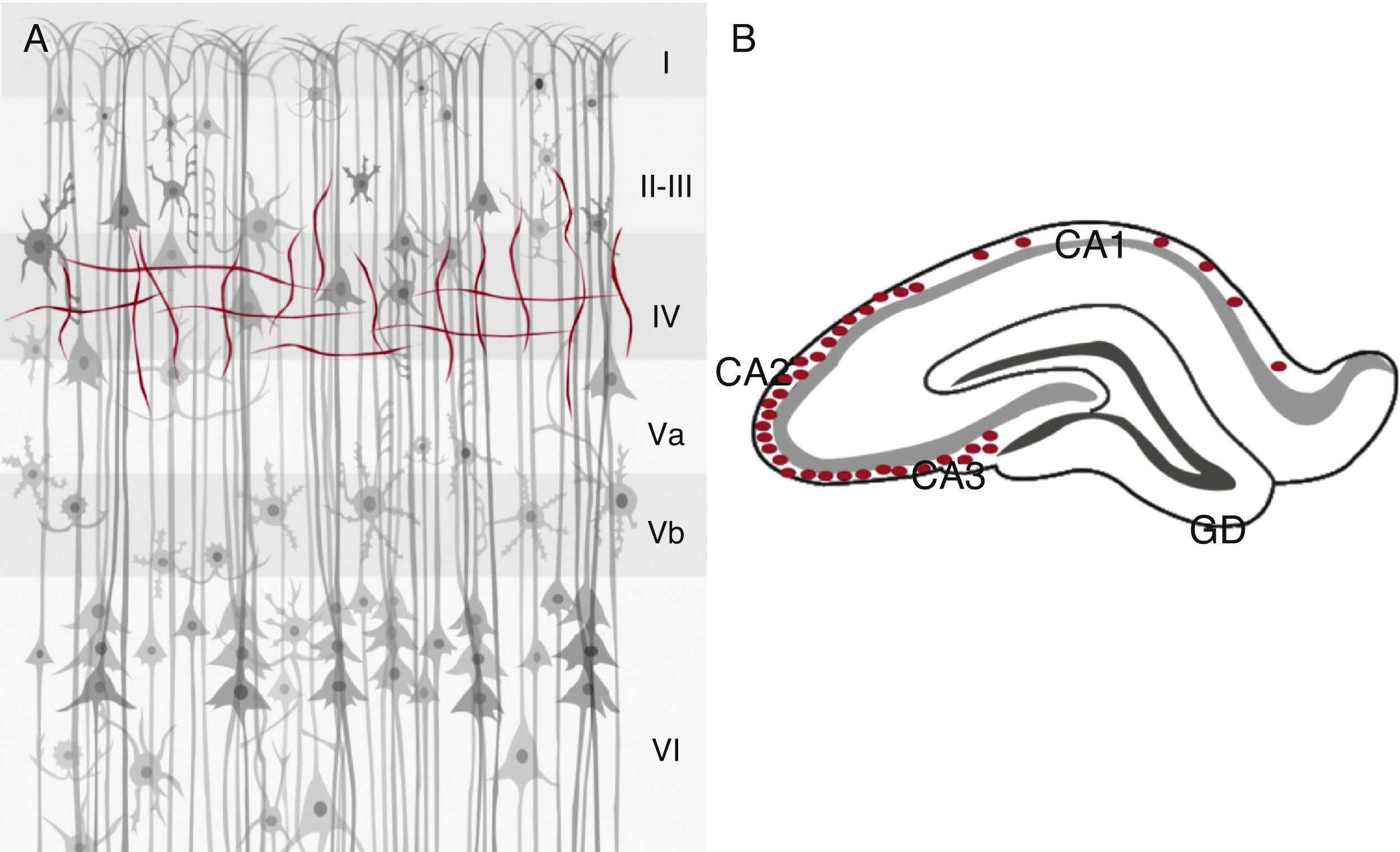
En la corteza cerebral, las fibras inmunorreactivas para la ChAT se observan en las capas iiiy iv, y con un marcaje tenue en la capa ii2,34, así mismo, se encuentran cuerpos celulares fusiformes en dichas capas2. Esto representa solo una pequeña fracción de neuronas corticales que se encuentran con un marcaje menos intenso que las que se ubican en el NBM; muchas de estas neuronas positivas para la ChAT presentan un patrón dendrítico bipolar y algunas son de tipo estrellado, con dendritas orientadas verticalmente a través de las capas corticales34. En la corteza visual primaria el área 17 presenta una gran densidad de fibras en la capa i y menos fibras en las capas iv y v, tanto para la ChAT como para la AChE35.
El hipocampo muestra una distribución de la ChAT positiva finamente granular en el estrato oriens, donde la inmunorreactividad es más densa en las regiones CA2 y CA3. Esta positividad granular del estrato oriens continúa con las fibras inmunorreactivas para la ChAT en el alveus y la fimbria. En el giro dentado se observan tanto gránulos como fibras inmunoreactivas para la ChAT con distribución dorsal y ventral, así como en la capa molecular, con una distribución superficial. En el estrato lacunoso molecular hay pocas fibras positivas para este marcador, los cuales se distribuyen a través de CA1 en transición en el subiculum y hacia la sustancia blanca subcortical36. El hipocampo de la rata recibe fibras aferentes de la AChE, las cuales forman parte de la activación del SC37,38. Se ha reportado que las neuronas positivas para la AChE en el cerebro de la rata poseen una morfología parecida que las neuronas positivas para la ChAT. Se han observado algunas neuronas positivas para la AChE que indican que no es un marcador específico de neuronas colinérgicas en la corteza cerebral en esta especie. Además, la inmunorreactividad de ambos marcadores (ChAT y AChE) no es lo suficientemente intensa como para permitir observar el doble marcaje39 (fig. 3).
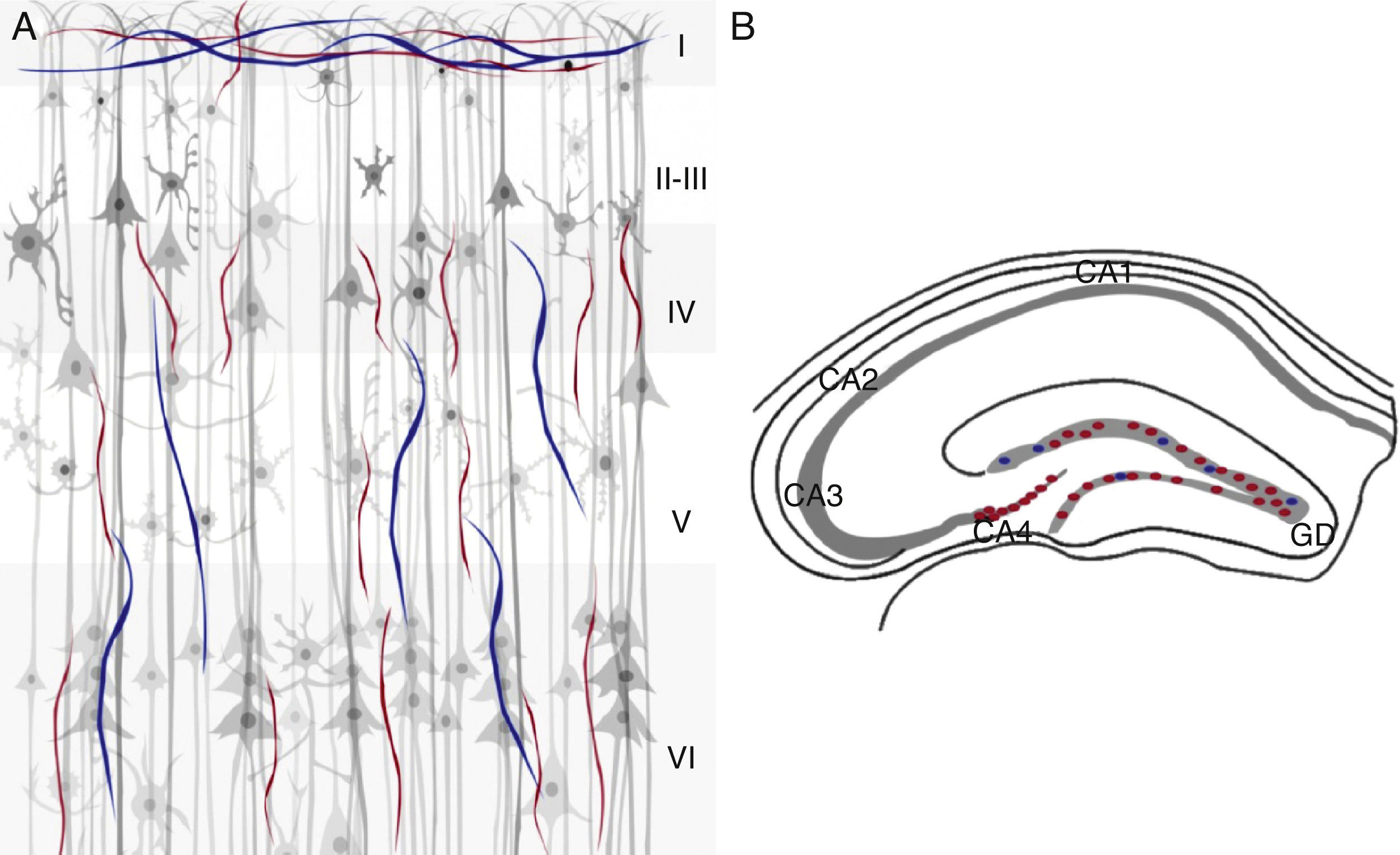
Marcadores colinérgicos en el cerebro del ratónEn las regiones visual, somatosensorial y frontal de la corteza cerebral, el patrón de fibras positivas para la ChAT y la AChE se encuentra organizado de forma trilaminar y se localizan 3 bandas horizontales inmunorreactivas para ambos marcadores. En la capa i, iv y vi, y en menor proporción en la capa v40. Se observa una banda delgada en las capas i y i i más densas localizadas en las capas iv, v y vi; además, la última capa, muestra una acumulación densa de las fibras inmunorreactivas para la ChAT40. En la corteza visual, las fibras colinérgicas se identifican como una banda delgada que atraviesa en la capa i paralela a la superficie pial. En la corteza somatosensorial la mayoría de las células positivas tanto para la ChAT como para la AChE contienen fibras en la capa iv. En todas las regiones de la corteza frontal se incrementa la densidad de fibras colinérgicas sobre todo en la capa i40. En la región del hipocampo se encuentran bandas distintas de fibras colinérgicas. La capa de células piramidales es inmunorreactiva para la ChAT principalmente en CA4. En el giro dentado se observa una banda delgada de este tipo de fibras en toda la capa de células granulares40 (fig. 4).
Modelos animales para Alzheimer y la inervación colinérgicaEn el estudio durante el desarrollo de la inervación colinérgica de la corteza cerebral y el hipocampo en el modelo de la EA, en el ratón transgénico (APPSw,Ind41) que sobre expresa β-amiloide se observó la inmunorreactividad de la ChAT, indicando que la alteración es selectiva al SC en este modelo animal42. En el triple transgénico de la EA (3×Tg-AD), las alteraciones colino-trópicas son dependientes de la edad y el sexo, y de manera más pronunciada en el hipocampo, en la cual se desarrollan primero los péptidos β-amiloide. Por otra parte, la disminución en la expresión de la ChAT en este mismo ratón (3×Tg-AD) se podría explicar por el aumento de la expresión del factor de transcripción REST/NRSF, asociado a los trastornos degenerativos neuronales observados en la EA43.
ConclusiónEn los cerebros de humanos, primates y murinos (rata y ratón), se describen los 2 marcadores principales (ChAT y AChE) del SC, en la corteza cerebral e hipocampo y su distribución particular. En la EA se ha postulado la hipótesis colinérgica que plantea que la disfunción de este sistema conlleva al déficit cognitivo, por ello la importancia de conocer la distribución de dichos marcadores en estas áreas cerebrales (corteza cerebral e hipocampo) que en esta afección se ven principalmente afectadas. Además, los modelos animales permiten una mejor aproximación en la alteración de este SC y su relación con el desarrollo de la EA, para el diseño de estrategias farmacológicas que prevengan o bien que ayuden a su tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.