Aunque la citrulina es producida por la sintasa del óxido nítrico (NO) al activarse el receptor glutamatérgico NMDA, nitritos y nitratos (NOx) son considerados los mejores marcadores de síntesis del NO pues citrulina es también metabolizada por otras enzimas. En este estudio se realizó un análisis de correlaciones de concentraciones de citrulina y NOx en líquido cefalorraquídeo humano para evaluar la proporción en que la citrulina refleja la síntesis del NO y la neurotransmisión glutamatérgica.
MétodosSe incluyeron pacientes con trastornos neurológicos agudos a los que se realizó punción lumbar (n=240). Se determinó la concentración de NOx y aminoácidos por HPLC.
ResultadosNOx no fue diferente por la presencia de infección (p=0,110) o inflamación (p=0,349). La regresión múltiple mostró que NOx correlacionó con glutamina (r=-0,319, p<0,001) y citrulina (r=0,293, p=0,005) pero no con el cociente citrulina/arginina (r=-0,160, p=0,173). El ANCOVA confirmó que NOx está asociado con citrulina (F=7,6, p=0,007) pero no con el cociente citrulina/arginina (F=2,2; p=0,136), ni con la infección (F=1,8; p=0,173) o la inflamación (F=1,4; p=0,227). NOx no correlacionó con arginina ni con glutamato.
ConclusionesEsto sugiere que citrulina refleja parte de la síntesis del NO a pesar de la contribución de otras vías metabólicas. Además, este estudio muestra que la glutamina es un modulador importante de la actividad de la NOS, y que arginina y glutamato no correlacionan con la concentración de NOx.
Although citrulline is produced by nitric oxide (NO) synthase upon activation of the NMDA glutamate receptor, nitrite and nitrate (NOx) concentration is considered the best marker of NO synthesis, as citrulline is also metabolised by other enzymes. This study analyses the correlation between human cerebrospinal fluid NOx and citrulline concentrations in order to determine the extent to which citrulline reflects NO synthesis and glutamatergic neurotransmission.
MethodsParticipants were patients with acute neurological diseases undergoing lumbar puncture (n=240). NOx and amino acid concentrations were determined by HPLC.
ResultsNOx concentrations did not vary significantly where infection (p=0,110) or inflammation (p=0,349) were present. Multiple regression analysis showed that NOx concentration was correlated with glutamine (r=–0,319, p<0,001) and citrulline concentrations (r=0,293, p=0,005) but not with the citrulline/arginine ratio (r=–0,160, p=0,173). ANCOVA confirmed that NOx concentration was correlated with citrulline concentration (F=7,6, p=0,007) but not with the citrulline/arginine ratio (F=2,2, p=0,136), or presence of infection (F=1,8, p=0,173) or inflammation (F=1,4, p=0,227). No association was found between NOx and arginine or glutamate concentrations.
ConclusionThe results suggest that CSF citrulline concentration reflects NOx synthesis to some extent, despite the contribution of other metabolic pathways. In addition, this study shows that glutamine is an important modulator of NO synthase activity, and that arginine and glutamate are not correlated with NOx.
La citrulina y el óxido nítrico (NO) son producidos simultáneamente por la sintasa del NO (NOS, EC 1.14.13.39) en cantidades equimolares1,2; por esto, tanto la citrulina como el cociente citrulina/arginina (Cit/Arg) han sido utilizados en diferentes estudios como marcadores de la síntesis del NO3,4. Sin embargo, dado que otras vías metabólicas alteran los niveles de citrulina, se ha sugerido que este aminoácido no es un marcador confiable de la síntesis del NO5 aunque, por otro lado, algunos estudios han sugerido que la citrulina puede ser un marcador incluso más sensible de la actividad de la NOS en el sistema nervioso central (SNC) humano4,6.
Respecto de los marcadores de la actividad de la NOS, nitritos y nitratos (NOx) son utilizados con mayor frecuencia, especialmente en estudios in vivo. Se considera que los NOx son los mejores marcadores de la síntesis del NO; se ha reportado que su contenido cerebral correlaciona con la actividad de la NOS7,8, aunque no se ha realizado un estudio similar para la participación de la citrulina.
La utilidad de los niveles de citrulina para estimar la síntesis del NO se ha cuestionado pues este aminoácido es metabolizado por varias enzimas5. Por ejemplo, dimetilarginina dimetilaminohidrolasa (DDAH, EC 3.5.3.18) genera citrulina a partir de las metilargininas, que son inhibidores competitivos de la NOS9,10; esta enzima es inducida por citocinas10,11 y es inhibida por arginina, citrulina y el NO producido por la NOS inducible (iNOS)12,13.
Junto con la síntesis de citrulina, en el SNC (y otros sistemas) ocurre la única reacción conocida de la que este aminoácido es sustrato14 a través de la argininosuccinato sintetasa (ASS, EC 6.3.4.5). La ASS es estimulada por la citrulina y por estímulos proinflamatorios y aumenta la síntesis del NO15–17. Esta enzima cataliza la condensación de aspartato y citrulina en el paso limitante de la biosíntesis de arginina15,18; sin embargo, su actividad está también regulada por el NO pues la ASS se inhibe por nitrosilación19.
Por estas razones, se requieren más estudios para determinar la proporción en que la citrulina refleja realmente la síntesis del NO en el SNC humano. Este trabajo describe un análisis de correlaciones entre los distintos marcadores de la síntesis del NO y aminoácidos relacionados, tanto con el NO como con el metabolismo de la citrulina en líquido cefalorraquídeo (LCR) humano, para evaluar la contribución relativa de distintas vías metabólicas a los niveles de NOx y de citrulina, como marcadores de síntesis del NO.
MétodosEste estudio transversal fue aprobado por el Comité de Ética en Investigación del Instituto Nacional de Neurología y Neurocirugía. Todos los pacientes y sus familiares recibieron información por escrito sobre el objetivo del estudio, y quienes aceptaron participar firmaron un consentimiento informado. Los participantes fueron tratados de acuerdo con los principios éticos de la Declaración de Helsinki; los procedimientos aplicados a los pacientes fueron únicamente los necesarios para su diagnóstico y manejo clínico estándar.
Los pacientes fueron reclutados por muestreo consecutivo en el Servicio de Urgencias. Aquellos con trastornos neurológicos agudos, compatibles con infección del SNC, fueron evaluados con procedimientos estándar como electroencefalografía, tomografía computada (TC), imagenología de resonancia magnética, punción lumbar y laboratorios generales.
Se realizó a todos los pacientes una prueba de ELISA para VIH, haciendo un análisis confirmatorio para aquellos que dieron un resultado positivo. El diagnóstico de encefalitis viral en pacientes VIH-negativos se basó en los siguientes criterios: 1) sujetos previamente sanos, con datos clínicos de trastorno cerebral agudo (fiebre, convulsiones, alteración del estado de alerta, agitación psicomotriz o letargia); 2) electroencefalografía anormal con enlentecimiento generalizado del ritmo de base o hallazgos sugerentes en los estudios de imagen (edema cerebral, lesiones hiperintensas en la secuencia T2, reforzamiento de los giros corticales); 3) datos de inflamación en el LCR, con conteos aumentados de proteínas y células; y 4) cultivos negativos para bacterias y hongos en el LCR, así como análisis negativo para anticuerpos anticisticercos. La encefalitis primaria aguda por VIH se diagnosticó cuando se descartaron otros patógenos y los pacientes presentaron resultados serológicos positivos para VIH.
La meningitis tuberculosa se determinó por un perfil de LCR compatible y un cultivo positivo para Mycobacterium tuberculosis (M. tuberculosis), o una PCR positiva para el ADN de M. tuberculosis junto con niveles de adenosina desaminasa en LCR superiores a 7 UI/l. El diagnóstico de meningitis por criptococo se estableció por un cultivo positivo para Cryptococcus neoformans. La meningitis bacteriana se definió por el cultivo de las bacterias patógenas en el LCR y un cuadro clínico compatible. La neurocisticercosis se identificó por la presencia de lesiones típicas en los estudios de imagen y una prueba positiva en LCR para los anticuerpos contra cisticercos. La inflamación del SNC fue definida como un conteo de células en LCR ≥ 8 células/mm3, por tratarse de un criterio utilizado en nuestra institución.
Los registros clínicos y bioquímicos estuvieron cegados entre sí. El LCR se obtuvo por punción lumbar después de realizar una TC en todos los casos; no se observaron complicaciones secundarias a este procedimiento. Las concentraciones de NOx y de aminoácidos se determinaron por cromatografía de líquidos de alta resolución (HPLC) como se ha reportado4,20.
Para el análisis de los aminoácidos, las muestras fueron colectadas en tubos de vidrio que se almacenaron a −80°C. Posteriormente, el LCR fue descongelado y filtrado por membranas de nitrocelulosa (0,45μm de diámetro de poro). Las muestras fueron derivatizadas con o-ftalaldehído/mercaptoetanol e inyectadas a una columna Adsorbosphere OPA HS (100×4,6mm, 5μm de diámetro de partícula, Alltech Associates) conectada a una bomba cuaternaria (serie 1100, Agilent Technologies). La fase móvil estuvo compuesta de un amortiguador de acetatos (50mmol/l, pH 5,9) y metanol absoluto grado HPLC (MetOH); se utilizó un flujo de 1,5mL/min. El programa de solventes consistió en un gradiente lineal de 12-22% de MetOH durante 27 min. Las señales se registraron a longitudes de onda de 232nm para excitación y 455nm de emisión con el software ChemStation 10.02 (Agilent Technologies).
Para el análisis de NOx, las muestras fueron colectadas en tubos de vidrio y almacenadas a -80°C. Posteriormente, las muestras fueron descongeladas y filtradas por membranas de nailon (0,45μm de diámetro de poro) y se inyectaron en una columna Lichrosorb C18 (250×4,6mm, 5μm de diámetro de partícula, Alltech Associates) conectada a una bomba isocrática (serie 1200, Agilent Technologies). La fase móvil fue una solución de octilamina (pH 6,4) que fluyó a una velocidad de 1,2mL/min. Las señales se registraron a 228nm con el software ChemStation 10.02 (Agilent Technologies).
Análisis estadísticoSe realizaron las pruebas de Kolmogorov-Smirnov (normalidad) y Levene (homogeneidad de varianza). Se compararon las variables del LCR mediante la U de Mann-Whitney. El género se comparó con la prueba exacta de Fisher. Se realizaron correlaciones bivariadas con la prueba de Spearman. Los predictores de la concentración de NOx fueron identificados por regresión lineal múltiple y ANCOVA utilizando los valores logarítmicos de NOx y Cit. Los resultados se muestran como mediana (Q1-Q3) y se consideraron significativos al obtener un valor bilateral de p<0,05.
ResultadosSe incluyeron 240 pacientes. Con la finalidad de reducir la heterogeneidad de la muestra, 12 pacientes fueron excluidos por no contar con un diagnóstico definitivo al momento del análisis de los datos y 51 pacientes por presentar un trastorno psiquiátrico primario. Se analizaron solamente los padecimientos neurológicos al ser los diagnósticos más frecuentes en nuestra población.
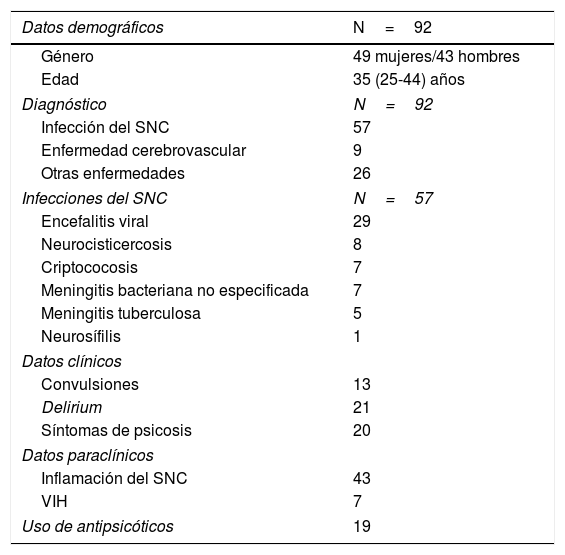
Se diagnosticó un trastorno neurológico en 177 pacientes de los que se logró completar el análisis bioquímico en 92 casos. El diagnóstico más frecuente fue el de neuroinfección, siendo la encefalitis viral el más prevalente. Los 92 pacientes fueron clasificados en cuatro grupos por la presencia de infección o inflamación en el SNC (tabla 1): 18 pacientes tuvieron infección sin evidencia de inflamación, 4 pacientes tuvieron un trastorno inflamatorio del SNC (principalmente desmielinizante) sin infección, 39 pacientes tuvieron tanto infección como inflamación y 31 no presentaron ninguna de estas características.
Descripción de la población incluida en el estudio
| Datos demográficos | N=92 |
|---|---|
| Género | 49 mujeres/43 hombres |
| Edad | 35 (25-44) años |
| Diagnóstico | N=92 |
| Infección del SNC | 57 |
| Enfermedad cerebrovascular | 9 |
| Otras enfermedades | 26 |
| Infecciones del SNC | N=57 |
| Encefalitis viral | 29 |
| Neurocisticercosis | 8 |
| Criptococosis | 7 |
| Meningitis bacteriana no especificada | 7 |
| Meningitis tuberculosa | 5 |
| Neurosífilis | 1 |
| Datos clínicos | |
| Convulsiones | 13 |
| Delirium | 21 |
| Síntomas de psicosis | 20 |
| Datos paraclínicos | |
| Inflamación del SNC | 43 |
| VIH | 7 |
| Uso de antipsicóticos | 19 |
Utilizamos esta clasificación pues la inflamación puede presentarse en ausencia de infección (como en las enfermedades cerebrovasculares) mientras que algunas infecciones (como la encefalitis viral) pueden ocurrir sin signos de inflamación en el análisis citoquímico del LCR.
Análisis bioquímicosLa concentración de NOx no varió entre hombres y mujeres (mujeres: 104 [52-190], hombres: 71 [56-126] μM; p=0,150) o por la presencia de delirium (presente: 76 [58-122], ausente: 89 [51-188] μM; p=0,469), infección (presente: 66 [49-150], ausente: 106 [59-204] μM; p=0,110) o inflamación (presente: 66 [53-192], ausente: 96 [55-172] μM; p=0,349) del SNC, síntomas de psicosis (presentes: 73 [55-122], ausentes: 88 [54-205] μM; p=0,337), infección por VIH (presente: 60 [30-364], ausente: 86 [55-174] μM; p=0.639), enfermedad cerebrovascular (presente: 82 [50-319], ausente: 84 [54-174] μM; p=0,789), convulsiones (presentes: 89 [43-155], ausentes: 84 [56-181] μM; p=0,583) o por la administración de fármacos antipsicóticos (presentes: 88 [51-141], ausentes: 82 [55-181] μM; p=0,529).
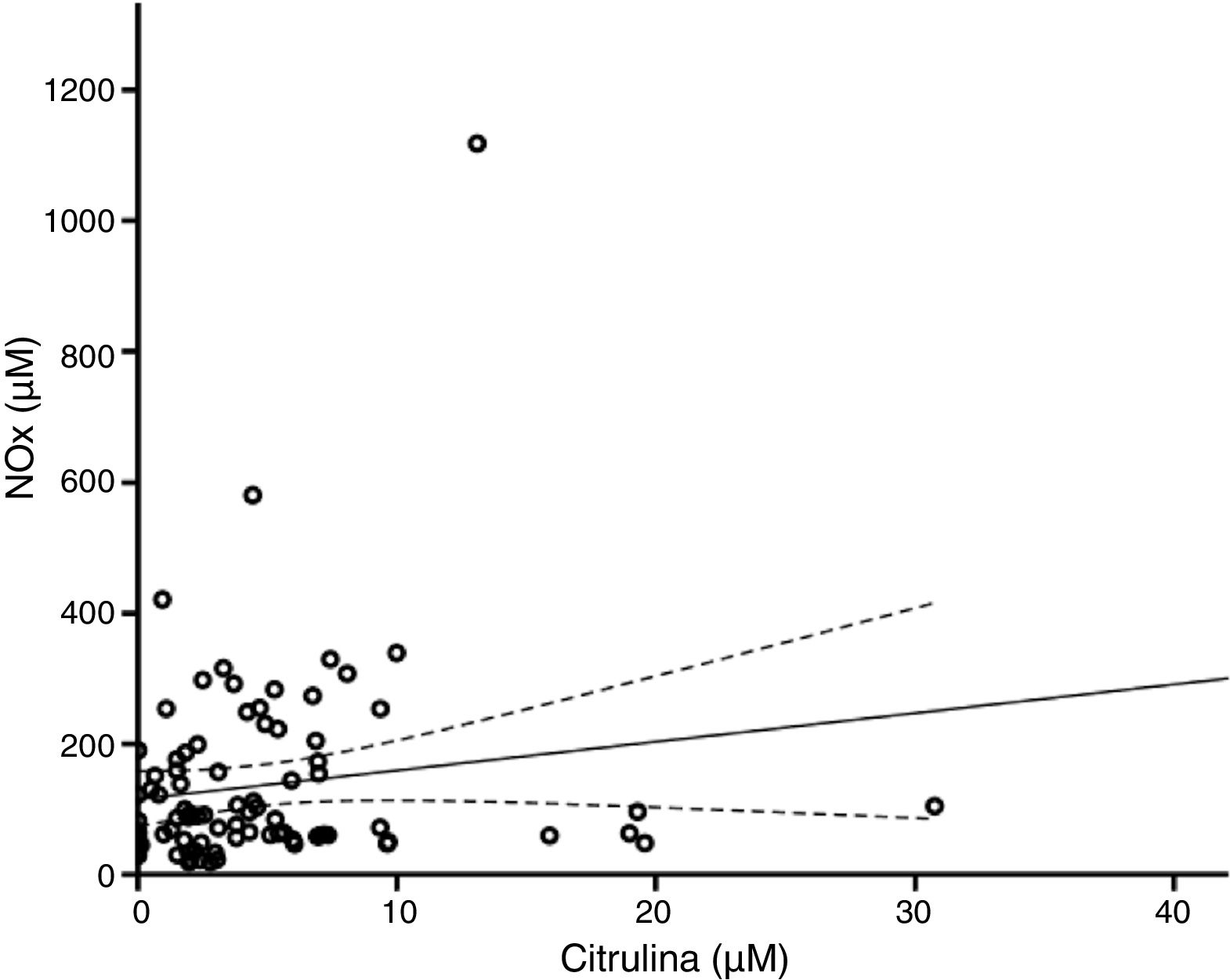
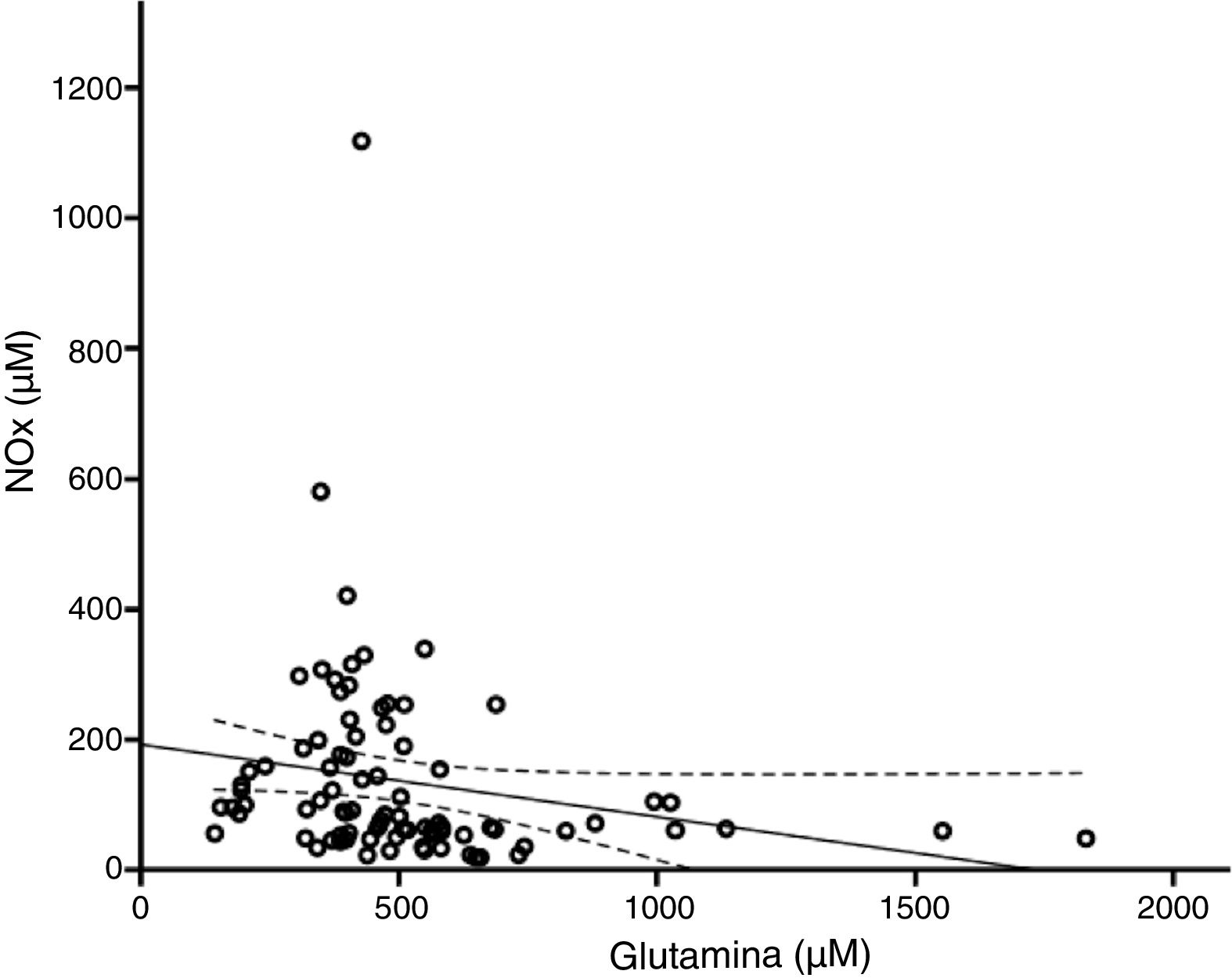
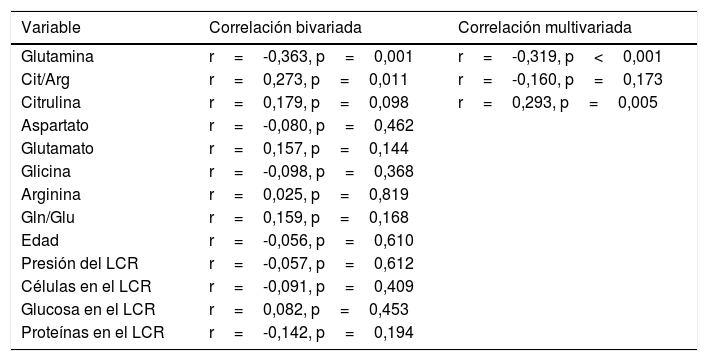
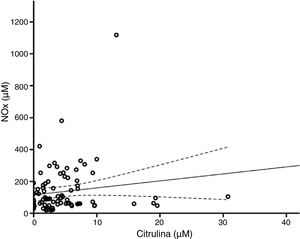
De acuerdo con el análisis bivariado, la concentración de NOx correlacionó con la de glutamina y con el cociente Cit/Arg; se observó una tendencia de correlación para la citrulina. Las ecuaciones para las correlaciones de citrulina y glutamina fueron NOx=4,3*Cit+115,5 y NOx=-111,0*Gln+192,3; la ordenada al origen para la regresión Cit-NOx fue de 115,5±21,4 (IC 95% 72,8-158,2) μM. No se observaron correlaciones con la edad, el aspartato, el glutamato, la glicina, la arginina, el cociente glutamina/glutamato (Gln/Glu), ni con la presión, el conteo de células o la concentración de proteínas en el LCR (tabla 2).
Correlaciones bivariadas y multivariadas entre la concentración de NOx en el LCR y varios posibles predictores
| Variable | Correlación bivariada | Correlación multivariada |
|---|---|---|
| Glutamina | r=-0,363, p=0,001 | r=-0,319, p<0,001 |
| Cit/Arg | r=0,273, p=0,011 | r=-0,160, p=0,173 |
| Citrulina | r=0,179, p=0,098 | r=0,293, p=0,005 |
| Aspartato | r=-0,080, p=0,462 | |
| Glutamato | r=0,157, p=0,144 | |
| Glicina | r=-0,098, p=0,368 | |
| Arginina | r=0,025, p=0,819 | |
| Gln/Glu | r=0,159, p=0,168 | |
| Edad | r=-0,056, p=0,610 | |
| Presión del LCR | r=-0,057, p=0,612 | |
| Células en el LCR | r=-0,091, p=0,409 | |
| Glucosa en el LCR | r=0,082, p=0,453 | |
| Proteínas en el LCR | r=-0,142, p=0,194 |
Solo las variables que mostraron un valor bivariado de p<0,100 fueron incluidas en el modelo multivariado.
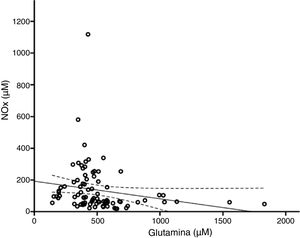
El modelo resultante del análisis de regresión lineal múltiple (r=0,440, F=5,76, p=0,001) mostró que la concentración de NOx correlacionó significativamente con la citrulina (fig. 1) y la glutamina (fig. 2); la correlación con el cociente Cit/Arg perdió significación. De acuerdo con este análisis, citrulina y glutamina explican de forma independiente el 8% (r2=0,085) y el 10% (r2=0,101) de la varianza de NOx, respectivamente; el modelo completo explica el 19% (r2=0,193) de la varianza de NOx (tabla 2).
El ANCOVA confirmó que la concentración de NOx estuvo asociada con la glutamina (F=17,1, p<0,001) y la citrulina (F=7,6; p=0,007) pero no con el cociente Cit/Arg (F=2,2; p=0,136) ni con la presencia de infección (F=1,8; p=0,173) o inflamación (F=1,4; p=0,227) en el SNC.
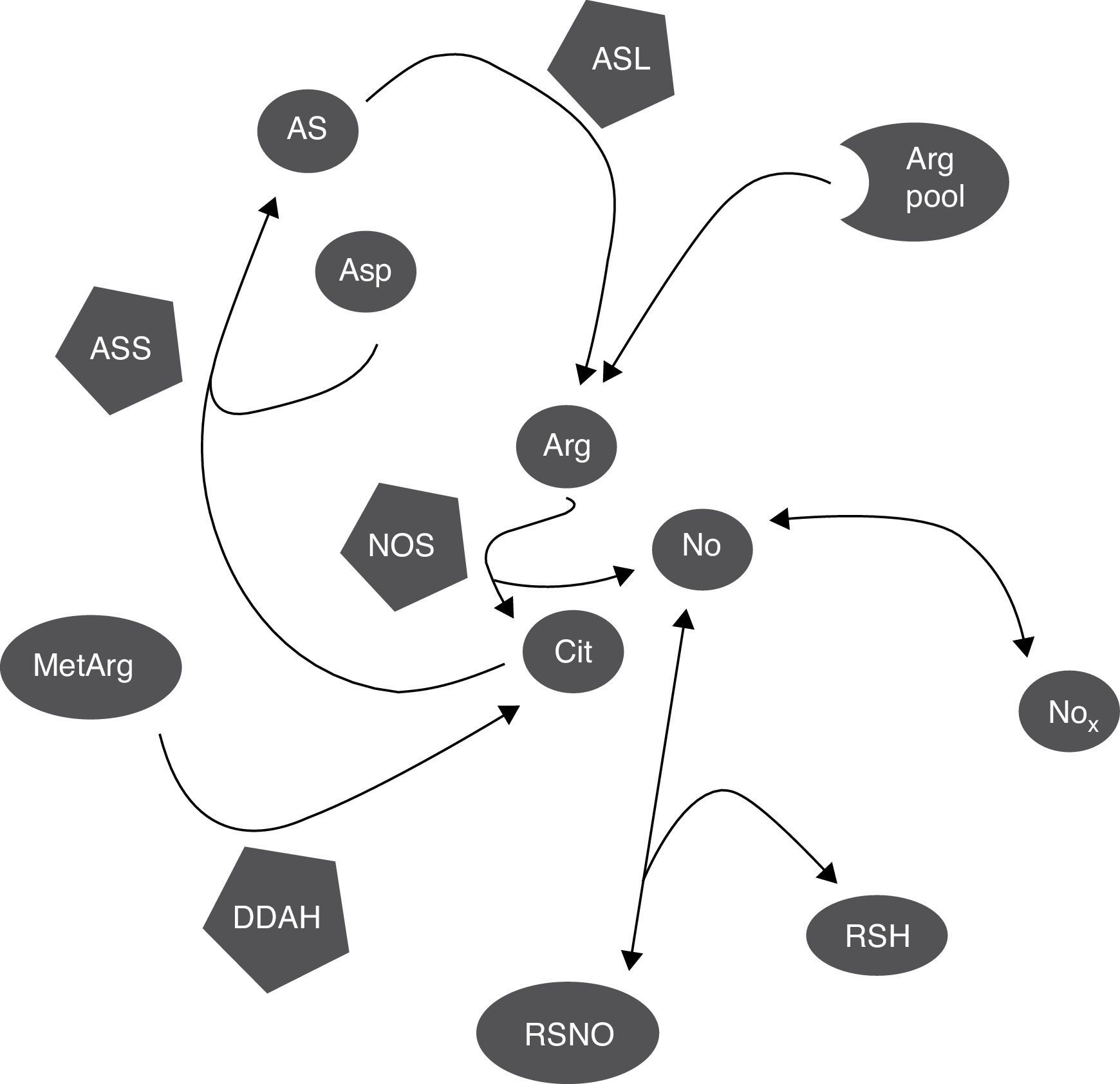
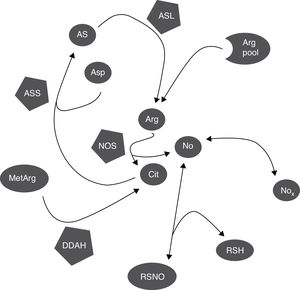
DiscusiónCitrulina y nitritos+nitratos son marcadores de la síntesis del óxido nítricoLa citrulina y el NO se producen simultáneamente por la NOS en cantidades equimolares (fig. 3)1,2; por esto, tanto la citrulina como el cociente Cit/Arg han sido utilizados en muchos estudios como marcadores de la síntesis del NO3,4. Sin embargo, otras vías metabólicas pueden alterar la concentración de citrulina (fig. 3), por lo que se requieren más estudios para determinar cuál es la proporción en la que su concentración refleja realmente la síntesis del NO.
Mecanismos bioquímicos que determinan la correlación entre marcadores de síntesis del NO. La NOS consume una proporción pequeña del pool de arginina para la síntesis del NO; la citrulina y el NO son producidos en cantidades equimolares y el NO se oxida a NOx en la misma proporción. Los NOx pueden ser reducidos de nuevo a NO por acción de varias hemoproteínas. El NO puede ser capturado por tioles y liberado por nitrosotioles regulando así la actividad de la NOS pues se inhibe por retroalimentación negativa. La citrulina, puede sintetizada por la DDAH durante la hidrólisis de metilargininas, que inhiben la NOS, y consumida por la ASS para la síntesis de arginina. El NO también regula estos procesos pues tanto la DDAH como la ASS son inhibidas por nitrosilación. Arg: arginina; Arg pool: pool de arginina; AS: argininosuccinato; ASL: argininosuccinato liasa; asp: aspartato; ASS: argininosuccinato sintetasa; cit: citrulina; DDAH: dimetilarginina dimetilaminohidrolasa; MetArg: metilargininas; NO: óxido nítrico; NOx: nitritos y nitratos; RSH: tiol; RSNO: nitrosotiol.
Debe considerarse que el que la citrulina, o cualquier metabolito, sea un marcador de la actividad de la NOS no implica únicamente que este sea producido por la enzima; significa que la variación de sus niveles refleja con exactitud los cambios en la actividad de la enzima. De este modo, la citrulina puede ser un marcador de la actividad de la NOS si su concentración cambia junto con la actividad de la NOS aún independientemente de que el aminoácido sea o no producido por esta enzima.
En este sentido, de acuerdo con los análisis de regresión, cuando la concentración de citrulina es igual a 0μM la de NOx equivale a 115,5μM, lo que sugiere la existencia de un pool de NOx que es independiente del metabolismo de la citrulina; de hecho, la pendiente de la curva de regresión entre estos marcadores es de 4,3, lo que indica que, en nuestra población, 1μM de citrulina equivale a 4,3μM de NOx, apoyando la hipótesis de que el nivel de estos marcadores resulta de la combinación de diversos mecanismos de síntesis y degradación.
Si la citrulina es producida por la NOS, su concentración debe ser similar a la de el NO, pero este gas tiene una vida media muy corta21,22; por esto, en muestras biológicas, el contenido de NOx es un mejor correlato de la actividad de la NOS8,23. Los NOx se producen por la oxidación del NO cuando interactúa con hemoproteínas (fig. 3), como la hemoglobina, y son utilizados como marcadores de la síntesis del NO4,24.
Teóricamente, los cambios en la concentración de la citrulina deben coincidir con los de NOx. De hecho, nuestros resultados muestran que la citrulina correlaciona positivamente con la concentración de NOx (fig. 1). Esto indica que la concentración de citrulina en el LCR es un buen marcador de la síntesis de NO en el SNC humano, como se ha sugerido previamente3,4,25. Las limitaciones de esta afirmación se discuten más adelante.
Debe tomarse en cuenta que otras vías metabólicas modifican los niveles de citrulina, como la actividad de la ASS (que consume al aminoácido, figura 3)18,26 la cual es estimulada por la misma citrulina (así como por estímulos proinflamatorios) y aumenta la síntesis del NO15–17. El NO inhibe la actividad de la ASS por nitrosilación19, por lo que es probable que el aumento en la actividad de la NOS inhiba la actividad de la ASS y aumente (o, al menos, que no disminuya) la concentración de su sustrato: la citrulina (fig. 3); pero, aún en este caso, el aumento en la concentración de citrulina sería (aunque indirectamente) causado por la actividad de la NOS.
A través de este mecanismo es posible que, durante la producción del NO, la concentración de citrulina aumente aún en mayor proporción que los NOx y, entonces, este aminoácido podría ser un marcador de la síntesis del NO más sensible que los NOx, como han sugerido algunos autores4. Sin embargo, también debe tenerse en cuenta que la disfunción de la ASS aumenta la concentración de citrulina en el LCR como se observa en la citrulinemia tipo II27, por lo que la contribución de esta enzima a nuestros resultados no debe descartarse por completo.
Además, no solo la ASS puede alterar los niveles de citrulina. DDAH y la NOS son las principales enzimas que sintetizan citrulina en el SNC (fig. 3)10,14. DDAH produce citrulina a partir de las metilargininas, que son inhibidores competitivos de la NOS (fig. 3)9,10; esta enzima se induce por citocinas10,11 y es inhibida por arginina, citrulina y el NO producido por la iNOS12,13. Nuevamente, la enzima es inhibida por nitrosilación durante la actividad de la iNOS, lo que resultaría en una disminución de la síntesis de citrulina (fig. 3) por lo que, a diferencia de lo que se ha propuesto por algunos autores5, este mecanismo no explica la correlación positiva entre la citrulina y los NOx (fig. 1). Es posible que estos mecanismos estén ocurriendo en nuestros pacientes pues se ha reportado que la actividad de la iNOS aumenta en el LCR de pacientes con trastornos inflamatorios del SNC (esclerosis múltiple)28 como los que fueron incluidos en el presente estudio.
Adicionalmente, la citrulina correlaciona con los NOx mejor que el cociente Cit/Arg. Esto puede deberse a que la concentración de arginina puede permanecer sin cambios aún en trastornos metabólicos como la insuficiencia renal pues está más relacionada con la degradación de proteínas que con el metabolismo de los aminoácidos29,30. Los niveles de arginina pueden mantenerse sin cambios incluso durante la síntesis del NO31. Se ha propuesto que solo el 1% del total de la arginina disponible se utiliza para la síntesis del NO (fig. 3)5,32; de este modo, es posible que ni el cociente Cit/Arg ni la concentración de arginina reflejen con exactitud la actividad de la NOS.
Finalmente, no solo la citrulina puede verse alterada por mecanismos independientes de la NOS. Los nitritos pueden ser reducidos a NO por interacción con diferentes metaloproteínas como la misma NOS (fig. 3), produciendo vasodilatación y disminuyendo la presión arterial33,34. También, el NO puede interactuar con el glutatión y otros tioles formando diferentes moléculas como los nitrosotioles y el N2O (fig. 3)35,36, limitando así la formación del NO; de hecho, los nitrosotioles formados pueden liberar NO causando así un aumento en la concentración de NOx (fig. 3), por lo que tanto los niveles de citrulina como los de NOx pueden verse alterados por mecanismos independientes de la actividad de la NOS.
La correlación entre citrulina y NOx fue independiente de la presencia de infección o inflamación en el SNC, lo que puede deberse a que todas las isoformas de la NOS sintetizan ambos metabolitos en cantidades equimolares. Se ha descrito en muchos estudios que las citocinas inducen la expresión de la iNOS en condiciones de infección e inflamación10,37; de hecho, también la NOS neuronal puede ser inducida por citocinas21, por lo que el NO puede ser producido por ambas enzimas durante la infección o la inflamación.
Nuestros resultados muestran que existe una relación directa entre la citrulina y la síntesis del NO independiente de la presencia de infección o inflamación. Debe tenerse en cuenta que se ha reportado que la concentración de NOx en el LCR no se modifica en pacientes con infecciones del SNC38,39 a diferencia de los reportados en trastornos inflamatorios (esclerosis múltiple)28. Es posible que los padecimientos infecciosos e inflamatorios presenten un perfil bioquímico diferente.
La glutamina y el óxido nítrico se regulan recíprocamenteUna cantidad creciente de estudios indica que existe una relación inversa entre el NO y la glutamina como se observa en el presente estudio (fig. 2). La glutamina (200μM) inhibe la actividad de la ASS40,41 y la síntesis del NO42. Por este mecanismo, la glutamina reduce la concentración intracelular de arginina, la liberación del NO y la vasorrelajación24,43,44. Esto puede estar relacionado con el hecho de que las dietas ricas en glutamina reducen la concentración plasmática de NOx45,46.
Los estudios mencionados involucran a la actividad endotelial de la NOS pero la glutamina puede modular a otras isoformas. Por ejemplo, la glutamina reduce la expresión de la iNOS47, la síntesis del NO y la nitración de proteínas48,49. Otros estudios indican que la glutamina aumenta la síntesis del NO50,51 aunque nuestros resultados no avalan que esto ocurra en los pacientes neurológicos.
Por otro lado, el NO regula la síntesis de glutamina. La activación de receptores para glutamato y la síntesis del NO reducen la actividad de la glutamina sintetasa (EC 6.3.1.2) a través de la nitración de tirosina, mientras que la inhibición de la NOS da el efecto contrario52,53 aumentando la concentración del aminoácido54.
Es posible que esta relación inversa esté relacionada principalmente con la actividad de la iNOS dado que el contenido de glutamina está aumentado en varias regiones cerebrales de los ratones knock out para esta isoforma55. También cabe hacer notar que es muy probable que la iNOS esté presente en las muestras analizadas en este estudio debido al componente inflamatorio de los trastornos neurológicos, como ha sido reportado28.
Adicionalmente, el NO genera la desamidación no enzimática de los residuos peptídicos de glutamina en presencia de O256 reduciendo así su concentración.
Por último, se ha reportado una correlación inversa entre estos marcadores bioquímicos y las escalas de cognición en pacientes neurológicos, por lo que es posible que esta modulación recíproca sea relevante para la fisiología cerebral57.
ConclusionesLos resultados del presente estudio no permiten descartar por completo la participación de la ASS y la DDAH en la regulación de los niveles de citrulina, pero muestran que la concentración de este aminoácido en el LCR es un buen correlato de la síntesis del NO en el SNC humano. Los mecanismos que regulan esta relación entre los marcadores podrían ser distintos en diferentes regiones cerebrales o en distintas condiciones de enfermedad. Además, nuestros resultados muestran que la glutamina es un modulador importante de la síntesis del NO en el SNC y puede explicar la «paradoja de arginina» en este sistema. Finalmente, la relevancia de los niveles de citrulina y glutamina para la síntesis del NO debe ser interpretada con cuidado pues ambos metabolitos pueden ser modulados por mecanismos independientes de la NOS.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.