La incidencia del síndrome de Guillain-Barré (SGB) es variable y aún se desconoce en nuestro ámbito geográfico. Se han estudiado factores de mal pronóstico, pero pocos han analizado aquellos que influyen en resultados a largo plazo. El objetivo de este estudio es conocer la incidencia, las características y los factores asociados a discapacidad y dependencia en estos pacientes a partir de un registro poblacional.
Sujetos y métodoEstudio observacional en diagnosticados de SGB desde 2009 a 2020 y registrados en el Sistema de Información de Enfermedades Raras de la Región de Murcia (SIER). Se calcularon las tasas crudas y ajustadas por edad, sexo y año del periodo y se analizaron las asociaciones entre discapacidad y/o dependencia con el resto de variables.
ResultadosDurante el periodo de estudio se diagnosticaron 250 casos incidentes. La tasa de incidencia estandarizada (TIE) fue de 1,52/100.000 personas-año, mayor en hombres e incrementándose con la edad en ambos sexos. La enfermedad fue más frecuente tras infecciones respiratorias (46,4%) y en los meses fríos (56,4%), y la variante predominante fue la AIDP (54,3%). Se observó mayor discapacidad y/o dependencia en pacientes con estancia hospitalaria prolongada (OR=13,19; IC95%: 3,81-45,67), ingreso en UCI (OR=2,37; IC95%: 1,11-5,06) y afectados por variantes axonales (OR=3,54; IC95%: 1,64-7,69) (p<0,05).
ConclusionesLa TIE regional es concordante con la reportada en la literatura nacional e internacional. El 18,4% de los casos tienen reconocida dependencia y/o discapacidad, asociadas a las formas axonales de la enfermedad. Los estudios basados en registros poblacionales ofrecen información representativa y actualizada y permiten conocer características asociadas a un peor pronóstico.
The incidence of Guillain-Barré Syndrome (GBS) is variable and is still unknown in our geographical area. Poor prognostic factors have been studied, but few have analyzed those that influence long-term results. The objective of this study is to know the incidence, characteristics and factors associated with disability and dependency in these patients from a population registry.
Subjects and methodObservational study in patients diagnosed with GBS from 2009 to 2020 and registered in the Rare Disease Information System (SIER) of the Region of Murcia (Spain). The crude and adjusted rates for age, sex and year of the period were calculated and the associations between disability and/or dependency with the rest of the variables were analyzed.
ResultsDuring the study period, 250 incident cases were diagnosed. The standardized incidence rate (SIR) was 1.52/100,000 person-years, higher in men and increasing with age in both sexes. The disease was more frequent after respiratory infections (46.4%) and in the cold months (56.4%), and the predominant variant was AIDP (54.3%). Greater disability and/or dependence were observed in patients with prolonged hospital stay (OR=13.19; 95%CI: 3.81-45.67), ICU admission (OR=2.37; 95%CI: 1.11- 5.06) and affected by axonal variants (OR=3.54; 95%CI: 1.64-7.69) (P<.05).
ConclusionsThe regional SIR is consistent with that reported in the national and international literature. 18.4% of the cases have recognized dependency and/or disability, associated with the axonal forms of the disease. Studies based on population registries offer representative and updated information and allow us to discover characteristics associated with a worse prognosis.
El síndrome de Guillain-Barré (SGB) es una polirradiculoneuropatía inflamatoria aguda poco frecuente, de etiología inmunomediada y caracterizada por debilidad muscular simétrica de las extremidades, acompañada o no de disminución o ausencia de reflejos tendinosos1,2.
La incidencia es variable en todo el mundo, con tasas que oscilan entre 0,38 y 2,53/100.000 personas-año, aunque la mayoría de estudios la sitúan entre 1,1 y 1,8/100.000, siendo mayor en el sexo masculino e incrementándose con la edad3,4. En España se han reportado cifras entre 0,86 y 1,56/100.000 personas-año. No obstante, las cifras no han sido actualizadas en los últimos años, por lo que son escasas las publicaciones que permiten una visión reciente de la enfermedad, y ninguna de ellas se ha llevado a cabo en nuestro ámbito geográfico5-7.
Pese a que se trata de una enfermedad aguda que suele resolverse por completo durante los meses posteriores al inicio del cuadro clínico, algunos pacientes pueden presentar secuelas persistentes8. Hasta ahora, diversos autores han descrito posibles factores relacionados con un pronóstico desfavorable a partir de puntuaciones altas obtenidas en diferentes escalas de medición del grado de incapacidad de los pacientes9,10. Sin embargo, la mayoría de ellos emplean información procedente de unidades clínicas hospitalarias o grupos de población concretos, y pocos han analizado los factores de mal pronóstico a largo plazo11-13.
El objetivo de este estudio fue conocer la incidencia y las principales características de los pacientes diagnosticados de SGB en la Región de Murcia, así como analizar los factores asociados a la discapacidad y dependencia reconocidas por la enfermedad a partir de la información del registro autonómico de enfermedades raras.
Sujetos y métodoPoblación de estudioSe realizó un estudio observacional de los pacientes diagnosticados de SGB desde enero de 2009 a diciembre de 2020 que se encontraban registrados en el Sistema de Información de Enfermedades Raras (SIER) de la Región de Murcia14. Se excluyó a las personas no residentes en la región, a los pacientes con diagnóstico no concluyente y a aquellos con diagnóstico definitivo de polineuropatía desmielinizante inflamatoria crónica (PDIC).
No fue necesario el consentimiento informado individual, dado que el SIER está incluido entre las excepciones recogidas por la normativa de protección de datos de carácter personal sobre actuaciones en materia de salud pública relacionadas con las enfermedades raras de la Ley de Salud Pública, y está habilitado para ello por su propia normativa regulatoria15.
Sistema de Información de Enfermedades Raras (SIER)El SIER es un registro de base poblacional puesto en marcha en 2010 en la Región de Murcia (1.518.486 habitantes a 1 de enero de 2021, cifra que representa alrededor del 3,20% de la población española)16. Para la incorporación de personas con una posible enfermedad rara (ER) se utiliza un listado de códigos seleccionados de la Clasificación Internacional de Enfermedades (CIE). En el caso del SGB se utilizaron los códigos 357.0 de la Clasificación Internacional de Enfermedades, Novena Revisión, Modificación Clínica (CIE9-MC) hasta 2015, y G61.0 de la décima versión de la Modificación Clínica Española (CIE10-ES) de 2016 a 2020. El registro emplea 50 fuentes de información para incorporar pacientes con alguna ER. Aquellas que aportaron casos de SGB se muestran en la figura 1.
Una vez incorporados los casos, se someten a un proceso de validación y confirmación del diagnóstico mediante la revisión de la historia clínica electrónica.
Recopilación de datosPara cada uno de los pacientes se obtuvo la siguiente información:
Datos básicos del paciente. Se recogieron las variables sexo, nacionalidad, fecha de nacimiento, fecha de diagnóstico de la enfermedad, si el paciente se encontraba fallecido (sí/no) y la causa del fallecimiento.
Características y clínica de inicio. Se consideró la estación del año de diagnóstico, la fecha y las manifestaciones de inicio del cuadro clínico y los factores precedentes en las cuatro semanas previas: infección gastrointestinal, respiratoria u otras, entre las que se incluye la exposición a tóxicos, los antecedentes de cirugías o inmunización, y otras infecciones.
Respecto a la sintomatología de inicio, consideramos parestesias la sensación de quemazón, hormigueo o adormecimiento de las extremidades que no causa dolor, y disestesias la hipersensibilidad ante un estímulo con sensación de dolor, ardor o rigidez17.
También se clasificó a los pacientes según la variante de SGB que padecían, diferenciándose los siguientes subtipos: polirradiculoneuropatía desmielinizante inflamatoria aguda (AIDP), neuropatía axonal sensitivo-motora aguda (AMSAN), neuropatía axonal motora aguda (AMAN), neuropatía atáxica sensitiva aguda, síndrome de Miller-Fisher, encefalitis troncoencefálica de Bickerstaff, diplejía facial con parestesias y variante faringo-cervico-braquial. Asimismo, todas ellas se agruparon en axonales (AMAN y AMSAN) y desmielinizantes (el resto de las variantes presentadas) según la afectación electrofisiológica y las características descritas en la historia clínica de los pacientes. Se excluyó la variante faringo-cervico-braquial por considerar que podría pertenecer a ambas categorías en el paciente en la que fue diagnosticada18,19.
Datos de hospitalización. Se obtuvieron datos acerca del ingreso en la unidad de cuidados intensivos (UCI) (sí/no) y la estancia hospitalaria total y en UCI (días). También se recogió si los pacientes habían recibido tratamiento con inmunoglobulinas intravenosas, plasmaféresis o ambos, y la necesidad de traqueostomía o ventilación mecánica derivadas de la presencia de complicaciones intrahospitalarias.
Evolución del cuadro clínico. Incluimos información sobre el padecimiento de recurrencias del SGB, la presencia de secuelas a los 6 y 12meses desde el cuadro clínico inicial y el traslado de los pacientes al Hospital Nacional de Parapléjicos de Toledo, centro especializado en la atención integral de pacientes con alteraciones medulares. Se consideró recurrencia si constaban dos o más episodios que cumplían criterios diagnósticos de SGB con una recuperación completa o casi completa identificable después del episodio inicial y un mínimo de 2meses entre episodios. Los pacientes que presentaron una mejora tras el tratamiento con recaída posterior en menos de 2meses no fueron considerados como recurrentes20,21. Consideramos secuela la persistencia de cualquiera de las manifestaciones de inicio, si el paciente desarrollaba atrofia muscular, o si aparecían calambres, temblor o dolor neuropático21.
Finalmente, se recopiló información del reconocimiento oficial de la situación de discapacidad (igual o mayor al 33%) y/o dependencia por SGB, así como de sus grados correspondientes hasta el 31 de diciembre de 2021, un año después de la fecha de estudio22,23.
Método de análisisSe calcularon las tasas crudas y ajustadas por grupo de edad, sexo y año del periodo en la población de estudio. Para el cálculo de las tasas crudas se utilizó la población del Padrón Municipal del Portal Estadístico de la Región de Murcia, mientras que para el ajuste de tasas se empleó el método de estandarización directo a partir de la Población Europea Estándar de 2013 (PEE).
Se calcularon los intervalos de confianza al 95% (IC95%) por el método exacto asumiendo una distribución de Poisson. Además, se analizaron las tendencias temporales mediante Joinpoint Regression Program, Version 4.9.0.0. March, 2021 (Statistical Research and Applications Branch, National Cancer Institute).
Posteriormente se realizó un análisis de las variables obtenidas para los pacientes incluidos en el estudio y para cada una de las variantes del SGB utilizando estadísticas descriptivas. Además, se emplearon diferentes test de contraste de hipótesis según el tipo de variables y su normalidad. La normalidad se verificó mediante la prueba de Kolmogorov-Smirnov y la igualdad de varianzas mediante el test de Welch. Para las variables cuantitativas se utilizó la prueba de ANOVA si los datos tenían una distribución normal y la prueba de Kruskal-Wallis en caso contrario. Para las cualitativas, la prueba de chi-cuadrado o exacta de Fisher cuando correspondía.
Por último, se calcularon las razones de probabilidad (OR) crudas y ajustadas y el intervalo de confianza al 95% mediante un análisis de regresión logística binaria para examinar las asociaciones entre la discapacidad y/o la dependencia y el resto de variables.
Todas las pruebas fueron a dos colas, y el nivel de significación estadística se estableció en ≤0,05. Los análisis estadísticos se realizaron con el paquete estadístico IBM SPSS 25.0 (IBM Corporation, Armonk, Nueva York, EE.UU.).
ResultadosEn el SIER se registraron 629 posibles casos de SGB, de los cuales se confirmó el diagnóstico en 382, siendo 250 de ellos incidentes entre 2009 y 2020 (fig. 2).
La tasa de incidencia estandarizada (TIE) fue de 1,52/100.000 personas-año (IC95%: 1,34-1,70), superior en hombres respecto a mujeres, con una ratio de 2,53 (tabla 1). Además, se observó un aumento de la incidencia con la edad a partir del intervalo de 30 a 39años, con un pico máximo entre los 70-79 (TIE: 2,99; IC95%: 1,99-4,00), seguido de un descenso global por la menor incidencia en hombres. De hecho, en las mujeres el pico máximo se observó en el grupo de 80 o más años (TIE: 1,91; IC95%: 0,66-3,16) (tabla 1 y fig. 3).
Tasas de incidencia de síndrome de Guillain-Barré por intervalo de edad y sexo en la Región de Murcia. Periodo 2009-2020
| Hombres | Mujeres | Total | |
|---|---|---|---|
| Tasa de incidencia (IC95%) | |||
| Casos incidentes | 175 | 75 | 250 |
| Personas/año | 8.879.959 | 8.797.991 | 17.677.950 |
| TI cruda | 1,97 (1,68-2,26) | 0,85 (0,66-1,05) | 1,41 (1,24-1,59) |
| TI estandarizadaa | 2,20 (1,89-2,51) | 0,87 (0,68-1,07) | 1,52 (1,34-1,70) |
| TI estandarizada por intervalo de edad y sexoa | |||
| 0-9 | 1,40 (0,69-2,10) | 0,49 (0,06-0,93) | 0,96 (0,54-1,38) |
| 10-19 | 1,27 (0,58-1,96) | 0,62 (0,12-1,12) | 0,96 (0,53-1,39) |
| 20-29 | 1,06 (0,46-1,66) | 0,65 (0,17-1,14) | 0,86 (0,47-1,25) |
| 30-39 | 1,11 (0,58-1,63) | 0,79 (0,32-1,26) | 0,96 (0,60-1,31) |
| 40-49 | 1,95 (1,24-2,67) | 0,73 (0,28-1,18) | 1,36 (0,94-1,79) |
| 50-59 | 2,48 (1,54-3,41) | 0,74 (0,23-1,25) | 1,61 (1,08-2,14) |
| 60-69 | 3,49 (2,15-4,83) | 1,49 (0,65-2,34) | 2,45 (1,67-3,23) |
| 70-79 | 5,26 (3,28-7,25) | 1,12 (0,29-1,96) | 2,99 (1,99-4,00) |
| 80 y más | 3,14 (1,09-5,20) | 1,91 (0,66-3,16) | 2,38 (1,28-3,48) |
IC 95%: intervalo de confianza al 95%.
A lo largo del periodo de estudio las tasas no presentaron grandes oscilaciones para el total de la población, pasando de 1,52/100.000 personas-año en 2009 (IC95%: 0,63-2,42) a 1,39/100.000 personas-año en 2020 (IC95%: 0,55-2,23), siendo 2015 el año que registró la mayor cifra (TIE: 2,11/100.000; IC95%: 1,06-3,16) (fig. 4). Sin embargo, el análisis de tendencias no mostró cambios significativos durante el periodo (p=0,16) (fig. 5).
En la tabla 2 se muestran las principales características de los pacientes. El 70% fueron varones, y la edad media al diagnóstico fue de 47,6±23,3años. De aquellos pacientes en los que se disponía de información, las infecciones respiratorias seguidas de las gastrointestinales constituyeron los factores precedentes mayoritarios (46,4% y 40,4%, respectivamente), con un ligero predominio de los casos durante los meses más fríos (56,4%).
Características clínico-epidemiológicas de los pacientes con síndrome de Guillain Barré en la Región de Murcia. Periodo 2009-2020
| Hombres | Mujeres | Total | |
|---|---|---|---|
| Características de los pacientes | N.° pacientes/N.° de pacientes con información (%) | ||
| Sexo | 175/250 (70,0) | 75/250 (30,0) | 250/250 (100,0) |
| Edad al diagnóstico (años) | |||
| Mediana (25-75)a | 50,0 (32,0-67,0) | 49,0 (30,0-68,0) | 49,5 (31,8-67,0) |
| Media±DE | 47,4±23,0 | 48,1±24,2 | 47,6±23,3 |
| Nacionalidad española | 156/175 (89,1) | 70/75 (93,3) | 226/250 (90,4) |
| Etiología | |||
| Respiratoria | 47/108 (43,5) | 30/58 (51,7) | 77/166 (46,4) |
| Gastrointestinal | 44/108 (40,7) | 23/58 (39,7) | 67/166 (40,4) |
| Exposición a tóxicos | 13/108 (12,0) | 2/58 (3,4) | 15/166 (9,0) |
| Antecedentes quirúrgicos | 2/108 (1,9) | 1/58 (1,7) | 3/166 (1,8) |
| Antecedentes de inmunización | 1/108 (0,9) | 1/58 (1,7) | 2/166 (1,2) |
| Otras infecciones | 1/108 (0,9) | 1/58 (1,7) | 2/166 (1,2) |
| Estacionalidad | |||
| Invierno | 62/175 (35,4) | 26/75 (34,7) | 88/250 (35,2) |
| Otoño | 37/175 (21,1) | 16/75 (21,3) | 53/250 (21,2) |
| Primavera | 39/175 (22,3) | 15/75 (20,0) | 54/250 (21,6) |
| Verano | 37/175 (21,1) | 18/75 (24,0) | 55/250 (22,0) |
| Clínica de inicio | |||
| Debilidad en miembros inferiores | 146/175 (83,4) | 64/75 (85,3) | 210/250 (84,0) |
| Debilidad en miembros superiores | 123/175 (70,3) | 58/75 (77,3) | 181/250 (72,4) |
| Parestesias | 95/175 (54,3) | 42/75 (56,0) | 137/250 (54,8) |
| Disminución de reflejos/arreflexia | 70/175 (40,0) | 33/75 (44,0) | 103/250 (41,2) |
| Disestesias | 57/175 (32,6) | 36/75 (48,0) | 93/250 (37,2) |
| Parálisis facial | 31/175 (17,7) | 12/75 (16,0) | 43/250 (17,2) |
| Tetraparesia | 28/175 (16,0) | 13/75 (17,3) | 41/250 (16,4) |
| Oftalmoplejía | 21/175 (12,0) | 12/75 (16,0) | 33/250 (13,2) |
| Alteraciones de la deglución | 14/175 (8,0) | 13/75 (17,3) | 27/250 (10,8) |
| Variantes del SGBb | |||
| PNP desmielinizante inflamatoria aguda | 78/144 (54,2) | 36/66 (54,5) | 114/210 (54,3) |
| PNP axonal sensitivo-motora aguda | 15/144 (10,4) | 15/66 (22,7) | 30/210 (14,3) |
| PNP axonal motora aguda | 28/144 (19,4) | 2/66 (3,0) | 30/210 (14,3) |
| Síndrome de Miller-Fisher | 17/144 (11,8) | 11/66 (16,7) | 28/210 (13,3) |
| Diplejía facial | 2/144 (1,4) | 1/66 (1,5) | 3/210 (1,4) |
| Encefalitis troncoencefálica de Bickerstaff | 3/144 (2,1) | 0/66 (0,0) | 3/210 (1,4) |
| Variante faringo-cervico-braquial | 1/144 (0,7) | 0/66 (0,0) | 1/210 (0,5) |
| Neuropatía atáxica sensitiva aguda | 0/144 (0,0) | 1/66 (1,5) | 1/210 (0,5) |
| Tiempo desde inicio de síntomas hasta hospitalización (días) | |||
| Mediana (25-75)a | 7,0 (3,0-14,0) | 7,0 (4,8-14,3) | 7,0 (4,0-14,0) |
| Media±DE | 10,0±10,8 | 10,3±9,1 | 10,1±10,3 |
| Estancia hospitalaria (días) | |||
| Mediana (25-75)a | 13 (9,0-25,3) | 16,0 (9,0-34,0) | 14,0 (9,0-28,0) |
| Media±DE | 27,1±37,1 | 34,0±50,1 | 29,1±41,4 |
| Ingreso en UCI | 42/175 (24,0) | 23/75 (30,7) | 65/250 (26,0) |
| Estancia en UCI (días) | |||
| Mediana (25-75)a | 14,5 (5,0-34,3) | 9,0 (5,0-37,0) | 13,0 (5,0-34,5) |
| Media±DE | 27,9±45,8 | 29,3±45,9 | 28,4±45,5 |
| Necesidad de ventilación mecánica | 15/175 (8,6) | 12/75 (16,0) | 27/250 (10,8) |
| Necesidad de traqueostomía | 12/175 (6,9) | 12/75 (16,0) | 24/250 (9,6) |
| Tratamiento | |||
| Inmunoglobulinas | 132/140 (94,3) | 55/59 (93,2) | 187/199 (94,0) |
| Plasmaféresis | 1/140 (0,7) | 0/59 (0,0) | 1/199 (0,5) |
| Ambos tratamientos | 7/140 (5,0) | 4/59 (6,8) | 11/199 (5,5) |
| SGB recurrentec | 7/175 (4,0) | 4/75 (5,3) | 11/250 (4,4) |
| Secuelasd | 58/175 (33,1) | 23/75 (30,7) | 81/169 (47,9) |
| Discapacidad | 25/175 (14,3) | 12/75 (16,0) | 37/250 (14,8) |
| Dependencia | 16/175 (9,1) | 11/75 (14,7) | 27/250 (10,8) |
| Éxituse | 3/175 (1,7) | 3/75 (4,0) | 6/250 (2,4) |
DE: desviación estándar.
No se disponía de información acerca de la variante en 40 pacientes, por lo que no fueron clasificados.
Se dispuso de información para clasificar la variante clínica en el 84,0% de los pacientes, siendo las más frecuentes la polirradiculoneuropatía desmielinizante inflamatoria aguda, o AIDP (54,3%), seguida por la neuropatía axonal sensitivo-motora aguda, o AMSAN (14,3%), y la neuropatía axonal motora aguda, o AMAN (14,3%).
El tiempo medio desde el inicio del cuadro clínico hasta el ingreso fue de 10,1±10,3 días, siendo la sintomatología clínica predominante la debilidad en miembros y las parestesias. Por otro lado, la estancia hospitalaria media fue de 29,1±41,4 días, y el 26,0% de las personas precisaron ingreso en la UCI, con una estancia media de 28,4±45,5 días.
Además, en el 79,6% de todos los pacientes constaba que habían recibido tratamiento, el 4,4% presentaron recurrencias y el 2,8% de los pacientes precisaron ser trasladados al Hospital de Parapléjicos de Toledo, siendo en su mayoría hombres (85,7%). Asimismo, la mortalidad por SGB se pudo confirmar en 6 personas (2,4%). En cuanto al reconocimiento de discapacidad y dependencia, se constató en 46 casos (19 con discapacidad, 9 con dependencia y 18 con ambas condiciones reconocidas oficialmente).
La tabla 3 muestra las características de los pacientes según su variante del SGB. Tal como se observa, los pacientes afectados por los subtipos axonales presentaron más tetraparesia como síntoma de inicio del cuadro clínico, mientras que los clasificados como «otras» (variantes regionales y funcionales) presentaron mayoritariamente afectación de los pares craneales. Asimismo, las variantes axonales se relacionaron con una mayor estancia hospitalaria, ingreso y estancia en la UCI, porcentaje de tratamiento, así como con una mayor frecuencia de secuelas y discapacidad y/o dependencia asociadas a la enfermedad de manera estadísticamente significativa (p<0,05). Por otro lado, la variante AMAN se presentó con mayor frecuencia en los varones, y en su mayoría relacionada con etiología gastrointestinal, y la variante AMSAN, en pacientes con mayor edad al diagnóstico (p<0,05).
Características de los pacientes con síndrome de Guillain Barré en la Región de Murcia según variante clínica. Periodo 2009-2020
| AIDP (n=114) | AMSAN (n=30) | AMAN (n=30) | Otras variantesa (n=36) | p (p≤0,05) | |
|---|---|---|---|---|---|
| Sexo masculino, n (%) | 78 (68,4) | 15 (50,0) | 28 (93,3) | 23 (63,9) | 0,003 |
| Edad al diagnóstico (años) | |||||
| Mediana (25-75)b | 51,0 (34,0-68,0) | 59,0 (42,0-73,0) | 45,0 (17,0-62,0) | 40,0 (23,0-60,0) | 0,034 |
| Media±DE | 48,0±22,0 | 56,0±22,0 | 40,0±25,0 | 43,0±23,0 | |
| Nacionalidad española, n (%) | 105 (92,1) | 26 (86,7) | 29 (96,7) | 35 (97,2) | 0,318 |
| Etiología, n (%) | |||||
| Gastrointestinal | 26 (22,8) | 6 (20,0) | 19 (63,3) | 8 (22,2) | <0,001 |
| Respiratoria | 39 (34,2) | 10 (33,3) | 3 (10,0) | 14 (38,9) | 0,051 |
| Otrasc | 11 (9,6) | 4 (13,3) | 2 (6,7) | 1 (2,8) | 0,437 |
| Estacionalidad, n (%) | |||||
| Invierno | 36 (31,6) | 11 (36,7) | 9 (30,0) | 17 (47,2) | 0,345 |
| Otoño | 22 (19,3) | 12 (40,0) | 9 (30,0) | 5 (13,9) | 0,040 |
| Primavera | 34 (29,8) | 1 (3,3) | 3 (10,0) | 8 (22,2) | 0,005 |
| Verano | 22 (19,3) | 6 (20,0) | 9 (30,0) | 6 (16,7) | 0,553 |
| Clínica de inicio, n (%) | |||||
| Debilidad en miembros inferiores | 104 (91,2) | 25 (83,3) | 28 (93,3) | 23 (63,9) | <0,001 |
| Debilidad en miembros superiores | 93 (81,6) | 22 (73,3) | 23 (76,7) | 18 (50,0) | 0,002 |
| Disminución de reflejos/arreflexia | 55 (48,2) | 14 (46,7) | 13 (43,3) | 12 (33,3) | 0,470 |
| Disestesias | 51 (44,7) | 15 (50,0) | 4 (13,3) | 7 (19,4) | 0,001 |
| Tetraparesia | 11 (9,6) | 10 (33,3) | 11 (36,7) | 1 (2,8) | <0,001 |
| Alteraciones de la deglución | 15 (13,2) | 3 (10,0) | 3 (10,0) | 4 (11,1) | 0,940 |
| Parálisis facial | 25 (21,9) | 1 (3,3) | 0 (0,0) | 13 (36,1) | <0,001 |
| Oftalmoplejía | 5 (4,4) | 1 (3,3) | 1 (3,3) | 24 (66,7) | <0,001 |
| Tiempo desde inicio síntomas hasta hospitalización (días) | |||||
| Mediana (25-75)b | 7,0 (5,0-15,0) | 7,0 (3,0-10,0) | 7,0 (3,0-11,0) | 5,0 (2,0-7,0) | 0,005 |
| Media±DE | 12,0±12,0 | 9,0±10,0 | 8,0±6,0 | 5,0±4,0 | |
| Estancia hospitalaria (días) | |||||
| Mediana (25-75)b | 13,0 (9,0-28,0) | 27,0 (12,0-75,0) | 21,0 (12,0-55,0) | 13,0 (8,0-17,0) | <0,001 |
| Media±DE | 25,0±33,0 | 51,0±55,0 | 41,0±57,0 | 13,0±7,0 | |
| Ingreso en UCI, n (%) | 31 (27,2) | 12 (40,0) | 11 (36,7) | 4 (11,1) | 0,038 |
| Estancia en UCI (días) | |||||
| Mediana (25-75)b | 9,0 (4,0-20,0) | 32,0 (9,0-71,0) | 15,0 (6,0-38,0) | 6,0 (3,0-9,0) | 0,042 |
| Media±DE | 18,0±34,0 | 41,0±37,0 | 31,0±39,0 | 6,0±5,0 | |
| Complicaciones intrahospitalariasd, n (%) | 16 (14,0) | 6 (20,0) | 6 (20,0) | 1 (2,8) | 0,132 |
| Tratamientoe, n (%) | 95 (83,3) | 26 (86,7) | 28 (93,3) | 23 (63,9) | 0,011 |
| SGB recurrentef, n (%) | 5 (4,4) | 2 (6,7) | 1 (3,3) | 1 (2,8) | 0,877 |
| Secuelasg, n (%) | 38 (26,4) | 14 (46,7) | 19 (63,3) | 10 (27,8) | 0,009 |
| Discapacidad, n (%) | 11 (9,6) | 7 (23,3) | 10 (33,3) | 2 (5,6) | 0,002 |
| Dependencia, n (%) | 9 (7,9) | 5 (16,7) | 10 (33,3) | 1 (2,8) | <0,001 |
| Éxitush | 1 (0,9) | 1 (3,3) | 0 (0,0) | 0 (0,0) | 0,485 |
AIDP: polirradiculoneuropatía desmielinizante inflamatoria aguda; AMAN: neuropatía axonal motora aguda; AMSAN: neuropatía axonal sensitivo-motora aguda; DE: desviación estándar.
Otras variantes: incluye las variantes funcionales (neuropatía atáxica sensitiva aguda) y regionales del SGB (síndrome de Miller-Fisher, encefalitis troncoencefálica de Bickerstaff, diplejía facial con parestesias y variante faringo-cervico-braquial). No se disponía de información acerca de la variante en 40 pacientes, por lo que no fueron analizados.
Incluye la necesidad de traqueostomía o ventilación mecánica derivada de complicaciones intrahospitalarias.
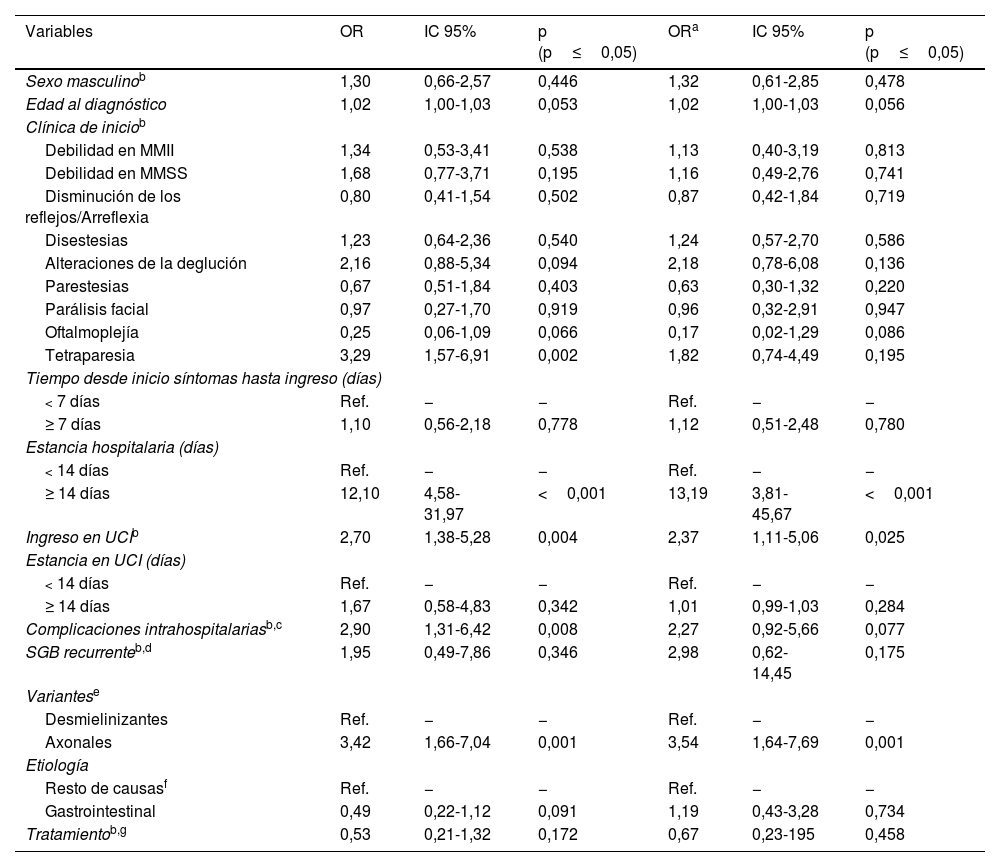
Por último, en la tabla 4 se muestra la asociación de las diferentes características de los pacientes y la discapacidad y/o dependencia reconocidas como consecuencia de la enfermedad. Se observó un mayor reconocimiento de estas condiciones en los pacientes con una estancia hospitalaria igual o superior a 14días (OR=13,19; IC95%: 3,81-45,67), en aquellos que precisaron ingreso en la UCI (OR=2,37; IC95%: 1,11-5,06) y en las personas afectadas por alguna de las variantes axonales (OR=3,54; IC95%: 1,64-7,69) (p<0,05).
Análisis multivariante de las características de los pacientes con síndrome de Guillain-Barré y discapacidad y/o dependencia reconocidas por la enfermedad
| Variables | OR | IC 95% | p (p≤0,05) | ORa | IC 95% | p (p≤0,05) |
|---|---|---|---|---|---|---|
| Sexo masculinob | 1,30 | 0,66-2,57 | 0,446 | 1,32 | 0,61-2,85 | 0,478 |
| Edad al diagnóstico | 1,02 | 1,00-1,03 | 0,053 | 1,02 | 1,00-1,03 | 0,056 |
| Clínica de iniciob | ||||||
| Debilidad en MMII | 1,34 | 0,53-3,41 | 0,538 | 1,13 | 0,40-3,19 | 0,813 |
| Debilidad en MMSS | 1,68 | 0,77-3,71 | 0,195 | 1,16 | 0,49-2,76 | 0,741 |
| Disminución de los reflejos/Arreflexia | 0,80 | 0,41-1,54 | 0,502 | 0,87 | 0,42-1,84 | 0,719 |
| Disestesias | 1,23 | 0,64-2,36 | 0,540 | 1,24 | 0,57-2,70 | 0,586 |
| Alteraciones de la deglución | 2,16 | 0,88-5,34 | 0,094 | 2,18 | 0,78-6,08 | 0,136 |
| Parestesias | 0,67 | 0,51-1,84 | 0,403 | 0,63 | 0,30-1,32 | 0,220 |
| Parálisis facial | 0,97 | 0,27-1,70 | 0,919 | 0,96 | 0,32-2,91 | 0,947 |
| Oftalmoplejía | 0,25 | 0,06-1,09 | 0,066 | 0,17 | 0,02-1,29 | 0,086 |
| Tetraparesia | 3,29 | 1,57-6,91 | 0,002 | 1,82 | 0,74-4,49 | 0,195 |
| Tiempo desde inicio síntomas hasta ingreso (días) | ||||||
| < 7 días | Ref. | − | − | Ref. | − | − |
| ≥ 7 días | 1,10 | 0,56-2,18 | 0,778 | 1,12 | 0,51-2,48 | 0,780 |
| Estancia hospitalaria (días) | ||||||
| < 14 días | Ref. | − | − | Ref. | − | − |
| ≥ 14 días | 12,10 | 4,58-31,97 | <0,001 | 13,19 | 3,81-45,67 | <0,001 |
| Ingreso en UCIb | 2,70 | 1,38-5,28 | 0,004 | 2,37 | 1,11-5,06 | 0,025 |
| Estancia en UCI (días) | ||||||
| < 14 días | Ref. | − | − | Ref. | − | − |
| ≥ 14 días | 1,67 | 0,58-4,83 | 0,342 | 1,01 | 0,99-1,03 | 0,284 |
| Complicaciones intrahospitalariasb,c | 2,90 | 1,31-6,42 | 0,008 | 2,27 | 0,92-5,66 | 0,077 |
| SGB recurrenteb,d | 1,95 | 0,49-7,86 | 0,346 | 2,98 | 0,62-14,45 | 0,175 |
| Variantese | ||||||
| Desmielinizantes | Ref. | − | − | Ref. | − | − |
| Axonales | 3,42 | 1,66-7,04 | 0,001 | 3,54 | 1,64-7,69 | 0,001 |
| Etiología | ||||||
| Resto de causasf | Ref. | − | − | Ref. | − | − |
| Gastrointestinal | 0,49 | 0,22-1,12 | 0,091 | 1,19 | 0,43-3,28 | 0,734 |
| Tratamientob,g | 0,53 | 0,21-1,32 | 0,172 | 0,67 | 0,23-195 | 0,458 |
OR: Odds Ratio, razón de riesgo.
Incluye la necesidad de traqueostomía o ventilación mecánica derivada de complicaciones intrahospitalarias.
Si ha tenido dos o más episodios que cumplan criterios diagnósticos de SGB con una recuperación completa o casi completa identificable después del episodio inicial y un mínimo de 2meses entre episodios.
Desmielinizantes: incluyen la polirradiculoneuropatía desmielinizante inflamatoria aguda, el síndrome de Miller-Fisher, la encefalitis troncoencefálica de Bickerstaff, la diplejía facial con parestesias y la neuropatía atáxica sensitiva aguda. La variante faringo-cervico-braquial fue excluida de este análisis por presentar un patrón mixto (desmielinizante y axonal).
Por otro lado, la mayor edad al diagnóstico de la enfermedad, la mayor estancia en la UCI, las alteraciones en la deglución, la tetraparesia inicial, las complicaciones intrahospitalarias y la recurrencia de la enfermedad no alcanzaron significación estadística.
DiscusiónEl presente estudio es el único que se ha realizado hasta el momento en la Región de Murcia en el que se muestra la incidencia y las principales características de las personas con diagnóstico de SGB, así como el primero que analiza los factores asociados al reconocimiento oficial de discapacidad y dependencia a nivel estatal. Además, pocos trabajos han utilizado información proveniente de un registro de base poblacional que aporte datos en un amplio periodo de tiempo.
La tasa de incidencia estandarizada de SGB en nuestra población fue de 1,52/100.000 personas-año, encontrándose dentro del rango estimado en Europa y en Estados Unidos24,25. De la misma manera, estas cifras están en consonancia con las informadas en trabajos realizados previamente en España6,7. Según nuestros resultados, no existen tendencias significativas a lo largo del periodo de estudio y la incidencia parece aumentar con la edad, situándose el pico máximo en el intervalo de 70-79años para posteriormente descender. Aunque en la mayor parte de la literatura consultada el incremento de la incidencia se sitúa alrededor de los 50años, en nuestro estudio se detectó a partir del intervalo de 30-39años, coincidiendo con otras publicaciones26,27. Asimismo, reportamos datos de incidencia más alta en los varones respecto a las mujeres, con una ratio de 2,53, similar a lo observado por otros autores28,29. No obstante, las mujeres presentaron el pico máximo por encima de los 80años, al igual que lo descrito en el metaanálisis realizado por Sejvar et al.4 y en el estudio de Aragonès et al.30, en los que se advierte que podría existir un posible infradiagnóstico en esta edad.
Los hallazgos encontrados respecto a factores precedentes concuerdan con la mayoría de las publicaciones, siendo ligeramente más frecuente el antecedente de infección respiratoria27,31-33. Sin embargo, la infección gastrointestinal se presentó en un elevado porcentaje de pacientes (40,4%), superior a lo descrito previamente34,35, pero en consonancia con los datos de Aladro et al.7 y Piñol-Ripoll et al.36. No obstante, en nuestro estudio no se ha obtenido información sobre el agente responsable de estas infecciones, y podría ser interesante en futuros trabajos analizar la incidencia de alguno de los principales patógenos desencadenantes.
El tiempo desde el inicio de síntomas hasta el ingreso y el tiempo de estancia hospitalaria y en la UCI, aunque variables según las series, también coincide con nuestros resultados9,12,34,37. De igual modo, en la mayoría de los pacientes (79,6%) constaba que habían requerido tratamiento con inmunoglobulinas intravenosas, plasmaféresis o ambos, tal y como describen en otros estudios27,36, y el 10,8% y el 9,6% necesitaron ventilación mecánica y traqueostomía, respectivamente, datos inferiores a los encontrados en la literatura7,28.
La mortalidad por SGB en nuestros pacientes fue del 2,4%, encontrándose por debajo de lo reportado a nivel nacional y europeo, donde se estima que se encuentra entre el 3 y el 7%24,38,39. Sin embargo, nosotros solo consideramos aquellos casos en los que constaba el SGB como causa del fallecimiento en la historia clínica del paciente, siendo posible que esta información no esté disponible en algunos de ellos, lo que explica este bajo porcentaje. La misma situación puede explicar el porcentaje observado en algunos síntomas clínicos de inicio, tales como la arreflexia, en la que nuestro porcentaje se situó por debajo de la mayoría de las publicaciones.
Nuestros resultados también se muestran acordes a los de Europa y Norteamérica en cuanto al predominio de la variante AIDP, cifrada en torno al 60-90%28,34,40,41. En este estudio fue del 54,3% en aquellos para los que disponíamos de información, aunque es posible que el porcentaje sea superior al existir un 16% de pacientes que no pudieron ser clasificados.
En el análisis multivariante se agruparon los subtipos de variantes en axonales o desmielinizante, tal como proponen otros autores12,19. Hasta ahora se ha sugerido que las formas axonales tienen peor pronóstico que las desmielinizantes, ya que los pacientes tardan más en recuperarse o lo hacen de forma incompleta26,28,35. Sin embargo, hasta la fecha no se ha empleado esta clasificación con el objetivo de estudiar su relación con los efectos de la enfermedad a largo plazo. Los hallazgos obtenidos sugieren que las variantes axonales, el incremento de la estancia hospitalaria y el ingreso en la UCI se asocian con una mayor discapacidad y dependencia reconocidas oficialmente.
Por otra parte, numerosos estudios han descrito que las altas puntuaciones en diferentes escalas funcionales, la edad y la etiología gastrointestinal8,9,30,38 podrían relacionarse con un mal pronóstico de la enfermedad. Sin embargo, estas últimas no alcanzaron la significación estadística en nuestro trabajo.
Teniendo en cuenta las limitaciones, aunque nuestra población era relativamente pequeña, esto sería relevante para un error tipoII, pero no en nuestro estudio, ya que se encontraron asociaciones estadísticamente significativas. Además, aunque no se dispuso de información sobre hospitalización y clínica en todos los pacientes, no hubo diferencias significativas entre aquellos con o sin esta información en cuanto a discapacidad y dependencia reconocida, por lo que es poco probable un sesgo de información.
También cabe mencionar que no todas las personas del estudio tenían el mismo tiempo de evolución de la enfermedad, lo que puede influir en el reconocimiento de discapacidad y dependencia, al requerir un tiempo desde el diagnóstico. De hecho, el tiempo medio desde el diagnóstico hasta la primera valoración fue de 13meses, por lo que, aunque se recogió información hasta el 31 de diciembre de 2021, es posible que algunos pacientes fueran valorados con posterioridad. Además, el 3,2% de los casos del estudio fueron clasificados como personas sin discapacidad al obtener un reconocimiento inferior al 33%.
Por otro lado, en este estudio no se han valorado puntuaciones en escalas funcionales, lo cual reconocemos como limitación. Sería interesante revisar las puntuaciones de los pacientes en escalas como GBS Disability Score o EGOS Score y compararlas con los datos obtenidos de las evaluaciones de discapacidad y dependencia como resultado de mal pronóstico a largo plazo.
Por último, es importante señalar que, aunque se analizó un amplio conjunto de variables, hay algunas de importancia que no fueron abordadas, como los resultados en el líquido cefalorraquídeo (LCR) o los cambios en los parámetros electrofisiológicos, que podrían ser incluidos en estudios posteriores. Asimismo, aunque se recogen manifestaciones clínicas al inicio de la enfermedad, aquellas que pudieron aparecer en el transcurso de la enfermedad no se incluyeron, pudiendo ser de gran interés.
Por el contrario, una de las principales fortalezas de nuestro trabajo es la utilización de datos provenientes de un registro de base poblacional, que ofrece información representativa y actualizada de los afectados por esta enfermedad permitiendo conocer la frecuencia, la distribución y las características de los pacientes con SGB. No obstante, sería de gran interés la realización de futuros estudios que aborden los aspectos tratados en este trabajo y con la metodología empleada en una población de mayor tamaño para respaldar nuestros resultados.
Por otra parte, los resultados obtenidos permiten conocer el impacto de la enfermedad en la salud pública y planificar los recursos que los servicios de salud deben proporcionar a las personas con SGB, contribuyendo al desarrollo de estrategias que ayuden a optimizar la atención sanitaria de estos pacientes.
ConclusionesLa TIE de SGB en la Región de Murcia concuerda con las cifras reportadas tanto en la literatura nacional como a nivel internacional. A pesar de manifestarse como una enfermedad aguda, el 18,4% de los pacientes de nuestro estudio tienen reconocida dependencia y/o discapacidad, que se encuentran asociadas a las formas axonales de la enfermedad. Asimismo, el incremento de la estancia hospitalaria y el ingreso en la UCI se han relacionado con un mayor reconocimiento de estas condiciones.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Responsabilidades éticas y legalesNo se requirió el consentimiento informado dado que el SIER está incluido en las excepciones recogidas en la normativa de protección de datos de carácter personal sobre actuaciones en materia de salud pública relacionadas con las enfermedades raras (Ley de Salud Pública), y está habilitado por su propia normativa regulatoria
Contribuciones de los autoresSRN y MPME diseñaron e iniciaron el estudio actual. MPME, JAPR y PCM coordinaron la depuración de la información y administraron el SIER. PCM se encargó del mantenimiento de la base de datos. MPME y ASE validaron y confirmaron el diagnóstico de la enfermedad. SRN, MPME, ASE y LAMR clasificaron a los pacientes según su variante. ASE se encargó de recopilar datos demográficos y clínicos de los pacientes. SRN y MPME fueron las encargadas de analizar los datos. MPME y SRN escribieron el borrador del manuscrito. JMCF ayudó en la redacción del manuscrito. Todos los autores revisaron y aprobaron el manuscrito final.
Declaración de originalidadLos autores declaran que este estudio es original y que no se ha publicado previamente, ni se encuentra en procesos de evaluación en otras revistas para su publicación.
Disponibilidad de los datosEl conjunto de datos pseudo-anonimizados utilizados para llevar a cabo este estudio y que sustentan sus conclusiones están restringidos siguiendo el Reglamento (UE) 2016/679, la Ley 3/2018 de Protección de Datos de Carácter Personal, la Ley 14/2007 de Investigación Biomédica y la Ley 37 /2007 y la Ley 18/2015 de Reutilización de la Información del Sector Público. En virtud de lo anterior, solo es posible acceder a los datos agregados con solicitud razonada en la siguiente dirección: serplan@listas.carm.es
Conflicto de interesesNinguno.
Agradecemos la colaboración de todos los profesionales que aportan datos al SIER y el trabajo realizado por el personal del Servicio de Planificación y Financiación Sanitaria, encargado de su mantenimiento. A Julián Jesús Arense Gonzalo, profesor asociado del departamento de Ciencias Sociosanitarias de la Universidad de Murcia, y a Pablo Herrero Bastida, Médico Interno Residente de Neurología del Hospital Clínico Universitario Virgen de la Arrixaca, por su ayuda y consejos.