El complejo esclerosis tuberosa (CET) es uno de los trastornos neurocutáneos más frecuentes. Las tuberosidades corticales son las alteraciones patológicas más frecuentes y están relacionadas directamente con las principales expresiones clínicas, crisis epilépticas, retraso mental y comportamiento autista. El motivo de este trabajo es mostrar la importancia de los diferentes tipos de tuberosidades en la expresión clínica de los pacientes.
ObjetivoLa finalidad de este trabajo es relacionar el tamaño de las tuberosidades con la severidad de las alteraciones clínicas.
Material y métodosSe estudiaron retrospectivamente los hallazgos clínicos y neurorradiológicos de 45 pacientes infantiles (22 mujeres y 23 varones) con CET y comparamos los hallazgos clínicos con la localización, el tamaño y el número de las tuberosidades corticales en cada paciente.
ResultadosCuatro pacientes tenían tuberosidades muy voluminosas en los hemisferios cerebrales. Todas mostraban crisis epilépticas muy rebeldes y retraso mental profundo con comportamiento autista en 3 de ellos, pese a que se extirparon las tuberosidades en los 4 casos. Trece pacientes tenían tuberosidades de tamaño promedio-grande. Todos tenían crisis epilépticas muy rebeldes y retraso mental. Nueve pacientes habían tenido espasmos infantiles durante el primer año de vida y presentaban comportamiento autista. Veintiocho pacientes mostraban muchas tuberosidades de tamaño promedio-pequeño. La mayoría de ellos tenían crisis con buena respuesta al tratamiento farmacológico y poca prevalencia del autismo. Tres pacientes mostraban tuberosidad córtico-subcortical única en un polo frontal u occipital, todos ellos con crisis controladas con medicación y cociente intelectual normal. Trece pacientes de los 45 tenían tuberosidades cerebelosas, siempre asociadas a algún tipo de tuberosidad hemisférica y generalmente presentes en casos con mayor expresividad clínica.
ConclusionesLas tuberosidades de gran tamaño, aunque sean poco numerosas, tienen mucha mayor relación con la presencia de sintomatología clínica severa —crisis epilépticas, retraso mental y comportamiento autista— que las tuberosidades de pequeño-mediano tamaño, aunque sean muy numerosas.
Tuberous sclerosis complex (TSC) is one of the most frequent neurocutaneous disorders. Cortical tubers are the most common pathological changes in TSC and they are directly related to the disease's main clinical manifestations: seizures, mental retardation, and autistic behaviour.
ObjectiveThe aim of this study is to establish a correlation between tuber size and the severity of clinical features in TSC.
Material and methodsWe performed a retrospective study of the clinical and imaging findings from 45 TSC patients (22 females and 23 males) and compared the clinical features with the location, size, and number of the cortical tubers in each patient.
ResultsFour patients had voluminous tubers located in 1 or both cerebral hemispheres. All of these patients had intractable seizures and severe mental retardation; 3 of these cases also presented with autistic behaviour, despite tubers having been resected in all 4 patients. Thirteen patients had tubers of large-to-average size, and all patients in this group showed intractable seizures and mental retardation. Nine patients who had experienced infantile spasms during the first year of life presented autistic behaviour. Multiple tubers of small to average size were found in 28 patients. In general, this group had seizures that responded well to antiepileptic drugs and a low prevalence of autism. In 3 patients who all presented good seizure control and normal intelligence, single cortical/subcortical tubers were located in the frontal or occipital lobes. Of the total of 45 patients, 13 had cerebellar as well as cerebral tubers; these were generally present in cases with more severe clinical features.
ConclusionsAlthough large tubers are less common than small to medium-sized ones, they are much more likely to be accompanied by severe clinical symptoms (seizures, mental retardation and autistic behaviour), even when the smaller tubers are quite numerous.
El complejo esclerosis tuberosa (CET) (OMIM 605284 y 191092) es un trastorno multisistémico, heredado por vía autosómica dominante, causado por mutaciones en los genes supresores tumorales hamartina (TSC1) y tuberina (TSC2), localizados en los cromosomas 9q34 y 16p13, respectivamente. El CET está asociado la mayoría de las veces con epilepsia fármaco-resistente y retraso en el desarrollo mental en los niños. El trastorno está directamente relacionado con la presencia de tuberosidades corticales, la lesión histológicamente más representativa del CET. Los estudios histológicos de las lesiones cerebrales del CET comenzaron en 1901 con Pellazzi1. Macroscópicamente, las tuberosidades aparecen como lesiones que están localizadas en la superficie de los hemisferios cerebrales en el 82-100% de pacientes con CET y participan directamente en el origen de las crisis2. Las tuberosidades hacen prominencia en las circunvoluciones y son firmes, suaves y más pálidas que el córtex circundante no afectado, variando marcadamente en número, tamaño, localización y apariencia en los estudios de resonancia magnética (RM) en el tiempo de realizar los estudios3,4. Histológicamente, las tuberosidades corticales son hamartomas hipomielinizados, que se caracterizan por laminación cortical anormal, presencia de células gigantes balonadas, celularidad anormal, estando a la vez reducido el número de neuronas, incrementada la presencia de células gigantes, balonadas, neuronas displásicas y astrocitos de gran tamaño5-8.
Las tuberosidades han sido identificadas en fetos de 20 semanas y persisten durante toda la vida. Estudios seriados de RM de pacientes con CET muestran cambios de las tuberosidades en relación con la edad de los pacientes4.
Aproximadamente, un 95% de los pacientes con CET presentan tuberosidades cerebrales9. Los principales problemas de los pacientes con CET son epilepsia, retraso mental y autismo, que pueden ir manifestándose a lo largo de la vida. Las crisis epilépticas aparecen frecuentemente en el primer año de la vida y consisten en espasmos infantiles en un alto porcentaje de casos. Otros tipos de crisis, tales como las focales y mioclónicas, suelen aparecer algo más tarde, entre el primer y el segundo años, e incluso en edades más tardías.
La epileptogénesis en los casos de CET está causada más por las características anatómicas o funcionales de la corteza cerebral que circunda a las tuberosidades corticales que directamente por estas10. Durante los últimos años, la histoquímica de las enzimas oxidativas mitocondriales han revelado la presencia de neuronas dispersadas o agrupadas, con actividades más fuertes que otras en los focos epilépticos en las secciones congeladas de tuberosidades recientemente obtenidas por cirugía de pacientes con CET y de displasia cortical focal11,12. Parece evidente la relación directa entre el desarrollo mental, la epilepsia y las características de las tuberosidades corticales, especialmente su número y localización13-15, y también la posible directa importancia de las tuberosidades cerebelosas como causa de las crisis y del retraso mental16,17.
Hay varios estudios en la literatura que sugieren una asociación entre los hallazgos aportados por la RM en el cerebro, que atañen especialmente al número y la localización de las tuberosidades y la función cognitiva, presencia de crisis, especialmente espasmos infantiles, y edad al comienzo de las crisis en pacientes con CET13,18-22. Sin embargo, pocos trabajos relacionan la severidad de las alteraciones neurológicas con el tamaño de las tuberosidades y, en menor grado, una determinada localización de las mismas23 y la relación entre la actividad de las tuberosidades, epilepsia y función cognitiva24, así como el intervalo transcurrido entre el comienzo de las crisis y el inicio del tratamiento25,26.
Una revisión retrospectiva de 45 pacientes con CET estudiados por RM durante edades infantiles y con seguimiento a lo largo de muchos años (hasta la adolescencia y la edad adulta en algunos) nos ha permitido conocer que el tamaño de las tuberosidades es la alteración más importante de las que se asocian a las secuelas más severas en el CET. Casos con CET estudiados en la época anterior a disponer de técnicas de RM, y publicados entonces por su interés científico27,28, no han sido incluidos a menos que posteriormente fueran estudiados por RM.
Material y métodosDesde el año 1996 hasta el 2004, 45 pacientes con CET (22 mujeres y 23 varones) eran estudiados en el Servicio de Neurología Pediátrica de Hospital Universitario La Paz de Madrid. Unos pocos pacientes eran estudiados también por genética molecular para determinar el gen transmisor TSC1 o TSC2, pero dado su escaso número, los resultados no han sido tenidos en cuenta al elaborar este trabajo. Una relación de los pacientes y los motivos del estudio figuran en la tabla 1. La relación de pruebas realizadas a los pacientes está expuesta en la tabla 2. Casi todos los estudios de RM fueron realizados en cada paciente con aparato de 1,5 Tesla y 25 de ellos tenían estudios previos de RM (algunos con aparato de 1,0 Tesla), realizados en otros hospitales en los que no se había seguido una sistemática protocolaria de la fiabilidad de la de nuestro centro, y por ello se repitió la exploración por nuestra parte.
Pacientes con CET estudiados (1996-2004)
| Total: 45 (23V; 22M) |
| Edades: 2 meses a 12 años |
| Seguimiento: hasta los 20 años en 5 casos |
| Motivo principal de la consulta |
| Crisis epilépticas: 45 casos |
| Otros motivos |
| Retraso psicomotor |
| Comportamiento autista |
| Déficit de atención/hiperactividad |
| Lesiones cutáneas |
| Lesiones renales |
El estudio electroencefalográfico era muy importante para conocer la presencia o no de trazado de hipsarritmia que pudiera orientar hacia un tratamiento adecuado desde muy pronto, y también en objetivar la existencia de uno o más focos epileptógenos que pudieran orientar hacia la localización del origen de las crisis y las posibilidades quirúrgicas, así como para conocer si era preciso extirpar una o más tuberosidades.
El protocolo de estudio de RM incluía imágenes coronales, axiales y sagitales, usando spin-eco T1, spin-eco T2 e imágenes en T1 enriquecidas con contraste. Además, en los casos en los que era necesario identificar con detalle las lesiones corticales, también se recurría a las técnicas de RM tridimensional y fluido-atenuado inversión recuperación y reconstrucción cortical.
Se ha centrado la atención principal del trabajo en el número, la forma o el tipo, el tamaño y la localización de las tuberosidades y su relación con las crisis epilépticas, especialmente los espasmos infantiles, y con el desarrollo mental, la frecuencia y la importancia de las tuberosidades cerebelosas, y la relación del nivel mental con las características de los diferentes tipos de tuberosidades. Somos conscientes de las dificultades que existen para la clasificación diferencial por tamaños de las tuberosidades (tabla 3), por ello no existen en la literatura, mientras que son muy abundantes los trabajos que se refieren a la importancia de su número13-15 en relación con la presentación de crisis y la afectación psicomotriz y el autismo. No hemos encontrado modelos publicados previamente en los que basarnos. Por ello hemos recurrido a uno propio un tanto artificial, que nos parece cuadra mejor con la severidad clínica del síndrome que el ya ampliamente conocido del número de tuberosidades, sobre cuya validez no hay acuerdo unánime. Hemos catalogado como tuberosidades voluminosas las que se extienden por todo un lóbulo cerebral como promedio-grandes y que tienen un diámetro superior a 3cm, pero no se extienden por todo un lóbulo, y promedio-pequeñas las que tienen un diámetro inferior a los 3cm. No hemos hecho mediciones del tamaño de las tuberosidades del cerebelo, pero la mayoría de las veces son del tipo 2 o promedio-grandes.
ResultadosEl resumen de los resultados de los tipos de tuberosidades encontrado figura en la tabla 4. Excepto en tres 3 pacientes que presentaban una tuberosidad cerebral única —uno en el lóbulo frontal y 2 en el lóbulo occipital— correspondiente al grupo de tamaño promedio-pequeño, el resto de los casos presentaba más de una tuberosidad de diferentes tamaños, distribuidas en parecido número por ambos hemisferios cerebrales. Las tuberosidades captaban muy bien el contraste en una parte de la misma o en su totalidad. En 13 pacientes también se observaban tuberosidades en el cerebelo, nunca aisladas sino siempre asociadas a alguno de los tipos de tuberosidades de los hemisferios cerebrales. Las alteraciones encontradas en los grupos correspondientes a los 3 tipos de tamaños de las tuberosidades figuran en la tabla 5.
Alteraciones neurológicas encontradas en los pacientes de cada grupo
| 1. Los 4 pacientes con tuberosidades voluminosas presentaban: |
| Crisis de varios tipos rebeldes al tratamiento |
| Espasmos infantiles |
| Retraso mental profundo: los 4 casos |
| Comportamiento autista: 3 de los 4 casos |
| A todos les fue extirpada la tuberosidad con: |
| Resultado eficaz sobre la epilepsia |
| Sin resultado sobre el nivel intelectual |
| 2. En los 13 pacientes con tuberosidades de tamaño promedio-grande se observaron: |
| Crisis epilépticas de diverso tipo: los 13 casos |
| Espasmos infantiles durante el primer año de vida: 9 casos |
| Retraso mental: los 13 casos |
| Comportamiento autista: 9 casos |
| 3. En los 28 pacientes con tuberosidades de tamaño promedio-pequeño se observaron: |
| Más de 12 tuberosidades distribuidas por ambos hemisferios en 25 pacientes |
| Crisis de algún tipo en 24 pacientes (96%) |
| Espasmos infantiles en el primer año en 10 pacientes (40%) |
| Control de las crisis en 18 (73%) |
| Nivel intelectual normal (CI>85) en 7 (27%) |
| Nivel intelectual límite (CI = 70-85) en 12 (46%) |
| CI inferior al normal (CI<70) en 9 (31%) |
| Comportamiento autista en 4 (15%) |
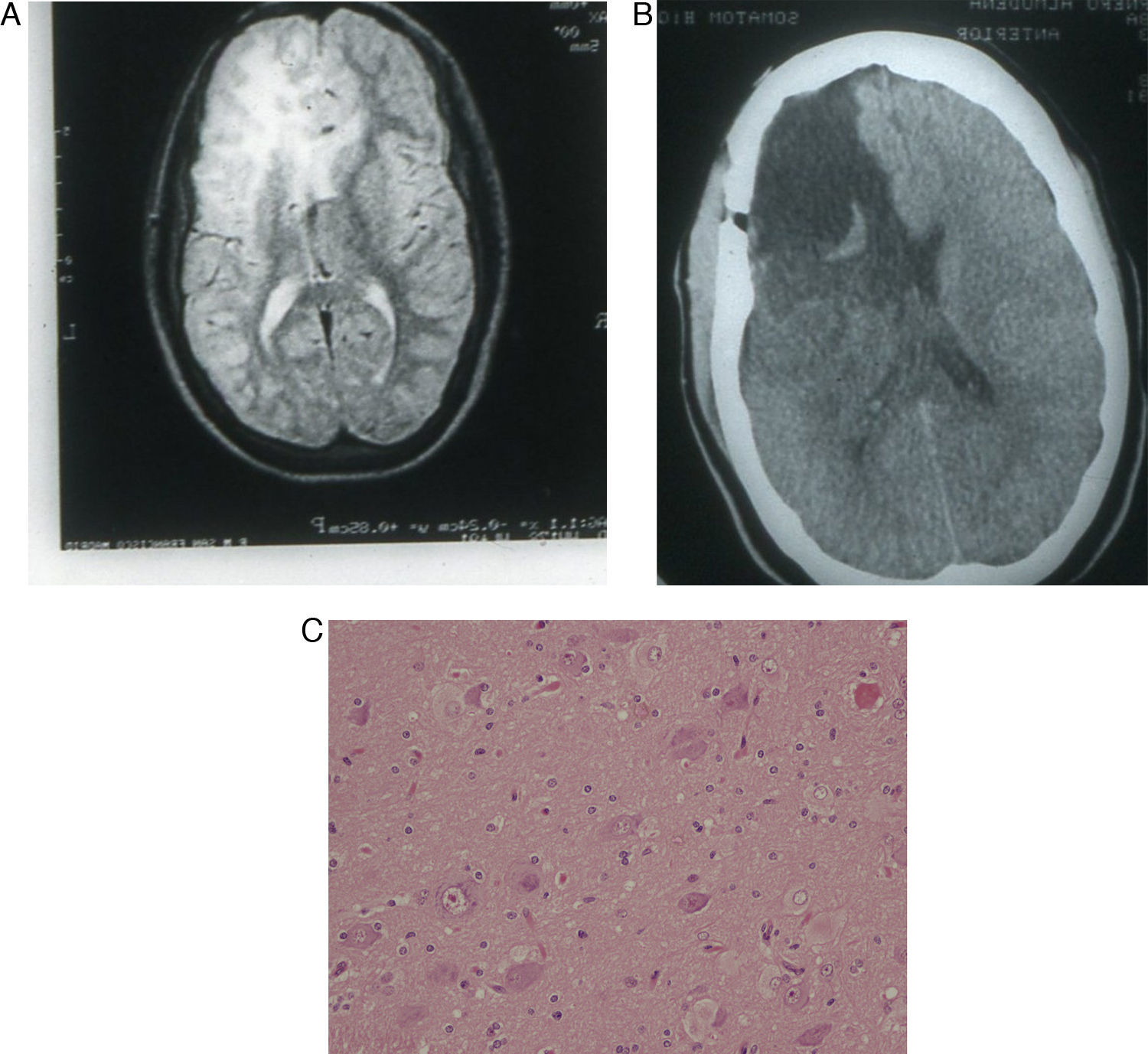
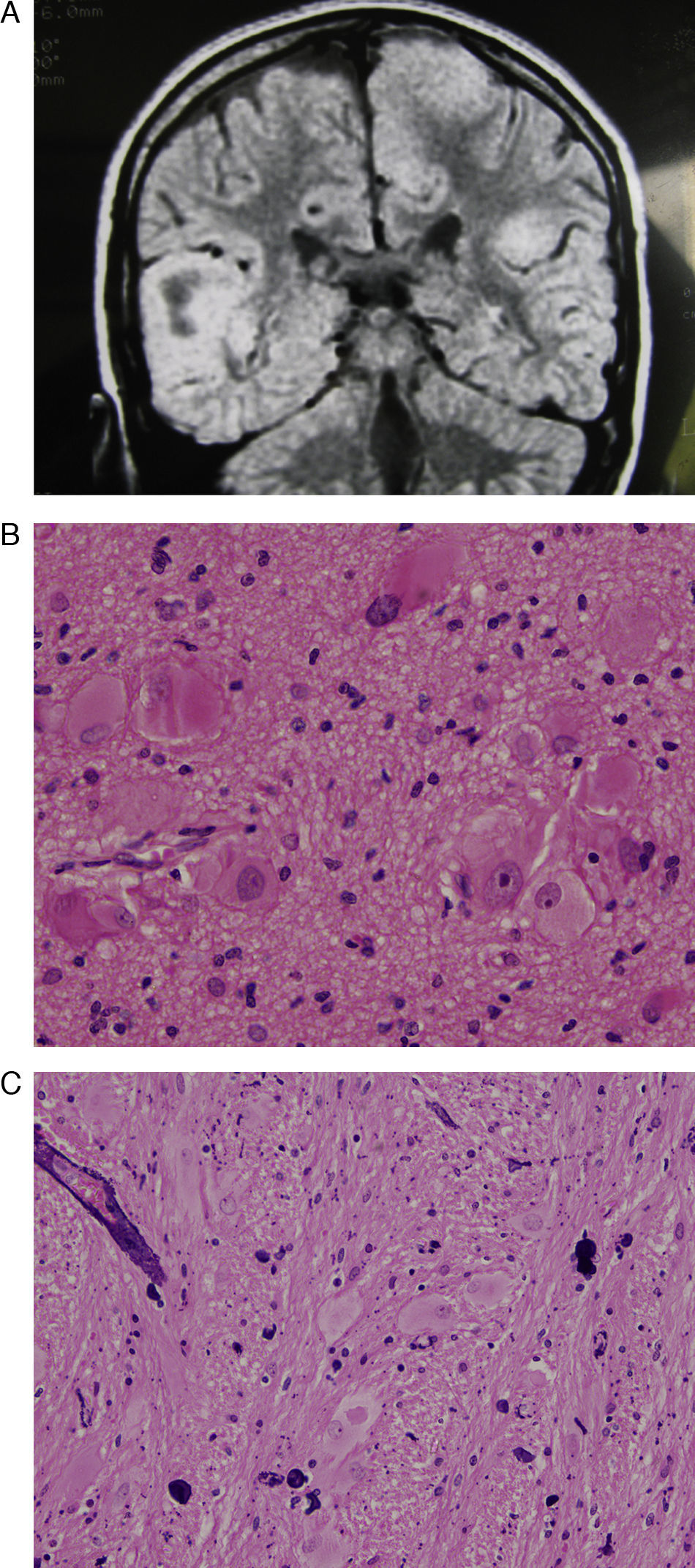
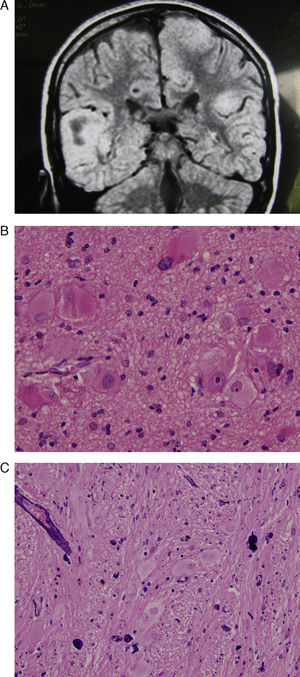
Las crisis eran muy rebeldes a todos los tipos de medicación antiepiléptica ensayados. Los 4 pacientes con tuberosidades muy voluminosas evolucionaron con retraso mental profundo y crisis incontroladas, y fueron operados entre los 3 y los 17 años. A uno de ellos se le extirpó a los 17 años una enorme tuberosidad que había ido aumentando de tamaño desde que se diagnosticó en los primeros años de vida y que tras la adolescencia se extendía por todo el lóbulo frontal derecho (fig. 1), habiendo desaparecido las crisis totalmente, pero sin mejorar su nivel intelectual y su comportamiento autista. A otro paciente con crisis parciales muy frecuentes, retraso mental con CI por debajo de 50, pero sin comportamiento autista, y con 2 tuberosidades grandes, una que se extendía por todo el lóbulo temporal derecho y otra localizada en la zona parasagital fronto-parietal izquierda (fig. 2), le fue extirpada a los 8 años la tuberosidad del lóbulo temporal con lo que se consiguió que disminuyera el número de crisis de forma definitiva en más de un 90%, pero sin mejorar su nivel intelectual. A otro paciente con crisis muy rebeldes y retraso mental profundo se le extirpó a los 3 años una tuberosidad voluminosa y de límites muy difusos, localizada en zona parietooccipital izquierda, sin que la operación hiciera disminuir las crisis ni mejorar su nivel intelectual y su autismo. El cuarto paciente era una niña que había presentado espasmos infantiles desde los primeros meses de vida y posteriormente continuó presentando varios tipos de crisis, especialmente de tipo focal, con sintomatología compleja, acompañadas de retraso mental profundo, comportamiento autista y gran inquietud; el estudio de RM mostró algunas tuberosidades en ambos hemisferios, pero había 3 voluminosas, una que se extendía por los lóbulos frontal y temporal del hemisferio derecho, y una tercera en el lóbulo occipital izquierdo; a los 12 años se le extirpó la tuberosidad del hemisferio cerebral derecho, quedando las crisis totalmente controladas durante 2 años, al cabo de los cuales reaparecieron las crisis con carácter incontrolable, cayendo 2 meses más tarde en estatus de mal epilepticus y falleciendo en el curso del mismo. Los 4 pacientes de este grupo presentaban también tuberosidades en el cerebelo. El estudio anatomohistológico de las piezas operatorias de estos 4 casos mostró alteraciones muy similares, que se caracterizaban por mala diferenciación del límite entre las sustancias blanca y gris, y difuminación de la laminación cortical, disminución del número de neuronas normales, incremento del número de astrocitos gigantes y presencia de células gigantes. Los 13 pacientes con tuberosidadades de tamaño promedio-grande presentaban retraso mental severo (CI < 50), 9 de ellos habían presentado espasmos infantiles a lo largo del primer año de vida y los 9 evolucionaron con comportamiento autista. No existían notables diferencias en la sintomatología de los que presentaban una o más tuberosidades grandes, ni dependiendo de su localización ni del sexo. Tres de estos pacientes presentaban también una o 2 tuberosidades en los hemisferios cerebelosos.
A) Corte axial de la RM en T2 que muestra una voluminosa tuberosidad que ocupa todo el lóbulo frontal derecho, que incluso se extiende a zona medial del lóbulo frontal izquierdo. B) Mismo caso. La imagen postoperatoria de la RM muestra el gran vacío de masa cerebral en la zona anterior del hemisferio cerebral derecho. C) Tinción con hematoxilina-eosina de un corte histológico de la tuberosidad resecada en el que se aprecian diversos tipos de células dismórficas y aumentadas de tamaño, destacando las células balonadas.
A) Corte coronal de la RM en T2 que muestra principalmente una voluminosa tuberosidad que ocupa todo el lóbulo temporal derecho, otra tuberosidad muy voluminosa situada en la zona paramediana del hemisferio cerebral izquierdo y zonas tuberosas en las partes periféricas de ambos hemisferios cerebelosos. B) Corte histológico de la tuberosidad temporal. Tinción con hematoxilina-eosina. Abundancia de diferentes tipos de células gigantescas y deformes, predominando las células balonadas. C) Otro corte histológico teñido con hematoxilina-eosina en el que destaca el abundante número de vasos sanguíneos con calcificaciones perivasculares.
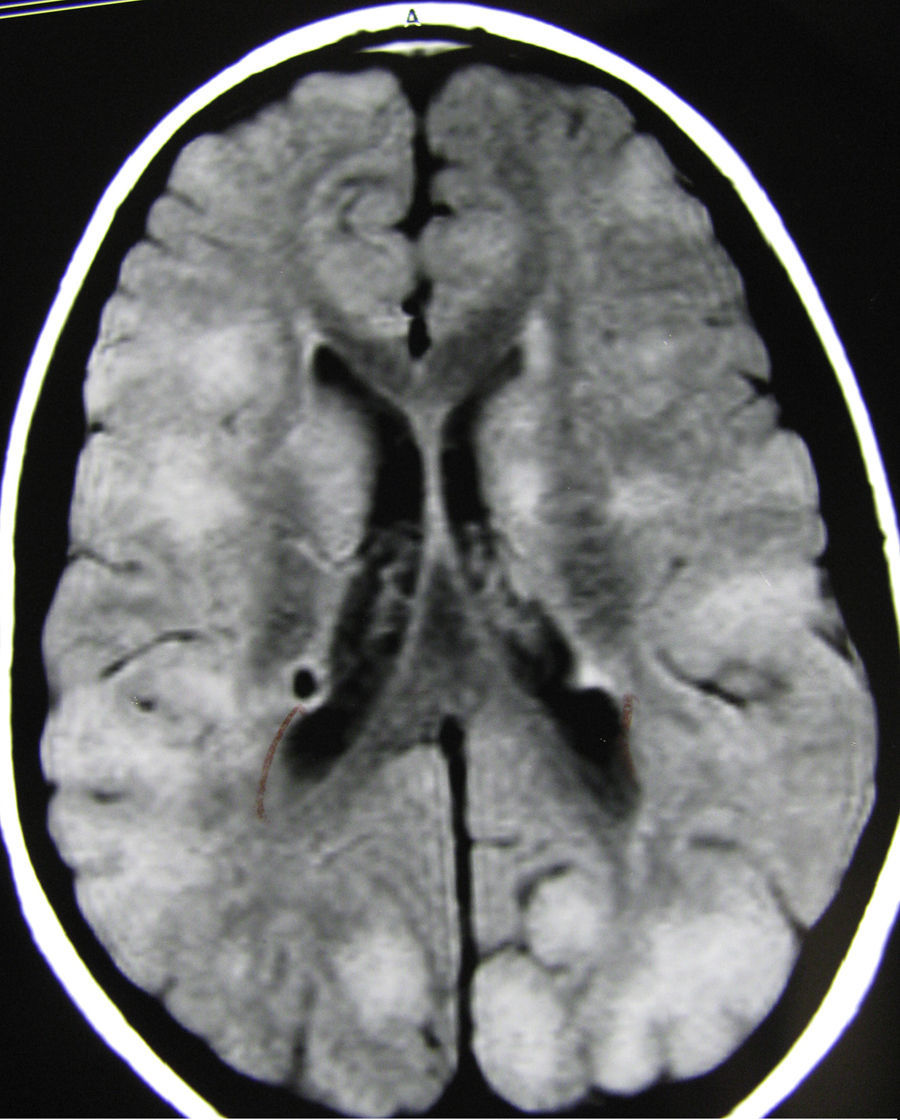
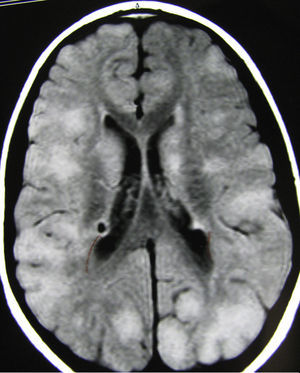
En el grupo de tuberosidades con tamaño promedio-pequeño, la localización era generalmente muy variable, pudiendo haber diferencias notables entre uno y otro hemisferio (fig. 3). Los resultados concernientes a las alteraciones clínicas de los pacientes en este grupo de tamaño de las tuberosidades, al igual que los de los otros 2, están expuestos en la tabla 5. La mayoría de los pacientes que evolucionaron con nivel mental por debajo del límite y los 4 con comportamiento autista correspondían a casos con crisis sin controlar o que habían presentado espasmos infantiles en edades muy tempranas y que posteriormente habían seguido con otras crisis que no habían podido ser controladas totalmente; este tipo de tuberosidades estaba asociado a casos de tuberosidades cerebelosas en 6 pacientes sin que se apreciara en ellos influencia sobre la presencia de crisis y sobre el desarrollo intelectual.
Todos los pacientes con CI por encima de 70 habían presentado los espasmos infantiles después de los 6 meses. En los casos de tuberosidades voluminosas, los espasmos infantiles habían aparecido antes de los 6 meses.
El tratamiento de los espasmos infantiles fue realizado principalmente con hormona adrenocorticotropa y vigabatrina, si bien manteniendo una estricta vigilancia de la evolución de los pacientes no solo desde el punto de vista de las crisis, sino también de las graves secuelas que ambas sustancias pueden causar. Por ello, cuando tras el control de los espasmos persistían crisis epilépticas focales y/o generalizadas, se procuraba mantener muy poco tiempo el tratamiento con vigabatrina debido a su frecuente y grave acción sobre el campo visual, cambiándose por levetiracetam, que presentaba una acción positiva sobre las crisis similar a la de la vigabatrina. Solo se recurrió a la cirugía en los 4 pacientes ya señalados, que presentaban tuberosidades muy voluminosas. No se trató ningún caso con dieta cetogénica ni con estimulación vagal.
DiscusiónLos criterios diagnósticos del CET existen desde 199829.
Las imágenes de RM de los 2 tipos de tuberosidades, Pellazzi 1 y Pellazzi 2, fueron descritos por Braffman et al. en 199230 y recientemente se observó la asociación entre el tipo 2 de tuberosidades corticales y la mutación en el gen TSC231. Gallagher et al.3 identificaban 3 tipos de tuberosidades basados en la intensidad de la señal en el componente de la sustancia blanca subcortical y también identificaban 3 grupos de pacientes sobre la base del tipo dominante de tuberosidad existente. Añadiendo importancia a los hallazgos en la RM, Gama et al.32 demostraban la presencia, aunque no muy frecuente, de anormalidades de tipo esclerosis mesial temporal (EMT), interpretando que este tipo de lesión se debía al padecimiento de crisis febriles durante el primer año de la vida. La presencia de ambos hechos, el primario o las tuberosidades, y el secundario o EMT, zonas epileptógenas en pacientes con CET, incluso con múltiples focos bilaterales, no es necesariamente una contraindicación para el tratamiento quirúrgico en pacientes seleccionados33. El número, el tamaño, la localización y la unilateralidad o bilateralidad de las tuberosidades, así como la edad al comienzo de las crisis, la presencia o no de espasmos infantiles21, la respuesta de las crisis a las medicaciones antiepilépticas y el tiempo que pasó entre la presentación de las crisis y la iniciación del tratamiento son factores importantes que contribuyen a la afectación cerebral14. Se ha sugerido por algunos autores19 que la presencia de más de 7 tuberosidades conlleva un alto riesgo de presentación de espasmos infantiles y afectación intelectual, mientras otros14 encontraban que eran precisas más de 10 tuberosidades para causar crisis epilépticas y retraso mental. Sin embargo, el estudio clínico-radiológico-genético de una gran serie34 no ha podido confirmar la relación del número de tuberosidades en los hemisferios cerebrales y el retraso mental de los pacientes afectados. Tampoco lo hemos podido constatar en nuestra serie.
La presentación de crisis epilépticas se considera un factor importante que condiciona el desarrollo intelectual de las personas con CET, habiendo series en las que las crisis estaban presentes en el 99% de los pacientes con retraso mental34.
Aunque el estudio de las tuberosidades corticales por RM espectroscópica (RME) ha mostrado disminución de la relación NAA/Cr y un aumento de mioinositol/Cr, sin existir diferencia en la relación Cho/Cr35 respecto a los controles normales, pensamos que el valor diagnóstico aportado por esta prueba no es equiparable al proporcionado por otros tipos de estudio de neuroimagen, como puede ser el tamaño de las tuberosidades, si bien es verdad que nosotros no hemos realizado un estudio comparativo entre ambos parámetros por no ser importante el número de casos estudiados por RME.
Los datos clínicos referidos en los estudios de pacientes con CET ponen en evidencia la asociación del síndrome con el retraso mental36,37. Casi todos los pacientes con CET, incluso sin presentar crisis epilépticas, tienen problemas cognitivos y de comportamiento importantes36. Es evidente, por tanto, el papel que desempeñan las tuberosidades a la vista de los resultados en nuestra serie, su tamaño más que su número, como causa de crisis epilépticas, especialmente espasmos infantiles en la generación de los problemas intelectuales. Hay autores, sin embargo, que consideran que las tuberosidades y las crisis no son necesarias ni suficientes para explicar las manifestaciones clínicas del CET y que debe de haber otros mecanismos moleculares que causen el trastorno38. Uno de ellos podría estar relacionado con el origen en mutaciones en el gen TSC234, pero esta relación precisa de futuros estudios para valorarla de forma más objetiva.
El tratamiento farmacológico se ofrece todavía como el de elección preferente y, aunque en las crisis que no corresponden a espasmos infantiles, la vigabatrina y el levetiracetam son considerados como las medicaciones de elección, la oferta se va ensanchando a medida que pasa el tiempo.
La estimulación del nervio vago también ha sido utilizada en personas con CET con crisis rebeldes a todo tipo de tratamiento, siendo sus resultados pobres39.
El tratamiento de inhibidores mTOR (familia de sirulimús o rapamicina), que se describe como muy efectivo en el tratamiento de los astrocitomas subependimarios giganto-celulares40,41 no ha sido considerado todavía como alternativa al tratamiento de las tuberosidades.
La literatura de los últimos años sobre el tema sugiere que la resección quirúrgica de las tuberosidades que causan epilepsia fármaco-resistentes ofrecen beneficios en pacientes seleccionados atendiendo a la semiología, el EEG ictal e interictal, el tamaño, la localización y las características de las imágenes vídeo-EEG42. Se ha considerado tradicionalmente que la cirugía sobre lesiones que incluyen la corteza rolándica-perirrolándica en pacientes con CET supone un mayor riesgo de dejar secuelas motoras/sensitivas en el hemicuerpo contralateral, pero este hecho no ha sido confirmado por algunos autores43. Esta disminución del riesgo que aparentemente debería existir podría deberse a reorganización de la función cortical o porque las tuberosidades no contienen una función específica43. Estudios por electrocorticografía han mostrado que la epileptogenicidad de las tuberosidades corticales es causada más por la perturbación o anormal desarrollo de la corteza cerebral colindante que por la propia tuberosidad44. La identificación de las áreas epileptógenas puede ser difícil en algunos casos, pero las técnicas diagnósticas mejoran a medida que pasa el tiempo45 y permiten disponer de métodos diagnósticos no invasivos para conseguir un diagnóstico prequirúrgico de la tuberosidad y de la zona circundante epileptógenas, incluso con datos de imagen que superan a los proporcionados por el SPECT y el PET, como se ha visto con el uso combinado de EEG-MRI funcional46.
Dada la diferencia de tamaño de las tuberosidades, la resección de estas puede realizarse mediante la extirpación únicamente de la tuberosidad o ampliando la extensión de la cirugía a todo un lóbulo, o incluso a zonas cerebrales contiguas, como ocurría en uno de nuestros pacientes operados, que no volvió a tener crisis posteriormente a la operación. Sin embargo, estudios de casos operados, cuya evolución ha sido seguida durante varios años, han demostrado que la mayor eficacia se nota al principio del estado postoperatorio y el porcentaje de reducción de crisis va disminuyendo con el paso del tiempo46.
El comportamiento autista va asociado a retraso mental, profundo en la mayoría de los casos con CET. Así ocurría en los 15 (33,3%) de los 45 pacientes de nuestra serie, que se repartía en el 64,7% de los pacientes con tuberosidades hemisféricas voluminosas y en el 15,4% de los casos con tuberosidades más numerosas y de menor volumen. Los porcentajes de pacientes con comportamiento autista descritos en las diferentes series de CET oscilan entre el 1747 y el 68%48,49. La relación de las crisis epilépticas con el comportamiento autista ha sido referida en la mayoría de las series y observada también en la nuestra. Se ha encontrado con mucha frecuencia la presencia de trastorno por déficit de atención asociado con el comportamiento autista48.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.