La disección de arterias cervicales (DAC) es la causa del 2-3% de ictus isquémicos y del 10-25% en pacientes jóvenes. Nuestro objetivo es evaluar si la implementación de un centro terciario de ictus (CTI) facilita el diagnóstico y modifica el pronóstico de los pacientes con ictus agudo por DAC.
Pacientes y métodosEstudio retrospectivo de un registro de pacientes consecutivos con ictus agudo por DAC. Se clasificaron según el periodo de atención: pre-CTI (octubre 2004-marzo 2008, 42 meses) o post-CTI (abril 2008-junio 2012, 51 meses). Se compararon las características basales, el método diagnóstico, el tratamiento y la evolución de estos pacientes entre ambos periodos.
ResultadosSe diagnosticó a 9 pacientes con DAC en el periodo pre-CTI y 26 en el post-CTI, representando el 0,8 y el 2,1% de los ictus isquémicos atendidos en cada periodo. El diagnóstico de DAC se realizó en las primeras 24 h en el 42,3% de pacientes en el periodo post-CTI frente al 0% en el pre-CTI, gracias al uso de la arteriografía cerebral urgente como prueba diagnóstica en el 46,2% de los casos en el segundo periodo frente al 0% en el primero. La gravedad del ictus (mediana puntuación escala NIHSS 11 vs. 3, p=0,014) y el tiempo hasta la atención neurológica (265 minutos vs. 148, p=0,056) fueron mayores en la fase post-CTI. Se realizó tratamiento endovascular en el 34,3%, todos en el periodo post-CTI. El pronóstico funcional fue comparable en ambos periodos.
ConclusionesLa implementación de un CTI incrementa la frecuencia en el diagnóstico de DAC y aumenta las opciones terapéuticas en la fase aguda del ictus en estos pacientes.
Cervical artery dissection (CAD) is the cause of 2% to 3% of ischaemic strokes and 10% to 25% of the ischaemic strokes in young people. Our objective is to evaluate whether implementation of a comprehensive stroke centre (CSC) improves the diagnosis and modifies the prognosis of patients with acute stroke due to CAD.
Patients and methodsRetrospective study of a registry of consecutive patients with acute stroke due to CAD. They were classified according to the period of care at our centre: pre-CSC (October 2004-March 2008, 42 months) or post-CSC (April 2008-June 2012, 51 months). We compared baseline characteristics, methods of diagnosis, treatment and outcome of these patients in both periods.
ResultsNine patients were diagnosed with CAD in pre-CSC and 26 in post-CSC, representing 0.8% and 2.1% of all ischaemic strokes treated in each period, respectively. The diagnosis of CAD was made within the first 24hours in 42.3% of the patients in post-CSC versus 0% in pre-CSC, by using urgent cerebral angiography as a diagnostic test in 46.2% of cases in the second period compared to 0% in the first. Both severity of stroke (median NIHSS score 11 vs. 3, P=.014) and time to neurological care (265min vs 148, P=.056) were higher in the post-CSC period. Endovascular treatment was performed in 34.3%, and all treatments were post-CSC. The functional outcome was comparable for both periods.
ConclusionsImplementation of a CSC increases the frequency of the diagnosis of CAD, as well as the treatment options for these patients in the acute phase of stroke.
La disección de arterias cervicales (DAC) es la causa del 2-3% del total de ictus isquémicos en la población general y del 10-25% en los pacientes menores de 50 años1,2. La arteriografía ha sido tradicionalmente la prueba de elección para el diagnóstico de DAC, aunque el desarrollo de nuevas técnicas menos invasivas, como la resonancia magnética (RM), la angiografía por tomografía computarizada (TC) o los estudios ultrasonográficos, han desplazado a la arteriografía convencional en la práctica clínica diaria. A pesar de ello, ninguna de estas exploraciones ha demostrado una mayor sensibilidad para el diagnóstico de DAC, por lo que la arteriografía convencional continúa siendo la técnica de referencia3,4.
La trombólisis intravenosa es un tratamiento seguro en la fase aguda del ictus por DAC5–7. Sin embargo, los pacientes con ictus isquémico por DAC tratados con trombólisis sistémica presentan peor evolución clínica por la concurrencia frecuente de oclusiones en tándem de la arteria carótida interna intracraneal y de la arteria cerebral media6,8. La experiencia del tratamiento endovascular (TEV) en el ictus por DAC es escasa9–13 y se desconoce si el beneficio clínico del TEV es superior al de la trombólisis sistémica14,15.
Los centros terciarios de ictus (CTI) están capacitados 24 h al día para el diagnóstico por neuroimagen multimodal de tejido isquémico viable, el estudio angiográfico cerebral y el uso de sistemas de extracción mecánica de trombo16.
Nuestro objetivo fue determinar si la atención de los pacientes con ictus en un CTI facilita el diagnóstico de DAC y modifica su evolución funcional.
Pacientes y métodosSe ha estudiado retrospectivamente a los pacientes con ictus isquémico agudo por DAC diagnosticados en el Hospital Germans Trias i Pujol (HGTiP) e incluidos de forma prospectiva en el registro de ictus de la Sociedad Española de Neurología entre octubre del 2004 y junio del 201217.
En marzo del 2008, el HGTiP activó un equipo de guardia localizable en llamada 24 h al día, formado por un neurorradiólogo intervencionista, un neurólogo especializado en enfermedad vascular cerebral, enfermería especializada y anestesiólogo, la disponibilidad continuada de una sala de neuro-angiorradiología y la aplicación de protocolos específicos de diagnóstico y TEV en la fase aguda del ictus16. Esta organización funcional fue homologada por el Departament de Salut como CTI.
Los pacientes se clasificaron en 2 grupos según el periodo de atención: pre-CTI (octubre 2004-marzo 2008, 42 meses) o post-CTI (abril 2008-junio 2012, 51 meses).
Evaluación clínicaTodos los pacientes fueron evaluados por neurólogos a su admisión en urgencias e ingresados en una unidad de ictus. Se recogieron los datos demográficos, los factores de riesgo vascular, los signos vitales al ingreso, y el tiempo desde el inicio de los síntomas (o desde el último momento asintomático en casos de ictus del despertar o de cronología incierta) hasta la atención neurológica, y se valoró la gravedad neurológica mediante la puntuación en la escala National Institute of Health Stroke Scale (NIHSS). Se consideró mejoría neurológica precoz una disminución de 4 puntos o una puntuación de 0 o 1 en la NIHSS en las primeras 24 h y mejoría neurológica dramática una disminución de 10 puntos o una puntuación de 0 o 1 en la NIHSS en el mismo periodo de tiempo. Los pacientes con NIHSS de 0 o 1 en la valoración inicial no se incluyeron en el análisis para valorar la mejoría neurológica precoz o dramática. Se definió la variable «grado de mejoría neurológica a los 7 días» como la diferencia entre la NIHSS basal y la NIHSS a los 7 días. El pronóstico funcional de los pacientes fue evaluado al alta y a los 90 días del ictus mediante la modified Rankin Scale (mRS), definiendo como buen pronóstico funcional una puntuación en la mRS ≤ 2.
Protocolo diagnóstico y terapéuticoLa atención aguda se realizó siguiendo las recomendaciones de la European Stroke Organisation18. Los pacientes atendidos en ventana terapéutica para trombólisis sistémica fueron evaluados mediante una TC craneal simple y eco-Doppler de troncos supraaórticos y transcraneal, mientras que los pacientes atendidos fuera de ventana terapéutica para trombólisis sistémica fueron evaluados mediante una RM multimodal con angio-RM intracraneal o mediante una TC craneal simple y eco-Doppler de troncos supraaórticos si la RM no estaba disponible.
Se administró tratamiento trombolítico por vía intravenosa a la dosis estándar de 0,9mg/kg en los pacientes sin contraindicaciones para su administración si el tiempo de evolución de los síntomas era inferior a 3 h hasta noviembre del 2008, ampliándose la ventana terapéutica hasta las 4,5 h a partir de diciembre del 2008 tras la publicación de los resultados del estudio ECASS-319.
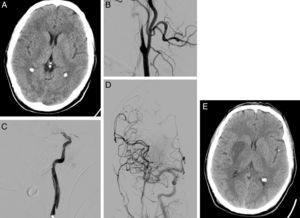
Tras la implementación del CTI, en marzo del 2008, se indicó angiografía diagnóstica y TEV en aquellos pacientes con oclusión arterial de gran vaso con contraindicación para la trombólisis por vía intravenosa o en aquellos en los que no se había conseguido la recanalización arterial con el rtPA intravenoso, siempre y cuando se demostrara la presencia de tejido isquémico viable en la neuroimagen realizada previamente (ASPECTS ≥ 7 en la TC o lesión < 50% del territorio arterial afectado en la secuencia de DWI en la RM sin lesión establecida en FLAIR). Se realizó trombectomía mecánica en los pacientes con oclusión de una arteria intracraneal accesible. En aquellos pacientes con oclusiones en tándem (arteria extracraneal y arteria intracraneal), se intentó inicialmente atravesar la oclusión/estenosis proximal para realizar posteriormente una trombectomía mecánica en la oclusión arterial intracraneal y, por último, tratar la oclusión/estenosis proximal mediante la colocación de un stent en el caso de que fuera necesario (fig. 1). Se excluyó del TEV a los pacientes con oclusión de la arteria carótida extracraneal sin oclusión intracraneal en tándem.
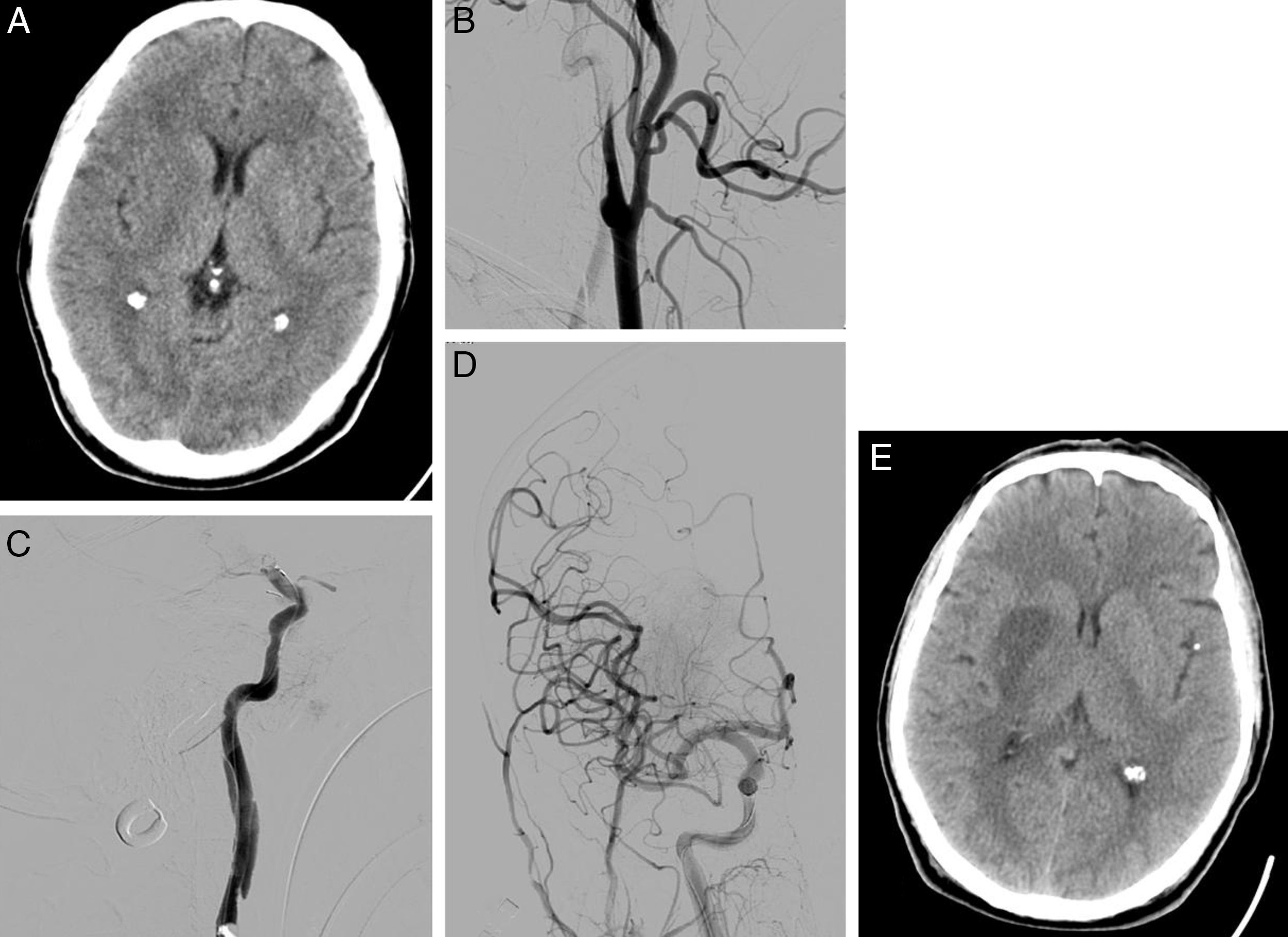
Varón de 58 años que consulta por disartria y hemiparesia izquierda, puntuando NIHSS 14. En la TC craneal se aprecia borramiento del lenticular e ínsula derecha puntuando ASPECTS de 8 (A). En la arteriografía basal se observa oclusión de la arteria carótida interna derecha, con imagen típica de disección en «pico de flauta» (B). Tras atravesar la oclusión carotídea, se objetiva oclusión en el segmento M1 de arteria cerebral media derecha (C). Se realiza una trombectomía mecánica de la oclusión intracraneal y se coloca un stent en la estenosis carotídea, consiguiendo recanalización completa en la arteriografía de control (D). En la TC craneal de control (24h), se aprecia infarto en territorio profundo de la arteria cerebral media derecha (E).
En los pacientes no candidatos a tratamiento de revascularización (por vía intravenosa o endovascular), se indicó tratamiento antitrombótico antiagregante o anticoagulante en función de las características clínicas del paciente, gravedad neurológica y tamaño del infarto cerebral.
El diagnóstico etiológico de confirmación de DAC se estableció ante la sospecha clínica y la realización de una arteriografía convencional o de RM craneal. Los hallazgos que se consideraron diagnósticos fueron la presencia de un flap intimal, una imagen de doble luz, una estenosis u oclusión afilada «en pico de flauta» o «en llama», el estrechamiento irregular de la arteria o un aneurisma disecante en la arteriografía o en la secuencia angiográfica de la RM craneal, o una imagen de semiluna adyacente a la luz vascular en los cortes axiales de las secuencias T1 con supresión grasa de la RM craneal. Se consideró que el diagnóstico de DAC se realizó en fase aguda cuando la prueba de neuroimagen que confirmó el diagnóstico se realizó durante las primeras 24 h desde el inicio de la clínica o durante la arteriografía diagnóstica previa al tratamiento de revascularización.
Análisis estadísticoLas variables continuas se expresaron como media ± desviación estándar si seguían una distribución normal, o como mediana y cuartiles si no seguían una distribución normal en nuestra población. Las variables categóricas se expresaron en porcentajes. Tras el análisis descriptivo de todas las variables estudiadas, la significación estadística para diferencias entre grupos se estimó con los test de la chi al cuadrado y estadístico exacto de Fisher para variables categóricas, y t de Student, Mann-Whitney, ANOVA y Kruskal-Wallis para variables continuas. Se consideró presencia de significación estadística aquellos valores de p<0,05.
ResultadosDe un total de 2.853 pacientes con un primer episodio de ictus registrados entre octubre del 2004 y junio del 2012, 35 (1,23%) pacientes presentaron un ictus isquémico por DAC, 9/1094 (0,8%) diagnosticados en la etapa pre-CTI y 26/1245 (2,1%) en la etapa post-CTI (p=0,008). El porcentaje de DAC también fue mayor durante el periodo post-CTI en el subgrupo de pacientes menores de 50 años (4,7% vs. 12%; p=0,068).
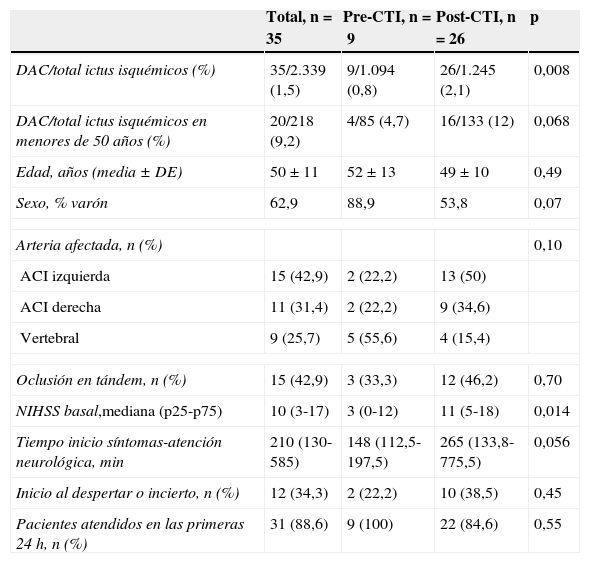
La tabla 1 muestra las características clínicas del total de la población estudiada y por subgrupos según el periodo de estudio. No se observaron diferencias estadísticamente significativas entre ambos grupos en la edad y el sexo, en el tipo de arteria cervical afectada por la disección o en el porcentaje de pacientes con oclusión en tándem, aunque en el periodo pre-CTI el porcentaje de disecciones de la arteria vertebral fue mayor. Notablemente, la gravedad inicial de los pacientes medida por la puntuación en la NIHSS basal y el tiempo desde el inicio de los síntomas hasta la atención neurológica en el HGTiP fue mayor en el grupo post-CTI.
Características basales de los pacientes con DAC en cada periodo
| Total, n=35 | Pre-CTI, n=9 | Post-CTI, n=26 | p | |
|---|---|---|---|---|
| DAC/total ictus isquémicos (%) | 35/2.339 (1,5) | 9/1.094 (0,8) | 26/1.245 (2,1) | 0,008 |
| DAC/total ictus isquémicos en menores de 50 años (%) | 20/218 (9,2) | 4/85 (4,7) | 16/133 (12) | 0,068 |
| Edad, años (media ± DE) | 50±11 | 52±13 | 49±10 | 0,49 |
| Sexo, % varón | 62,9 | 88,9 | 53,8 | 0,07 |
| Arteria afectada, n (%) | 0,10 | |||
| ACI izquierda | 15 (42,9) | 2 (22,2) | 13 (50) | |
| ACI derecha | 11 (31,4) | 2 (22,2) | 9 (34,6) | |
| Vertebral | 9 (25,7) | 5 (55,6) | 4 (15,4) | |
| Oclusión en tándem, n (%) | 15 (42,9) | 3 (33,3) | 12 (46,2) | 0,70 |
| NIHSS basal,mediana (p25-p75) | 10 (3-17) | 3 (0-12) | 11 (5-18) | 0,014 |
| Tiempo inicio síntomas-atención neurológica, min | 210 (130-585) | 148 (112,5-197,5) | 265 (133,8-775,5) | 0,056 |
| Inicio al despertar o incierto, n (%) | 12 (34,3) | 2 (22,2) | 10 (38,5) | 0,45 |
| Pacientes atendidos en las primeras 24 h, n (%) | 31 (88,6) | 9 (100) | 22 (84,6) | 0,55 |
ACI: arteria carótida interna.
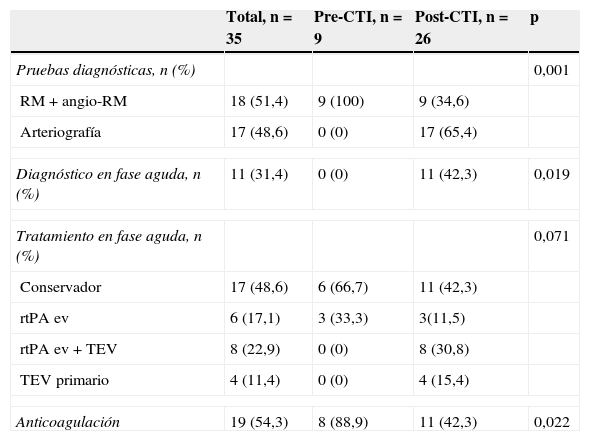
En la tabla 2 se muestran los procedimientos diagnósticos y los tratamientos de revascularización realizados en función del periodo de estudio. El diagnóstico de confirmación de DAC en el grupo pre-CTI se realizó siempre mediante RM y en ningún caso durante la fase aguda del ictus. Sin embargo, en el grupo post-CTI el diagnóstico de DAC se confirmó mediante arteriografía en 17 pacientes (65,4%) y en 11 de ellos (42,3%) durante la fase aguda del ictus. Del mismo modo, la implementación del CTI comportó un cambio en el tratamiento del ictus por DAC, de manera que el 57,7% de los pacientes del periodo post-CTI fueron tratados con alguna terapia de revascularización cerebral en la fase aguda frente al 33,3% en el grupo pre-CTI, y recibieron TEV en el 46,2% frente a un 0%, respectivamente. La indicación de tratamiento anticoagulante como prevención secundaria tras un ictus por DAC fue significativamente menor tras la implementación del CTI.
Variables relacionadas con el diagnóstico y el tratamiento de la DAC en cada periodo
| Total, n=35 | Pre-CTI, n=9 | Post-CTI, n=26 | p | |
|---|---|---|---|---|
| Pruebas diagnósticas, n (%) | 0,001 | |||
| RM+angio-RM | 18 (51,4) | 9 (100) | 9 (34,6) | |
| Arteriografía | 17 (48,6) | 0 (0) | 17 (65,4) | |
| Diagnóstico en fase aguda, n (%) | 11 (31,4) | 0 (0) | 11 (42,3) | 0,019 |
| Tratamiento en fase aguda, n (%) | 0,071 | |||
| Conservador | 17 (48,6) | 6 (66,7) | 11 (42,3) | |
| rtPA ev | 6 (17,1) | 3 (33,3) | 3(11,5) | |
| rtPA ev+TEV | 8 (22,9) | 0 (0) | 8 (30,8) | |
| TEV primario | 4 (11,4) | 0 (0) | 4 (15,4) | |
| Anticoagulación | 19 (54,3) | 8 (88,9) | 11 (42,3) | 0,022 |
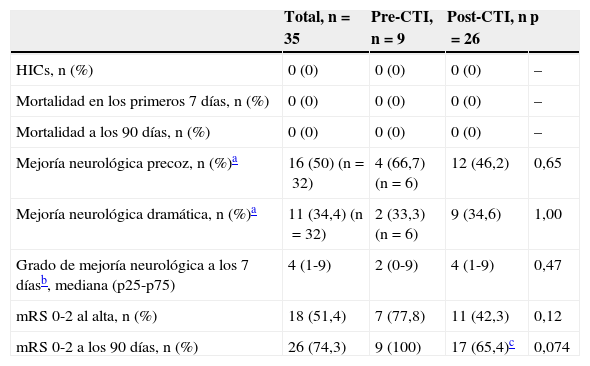
La tabla 3 muestra las principales variables de seguridad y eficacia según el periodo de estudio. Aunque la gravedad neurológica inicial de los pacientes en el periodo post-CTI fue significativamente mayor, la presencia de transformación hemorrágica sintomática del infarto, la mortalidad precoz y tardía, y el porcentaje de pacientes con independencia funcional al alta o a los 90 días no mostró diferencias entre ambos grupos. Tampoco hubo diferencias en el grado de mejoría neurológica a los 7 días según el periodo en que fueron atendidos.
Seguridad y pronóstico funcional de los pacientes con DAC en cada periodo
| Total, n=35 | Pre-CTI, n=9 | Post-CTI, n=26 | p | |
|---|---|---|---|---|
| HICs, n (%) | 0 (0) | 0 (0) | 0 (0) | – |
| Mortalidad en los primeros 7 días, n (%) | 0 (0) | 0 (0) | 0 (0) | – |
| Mortalidad a los 90 días, n (%) | 0 (0) | 0 (0) | 0 (0) | – |
| Mejoría neurológica precoz, n (%)a | 16 (50) (n=32) | 4 (66,7) (n=6) | 12 (46,2) | 0,65 |
| Mejoría neurológica dramática, n (%)a | 11 (34,4) (n=32) | 2 (33,3) (n=6) | 9 (34,6) | 1,00 |
| Grado de mejoría neurológica a los 7 díasb, mediana (p25-p75) | 4 (1-9) | 2 (0-9) | 4 (1-9) | 0,47 |
| mRS 0-2 al alta, n (%) | 18 (51,4) | 7 (77,8) | 11 (42,3) | 0,12 |
| mRS 0-2 a los 90 días, n (%) | 26 (74,3) | 9 (100) | 17 (65,4)c | 0,074 |
HICs: hemorragia intracraneal sintomática
De los 35 pacientes diagnosticados de DAC, en 17 se adoptó una actitud conservadora, 6 recibieron trombólisis sistémica y en 12 se indicó TEV, en 8 de rescate tras trombólisis sistémica y en 4 TEV primario. Finalmente, en 4 pacientes se adoptó una actitud conservadora tras la arteriografía basal por presentar una oclusión intracraneal en ramas distales o por buena compensación de la circulación intracraneal sin oclusión en tándem y en 2 pacientes no se pudo realizar TEV por presentar una oclusión no accesible al no lograr cateterizar la luz verdadera. Las características clínicas de los pacientes con DAC según el tipo de tratamiento indicado se muestran en la tabla 4. Los pacientes tratados con trombólisis sistémica aislada presentaron una gravedad inicial similar (NIHSS 12 [7-18] frente a 15 [11-20]; p=0,28) y no mostraron diferencias en la evolución neurológica precoz (al alta) o tardía (a los 90 días) en comparación con aquellos que fueron sometidos a TEV primario o de rescate.
Características basales y variables de pronóstico según el tratamiento recibido en la totalidad de la población
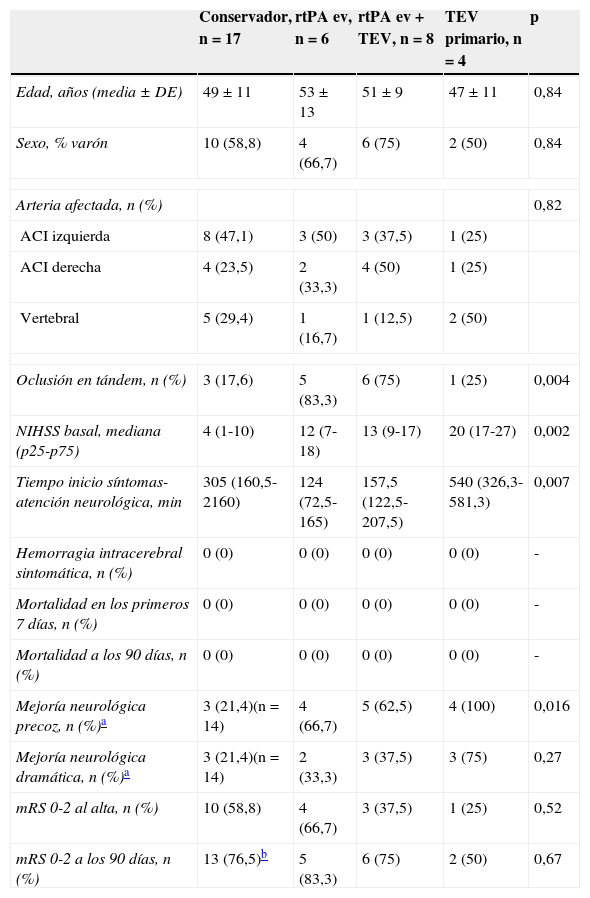
| Conservador, n=17 | rtPA ev, n=6 | rtPA ev+TEV, n=8 | TEV primario, n=4 | p | |
|---|---|---|---|---|---|
| Edad, años (media ± DE) | 49±11 | 53±13 | 51±9 | 47±11 | 0,84 |
| Sexo, % varón | 10 (58,8) | 4 (66,7) | 6 (75) | 2 (50) | 0,84 |
| Arteria afectada, n (%) | 0,82 | ||||
| ACI izquierda | 8 (47,1) | 3 (50) | 3 (37,5) | 1 (25) | |
| ACI derecha | 4 (23,5) | 2 (33,3) | 4 (50) | 1 (25) | |
| Vertebral | 5 (29,4) | 1 (16,7) | 1 (12,5) | 2 (50) | |
| Oclusión en tándem, n (%) | 3 (17,6) | 5 (83,3) | 6 (75) | 1 (25) | 0,004 |
| NIHSS basal, mediana (p25-p75) | 4 (1-10) | 12 (7-18) | 13 (9-17) | 20 (17-27) | 0,002 |
| Tiempo inicio síntomas-atención neurológica, min | 305 (160,5-2160) | 124 (72,5-165) | 157,5 (122,5-207,5) | 540 (326,3-581,3) | 0,007 |
| Hemorragia intracerebral sintomática, n (%) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | - |
| Mortalidad en los primeros 7 días, n (%) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | - |
| Mortalidad a los 90 días, n (%) | 0 (0) | 0 (0) | 0 (0) | 0 (0) | - |
| Mejoría neurológica precoz, n (%)a | 3 (21,4)(n=14) | 4 (66,7) | 5 (62,5) | 4 (100) | 0,016 |
| Mejoría neurológica dramática, n (%)a | 3 (21,4)(n=14) | 2 (33,3) | 3 (37,5) | 3 (75) | 0,27 |
| mRS 0-2 al alta, n (%) | 10 (58,8) | 4 (66,7) | 3 (37,5) | 1 (25) | 0,52 |
| mRS 0-2 a los 90 días, n (%) | 13 (76,5)b | 5 (83,3) | 6 (75) | 2 (50) | 0,67 |
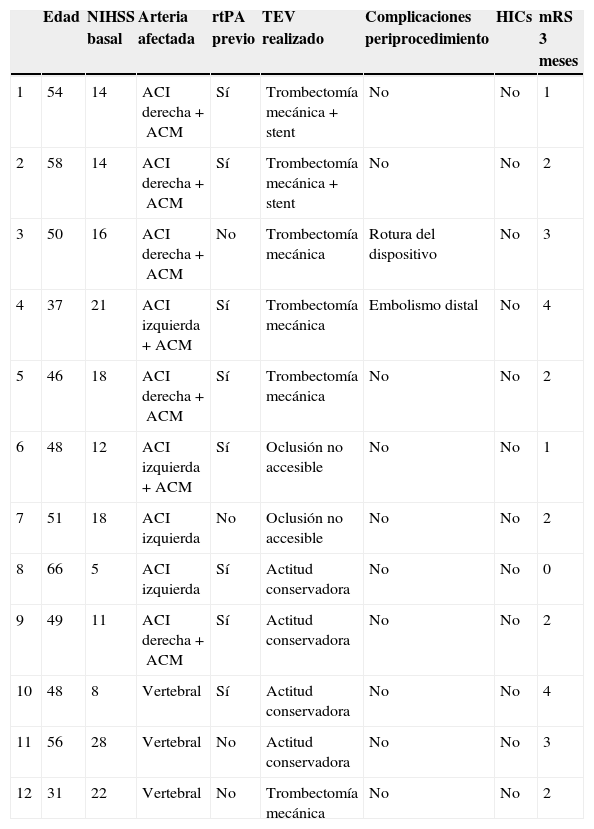
En los 6 pacientes en los que finalmente se realizó TEV, se practicó trombectomía mecánica de la oclusión distal a la DAC y en 2 casos se colocó además un stent en la arteria proximal afectada por la DAC. Dos pacientes presentaron complicaciones en relación con el procedimiento (un embolismo distal en territorio de la arteria cerebral anterior y una rotura del dispositivo) y 4 presentaron evolución neurológica favorable con independencia funcional al tercer mes. De los 6 pacientes en los que la oclusión no fue accesible o se adoptó una actitud conservadora, 4 evolucionaron de forma favorable a los 90 días (tabla 5).
Pacientes con DAC sometidos a TEV primario o de rescate en nuestro CTI
| Edad | NIHSS basal | Arteria afectada | rtPA previo | TEV realizado | Complicaciones periprocedimiento | HICs | mRS 3 meses | |
|---|---|---|---|---|---|---|---|---|
| 1 | 54 | 14 | ACI derecha+ACM | Sí | Trombectomía mecánica+stent | No | No | 1 |
| 2 | 58 | 14 | ACI derecha+ACM | Sí | Trombectomía mecánica+stent | No | No | 2 |
| 3 | 50 | 16 | ACI derecha+ACM | No | Trombectomía mecánica | Rotura del dispositivo | No | 3 |
| 4 | 37 | 21 | ACI izquierda+ACM | Sí | Trombectomía mecánica | Embolismo distal | No | 4 |
| 5 | 46 | 18 | ACI derecha+ACM | Sí | Trombectomía mecánica | No | No | 2 |
| 6 | 48 | 12 | ACI izquierda+ACM | Sí | Oclusión no accesible | No | No | 1 |
| 7 | 51 | 18 | ACI izquierda | No | Oclusión no accesible | No | No | 2 |
| 8 | 66 | 5 | ACI izquierda | Sí | Actitud conservadora | No | No | 0 |
| 9 | 49 | 11 | ACI derecha+ACM | Sí | Actitud conservadora | No | No | 2 |
| 10 | 48 | 8 | Vertebral | Sí | Actitud conservadora | No | No | 4 |
| 11 | 56 | 28 | Vertebral | No | Actitud conservadora | No | No | 3 |
| 12 | 31 | 22 | Vertebral | No | Trombectomía mecánica | No | No | 2 |
HICs: hemorragia intracerebral sintomática.
La implementación de un CTI se asoció a un aumento en la frecuencia del diagnóstico de ictus isquémicos por DAC. La incidencia de ictus por DAC en el periodo post-CTI (2,1% del global de pacientes y 12% de los menores de 50 años) es similar a la publicada en la literatura1,2; este resultado indica que esta afección pudo haber sido infradiagnosticada en el periodo pre-CTI en nuestro centro. El incremento en el diagnóstico de DAC en el periodo post-CTI cabe atribuirlo al desarrollo de la guardia específica de neurorradiología intervencionista 24 h al día y al uso de la arteriografía convencional en fase aguda frente a otros métodos diagnósticos menos sensibles3.
Además, gracias a la mayor especialización16, el periodo post-CTI se asoció a la atención de pacientes con ictus por DAC de mayor gravedad, y con tiempo de evolución más prolongado al aplicar protocolos diagnósticos de neuroimagen multimodal en la selección de pacientes con ictus del despertar o de cronología incierta para terapias de revascularización en fase aguda20,21.
No se observaron diferencias entre ambos periodos de estudio en la frecuencia de mejoría neurológica precoz, hemorragia intracraneal sintomática, mortalidad ni en la evolución funcional, a pesar de que los pacientes atendidos en la etapa post-CTI presentaban un mayor tiempo de evolución desde el inicio de los síntomas y mayor gravedad inicial. La implementación del CTI se asoció a un aumento de las terapias de revascularización en la fase aguda de los pacientes con ictus y DAC, lo que pudo contribuir a la mejor evolución de pacientes más graves.
En este contexto, en el periodo total del estudio, la frecuencia de mejoría neurológica precoz fue mayor en los pacientes sometidos a terapias de revascularización en comparación con los que recibieron tratamiento conservador. El escaso número de pacientes estudiados, la mayor gravedad neurológica basal y la mayor proporción de oclusiones en tándem en los pacientes sometidos a tratamiento de revascularización pudieron diluir su efecto favorable sobre otras variables evolutivas que no mostraron diferencias significativas en comparación con los pacientes a los que se les aplicó un tratamiento conservador.
En nuestra serie, el TEV no comportó un claro beneficio clínico respecto al tratamiento con trombólisis por vía intravenosa aislada, a diferencia de lo reportado por otros autores14. Es importante destacar, no obstante, que los pacientes con DAC tratados con TEV primario en nuestro centro presentaban un tiempo de evolución desde el inicio de los síntomas superior a las 4,5 h y que, por tanto, habrían recibido tratamiento conservador en el periodo pre-CTI.
El TEV del ictus causado por DAC puede comportar una mayor dificultad técnica que en el ictus de otras etiologías. Así, solo en un 3,9% del total de pacientes de nuestro registro con ictus isquémico que recibieron TEV (n=231) no se pudo acceder a la oclusión por problemas técnicos, mientras que esto ocurrió en 2/8 (25%) de los pacientes con DAC en los que se decidió TEV. Esta dificultad que supone el tratamiento de un paciente con estenosis u oclusión por DAC radica en la correcta identificación y cateterización de la luz verdadera y es un aspecto que no se trata de forma explícita en la literatura, aunque sí existen algunos artículos que mencionan el fracaso del procedimiento sin especificar el motivo del mismo13,22. Así pues, teniendo en cuenta la dificultad técnica añadida al procedimiento en los pacientes con DAC, en los casos en los que la arteria intracraneal está permeable o se prevé inaccesible y la gravedad neurológica es leve-moderada parece prudente mantener una actitud conservadora. En nuestra serie, 2 de los 4 pacientes en los que se decidió tratamiento conservador tras la realización de la arteriografía diagnóstica por buena compensación intracraneal o por presentar una oclusión intracraneal muy distal presentaron una evolución neurológica favorable.
Nuestro estudio presenta algunas limitaciones importantes. En primer lugar, el hecho de que en nuestro protocolo de imagen no se contemple la utilización de la TC multimodal en la fase aguda del ictus, a diferencia de lo que sucede en la mayoría de centros en nuestro país, podría haber contribuido a que no se realizaran diagnósticos de DAC en las primeras 24 h desde el inicio del ictus durante la etapa pre-CTI. En segundo lugar, el reducido tamaño muestral confiere baja potencia estadística y dificulta que podamos encontrar diferencias que pudieran existir entre los diferentes grupos. Por último, al ser nuestro estudio observacional, no nos permite extraer conclusiones acerca de la relación causal entre el tratamiento recibido y pronóstico funcional, ya que las características pronósticas basales no eran homogéneas entre ambos periodos de estudio.
En conclusión, los resultados de nuestro estudio indican que la implementación del CTI incrementa el número de pacientes diagnosticados de DAC como causa del ictus isquémico y permite aumentar las opciones terapéuticas en fase aguda de estos pacientes. En la fase aguda de un ictus por DAC el TEV es factible y seguro, sin embargo, tal y como sucede en el resto de los ictus isquémicos por otras etiologías según los últimos trabajos publicados23–25, no se observa un beneficio del TEV frente a la trombólisis sistémica, por lo que se necesitan estudios controlados para evaluar su impacto en el beneficio clínico de estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo fue presentado como comunicación oral en la LXIV Reunión Anual de la Sociedad Española de Neurología que se celebró en noviembre del 2012 en Barcelona.