La granulomatosis linfomatoide es un proceso linfoproliferativo de linfocitos B asociado al virus de Epstein-Barr (VEB), rodeado por un infiltrado de linfocitos T reactivos, con un patrón angiocéntrico y angiodestructivo1-3. Excepcionalmente, puede darse de forma aislada en el sistema nervioso central (SNC)3-5.
Presentamos el caso de una mujer de 56 años, que consultó por episodios repetidos de disartria transitoria. Como antecedentes destacaban hipertensión arterial, dislipidemia e insuficiencia renal crónica). Había sido receptora de trasplante renal, en tratamiento inmunosupresor desde 1981 y en la actualidad con prednisona (5mg/24h), tacrolimus (2mg/24h) y micofenolato-mofetilo (360mg/12h). La tomografía computarizada (TC) cerebral urgente objetivó una lesión hipodensa frontal izquierda. Durante el ingreso, presentó episodios de clonias periorales bilaterales y anartria, sugestivos de crisis epilépticas operculares, por lo que se inició levetiracetam (500mg/12h). Además, se constató un fracaso del injerto, por lo que se reinició la hemodiálisis. La resonancia magnética cerebral (fig. 1) demostró una lesión corticosubcortical frontal izquierda, edema vasogénico y captación anular de contraste: se planteó el diagnóstico diferencial entre proceso infeccioso o neoplásico. Se inició antibioticoterapia empírica y se suspendió el tratamiento inmunosupresor. La TC-body y la PET-TC-body fueron normales. Se realizó una punción lumbar con bioquímica normal, inmunofenotipo, citología y microbiología negativos, en la que se incluyó criptococo, veneral disease research laboratory, reacción en cadena de la polimerasa de toxoplasma, listeria, virus John Cunningham y cultivo de hongos y micobacterias. La paciente permaneció asintomática tras iniciar un antiepiléptico. Tras 21 días de antibioticoterapia, se observó mejoría radiológica (fig. 1). Dos meses después, presentó un empeoramiento progresivo del habla, dificultad para nominar, paresia facial derecha y clonias faciobraquiales derechas, que precisaron levetiracetam (1.000mg/12h) y lacosamida (50mg/12h) para su control. La resonancia magnética (fig. 1) demostró aumento del tamaño lesional y del edema. La biopsia cerebral (fig. 2) resultó diagnóstica de granulomatosis linfomatoide grado 3. Se repitieron TC-body y PET-TC-body para revalorar enfermedad a distancia, que resultaron normales. Tras valoración multidisciplinar, debido a la fragilidad de la paciente y a la insuficiencia renal crónica, se desestimaron radioterapia y quimioterapia (R-CHOP, rituximab). Se inició tratamiento compasivo con ibrutinib (inhibidor de la tirosincinasa de Bruton) con 560mg/día y buena tolerancia. Tras 8 meses de tratamiento, presentaba mejoría clínica parcial (persistían leve anomia y paresia facial) y radiológica significativa (fig. 1).
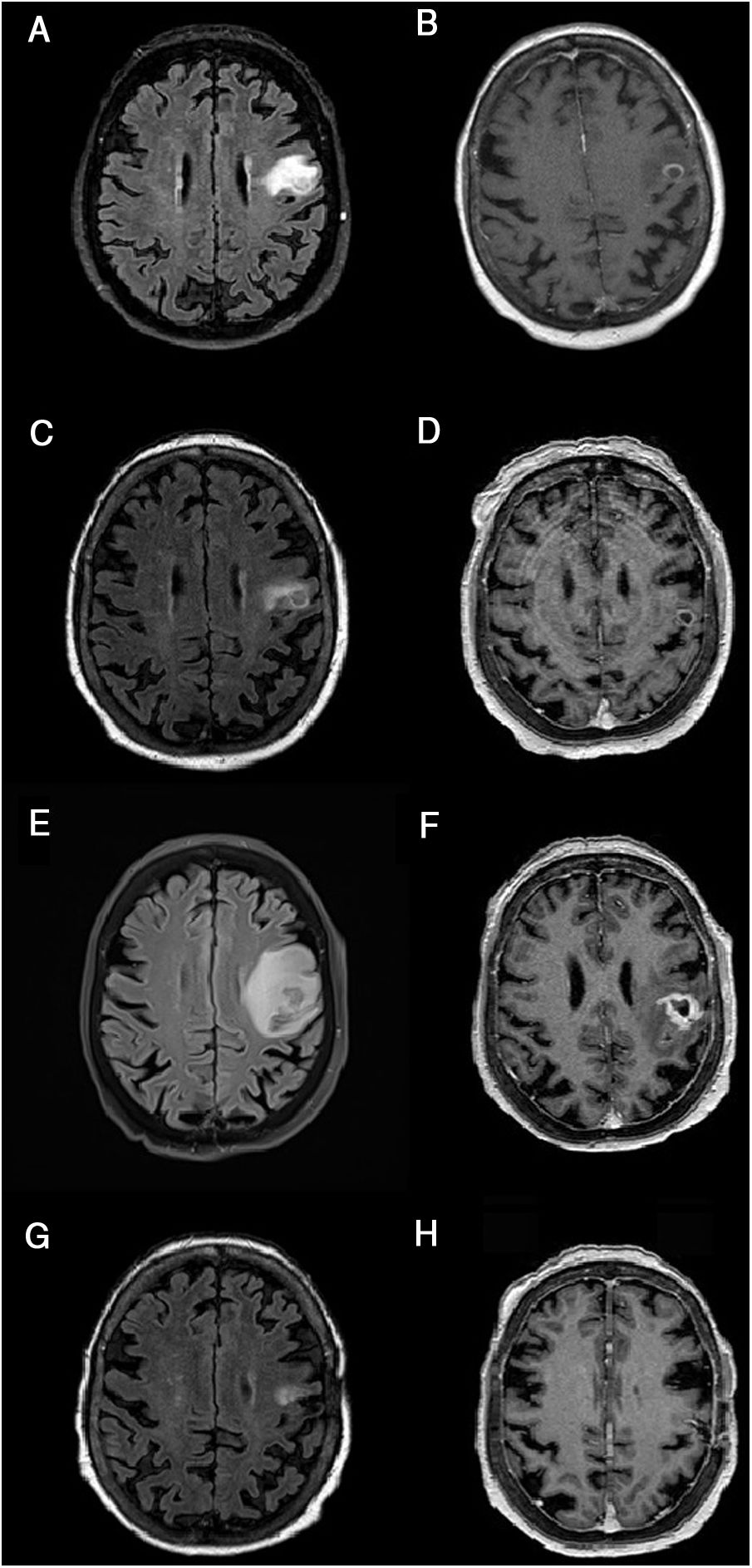
Resonancia magnética cerebral, evolución de la lesión.
A-B) Resonancia magnética cerebral al ingreso. C-D) Tras 21 días de tratamiento. E-F) Tras 2 meses. G-H) Tras 3 meses desde el inicio de tratamiento. Secuencias FLAIR (A, C, E, G) y T1 tras gadolinio (B, D, F, H). Cortes axiales. Las imágenes muestran la evolución de la lesión corticosubcortical localizada en el giro precentral/opérculo frontal izquierdo, redondeada, bien definida, iso- e hiperintensa en secuencias FLAIR (A, C, E, G) e hipointensa en T1 (B, D, F, H), rodeada de edema vasogénico y captación anular de contraste (B, D, F, H). El tamaño de la lesión en el momento del ingreso era de 15 × 12mm (anteroposterior × lateromedial) (A). Tras una discreta reducción inicial del tamaño lesional a 12 × 7,5mm y una mejoría significativa del edema perilesional (C), habiendo persistido sin apenas variación la captación de contraste en anillo (D), se objetiva un marcado crecimiento de la lesión nodular hasta 16 × 16mm y un aumento importante del edema vasogénico (E) respecto al estudio previo (D). La lesión evolucionó también en morfología (más abigarrada y heterogénea) (D) y con una captación de contraste más extensa e irregular (F). Tras 3 meses desde el inicio del tratamiento con ibrutinib, se objetivó una mejoría significativa, con reducción de la lesión y mejoría del edema (G), así como una disminución de la captación de contraste, apenas perceptible (H). Se observaron cambios poscraneotomía (biopsia) (G, H).
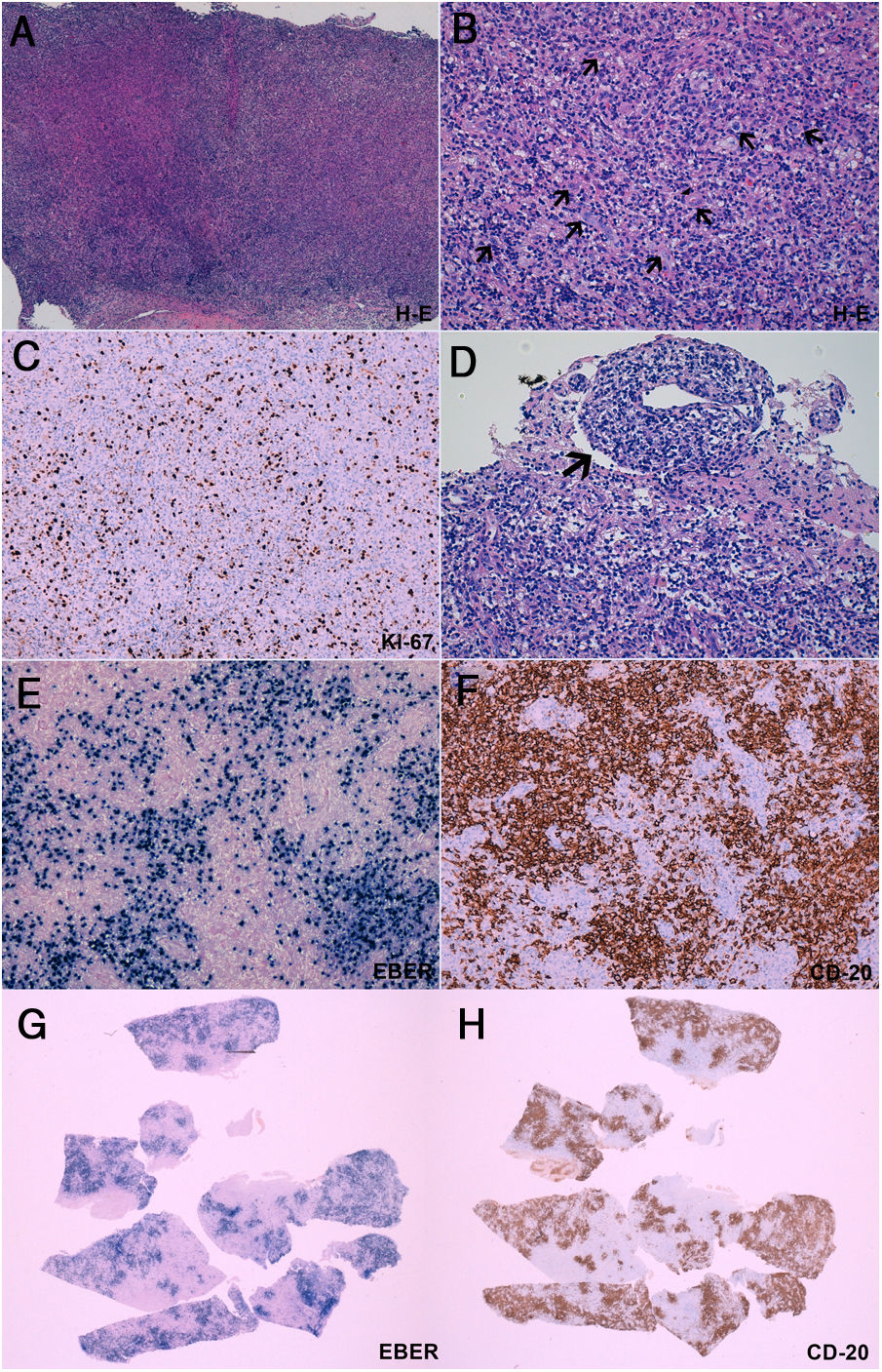
Biopsia cerebral
A-B) La tinción con hematoxilina-eosina demuestra un intenso infiltrado inflamatorio polimorfo de linfocitos, células plamáticas e histiocitos. Entremezcladas con el infiltrado inflamatorio, se identifican células grandes y atípicas (B, flechas), algunas de ellas en íntima relación a vasos sanguíneos (B, cabeza de flecha). C) El índice proliferativo es superior al 40%, determinado por el marcador inmunohistoquímico Ki67. Estas células tienden a formar agregados de >50 células (B) y tienen un carácter angiocéntrico y angiodestructivo (D). Mediante técnicas de inmunohistoquímica (E, F, G, H) se observa que dichas células atípicas expresan los marcadores CD20 (presente en linfocitos B) y EBER (micro-ARN de Epstein-Barr, indicador de infección por el virus de Epstein-Barr). Mediante una comparación de cortes histológicos a bajo aumento, se observa la práctica superposición de las células con expresión de EBER y CD20 (G, H). En conjunto, estos datos son diagnósticos de un proceso linfoproliferativo B asociado al virus de Epstein-Barr, compatible con granulomatosis linfomatoide grado 3.
La granulomatosis linfomatoide corresponde a una subclase de tumor de células B maduras6 muy infrecuente1,2,5,7. Es más común en hombres entre los 40 y los 60 años1-5,7. Habitualmente afecta a inmunodeprimidos1,2,7, aunque también puede darse en inmunocompetentes2,4,5. Es un proceso linfoproliferativo de linfocitos B atípicos que expresan proteínas del VEB1,2,7,8, carcinógeno implicado en el desarrollo de diferentes neoplasias linfoproliferativas9. Aunque se desconoce la relación fisiopatológica exacta entre el VEB y la granulomatosis linfomatoide, se cree que la reactivación de la infección latente facilitada por la inmunodepresión estimula la expresión de oncogenes y, estos, la linfoproliferación1,4. Los agregados linfocitarios se distribuyen rodeando un centro necrótico, debido a su comportamiento angiocéntrico y angiodestructivo1,7,8. Según la extensión del área necrótica (ausente, parcheada, extensa) y el número de linfocitos B positivos para el VEB (<5,5-20,>20/campo), la granulomatosis linfomatoide se clasifica en 3grados1,3,7,8. Los grados 1 y 2, considerados como linfoma indolente, pueden mejorar con corticoides2. El grado 3 tiene mal pronóstico, es equivalente al linfoma B difuso de célula grande y precisa un tratamiento intensivo con quimioterapia ± radioterapia1-3. El órgano más frecuentemente afectado es el pulmón (90%)1-3. La diseminación secundaria al SNC no es infrecuente (25-30%)1,3, pero la afectación primaria y aislada del SNC es excepcional: apenas se han reportado 49 casos2-5. Las formas no pulmonares, por ser atípicas, suelen tener mayor demora diagnóstica, lo que puede tener consecuencias pronósticas, ya que las formas de bajo grado pueden evolucionar a formas agresivas1,10. Por ello, los neurólogos debemos conocer esta entidad. En pacientes trasplantados, la granulomatosis linfomatoide debe diferenciarse del proceso linfoproliferativo postrasplante, proliferación de linfocitos B asociada también al VEB, pero que carece de infiltrado de linfocitos T reactivos y de necrosis2,4,8,11,12. En pacientes inmunocompetentes, la granulomatosis linfomatoide (lesión de componente necrótico) puede confundirse con el glioblastoma multiforme. Las formas de presentación troncoencefálica pueden ser indistinguibles del CLIPPERS13. Estas similitudes entre la granulomatosis linfomatoide y otras enfermedades aumentan aún más el reto diagnóstico. En nuestro caso, la insuficiencia renal crónica y la limitación de la barrera hematoencefálica para la difusión farmacológica constituyeron, además, un reto terapéutico. Ibrutinib, actualmente en investigación en ensayos clínicos como tratamiento del linfoma primario del SNC14, fue iniciado como tratamiento compasivo por su amplia difusión al SNC y escasa eliminación renal15. Este es el primer caso de granulomatosis linfomatoide primaria del SNC tratado con ibrutinib, el cual podría ser una alternativa terapéutica en caso de contraindicación para R-CHOP en futuros pacientes.
Nuestro caso tiene como particularidades la afectación aislada y primaria del SNC y la terapia con ibrutinib. Para facilitar el diagnóstico de la granulomatosis linfomatoide, es importante dar a conocer esta entidad entre los neurólogos.
DeclaracionesTodos los autores han contribuido intelectualmente en la realización del trabajo y han aprobado la versión final.
El trabajo respeta la confidencialidad y el anonimato de la paciente.
Conflicto de interesesNo existe conflicto de intereses.
Quisiéramos mostrar nuestro sincero agradecimiento a la Dra. Zaldumbide Dueñas (Servicio de Anatomía Patológica, Hospital Universitario de Cruces) por su colaboración incesante con el Servicio de Neurología, particularmente en este caso por sus explicaciones referentes a la anatomía patológica y la facilitación de las imágenes, y por estar siempre abierta a la colaboración entre nuestros servicios.