La demencia con cuerpos de Lewy (DCLw) es la segunda causa más frecuente de demencia degenerativa tras la demencia tipo Alzheimer (DTA). En esta entidad se ha descrito una denervación simpática cardíaca posganglionar, que puede cuantificarse mediante la gammagrafía miocárdica con MIBG (metayodobencilguanidina). El objetivo de nuestro trabajo fue evaluar retrospectivamente la captación miocárdica de MIBG, expresada cuantitativamente como el índice corazón/mediastino a las 4h (ICM) en pacientes con sospecha clínica de DCLw, y examinar su relación con los datos clínicos y paraclínicos.
Pacientes y métodosSe revisaron retrospectivamente datos de 77 pacientes con sospecha clínica de DCLw evaluados entre septiembre de 2005 y junio de 2008 en nuestro hospital a los que se les había realizado una gammagrafía miocárdica con MIBG. Se aplicaron los criterios internacionales de consenso para dividir la muestra en DCLw probable, DCLw posible y sin DCLw. Se analizaron el ICM en cada grupo y su relación con variables clínicas y neuropsicológicas. A un subgrupo de pacientes se le había realizado además un SPECT con FP-CIT (fluoropropil-carbometoxi-3β-4-yodofeniltropano) como parte de la evaluación.
ResultadosLos valores medios de ICM fueron significativamente menores en el grupo de DCLw probable que en los grupos de DCLw posible y sin DCLw. Valores disminuidos de ICM solamente se asociaron a una captación disminuida en el estriado en el FP-CIT SPECT, pero no a ninguna variable clínica ni neuropsicológica.
ConclusionesLa captación miocárdica reducida de MIBG es una medida robusta en la DCLw, y no se ve afectada por condiciones médicas o el estadio de la enfermedad. Una disminución en la captación miocárdica de MIBG se asocia a la degeneración nigroestriada en la DCLw.
Lewy body dementia (LBD) is the second most common cause of neurodegenerative dementia after Alzheimer's disease (AD). A cardiac post-ganglionic sympathetic denervation has been described in this condition which can be quantified by MIBG (metaiodobenzylguanidine) myocardial scintigraphy. The aim of our work was to retrospectively evaluate cardiac MIBG uptake (expressed as the heart-to-mediastinum ratio at 4h (HMR) in patients with suspected LBD, and to examine its relationship with clinical and para-clinical data.
Material and methodsA total of 77 patients with clinical suspicion of LBD evaluated at our centre between September 2005 and June 2008 to whom a MIBG myocardial scintigraphy has been performed were retrospectively reviewed. International Consensus Criteria of LBD were applied to divide the sample into probable LBD, possible LBD and non-LBD. HMR values and their relationships with clinical and neuropsychological data were analysed. A subgroup of patients had FP-CIT (fluoropropyl-carbomethoxy-3β-4-iodophenyltropane) SPECT as a part of the evaluation.
ResultsMean HMR values were significantly lower in probable LBD group than in possible LBD and non-LBD groups. Low HMR values were associated only with reduced FP-CIT uptake in the striatum, but not with any clinical or neuropsychological item.
ConclusionsLow MIBG myocardial scintigraphy uptake is a robust measure in LBD, and it is not largely affected by medical conditions, or by the stage of the disease. In LBD reduced MIBG myocardial uptake is associated with nigrostriatal degeneration.
La demencia con cuerpos de Lewy (DCLw) forma parte de un espectro de trastornos degenerativos que comparten la desregulación y la agregación de la alfa-sinucleína1. Anatomopatológicamente se caracterizan por presentar cuerpos y neuritas de Lewy intraneuronales en las zonas límbica y neocortical, pero también en grado variable en el tronco del encéfalo2. Las manifestaciones clínicas de las enfermedades por cuerpos de Lewy incluyen la DCLw, la enfermedad de Parkinson (EP), la EP con demencia (EPD) y el fallo autonómico puro (FAP)1.
La DCLw es la segunda causa de demencia degenerativa tras la demencia tipo Alzheimer (DTA) en ancianos3. Sus manifestaciones clínicas características incluyen fluctuaciones cognitivas, alucinaciones visuales recurrentes y parkinsonismo espontáneo2, y los déficit cognitivos se centran en la memoria, la atención y las funciones ejecutivas y visuoespaciales1. Su diferenciación precoz de las demás demencias, particularmente de la DTA, es importante no sólo porque la DCLw tiene un curso y un pronóstico distintos, sino también para evitar intervenciones farmacológicas iatrogénicas (en concreto se han descrito empeoramientos marcados tras tratamiento con neurolépticos que implican un aumento considerable de la mortalidad)1. Los criterios internacionales de consenso2 permiten el diagnóstico de DCLw en vida con una alta especificidad, aunque con baja sensibilidad, y su principal diagnóstico diferencial es la DTA. Casi un 60% de los pacientes con DTA pueden presentar parkinsonismo leve a moderado durante el curso de la enfermedad4, lo que complica aún más el diagnóstico entre las dos entidades.
Se ha investigado la utilidad de varias técnicas diagnósticas para diferenciar la DCLw de la DTA y otras demencias, incluida la neuroimagen estructural y funcional. No obstante, la sensibilidad de dichas pruebas es muy variable, y sólo la SPECT con fluoropropil-carbometoxi-3β-4-yodofeniltropano (FP-CIT) se incluye como criterio “sugestivo” en los criterios internacionales de consenso2.
En la DCLw, así como en la EP, la EPD y el FAP, existe una disfunción en el sistema autonómico cardiovascular a nivel posganglionar5–7. Esta alteración cardíaca ocurre de forma precoz en la evolución de la enfermedad, incluso precede a la pérdida neuronal en los ganglios simpáticos, y es debida a la presencia de cuerpos de Lewy en el sistema simpático. Se puede cuantificar mediante gammagrafía miocárdica con metayodobencilguanidina (MIBG), y se asocia con una captación disminuida de este radiotrazador en el miocardio, expresada con un índice corazón/mediastino (ICM) reducido. La MIBG es un análogo fisiológico de la noradrenalina, y se almacena en los terminales nerviosos simpáticos. Una captación miocárdica disminuida de MIBG no es un dato específico de la DCLw, ya que en varias enfermedades cardíacas (como la isquemia miocárdica aguda, las miocardiopatías dilatadas e hipertróficas, la insuficiencia cardíaca y las arritmias severas) y en la diabetes mellitus también se puede observar un patrón similar8–13. Una disminución fisiológica del trazador también se puede detectar con el envejecimiento normal8. Algunos fármacos como los antidepresivos tricíclicos, simpaticomiméticos y antihipertensivos también pueden alterar sus resultados14,15.
Varios trabajos han estudiado el papel de la gammagrafía miocárdica con MIBG en el diagnóstico de la DCLw4–7,16–22, y han demostrado una marcada reducción del ICM en la DCLw, comparando a pacientes con DTA con sujetos cognitivamente sanos. Pacientes con EP, DEP y FAP presentan resultados similares que aquellos con DCLw, con un ICM reducido, mientras que los pacientes con otros síndromes parkinsonianos, como la Atrofia multisistémica (AMS), la Parálisis supranuclear progresiva (PSP) y la Degeneración corticobasal (DCB), muestran una captación miocárdica del trazador normal o sólo ligeramente disminuida16,23,24. En los nuevos criterios internacionales de consenso para el diagnóstico de DCLw2, se menciona la gammagrafía miocárdica con MIBG como técnica de soporte para el diagnóstico. No obstante, las correlaciones clínicas de una captación miocárdica reducida de MIBG en la DCLw todavía no han sido bien definidas.
En este estudio, evaluamos el uso de la gammagrafía miocárdica con MIBG en pacientes con sospecha clínica de DCLw. También examinamos la relación de la captación miocárdica de MIBG con los síntomas característicos de la DCLw, los resultados del FP-CIT SPECT y el perfil neuropsicológico de estos pacientes.
Pacientes y métodosPacientesSe revisaron retrospectivamente datos de 77 pacientes con sospecha clínica de DCLw visitados en la Unidad de Memoria del Hospital de la Santa Creu i Sant Pau entre septiembre de 2005 y junio de 2008. Todos los pacientes fueron examinados por un neurólogo con experiencia en enfermedades neurodegenerativas y cumplían criterios de demencia detallados en el Diagnostic and Statistical Manual of Mental Disorders, fourth edition (DSM-IV)25. El neurólogo que visitaba al paciente en la consulta establecía la sospecha clínica de DCLw si éste presentaba, además de demencia, alguno de los signos o síntomas característicos de la entidad. Los datos demográficos recogidos fueron: edad, sexo, hipertensión arterial, diabetes mellitus, dislipemia, ictus y cardiopatía, antecedentes familiares de demencia y tratamiento. El criterio de inclusión en el estudio era haberse realizado una gammagrafía miocárdica con MIBG por sospecha clínica de DCLw.
En la mayoría de los pacientes se realizó un estudio neuropsicológico como parte de su evaluación, que incluía: Mini-Mental State Examination (MMSE)26,27 (puntuación ajustada), escala de demencia de Blessed28, test de denominación de Boston29, fluencias verbales semánticas y fonéticas30, Global Deterioration Scale (GDS)31 e Interview for Deterioration in Daily Life in Dementia (IDDD)32. Sólo se revisaron los estudios neuropsicológicos realizados como máximo 12 meses antes o después de la gammagrafía miocárdica.
Para analizar los resultados, 2 neurólogos aplicaron los criterios internacionales de consenso para DCLw2 de forma independiente y clasificaron los casos en DCLw probable, DCLw posible y sin DCLw. El coeficiente de correlación kappa entre éstos fue 0,63. En los casos en que hubo discordancia entre los 2 neurólogos para clasificar a un paciente, se realizó un diagnóstico de consenso tras revisar y discutir el caso en detalle. Brevemente, se consideró DCLw probable cuando el paciente presentaba dos de los tres criterios esenciales de la enfermedad (fluctuaciones cognitivas, alucinaciones visuales estructuradas y síntomas espontáneos de parkinsonismo) o bien cuando presenteba un criterio esencial y uno o más de los criterios sugestivos (trastorno de la conducta del sueño REM, sensibilidad a neurolépticos severa o reducción de la captación en los ganglios basales demostrada mediante PET o SPECT).
Finalmente, se evaluó la relación entre el ICM con síntomas característicos de DCLw (parkinsonismo espontáneo, alucinaciones visuales, fluctuaciones en el nivel de conciencia y disautonomía) y antecedentes patológicos, resultados de la captación estriatal en el FP-CIT SPECT, fármacos y datos del examen neuropsicológico.
Gammagrafía miocárdica con MIBGTreinta minutos tras el bloqueo tiroideo con la administración oral de 500mg de perclorato potásico, se administraron por vía intravenosa 370MBq de MIBG (GE Healthcare Biosciences). Se adquirieron imágenes planares del tórax a las 4h de la inyección del trazador. Se utilizó una gammacámara (GE Millenium Hawkeye V3) equipada con un colimador de alta resolución y para bajas energías. La ventana de energía de la gammacámara era del 20% centrado en el fotopico de 123I (159 KeV). Las imágenes planares se realizaron en una visión anterior del tórax y se almacenaron en una matriz de 128×128. La actividad miocárdica del trazador MIBG se semicuantificó y se obtuvo el ICM. Éste se calculó tras dibujar regiones de interés sobre el mediastino superior y sobre el ventrículo izquierdo en las imágenes planares obtenidas a las 4 h. Se usó la fórmula ICM=media de actividad/píxel en la región de interés cardíaca / media de actividad/píxel en la región de interés mediastínica. En nuestro centro, el ICM normal para los pacientes mayores de 65 años es > 1,5633.
FP-CIT SPECTPara reducir al máximo la radiación sobre la glándula tiroidea, se procedió en primer lugar a bloquearla con perclorato potásico (500mg, 20min antes de la inyección). Se inyectaron 5mCi (185MBq) de 123I-FP-CIT por vía intravenosa a cada sujeto. La adquisición de las imágenes se inició a las 3h tras la inyección. Para la adquisición de las imágenes se utilizó una gammacámara de 2 cabezales (GE Hawkeye) equipada con colimador de agujeros paralelos para propósitos generales, de alta resolución y para bajas energías, conectada a un ordenador dedicado. La ventana de energía de la gammacámara fue del 20% centrada en el fotopico del 123I (159keV). El SPECT se realizó obteniendo 120 imágenes de 20s cada una, a partir de un recorrido de 360° en órbita circular en modo “parada-disparo”. Todas las proyecciones se almacenaron usando una matriz de 128×128 y se procesaron con un filtro Butterworth. Tras la adquisición de las imágenes, se procedió a la obtención de cortes tomográficos axiales, oblicuos, coronales y sagitales, así como su cuantificación. Se valoraron las imágenes de forma visual.
Análisis estadísticoSe utilizó el Statistical Package for Social Sciences (SPSS) (v. 17) para todos los análisis. El ICM seguía una distribución normal en la muestra total. Se realizó un análisis de covarianza (ANCOVA) con el ICM como variable independiente en todos los grupos diagnósticos, con un test de Scheffe's F post-hoc. Se practicó una t de Student para evaluar la relación entre el ICM y el sexo, los resultados de la captación estriatal en el FP-CIT SPECT, los antecedentes personales y familiares y los síntomas característicos de DLCw. Se realizó un análisis de correlación de Pearson para evaluar la relación del ICM con la edad y las variables neuropsicológicas. Los resultados se expresaron en porcentaje para las variables cualitativas y en media±desviación estándar para los datos cuantitativos. Los valores de probabilidad < 0,05 se consideraron significativos. Se calculó el coeficiente de correlación kappa para determinar el acuerdo entre los 2 neurólogos al aplicar de forma independiente los criterios internacionales de consenso para DCLw2.
ResultadosSe recogieron datos de 77 pacientes (38 varones y 39 mujeres). La media de edad de toda la muestra fue 74,3±6,5 años.
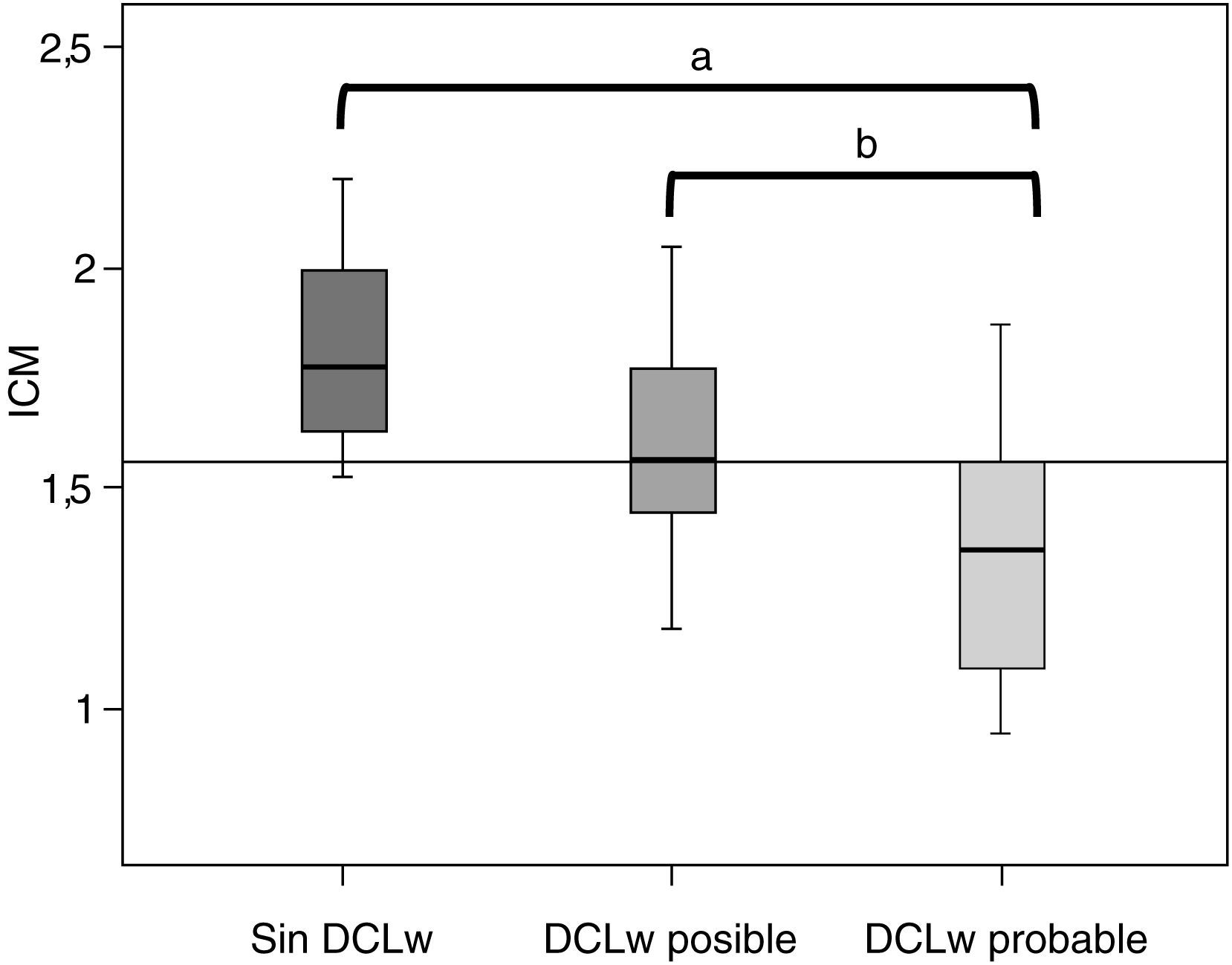
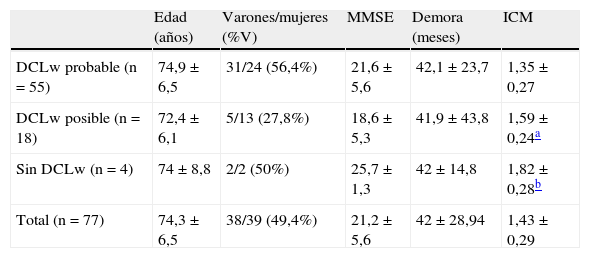
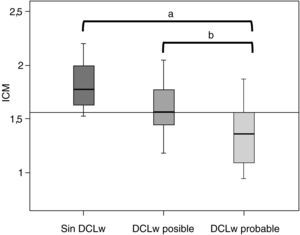
Se clasificó la muestra de pacientes en DCLw probable (n=55), DCLw posible (n=18) o sin DCLw (n=4) según los criterios internacionales de consenso para DCLw2. La tabla 1 muestra las características clínicas y el ICM tras aplicar dichos criterios. No se hallaron diferencias estadísticamente significativas entre los grupos con respecto a la edad, el sexo, la puntuación en el MMSE y la duración de los síntomas en el momento de realizar la gammagrafía miocárdica. El ICM medio fue significativamente menor en el grupo de DCLw probable respecto al grupo de DCLw posible (1,35±0,27 frente a 1,59±0,24 respectivamente; p=0,004) y también respecto al grupo sin DCLw (1,35±0,27 frente a 1,82±0,28 respectivamente; p=0,004) (fig. 1). Entre los grupos de DCLw posible y sin DCLw no se hallaron diferencias significativas en los ICM. Entre los pacientes clasificados como DCLw probable, 13 presentaban un ICM > 1,56 (considerado como valor normal en nuestro laboratorio33). Los 4 pacientes clasificados como sin DCLw fueron diagnosticados clínicamente con EA (n=3) y demencia mixta (n=1).
Características clínicas e ICM en cada categoría diagnóstica tras aplicar los criterios internacionales de consenso de DCLw2
| Edad (años) | Varones/mujeres (%V) | MMSE | Demora (meses) | ICM | |
| DCLw probable (n=55) | 74,9±6,5 | 31/24 (56,4%) | 21,6±5,6 | 42,1±23,7 | 1,35±0,27 |
| DCLw posible (n=18) | 72,4±6,1 | 5/13 (27,8%) | 18,6±5,3 | 41,9±43,8 | 1,59±0,24a |
| Sin DCLw (n=4) | 74±8,8 | 2/2 (50%) | 25,7±1,3 | 42±14,8 | 1,82±0,28b |
| Total (n=77) | 74,3±6,5 | 38/39 (49,4%) | 21,2±5,6 | 42±28,94 | 1,43±0,29 |
DCLw: demencia con cuerpos de Lewy; Demora: tiempo desde el inicio de los síntomas hasta la realización de la gammagrafía miocárdica; ICM: índice corazón/mediastino; MMSE: puntuación en el Mini-Mental State Examination26,27; %V: porcentaje de varones.
Relación del índice corazón/mediastino (ICM) con el diagnóstico según los criterios internacionales de consenso de demencia con cuerpos de Lewy (DCLw)2. El punto de corte se fijó en 1,56 (valor normal del ICM para pacientes mayores de 60 años según nuestro laboratorio)33.
aSignificación estadística (p=0,004) entre grupos con DCLw probable y sin DCLw.
bSignificación estadística (p=0,004) entre los grupos con DCLw posible y DCLw probable.
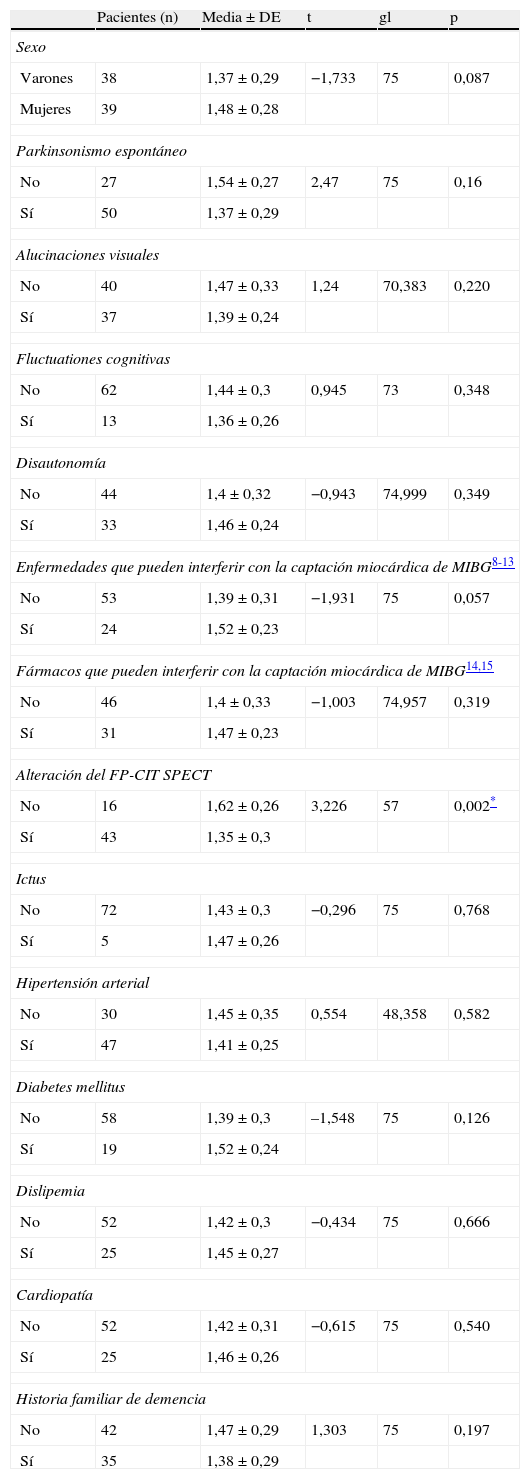
Se estudió también la relación entre el ICM y el sexo, los síntomas característicos de la DCLw y los antecedentes personales o familiares de los pacientes (tabla 2). Solamente se halló una asociación significativa entre valores reducidos de ICM y baja captación estriatal en el FP-CIT SPET (p=0,002). Los pacientes con parkinsonismo tenían menor ICM que los pacientes sin parkinsonismo, aunque la diferencia no alcanzó significación estadística. Ningún antecedente patológico ni la toma de fármacos influyeron en los resultados de la gammagrafía miocárdica. En la tabla 3 se especifica detalladamente los fármacos que tomaban los pacientes en el momento de realizarse la gammagrafía miocárdica.
Relación entre ICM y características clínicas y demográficas
| Pacientes (n) | Media±DE | t | gl | p | |
| Sexo | |||||
| Varones | 38 | 1,37±0,29 | −1,733 | 75 | 0,087 |
| Mujeres | 39 | 1,48±0,28 | |||
| Parkinsonismo espontáneo | |||||
| No | 27 | 1,54±0,27 | 2,47 | 75 | 0,16 |
| Sí | 50 | 1,37±0,29 | |||
| Alucinaciones visuales | |||||
| No | 40 | 1,47±0,33 | 1,24 | 70,383 | 0,220 |
| Sí | 37 | 1,39±0,24 | |||
| Fluctuationes cognitivas | |||||
| No | 62 | 1,44±0,3 | 0,945 | 73 | 0,348 |
| Sí | 13 | 1,36±0,26 | |||
| Disautonomía | |||||
| No | 44 | 1,4±0,32 | −0,943 | 74,999 | 0,349 |
| Sí | 33 | 1,46±0,24 | |||
| Enfermedades que pueden interferir con la captación miocárdica de MIBG8-13 | |||||
| No | 53 | 1,39±0,31 | −1,931 | 75 | 0,057 |
| Sí | 24 | 1,52±0,23 | |||
| Fármacos que pueden interferir con la captación miocárdica de MIBG14,15 | |||||
| No | 46 | 1,4±0,33 | −1,003 | 74,957 | 0,319 |
| Sí | 31 | 1,47±0,23 | |||
| Alteración del FP-CIT SPECT | |||||
| No | 16 | 1,62±0,26 | 3,226 | 57 | 0,002* |
| Sí | 43 | 1,35±0,3 | |||
| Ictus | |||||
| No | 72 | 1,43±0,3 | −0,296 | 75 | 0,768 |
| Sí | 5 | 1,47±0,26 | |||
| Hipertensión arterial | |||||
| No | 30 | 1,45±0,35 | 0,554 | 48,358 | 0,582 |
| Sí | 47 | 1,41±0,25 | |||
| Diabetes mellitus | |||||
| No | 58 | 1,39±0,3 | –1,548 | 75 | 0,126 |
| Sí | 19 | 1,52±0,24 | |||
| Dislipemia | |||||
| No | 52 | 1,42±0,3 | −0,434 | 75 | 0,666 |
| Sí | 25 | 1,45±0,27 | |||
| Cardiopatía | |||||
| No | 52 | 1,42±0,31 | −0,615 | 75 | 0,540 |
| Sí | 25 | 1,46±0,26 | |||
| Historia familiar de demencia | |||||
| No | 42 | 1,47±0,29 | 1,303 | 75 | 0,197 |
| Sí | 35 | 1,38±0,29 | |||
DE: desviación estándar; gl. grados de libertad; ICM: índice corazón/mediastino.
Tratamiento de los pacientes en el momento de realizarse la gammagrafía miocárdica con MIBG.
| Fármacos | Pacientes, n (%) |
| Antidemencia | |
| Ninguno | 17 (22,1) |
| Rivastigmina | 36 (46,8) |
| Donepezilo | 4 (5,2) |
| Galantamina | 5 (6,5) |
| Memantina | 5 (6,5) |
| Rivastigmina+memantina | 1 (1,3) |
| Rivastigmina+donepezilo | 5 (6,5) |
| Rivastigmina+galantamina | 2 (2,6) |
| Otros | 2 (2,6) |
| Antiparkinsonianos | |
| Ninguno | 48 (32,3) |
| Levodopa | 29 (37,7) |
| Neurolépticos | |
| Ninguno | 51 (66,2) |
| Quetiapina | 19 (24,7) |
| Risperidona | 4 (5,2) |
| Olanzapina | 1 (1,3) |
| Otros | 2 (2,6) |
| Antidepresivos | |
| Ninguno | 32 (41,6) |
| Fluoxetina | 4 (5,2) |
| Sertralina | 6 (7,8) |
| Citalopram | 9 (11,7) |
| Escitalopram | 8 (10,4) |
| Trazodona | 8 (10,4) |
| Otros ISRS | 3 (3,9) |
| IRSN | 4 (5,2) |
| Amitriptilina | 2 (2,6) |
| Otros | 1 (1,3) |
| Otros | |
| Antihipertensivos | 27 (29,9) |
| Simpáticomiméticos | 1 (1,3) |
| Opioides | 1 (1,3) |
IRSN: inhibidores de la recaptación de serotonina y noradrenalina; ISRS: inhibidores selectivos de la recaptación de serotonina.
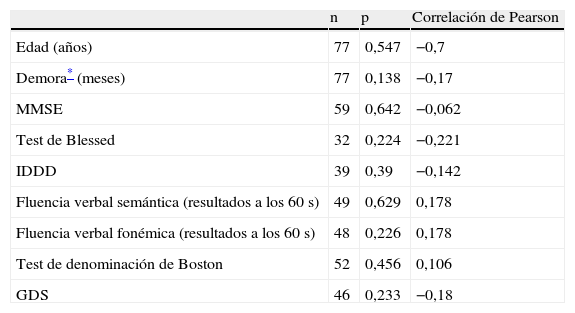
Por último, no se encontró relación en el ICM con ningún test del examen neuropsicológico, ni tampoco con la edad ni la duración de los síntomas en el momento de la realización de la gammagrafía miocárdica (tabla 4).
Correlación entre el ICM y la edad, la duración de los síntomas y los resultados de la evaluación neuropsicológica
| n | p | Correlación de Pearson | |
| Edad (años) | 77 | 0,547 | −0,7 |
| Demora* (meses) | 77 | 0,138 | −0,17 |
| MMSE | 59 | 0,642 | −0,062 |
| Test de Blessed | 32 | 0,224 | −0,221 |
| IDDD | 39 | 0,39 | −0,142 |
| Fluencia verbal semántica (resultados a los 60 s) | 49 | 0,629 | 0,178 |
| Fluencia verbal fonémica (resultados a los 60 s) | 48 | 0,226 | 0,178 |
| Test de denominación de Boston | 52 | 0,456 | 0,106 |
| GDS | 46 | 0,233 | −0,18 |
En este trabajo, se estudiaron las correlaciones de la gammagrafía miocárdica con MIBG en una muestra de pacientes con sospecha clínica de DCLw. Debido a que el diagnóstico clínico de estos pacientes puede estar influido en parte por el resultado de dicha exploración, 2 neurólogos aplicaron retrospectivamente y de forma independiente los criterios internacionales de consenso para DCLw2. Con esto, se dividió la muestra de pacientes en DCLw probable, DCLw posible y sin DCLw, y se halló que el ICM medio difería significativamente entre dichos grupos; el grupo con DCLw probable presentó los valores más reducidos, con una diferencia significativa respecto a los grupos con DCLw posible y sin DCLw, como era esperable. El ICM medio del grupo sin DCLw era menor que el del grupo con DCLw posible, aunque esta diferencia no alcanzó significación estadística. Este hallazgo podría explicarse por el reducido tamaño del grupo sin DCLw (n=4), que requeriría mayor magnitud de la diferencia entre los valores de ICM de ambos grupos para hallar diferencias significativas (como sí se dan al comparar su ICM con el del grupo con DCLw probable).
Estos datos son consistentes con los de otros estudios que han evaluado los resultados de la gammagrafía miocárdica en pacientes con DCLw4,16–22. En un trabajo previo realizado en nuestro centro, Estorch et al22 demostraron, en un grupo de 56 pacientes con demencia, con un seguimiento clínico de 4 años, que la gammagrafía miocárdica con MIBG realizada en la primera visita podía ayudar a diferenciar la DCLw de otras enfermedades degenerativas, usando un punto de corte de ICM de 1,36 con una sensibilidad del 94%, una especificidad del 96% y una precisión del 95%.
Varios trabajos publicados previamente se han centrado principalmente en el valor de la gammagrafía miocárdica con MIBG como herramienta diagnóstica en la DCLw, aunque su asociación con factores clínicos y neuropsicológicos sigue sin estar bien establecida. Únicamente un trabajo publicado recientemente34 ha correlacionado los resultados de la gammagrafía miocárdica con MIBG con los signos clínicos de pacientes con DCLw probable; solamente hallaron diferencias significativas en el ICM según la presencia o la ausencia de hipotensión ortostática. En nuestro estudio, evaluamos de forma retrospectiva si hay alguna relación entre valores de ICM y factores demográficos, clínicos o neuropsicológicos. No encontramos relación de la captación reducida de MIBG con ninguna variable clínica, como edad, sexo, antecedentes patológicos o fármacos. Esto probablemente significa que la denervación cardíaca simpática es un hecho precoz y robusto en la DCLw, y no se ve influida por variables clínicas o demográficas.
Según los criterios internacionales de consenso2, el FP-CIT SPECT es la única técnica de imagen considerada como criterio indicativo de DCLw. Una captación estriatal disminuida en el FP-CIT SPECT refleja la degeneración de la vía nigroestriada en el caudado y el putamen. Aprovechando que 59 (77%) de los pacientes de nuestra muestra se habían realizado un FP-CIT SPECT además de una gammagrafía miocárdica con MIBG como parte de su evaluación clínica, se analizaron sus resultados y se halló una asociación significativa entre captación estriatal reducida en el FP-CIT SPECT y valores disminuidos de ICM en la gammagrafía miocárdica con MIBG. La fuerte asociación entre los resultados de la gammagrafía miocárdica y el FP-CIT SPECT en nuestro estudio realza el hecho de que la denervación simpática miocárdica se asocia a la degeneración nigroestriada en la DCLw.
Las limitaciones de este estudio son el reducido tamaño de la muestra, su carácter retrospectivo, la limitación del estudio neuropsicológico (con ausencia de tests que evalúen más específicamente la funciones visuoperceptiva, visuoconstructiva y ejecutiva), la ausencia de confirmación patológica del diagnóstico y la ausencia de un grupo control. No obstante, los datos reflejan la experiencia diaria en una unidad de memoria de referencia.
En resumen, los datos de nuestro estudio apoyan la utilidad de la gammagrafía miocárdica con MIBG en el diagnóstico de la DCLw. Concluimos que la denervación simpática miocárdica es un rasgo robusto en la DCLw, independiente de datos demográficos y clínicos, y que se asocia a la degeneración nigroestriada observada en esta enfermedad.
PresentaciónUna parte de este trabajo fue presentada en la LX Reunión Anual de la Sociedad Española de Neurología, 2008, en Barcelona.
FinanciaciónEste trabajo no ha recibido financiación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.