Evaluar los factores sociodemográficos, clínicos, imagenológicos y relacionados con la atención médica que influyen sobre el pronóstico de los pacientes con hemorragia subaracnoidea aneurismática al alta hospitalaria.
Pacientes y métodoSe realizó un estudio tipo cohorte, retrospectivo, con 334 pacientes atendidos en el Hospital Hermanos Ameijeiras en La Habana, Cuba, en el periodo comprendido entre octubre de 2005 y junio de 2014.
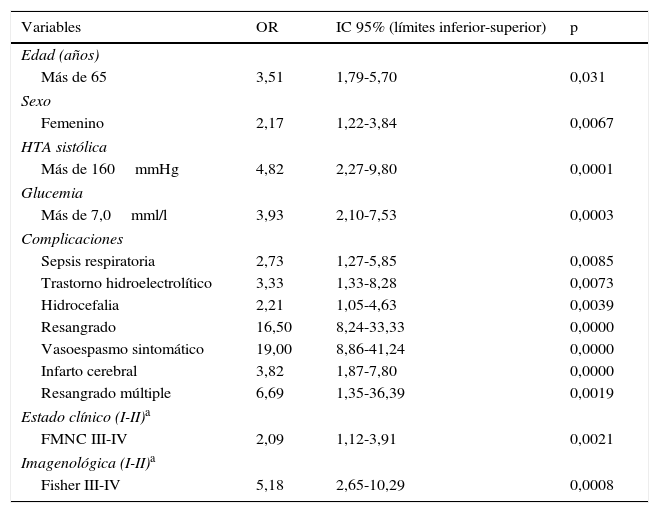
ResultadosEn el análisis multivariado se encontró que los factores asociados a una evolución desfavorable fueron la edad mayor a 65 años (OR 3,51, IC 95% 1,79-5,7, p=0,031), el sexo femenino (OR 2,17, IC 95% 1,22-3,84, p=0,0067), la HTA sistólica (OR 4,82, IC 95% 2,27-9,8, p=0,0001), la hiperglucemia al ingreso (OR 3,93, IC 95% 2,10-7,53, p=0,0003), las complicaciones como la sepsis respiratoria (OR 2,73, IC 95% 1,27-5,85, p=0,0085), los trastornos hidroelectrolíticos (OR 3,33, IC 95% 1,33-8,28, p=0,0073), la hidrocefalia (OR 2,21, IC 95% 1,05-4,63, p=0,0039), el resangrado (OR 16,50, IC 95% 8,24-41,24, p=0,0000), el vasoespasmo sintomático (OR 19,00, IC 95% 8,86-41,24, p=0,0000), el infarto cerebral (OR 3,82, IC 95% 1,87-7,80, p=0,0000), el resangrado múltiple (OR 6,69, IC 95% 1,35-36,39, p=0,0019), así como los grados iii y iv de las escalas de la Federación Mundial de Neurocirujanos (OR 2,09, IC 95% 1,12-3,91, p=0,0021) y de Fisher (OR 5,18, IC 95% 2,65-10,29, p=0,0008).
ConclusionesLa evolución de la hemorragia subaracnoidea aneurismática está relacionada con la edad, el sexo, el estado clínico al arribo a la unidad de ictus, así como las características imagenológicas según la escala de Fisher, las cifras de tensión arterial y de glucemia, y las complicaciones como los trastornos hidroelectrolíticos, la hidrocefalia, el resangrado, el vasoespasmo y el resangrado múltiple.
This study evaluates care-related sociodemographic, clinical, and imaging factors and influences associated with outcome at discharge in patients with aneurismal subarachnoid haemorrhage.
Patients and methodRetrospective cohort study in 334 patients treated at Hospital Hermanos Ameijeiras in Havana, Cuba between October 2005 and June 2014.
ResultsLogistic regression analysis determined that the following factors were associated with higher risk of poor outcome: age older than 65 years (OR 3.51, 95% CI 1.79-5.7, P=.031), female sex (OR 2.17, 95% CI 1.22-3.84, P=.0067), systolic hypertension (OR 4.82, 95% CI 2.27-9.8, P=.0001), and hyperglycaemia at admission (OR 3.93, 95% CI 2.10-7.53, P=.0003). Certain complications were also associated with poor prognosis, including respiratory infection (OR 2.73, 95% CI 1.27-5.85, P=.0085), electrolyte disturbances (OR 3.33, 95% CI 1.33-8.28, P=.0073), hydrocephalus (OR 2.21, 95% CI 1.05-4.63, P=.0039), rebleeding (OR 16.50, 95% CI 8.24-41.24, P=.0000), symptomatic vasospasm (OR 19.00, 95% CI 8.86-41.24, P=.0000), cerebral ischaemia (OR 3.82, 95% CI 1.87-7.80, P=.000) and multiplex rebleeding (OR 6.69, 95% CI 1.35-36.39, P=.0019). Grades of iii and iv on the World Federation of Neurological Surgeons (OR 2.09, 95% CI 1.12-3.91, P=.0021) and Fisher scales (OR 5.18, 95% CI 2.65-10.29, P=.0008) were also related to poor outcome.
ConclusionsOutcome of aneurysmal subarachnoid haemorrhage was related to age, sex, clinical status at admission to the stroke unit, imaging findings according to the Fisher scale, blood pressure, glycaemia and such complications as electrolyte disturbances, hydrocephalus, rebleeding, and multiplex rebleeding.
Las enfermedades cerebrovasculares se han mantenido de forma estable entre las 3 primeras causas de muerte a nivel mundial1. Sin ser la hemorragia subaracnoidea aneurismática (HSAa) de las más frecuentes dentro de este grupo, sí es considerada una de las que mayor morbimortalidad reporta, con cifras que oscilan entre un 23 y un 51%2.
Varios son los factores sociodemográficos, clínicos, radiológicos y relacionados con la atención médica que se han asociado a un pronóstico desfavorable de la HSAa, pero estos resultados derivan mayoritariamente de investigaciones realizadas en países desarrollados, y se realizaron en pacientes en los que los protocolos de tratamiento difieren sustancialmente de los propuestos recientemente, debido al surgimiento de nuevas tecnologías y fármacos3,4. Identificar las variables asociadas con mal pronóstico en nuestro contexto permitiría desarrollar e implementar estrategias de tratamiento más eficaces, enfocadas, en lo posible, a la prevención y el manejo de los factores que contribuyen a una evolución desfavorable (ED). Además, exiguas son las referencias de estudios que evaluaron los factores relacionados con mal pronóstico en nuestra área, así como los trabajos que abordan los factores de riesgo de mortalidad según el subtipo etiopatogénico de ictus1.
Teniendo estas razones como premisa, nos propusimos realizar la presente investigación con el objetivo de evaluar los factores sociodemográficos, clínicos, imagenológicos y relacionados con la atención médica que influyen sobre el pronóstico de los pacientes con HSAa al alta hospitalaria.
Pacientes y métodosSe realizó un estudio observacional, de cohorte, retrospectivo, en los 357 pacientes tratados por HSAa en la Unidad de Ictus (UI) del Hospital Clínico-Quirúrgico Hermanos Ameijeiras, en La Habana, Cuba, en el periodo comprendido entre el primero de octubre de 2005 y el 31 de junio de 2014. Los pacientes incluidos cumplieron los siguientes criterios: 1) diagnóstico confirmado de HSA por estudio de tomografía axial computarizada (TAC) inicial con signos de sangrado en el espacio subaracnoideo o de xantocromía del líquido cefalorraquídeo; 2) aneurisma demostrado por angio-TAC o angiografía cerebral, con un patrón de sangrado en la TAC inicial que coincidió con la localización de la misma; 3) edad mayor de 18 años; 4) puntuación en la escala de Glasgow5 mayor de 8 puntos; 5) gradación en la escala de la Federación Mundial de Neurocirujanos(FMNC)6 menor o igual a iv. Criterios de exclusión: aneurismas micóticos, datos no disponibles en la historia clínica.
Se excluyeron 18 pacientes por no poderse completar todos los datos necesarios para la investigación, y en 5 de ellos no fue posible completar el protocolo diagnóstico por sus complicaciones y fallecimiento precoz.
Las variables sociodemográficas estudiadas fueron: la edad, el color de la piel y el sexo biológico.
Las variables clínicas que se recogieron fueron: el antecedente de HSA familiar, hipertensión arterial y diabetes mellitus, las cuales fueron consideradas como positivas si el paciente o el familiar hicieron referencia al diagnóstico de las mismas. Se consideró fumador al paciente que hasta su ingreso fumaba al menos un cigarrillo o un tabaco diario, y como positivo a la ingesta de alcohol, al que al menos ingería 30ml de ron o 2 cervezas 3 veces a la semana por 2 meses de forma continua en el último semestre. Se registró la hipertensión arterial sistólica si las cifras de monitorización en las primeras 4h a su arribo a la UI, en alguna medición, fueron superiores a 160mmHg; se tomó también la cifra promedio de presión sistólica y diastólica de ese tiempo como variable cuantitativa continua. La glucemia al ingreso se recogió como mayor de 7,0mmol/l, y su valor, como variable cuantitativa continua.
Las complicaciones tenidas en cuenta fueron la sepsis respiratoria, demostrada por signos inflamatorios en la radiografía de tórax con técnica posteroanterior; la sepsis fue definida en todo paciente que presentó una temperatura superior a 38¿C, con urocultivo con más de 100.000 unidades formadoras de colonias por campo de un germen, en el caso de la infección urinaria. Fiebre (temperatura superior a 38¿C) con hemocultivo positivo, cuando se refería a un cuadro toxicoinfeccioso sin foco séptico demostrado y meningoencefalitis cuando el conteo de células en el líquido cefalorraquídeo fue superior a 10 polimorfonucleares. La sepsis del catéter y/o flebitis se definió acorde con los signos clínicos, trayecto venoso enrojecido, con signos de inflamación en vena sometida a proceder. Se consideró como crisis epiléptica cuando el paciente presentó fenómenos paroxísticos y recurrentes como movimientos tónicos, clónicos, mioclónicos, tónico-clónicos o trastornos discognitivos o fenómenos sensitivos con correlación electroencefalográfica en estudio de vigilia. Los trastornos hidroelectrolíticos fueron definidos según el resultado de los ionogramas diarios como hipernatremia (sodio superior a 145mmol/l), hiponatremia (sodio inferior a 130mmol/l), hiperpotasemia (potasio superior a 4,5mmol/l) e hipopotasemia (potasio inferior a 3mmol/l). La hidrocefalia se consideró cuando el paciente presentó deterioro del estado de conciencia con signos en la TAC simple de cráneo indicativos de la misma, y el resangrado por la presencia o incremento de cefalea, o modificaciones súbitas del estado de conciencia con TAC simple de cráneo evolutiva que demostró una mayor cantidad de sangre subaracnoidea o intraventricular que en el estudio inicial. También se registró el resangrado múltiple cuando se constataron en más de una ocasión signos clínicos y alteraciones en la neuroimagenología, como ya se describió. Las otras complicaciones registradas fueron la isquemia cerebral, cuando se demostró área hipodensa en la TAC simple de cráneo evolutiva, que no se encontraba en el estudio inicial, así como el vasoespamo sintomático, que se definió cuando el paciente tuvo velocidades de flujo arterial superiores a 130m/s en arterias de la circulación anterior y/o de 100m/s para arterias de la circulación posterior, asociado a síntomas en el examen físico correspondientes al territorio afectado.
Se tuvo en cuenta también si el paciente necesitó ventilación mecánica, craniectomía descompresiva o si estuvo en la Unidad de Cuidados Intensivos, además de la variante de tratamiento, embolización o presillamiento del aneurisma. Todas estas variables se consideraron dicotómicas. Se evaluó el estado clínico e imagenológico acorde con la escala de la FMNC y la de Fisher7, respectivamente. También se recogió en cada paciente el número de complicaciones y se dividió para su análisis en enfermos sin complicaciones, con una y 2 complicaciones, y los que presentaron 3 o más. Los pacientes fueron clasificados al alta hospitalaria según la escala de Rankin, medida que se utilizó como equivalente evolutivo. Los grados 1, 2 y 3 fueron considerados como los de evolución favorable (EF), y los 4, 5 y 6, como ED.
Todos los pacientes fueron atendidos de acuerdo con el protocolo institucional, que sigue las recomendaciones realizadas por las guías internacionales de tratamiento a pacientes con HSAa8. La modalidad de tratamiento neuroquirúrgico (presillamiento o embolización) fue realizada lo antes posible, preferentemente antes de las 72h. Todos los casos fueron discutidos por neurólogos vasculares, neurocirujanos vasculares y neurorradiólogos, determinándose la modalidad terapéutica a utilizar. Generalmente los procederes endovasculares se reservaron para los pacientes ancianos y los aneurismas localizados en la circulación posterior, aunque cada paciente fue evaluado de forma individual.
Todos recibieron tratamiento con solución salina al 0,9% a una dosis de 1ml/Kg/h y albúmina humana al 5% suplementaria en caso de ser necesaria para mantener una presión venosa central de hasta 5mmHg. La medicación estándar fue de nimodipino 360mg/día, paracetamol 2g/día, incluyendo tramadol si era necesario, fenitoína 100mg/2veces al día, en la etapa poshemorragia, y laxantes. La derivación ventricular al exterior fue realizada en los pacientes con hidrocefalia. Se les realizó diariamente a todos los pacientes un doppler transcraneal, y en los casos necesarios, electroencefalograma de vigilia por 2h.
El Comité de Ética de la institución discutió y aprobó el protocolo y la puesta en marcha de la investigación. No se divulgó ningún dato personal de los pacientes y se tuvo en cuenta la declaración de Helsinki de 1975.
Para el análisis de los resultados los pacientes fueron divididos en 2 grupos, uno con EF y otro con ED. Las variables cualitativas se expresaron en sus frecuencias absolutas y relativas, utilizándose pruebas no paramétricas para la comparación de las mismas, como los test de Chi cuadrado y de Fisher. Las variables cuantitativas se expresaron mediante sus medias y desviaciones estándar, valiéndose del estadígrafo t de Student para comparar las mismas. Se realizó una regresión logística binaria para determinar los factores independientes relacionados con el pronóstico desfavorable de los pacientes. Se consideró estadísticamente significativo el valor de p≤0,05. Se utilizó el software SSPS® 17.0 para el procesamiento estadístico.
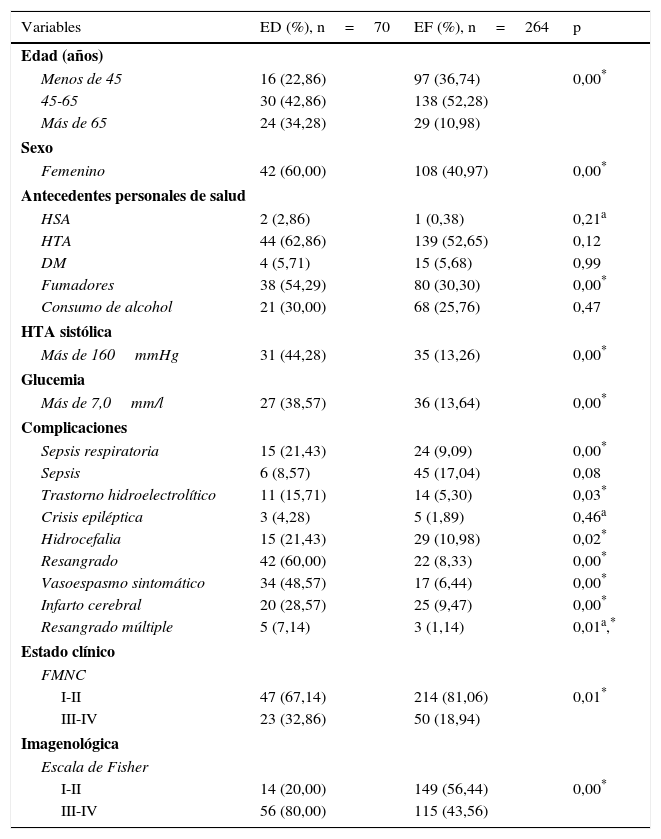
ResultadosUn total de 334 pacientes fueron incluidos finalmente; 70 (20,95%) de ellos tuvieron una ED. En el análisis univariado (tabla 1) se encontró un predominio en el grupo de edad de 45 a 65 años, con 42,86 y 52,28%, respectivamente, siendo el sexo femenino el de peor pronóstico dentro del grupo de ED, representando el 60% del total. Se constató una asociación estadísticamente significativa entre la ED y la edad (p=0,00), el sexo femenino (60 vs. 40,97%, p=0,00), el hábito de fumar (54,29 vs. 30,30%, p=0,00), la hipertensión arterial sistólica mayor de 160mmHg (44,28 vs. 13,26%, p=0,00), la glucemia al ingreso en la UI mayor de 7,0mmol/l (38,57 vs. 13,64%, p=0,00), así como el resangrado (60 vs. 8,33%, p=0,00), el vasoespasmo sintomático (48,57 vs. 6,44%, p=0,00) y el infarto cerebral (28,57 vs. 9,47%, p=0,00). El estado clínico de los pacientes al ingreso también se asoció con una ED (p=0,01), además de la cuantía del sangrado en la TAC inicial según la escala de Fisher (p=0,00).
Análisis univariado
| Variables | ED (%), n=70 | EF (%), n=264 | p |
|---|---|---|---|
| Edad (años) | |||
| Menos de 45 | 16 (22,86) | 97 (36,74) | 0,00* |
| 45-65 | 30 (42,86) | 138 (52,28) | |
| Más de 65 | 24 (34,28) | 29 (10,98) | |
| Sexo | |||
| Femenino | 42 (60,00) | 108 (40,97) | 0,00* |
| Antecedentes personales de salud | |||
| HSA | 2 (2,86) | 1 (0,38) | 0,21a |
| HTA | 44 (62,86) | 139 (52,65) | 0,12 |
| DM | 4 (5,71) | 15 (5,68) | 0,99 |
| Fumadores | 38 (54,29) | 80 (30,30) | 0,00* |
| Consumo de alcohol | 21 (30,00) | 68 (25,76) | 0,47 |
| HTA sistólica | |||
| Más de 160mmHg | 31 (44,28) | 35 (13,26) | 0,00* |
| Glucemia | |||
| Más de 7,0mm/l | 27 (38,57) | 36 (13,64) | 0,00* |
| Complicaciones | |||
| Sepsis respiratoria | 15 (21,43) | 24 (9,09) | 0,00* |
| Sepsis | 6 (8,57) | 45 (17,04) | 0,08 |
| Trastorno hidroelectrolítico | 11 (15,71) | 14 (5,30) | 0,03* |
| Crisis epiléptica | 3 (4,28) | 5 (1,89) | 0,46a |
| Hidrocefalia | 15 (21,43) | 29 (10,98) | 0,02* |
| Resangrado | 42 (60,00) | 22 (8,33) | 0,00* |
| Vasoespasmo sintomático | 34 (48,57) | 17 (6,44) | 0,00* |
| Infarto cerebral | 20 (28,57) | 25 (9,47) | 0,00* |
| Resangrado múltiple | 5 (7,14) | 3 (1,14) | 0,01a,* |
| Estado clínico | |||
| FMNC | |||
| I-II | 47 (67,14) | 214 (81,06) | 0,01* |
| III-IV | 23 (32,86) | 50 (18,94) | |
| Imagenológica | |||
| Escala de Fisher | |||
| I-II | 14 (20,00) | 149 (56,44) | 0,00* |
| III-IV | 56 (80,00) | 115 (43,56) | |
ED: evolución desfavorable (según la escala de Rankin grados 4, 5 y 6); EF: evolución favorable (según la escala de Rankin grados 1, 2 y 3); FMNC: escala de la Federación Mundial de Neurocirujanos; HTA: hipertensión arterial.
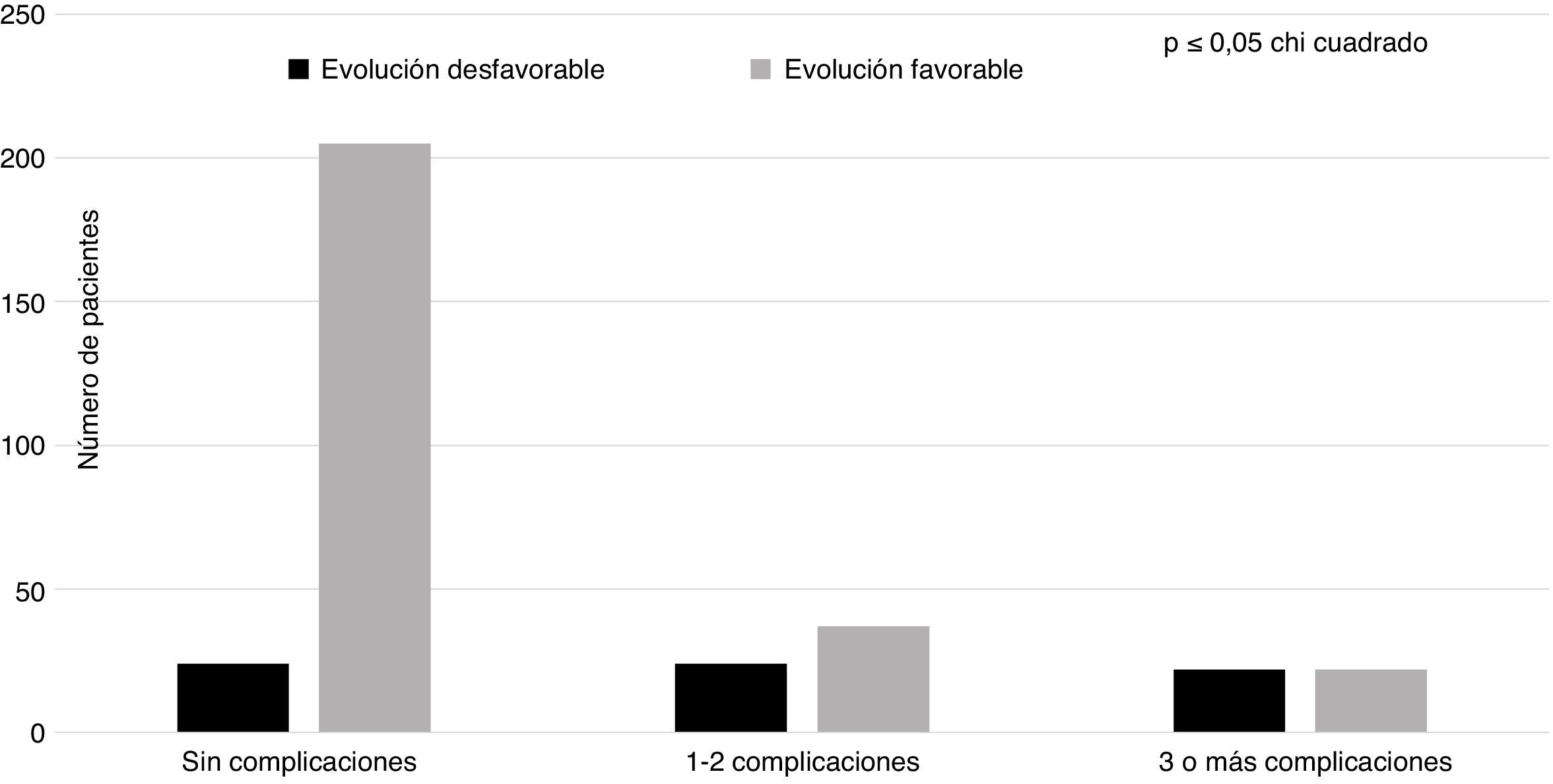
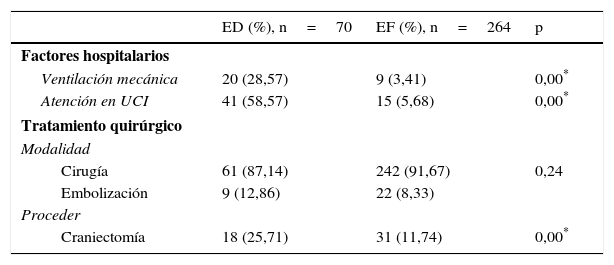
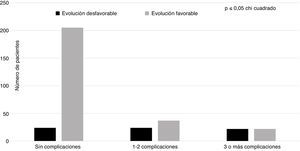
Dentro de los factores hospitalarios incluidos en el análisis (tabla 2) encontramos que la ventilación mecánica (p=0,00) y la necesidad de traslado a la Unidad de Cuidados Intensivos (p=0,00), junto con la craniectomía (p=0,00), fueron las variables que mostraron una relación estadística significativa con la ED. Sin embargo, no existieron diferencias en cuanto al abordaje quirúrgico. La figura 1 muestra la distribución de los pacientes con ED y EF según el número de complicaciones (sin complicaciones, con una o 2 complicaciones, o con 3 o más complicaciones). En los pacientes sin complicaciones predominó el grupo con EF, disminuyendo significativamente en los grupos con uno o 2, o con más de 3 complicaciones, mientras que los pacientes con ED tuvieron una distribución similar, sin interesar el número de complicaciones de los enfermos.
Factores hospitalarios y evolución
| ED (%), n=70 | EF (%), n=264 | p | |
|---|---|---|---|
| Factores hospitalarios | |||
| Ventilación mecánica | 20 (28,57) | 9 (3,41) | 0,00* |
| Atención en UCI | 41 (58,57) | 15 (5,68) | 0,00* |
| Tratamiento quirúrgico | |||
| Modalidad | |||
| Cirugía | 61 (87,14) | 242 (91,67) | 0,24 |
| Embolización | 9 (12,86) | 22 (8,33) | |
| Proceder | |||
| Craniectomía | 18 (25,71) | 31 (11,74) | 0,00* |
ED: evolución desfavorable (según la escala de Rankin grados 4, 5 y 6); EF: evolución favorable (según la escala de Rankin grados 1, 2 y 3); UCI: Unidad de Cuidados Intensivos.
En el análisis multivariado (tabla 3) se encontró que los factores asociados con una ED fueron, entre otros, la edad mayor de 65 años (OR 3,51, IC 95% 1,79-5,7), el sexo femenino (OR 2,17, IC 95% 1,22-3,84), la HTA sistólica (OR 4,82, IC 95% 2,27-9,8), la glucemia al ingreso (OR 3,93, IC 95% 2,10-7,53), las complicaciones como sepsis respiratoria (OR 2,73, IC 95% 1,27-5,85), el resangrado (OR 16,50, IC 95% 8,24-41,24), el vasoespasmo sintomático (OR 19,00, IC 95% 8,86-41,24) y el infarto cerebral (OR 3,82, IC 95% 1,87-7,80), además de los grados iii y iv de las escalas de la FMNC (OR 2,09, IC 95% 1,12-3,91) y de Fisher (OR 5,18, IC 95% 2,65-10,29).
Regresión logística
| Variables | OR | IC 95% (límites inferior-superior) | p |
|---|---|---|---|
| Edad (años) | |||
| Más de 65 | 3,51 | 1,79-5,70 | 0,031 |
| Sexo | |||
| Femenino | 2,17 | 1,22-3,84 | 0,0067 |
| HTA sistólica | |||
| Más de 160mmHg | 4,82 | 2,27-9,80 | 0,0001 |
| Glucemia | |||
| Más de 7,0mml/l | 3,93 | 2,10-7,53 | 0,0003 |
| Complicaciones | |||
| Sepsis respiratoria | 2,73 | 1,27-5,85 | 0,0085 |
| Trastorno hidroelectrolítico | 3,33 | 1,33-8,28 | 0,0073 |
| Hidrocefalia | 2,21 | 1,05-4,63 | 0,0039 |
| Resangrado | 16,50 | 8,24-33,33 | 0,0000 |
| Vasoespasmo sintomático | 19,00 | 8,86-41,24 | 0,0000 |
| Infarto cerebral | 3,82 | 1,87-7,80 | 0,0000 |
| Resangrado múltiple | 6,69 | 1,35-36,39 | 0,0019 |
| Estado clínico (I-II)a | |||
| FMNC III-IV | 2,09 | 1,12-3,91 | 0,0021 |
| Imagenológica (I-II)a | |||
| Fisher III-IV | 5,18 | 2,65-10,29 | 0,0008 |
FMNC: escala de la Federación Mundial de Neurocirujanos; HTA: hipertensión arterial; IC 95%: intervalo de confianza del 93%; OR: odds ratio.
Sin duda, el tratamiento de los pacientes con HSAa es todo un reto, sin embargo, durante la última década se ha apreciado una disminución de la mortalidad, atribuida en parte a un tratamiento cada vez más precoz y al incremento de nuevas tecnologías en el campo de la imagenología, así como de los procederes quirúrgicos. No obstante, se estima que la dependencia parcial o total de los enfermos que sobreviven a una HSAa alcanza hasta un 20% cuando se evalúa a los pacientes con la escala de Rankin modificada (grados 4 y 5) a los 12 meses, lo que se encuentra en el rango de lo reportado en esta serie8,9. Varios son los factores que se han asociado a una ED, entre ellos: la edad avanzada, el sexo femenino y la raza o color de la piel, entre otros3,8,10. Resultados similares fueron hallados en este trabajo, pero no se encontró relación estadísticamente significativa en cuanto a la raza o color de la piel; es probable que esto se deba al amplio mestizaje de la población cubana.
Otros factores relacionados con una ED demostrados en este estudio y en algunos previos fueron la hiperglucemia, la hipertensión sistólica y el estado clínico al ingreso acorde con la escala FMNC3,9,11,12. No solo la hiperglucemia como trastorno del metabolismo se ha relacionado con un pronóstico desfavorable, sino también las variaciones de la glucemia, como se demostró en un reciente estudio, donde la variabilidad estuvo asociada a un mayor distrés cerebral y mortalidad13. Las cifras de tensión arterial sistólica superiores a 160mmHg fueron un factor independiente de mal pronóstico, pero no se analizó si se debe a su relación con el resangrado. Similar situación presentamos para el estado clínico al ingreso (FMNC) y con los grados iii y iv en la escala Fisher y el vasoespasmo. A juicio de los autores, probablemente es más por una contribución multifactorial, que de un solo factor, si tenemos en cuenta que los pacientes con mayor sangrado generalmente tienen peor estado clínico y son más propensos a presentar resangrado, hidrocefalia y vasoespasmo, así como mayores complicaciones quirúrgicas.
Las complicaciones que se demostraron como predictores independientes de mala evolución fueron la sepsis respiratoria, los trastornos hidroelectrolíticos, la hidrocefalia, el resangrado, el vasoespasmo sintomático, el infarto cerebral y el resangrado múltiple, con reportes similares en otros estudios2,3,9,14,15. El resangrado es reconocido como una de las complicaciones de peor pronóstico y mayor mortalidad; así lo reflejan diversas investigaciones15, razón por la cual se recomienda que el tratamiento quirúrgico se realice lo antes posible. Aunque no son pocas las dificultades que se deben afrontar para lograr esta meta. Es importantes señalar que en esta investigación no se encontró relación entre la sepsis y el pronóstico de los pacientes, como se refiere en otros trabajos3,9, y a juicio de los autores se debe a que se agruparon varias condiciones que no son semejantes en cuanto a gravedad, como representan la sepsis del sistema nervioso central y la flebitis, lo que pudo haber constituido fuente de sesgo. Sin duda, son las complicaciones uno de los factores más importantes en la evolución de los pacientes, lo que se demuestra en el análisis del número de complicaciones del presente trabajo, donde influyó más la ausencia de complicaciones en la evolución favorable. También es necesario señalar que a juicio de los autores la ED de los pacientes sometidos a ventilación mecánica y a tratamiento en una Unidad de Cuidados Intensivos se debe a la mayor gravedad del curso de su enfermedad, no a una deficiente atención en estas unidades.
Dentro de las limitaciones que tiene este trabajo se encuentran las propias que se derivan del diseño (observacional retrospectivo), además de que el pronóstico tiene una relación multicausal, que indiscutiblemente no solo agrupa las variables que abordamos. Otro de los aspectos a tener en cuenta es que en esta serie solo se realizó tratamiento endovascular en los últimos 4 años, no en los inicios del estudio, lo que influye en los resultados. También es válido mencionar la posible introducción de sesgos durante los modelos de análisis multivariado.
En conclusión, los datos de esta investigación apoyan que la evolución de la HSAa está relacionada con la edad, el sexo, el estado clínico al arribo a la UI, así como con las características imagenológicas según la escala de Fisher, las cifras de tensión arterial y de glucemia, y las complicaciones como los trastornos hidroelectrolíticos, la hidrocefalia, el resangrado, el vasoespasmo y el resangrado múltiple.
FinanciaciónLos autores declaran que no recibieron ningún tipo de apoyo económico para la realización o publicación de esta investigación.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.