En muchas publicaciones se considera que la enfermedad de Alzheimer (EA) es privativa de la especie humana, y que ninguna otra especie animal padece dicha enfermedad. Sin embargo, diversos estudios han mostrado que existen en algunas especies algunas de las características definitorias de la enfermedad en el hombre, tanto en el aspecto neuropatológico como en el cognoscitivo-comportamental.
DesarrolloEn este trabajo se recogen los resultados mostrados en la bibliografía (PubMed) sobre alteraciones cerebrales en la senilidad en primates no humanos de diferente grado de evolución. Las alteraciones neuropatológicas relacionadas con la acumulación de amiloide o de proteína tau altamente fosforilada son muy raras fuera del orden primate, pero en todos los subórdenes, las familias, géneros y especies de primates que se han estudiado han mostrado que algunos individuos seniles presentan acumulaciones amiloideas en el cerebro. Incluso en algunas especies, la presencia de acumulaciones amiloideas en la senilidad es constante. Las alteraciones neuropatológicas relacionadas con la acumulación de proteína tau, siempre de muy escasa relevancia, se han detectado solo en algunas especies de primates no humanos, tanto poco evolucionados como muy evolucionados. En diferentes especies de primates no humanos, algunos tipos de alteraciones cognoscitivo-comportamentales están presentes en algunos individuos seniles con una mayor intensidad tanto frente a los individuos adultos normales como a otros individuos seniles de la especie. Se analiza además la importancia de la determinación de la longevidad de las especies en los diferentes hábitat (hábitat naturales, nuevos hábitat, semilibertad, cautiverio) para acreditar la condición de «senil» de los individuos en estudio.
ConclusionesExisten características morfohistoquímicas y cognoscitivo-comportamentales involutivas generales en los primates no humanos seniles similares a las observadas en el hombre anciano y otras características que pudieran ser indicio de un envejecimiento patológico «tipo Alzheimer».
Many publications consider that Alzheimer's disease (AD) is exclusive to the human species, and that no other animal species suffers from the disease. However, various studies have shown that some species can present with some of the defining characteristics of the human disease, including both neuropathological changes and cognitive-behavioural symptoms.
DevelopmentIn this work, the results published (PubMed) on senile brain changes in non-human primates of different degrees of evolution, are reviewed. The neuropathological changes associated with the accumulation of amyloid or highly phosphorylated tau protein are rare outside the primate order, but in all the sub-orders, families, genera and species of non-human primates that have been studied, some senile individuals have shown amyloid accumulation in the brain. In fact, in some species the presence of these deposits in senility is constant. Changes related to the accumulation of tau protein are always of very little significance, and have been detected only in some non-human primate species, both little evolved and highly evolved. In different species of non-human primates, some types of cognitive-behavioural changes are more common in some senile individuals when compared with both normal adult individuals and other senile individuals of the species. The importance of determining the longevity of the species in different habitats (natural habitats, new habitats, semi-captivity, captivity) is stressed in these studies.
ConclusionsMorphological, histochemical and cognitive-behavioural features similar to those observed in elderly humans are present in senile non-human primates. Moreover, other characteristics seen in non-human primates could be indicative of a pathological «Alzheimer type» ageing.
Es sumamente frecuente que en libros y monografías dedicadas a la enfermedad de Alzheimer (EA) se afirme, sin más justificación, que este síndrome neurodegenerativo es específico o privativo de la especie humana1. El escaso número de trabajos publicados sobre una posible «EA» en otras especies animales, incluidos los primates no humanos evolutivamente más próximos, parece confirmar esta suposición. Sin embargo, existen suficientes datos, aunque sean de difícil interpretación, como para que sea necesario un análisis profundo del tema, síntomas y signos de animales posiblemente afectados, antes de llegar a una conclusión tajante. Quizás un buen punto de partida sea la propia definición de lo que es la EA. La Organización Mundial de la Salud (OMS) en su décima edición de la Clasificación Internacional de las Enfermedades (CIE-10)2, define la EA como «una enfermedad degenerativa cerebral primaria, de etiología desconocida, que presenta rasgos neuropatológicos y neuroquímicos característicos» en cuya situación clínica destaca, predominantemente, la existencia de un cuadro demencial con determinadas características («comienzo insidioso y deterioro lento» y «ausencia de datos clínicos sugerentes de enfermedad cerebral o sistémica»). En realidad, esta definición, a falta de mayores conocimientos sobre las posibles etiologías de la EA, pone especial énfasis en la «dualidad» de cambios patológicos que concurren en ella y que ya fueron puestos de manifiesto por Alois Alzheimer hace ya más de cien años al describir lo que llamó «una mera enfermedad de la corteza cerebral»: un conjunto de síntomas clínicos neuropsicológicos indicativos de demencia (base del diagnóstico clínico in vivo, que precisa otros estudios para excluir otras causas de demencia) y un conjunto de signos neuropatológicos que son manifestaciones de las alteraciones morfofuncionales celulares y moleculares cerebrales (base del diagnóstico anatomopatológico post mortem). Esta ficticia dualidad surge tanto de los diferentes campos en donde se vive o se trata la enfermedad (la medicina clínica, la asistencia sociosanitaria, la investigación) como de nuestra incapacidad de correlacionar adecuadamente los cambios involutivos de los circuitos neuronales que progresivamente ocurren en el individuo que padece EA y sus implicaciones.
Concluir si un determinado mamífero puede padecer EA podría ser sencillamente el resultado de analizar si se da la concurrencia de estos dos tipos de alteraciones: mentales/comportamentales y neurodegenerativas. En cuanto al primer tipo de alteraciones, si volvemos a la CIE-10 para documentar la definición de demencia, encontramos que es un «síndrome debido a una enfermedad del cerebro… en la que hay déficits de múltiples funciones corticales superiores, entre ellas la memoria, el pensamiento, la comprensión, el cálculo, la capacidad de aprendizaje, el lenguaje y el juicio» y donde también se producen importantes alteraciones de la conducta (apatía, agresividad; etc.)3. Lógicamente, aplicada de manera estricta esta definición, solo la especie humana puede presentar el síndrome; ni siquiera otros primates evolutivamente cercanos pueden aspirar a presentar una parte significativa de estos déficits porque carecen de la gran mayoría de las funciones superiores humanas. Sin embargo, algunos déficits concretos pueden estar presentes en distintos individuos de otras especies durante su involución senil, como la disminución de la capacidad de aprendizaje, al tiempo que aparecen trastornos conductuales, como la apatía. Quizás el punto clave a considerar sería el significado de «déficit de múltiples funciones corticales superiores». Sin entrar en mayores discusiones sobre un tema (las funciones mentales) que no es el objetivo del trabajo, sí consideramos de manera relativa que en cada especie en concreto existen unas «funciones corticales superiores» específicas, cada especie pudiera desarrollar y padecer su particular «EA» si se diera una conjunción de «múltiples déficit» de esas funciones y alteraciones morfofuncionales neurodegenerativas corticales.
La denominación y/o significado de las funciones superiores en cada especie puede ser muy diversa y controvertida para diferentes campos de la ciencia en general y de la biomedicina en particular. De hecho, hay diferencias entre comportamiento, cognición y conciencia, aunque son muy sutiles y un tanto abstractas. El comportamiento puede definirse como el modo en que los seres vivos resuelven los problemas a los que deben enfrentarse a lo largo de sus vidas4. Lo consiguen mediante la construcción de pautas de respuesta que van desde los actos reflejos más sencillos hasta estrategias muy complejas. La cognición puede considerarse como la mezcla de las percepciones sensibles y su procesamiento determinado por unas estructuras cerebrales intrínsecas al sujeto5 y la conciencia como la estructura de la personalidad en que los fenómenos psíquicos son plenamente percibidos y comprendidos por la persona6. Comportamiento y cognición, en este amplio sentido, caben ser atribuidos a todos los animales, cada uno con su específica complejidad. Sin embargo, sería muy discutible considerar la existencia de una conciencia animal aunque solo fuera en los primates no humanos más evolucionados7,8.
Además de estas diferencias conceptuales entre diversas funciones superiores, existen diferencias entre funciones similares o equivalentes en especies del mismo o de distinto género, así como existen otras diferencias entre las funciones que sustentan algunas determinadas áreas corticales en distintas especies. En la mayoría de los estudios «cognoscitivos» que se llevan a cabo sobre animales experimentales de EA se determinan posibles déficit en aprendizaje, memoria y atención utilizando una amplia variedad de sistemas en donde los animales se enfrentan a un dilema a resolver o una tarea a realizar1,9. En estos estudios, en muchas ocasiones, se obtienen resultados contradictorios e inesperados desde el punto de vista de la «función superior» con la que consideramos que deberían estar relacionados. Por ejemplo, la lesión de los «núcleos» colinérgicos basalocorticales que inervan la corteza cerebral no siempre produce alteraciones similares de las funciones corticales en diferentes especies: las alteraciones en pruebas de aprendizaje y de atención son diferentes en monos y ratas tras la lesión del nucleo basalis). Esto complica tanto la definición y delimitación de las funciones superiores corticales como el establecimiento de equivalencias entre las funciones de las distintas especies1,9. A pesar de ello, los modelos animales son esenciales para poder seguir avanzando en la búsqueda de respuestas sobre la patogenia de las enfermedades neurodegenerativas, así como de posibles tratamientos, tanto paliativos como preventivos, para las mismas.
Del segundo grupo mencionado de alteraciones características de la EA humana, las alteraciones neuropatológicas, cabría pensar que se trata de un conjunto de signos objetivos y susceptibles de un análisis sistemático en todas las especies ya que, teóricamente, se podrían identificar y cuantificar los cambios celulares y moleculares acaecidos en el tejido cerebral de cada individuo. Es decir, que para diagnosticar en el laboratorio si un mamífero padece EA, solamente habría que comprobar si existen en su cerebro, con la densidad requerida, las alteraciones observadas en la EA humana. Estas alteraciones en humanos principalmente ocurren en, o afectan a, las neuronas, perturbando el normal funcionamiento de los circuitos neuronales3,10–14, aunque es de vital importancia en la patogenia la implicación de las células gliales (astroglía, microglía y oligodendroglía)15. La pérdida de conexiones neuronales y de neuronas, la gliosis y la producción y acumulación de proteínas aberrantes intraneuronales (formando los «ovillos neurofibrilares») y extraneuronales (formando las «placas» y los depósitos de amiloide difuso), junto al aumento del estrés oxidativo, a la disfunción de los sistemas de comunicación celular (neurotransmisores y no neurotransmisores) y a la activación de sistemas (pro)neuroinflamatorios, son los rasgos neuropatológicos y neuroquímicos más importantes en la EA3,10–19.
Al investigar si este cuadro neurodegenerativo se ha observado en otras especies, tanto de manera espontánea como de forma inducida, nos encontramos con que solo se ha llevado a cabo, o por lo menos publicado, un reducido número de estudios sistemáticos, la mayoría de ellos centrados únicamente en un número muy discreto de cambios morfohistoquímicos (amiloideos especialmente). Además, hay que hacer notar que en la mayoría de estos estudios no se han correlacionado las alteraciones neuropatológicas con las de las «funciones cerebrales superiores» de los individuos de estudio, y que tampoco se han diferenciado estas alteraciones de las seniles normales que cabría esperar en cada determinada especie. El escaso número de publicaciones podría deberse a la inexistencia de «afección de Alzheimer» en las especies estudiadas, pero también podría radicar en las dificultades existentes en llevar a cabo todos los estudios pertinentes en determinadas especies. Consideremos el caso de los roedores. Ratas y ratones, los animales de laboratorio más comúnmente utilizados, han sido analizados cuidadosamente hasta el límite de su supervivencia sin que aparecieran acumulaciones amiloideas u ovillos neurofibrilares de manera espontánea, aun en cepas o individuos con ligeros déficits de las funciones de memoria y aprendizaje pero con otras importantes alteraciones como aumento de la gliosis o del estrés oxidativo20. En modelos experimentales de Alzheimer producidos en estos roedores, especialmente en ratas con lesiones en los centros colinérgicos basalocorticales, pueden producirse, aunque no siempre, grandes déficit de ciertas funciones corticales dependiendo de las condiciones del subtipo de modelo1,9, pero: a) casi siempre existen discrepancias entre las alteraciones neuropatológicas observadas y los déficit comportamentales1,9 y b) nunca se observa la formación de afección fibrilar intra o extraneuronal1,9 aunque exista aumento de síntesis de APP tras la lesión21, así como intensa alteración de neuronas y gliosis muy pronunciada a medio y largo plazo1,22. Esta aparente manifiesta incapacidad para presentar afección amiloidea y/o la especial resistencia a que se produzcan los cambios imprescindibles para desarrollar depósitos amiloideos en estas especies, puede que esté condicionada tanto por el real bloqueo de factores pro-amiloideos como por la técnica de detección de los cambios celulares y moleculares en el sistema de produción de amiloide. Ratones transgénicos producidos por la inserción de genes humanos alterados (APP, PS1), provenientes de individuos con Alzheimer familiar, pueden llegar a formar depósitos similares a los observables en el hombre, aunque no lleguen a provocar alteraciones de funciones corticales superiores, al burlar las defensas específicas en la producción de amiloide a partir de APP murino20,23–26. Por otro lado, recientemente hemos observado que, empleando nuevas técnicas, ciertos tratamientos con anfetaminas en ratas en condiciones en las que no se manifestaban alteraciones neuropatológicas, pero sí una intensa elevación del estrés oxidativo, se inducía una mayor inmmunorreactividad frente a anticuerpos amiloideos (APP, 6E11, AG8) y un aumento de proteína de configuración beta detectada mediante microespectroscopía infrarroja y RAMAN27,28. La posible inducción de apoptosis y acumulación de substancias amiloideas en el hipocampo de ratas, junto a déficit cognoscitivos, fue publicada por primera vez en 200529 empleando animales seniles o con alimentación deficiente de vitamina E en condiciones de alto estrés oxidativo. En algunas subespecies de conejos (lagomorfos), pero no en otras, se puede encontrar una neurodegeneración del cerebro con la presentación de lesiones muy parecidas a las del cerebro humano que ha sufrido Alzheimer30,31. En algunos casos, algunos perros (cánidos)32,33, gatos (félidos)34, osos (plantígrados)35 y algún otro mamífero como el glotón (Gulo gulo, carnívoro mustélido)36 han mostrado alteraciones amiloideas extraneuronales y/o alteraciones fibrilares intraneuronales (especialmente en el glotón), pero no ha sido documentada la concurrencia con déficit de funciones cerebrales superiores o las diferencias entre posibles seniles normales y los seniles con rasgos patológicos similares a la EA humana.
Para intentar aclarar el problema de la posible existencia de la EA en otras especies animales diferentes a la humana parece muy útil empezar por investigar si existe un proceso patológico que pueda ser denominado «EA» en las especies más próximas al hombre, es decir, en los primates no-humanos. En esta monografía se analiza en profundidad la bibliografía internacional referida a posibles rasgos característicos de la EA en primates no humanos, especialmente los aspectos neuropatológicos más relacionados con el diagnóstico post-mortem.
Análisis bibliográfico y estudios propiosSe ha analizado la base de datos Medline (http://www.ncbi.nlm.nih.gov/pubmed) desde agosto de 1950 hasta abril de 2011). En la realización de esta búsqueda se ha recurrido al uso de palabras clave genéricas (en inglés) tales como envejecimiento, Alzheimer, ovillos, taupatías, amiloide, depósitos amiloides, placas, demencia, etc. y nombres de especies animales concretas. No ha sido posible una búsqueda empleando los términos primate, primate no humano, simio, etc. ya que los buscadores de esta base de datos no reconocen estas palabras (hecho confirmado por los responsables del servicio americano) y las búsquedas por nombre científico de cada especie solo reportan un número muy reducido de citas bibliográficas. De los más de 23.000 artículos datados, se seleccionaron por título o resumen unos 700 con menciones sugerentes de alteraciones tipo Alzheimer o transtornos seniles en primates. Tras su lectura, solo 227 recogían estudios sobre este tema. La mayoría de los autores/equipos de investigación tenían más de un trabajo sobre un mismo estudio o proyecto de investigación.
Los estudios propios sobre una colonia de macacos de cola en tirabuzón (Macaca arctoides), reflejados principalmente en la segunda parte de trabajo, se llevan a cabo siguiendo los protocolos de estudio del cerebro de enfermos de Alzheimer. En estos animales se sigue un análisis cognoscitivo-comportamental programado durante el envejecimiento.
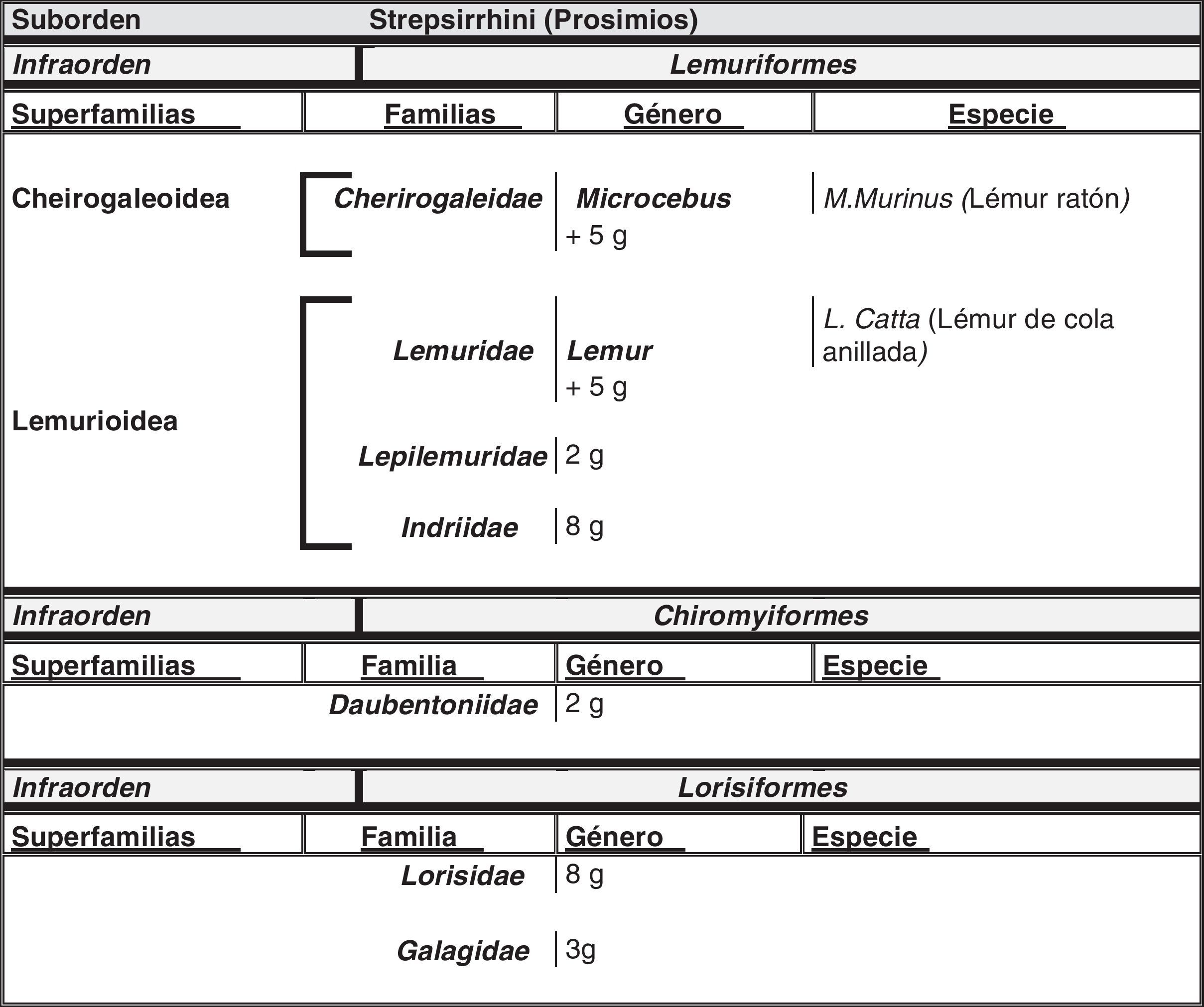
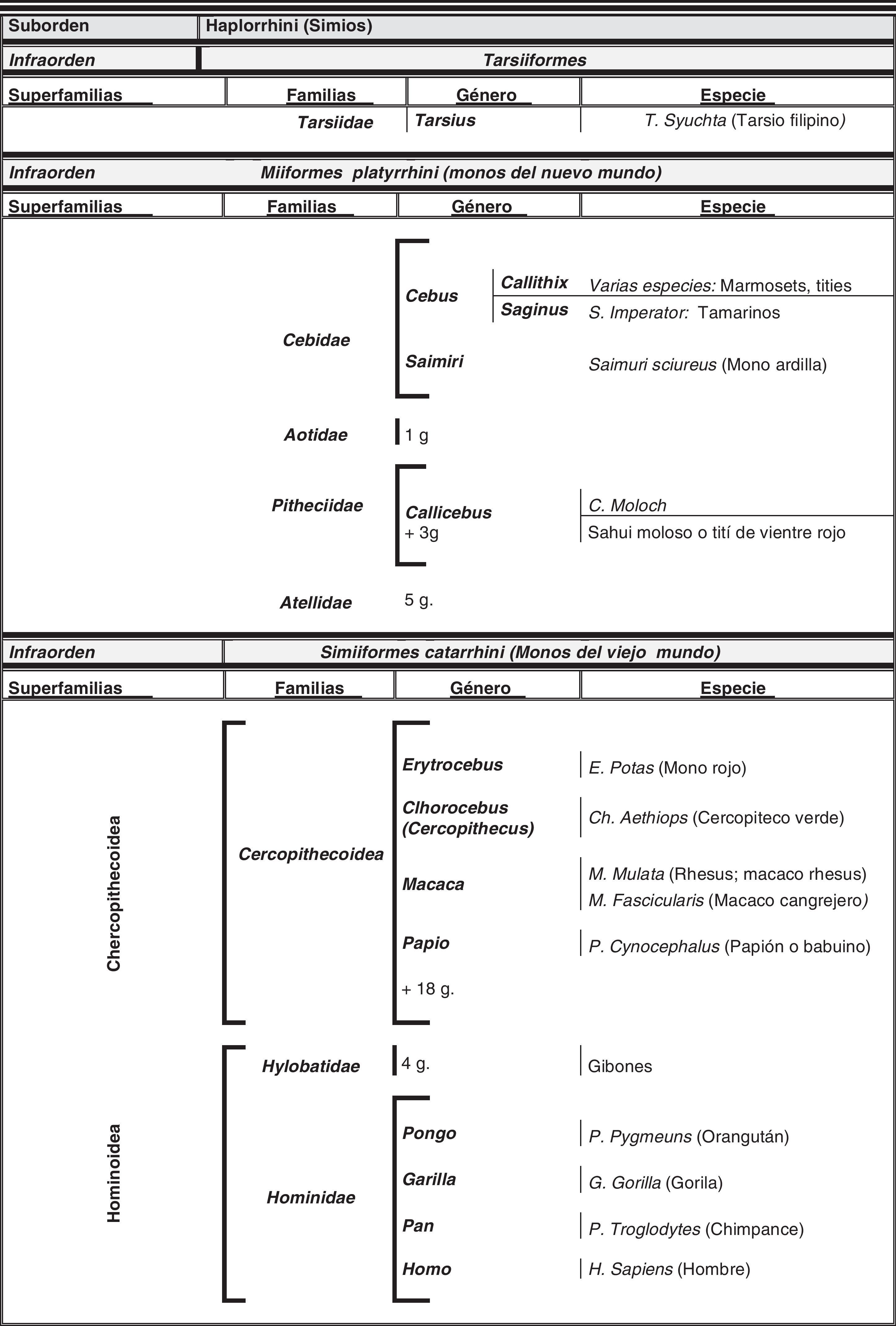
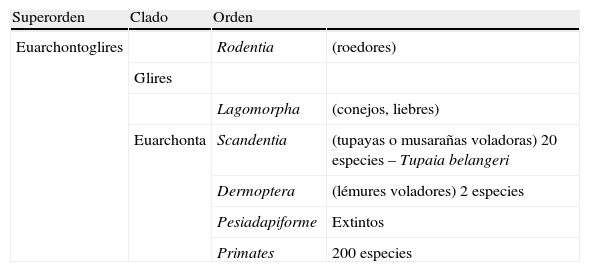
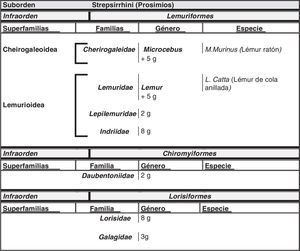
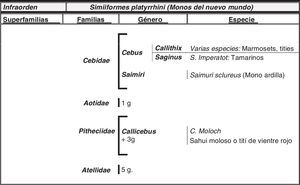
El hombre dentro del orden de los primatesEl ser humano pertenece a la especie Homo sapiens sapiens, dentro del orden de los primates. Nuestra especie como tal procede de un antropoide común (origen de la superfamilia hominoidae, que dio lugar a los homínidos y a los antiguamente denominados antropomorfos o grandes simios. Los pro-simios aparecieron en el cretácico, hace 60 millones de años, y el Homo sapiens surgió hace unos 200.000 años (Neandertales); Homo sapiens sapiens se data hacia el 20.000 a. C (Cromañones) y como humanos modernos se consideran las subespecies que surgieron unos 5.000 años a. C. En la tabla 1 se muestra un cladograma con la situación de los primates (unas 200 especies) al final de la escala evolutiva de los mamíferos y en las figuras 1 y 2 se presentan, atendiendo a su evolución, las familias y géneros del orden Primate, en el que se encuentra el género Homo. Se puede apreciar que existen dos subórdenes bien diferenciados, los pro-simios (Strepsirrhini, menos evolucionados) (fig. 1) y los simios (Haplorrhini, más evolucionados) (fig. 2). Dentro de estos últimos, se diferencian los Platyrrhinii, o monos del Nuevo Mundo, y los Catarrhinii, o monos del Viejo Mundo, donde se encuentra el hombre, incluido en el grupo de los grandes simios antropoides (familia hominoideae, géneros Pongo, Gorilla, Pan y Homo). En total, se considera la existencia de unos 22 géneros de prosimios (solo dos de los cuales han sido objeto de estudio en relación al Alzheimer) y de unos 49 géneros de simios, incluidos los ocho géneros de antropoides. En este infraorden más evolucionado, no son los antropoides los más estudiados junto al hombre en el tema del envejecimiento y la enfermedad de Alzheimer, sino los cercopitecos que son sus precursores evolutivos. En la figura 3 se muestran varias especies de primates no humanos con distinto grado de evolución. En ellas se observa el progresivo aumento de tamaño, el cambio de apariencia y la tendencia a la bipedestración desde los prosimios a los humanos.
Localización del orden Primates en el último peldaño de la escala evolutiva y sus relaciones con pro-primates (Scandentia y Dermoptera) y roedores
| Superorden | Clado | Orden | |
| Euarchontoglires | Rodentia | (roedores) | |
| Glires | |||
| Lagomorpha | (conejos, liebres) | ||
| Euarchonta | Scandentia | (tupayas o musarañas voladoras) 20 especies – Tupaia belangeri | |
| Dermoptera | (lémures voladores) 2 especies | ||
| Pesiadapiforme | Extintos | ||
| Primates | 200 especies |
Imágenes de primates no humanos: Microcebus murinus (lémur ratón), Lemur catta (lémur de cola anillada), Callithrix jacchus (marmoset o tití), Saguinus imperator (tamarino), Saimiri sciureus (mono ardilla), Pan troglodites (chimpancé) y Gorila gorila (gorila). Fotografías cedidas por Faunia-Madrid (Lemuriformes y Platyrrhinos) y Zoo-Aquarium-Madrid (chimpancé y gorila).
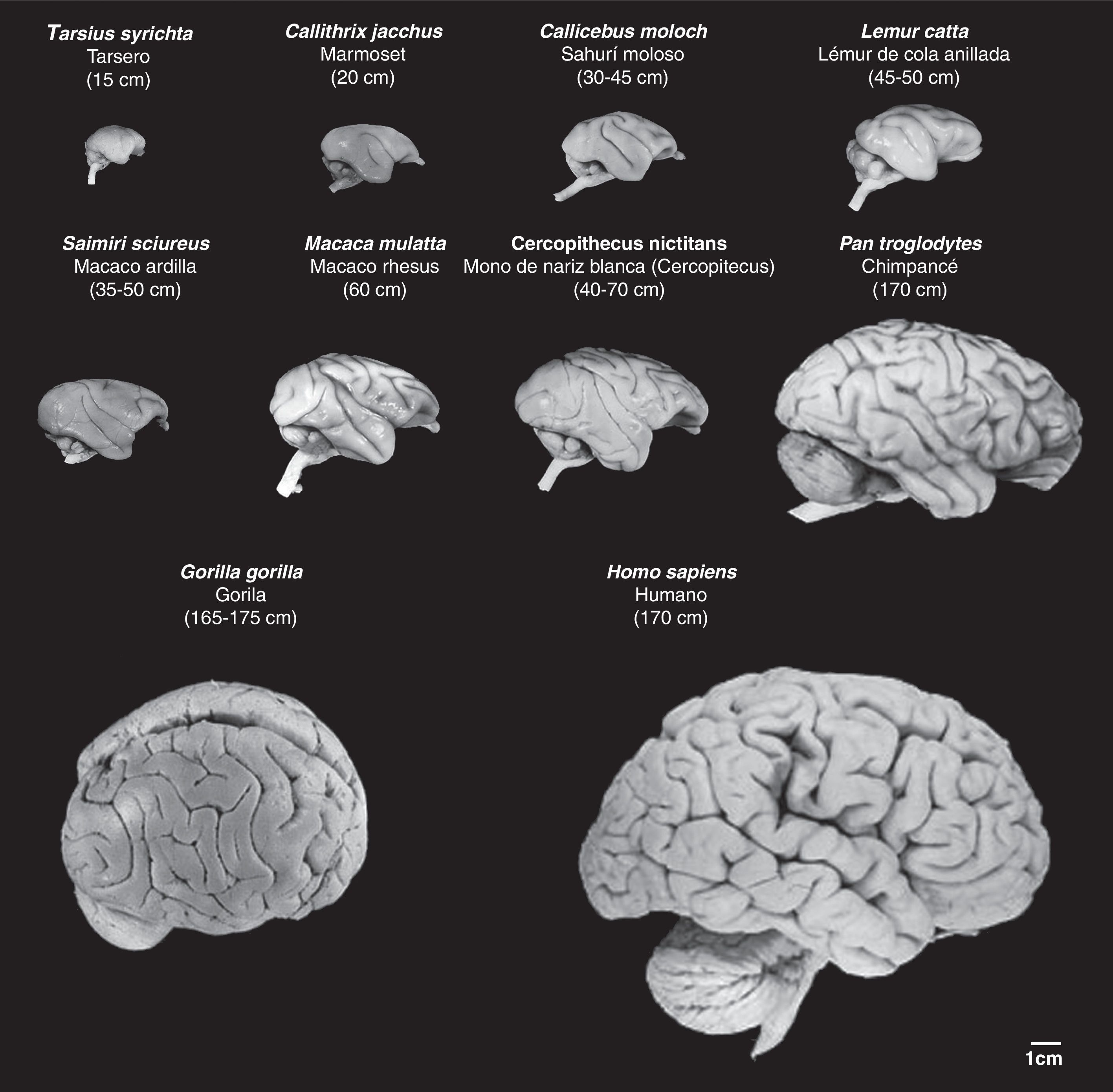
La especie Homo sapiens fue definida por Linneo en 175837 y sus características principales fueron descritas por éste y otros autores en años posteriores. Entre estas características diferenciales hay una que siempre se repite de manera destacada y que aparece de forma inherente a la especie: la existencia de un «cerebro complejo» con «funciones superiores»38,39. Ciertamente, las funciones de la corteza cerebral del hombre, calificadas de «superiores», difieren enormemente de las de los demás mamíferos, incluidos los primates no humanos. A lo largo de la evolución, se van sucediendo distintas etapas en las que la selección natural favoreció a aquellas especies con mejores capacidades funcionales cerebrales, conseguidas en el denominado proceso de encefalización40,41. Especialmente en los primates, en los saltos de las especies menos evolucionadas a las siguientes más evolucionadas, el desarrollo de diversas regiones del neocortex, del cortex prefrontal y de los centros y las áreas de asociación (figs. 4 y 5), junto al incremento de las conexiones sinápticas de sus neuronas han ido no solo perfeccionando sino configurando nuevas funciones cerebrales «superiores» en las esferas cognoscitiva y comportamental42–46. Los avances y perfeccionamientos morfofuncionales en áreas relacionadas con el aprendizaje, los diferentes tipos de memoria o el razonamiento no son graduales a lo largo de la evolución, pero tuvieron como resultado que en el gran salto de los grandes simios vivientes actuales al hombre (no sabemos bien a través de cuantas especies desaparecidas de ancestros) surgieran las características propias y exclusivas del ser humano: el área lingüística, la capacidad de razonamiento y juicio, las áreas cognoscitivas más complejas en los procesos de aprendizaje y memoria, etc.40–50.
Imágenes de cerebros de primates no humanos en comparación con el cerebro humano. Se conserva en las fotografías la proporcionalidad real. Se observa que junto al aumento de tamaño de la masa cerebral, progresivamente aumenta el número de circunvoluciones cerebrales, así como el volumen del cortex prefrontal y frontal. Entre paréntesis figura la longitud media del cuerpo (sin incluir la cola en las especies que la tienen) del primate adulto. Las imágenes proceden de University of Wisconsin and Michigan State Comparative Mammalian Brain Collections [consultado 26 Abr 2011]. Disponible en: http://brainmuseum.org/index.html.
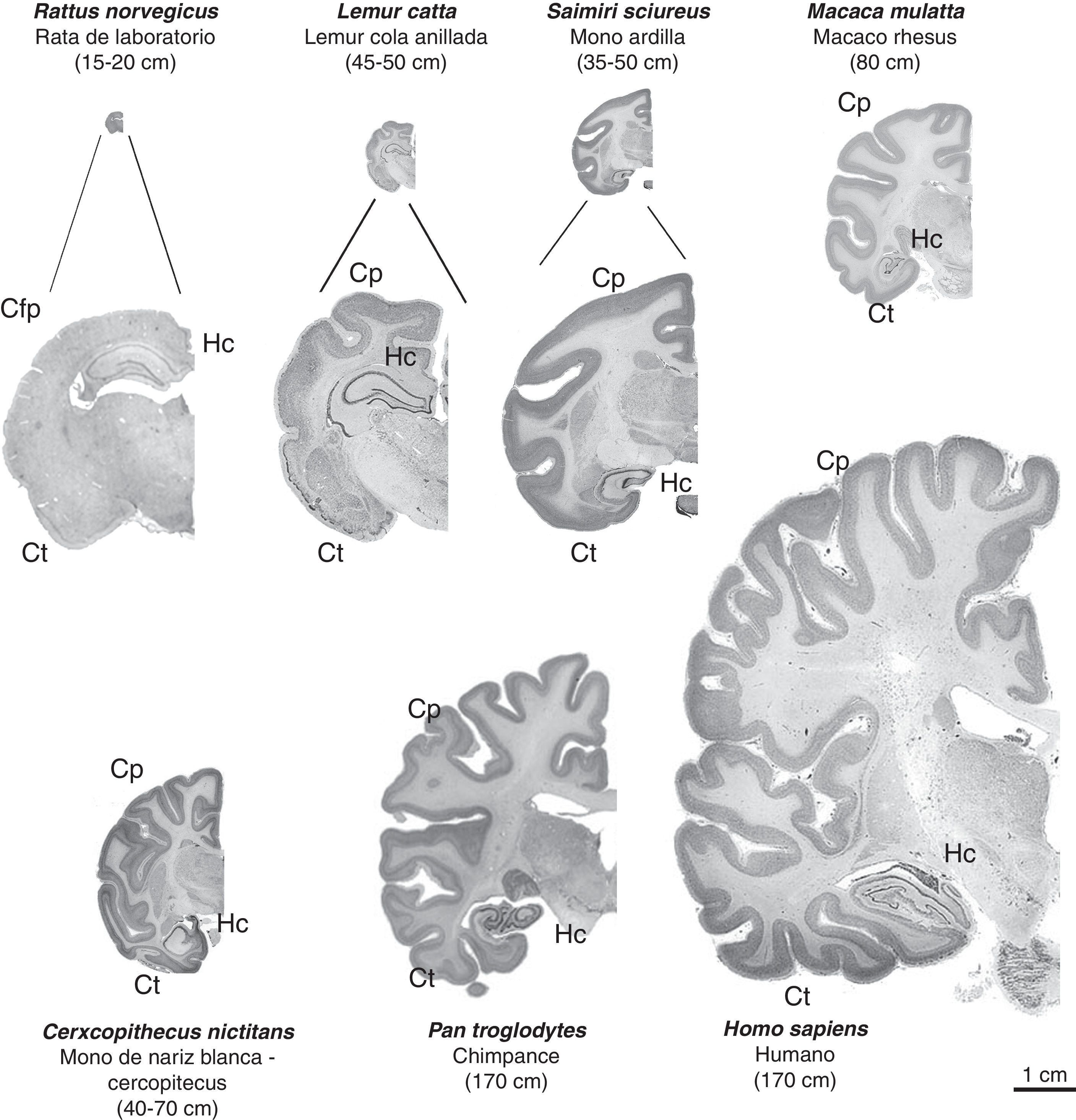
Imágenes de cortes cerebrales coronales de primates no humanos en comparación con el cerebro de rata y humano. Se conserva la proporcionalidad real en las imágenes (en las tres primeras, se complementa con una imagen aumentada para una mejor observación). Se puede apreciar que junto al incremento de tamaño de la masa cerebral, progresivamente aumenta el número de circunvoluciones cerebrales, una característica de los primates no humanos frente a la lisencefalia de los roedores (Cfp=corteza frontoparietal), así como el volumen del cortex parietal (Cp) y temporal (Ct). El hipocampo (Hc) se sitúa en posición dorsal en los prosimios (Lémur catta), de manera similar a lo que ocurre en los roedores (rata), observándose en posición ventral en los simios, al igual que en el humano. Entre paréntesis figura la longitud media del cuerpo (sin incluir la cola en las especies que la tienen) del primate adulto. Las imágenes de primates no humanos proceden de University of Wisconsin and Michigan State Comparative Mammalian Brain Collections [consultado 26 Abr 2011]. Disponible en: http://brainmuseum.org/index.html .
En la búsqueda de modelos animales útiles para investigar la senilidad humana y las enfermedades asociadas al envejecimiento se han utilizado, lógicamente, primates no humanos ya que teóricamente tienen, por ser especies filogenéticamente muy cercanas, dos grandes ventajas: similitud en algunos procesos cognoscitivos (p. ej., los relacionados con capacidades visuales no espaciales) o en habilidades para realizar ciertas tareas, y similitud estructural de muchas de las regiones cerebrales. Pero solo un reducido número de especies de primates ha sido objeto de estudio, tal como se aprecia en la figuras 1 y 2. Los motivos son muy variados: la muy problemática cría en cautividad; la larga expectativa de vida de algunas especies en cautividad; las dificultades del estudio de colonias salvajes, que son de muy reducido número de individuos y de difícil acceso y seguimiento; las restricciones o prohibiciones de experimentación con primates (leyes EE.UU., resoluciones del Parlamento Europeo, Proyecto Gran Simio, etc.). Además, analizando la temática de los trabajos publicados se aprecia una muy escasa realización de estudios comparativos entre los déficit cognoscitivos/comportamentales y las alteraciones celulares y moleculares, tanto en una misma especie como entre individuos representativos de especies con distinto grado de evolución (cosa también habitual en humanos). Este tipo de trabajo comparativo sería absolutamente necesario para entender no solo el envejecimiento fisiológico sino también el envejecimiento patológico característico de las enfermedades neurodegenerativas. En los humanos, los cambios involutivos seniles fisiológicos (considerados como tales los ocurridos en cerebros con una escasa presencia de rasgos neuropatológicos en el sentido clásico), producen alteraciones cognoscitivas y comportamentales de escasa entidad y trascendencia, mientras que la neurodegeneración del cerebro del paciente con Alzheimer conduce a la demencia, que ya no es solo una disminución de algunas de las funciones cognoscitivas sino que es la suma de graves alteraciones o aberraciones de todas las diversas funciones cognoscitivas superiores. En algunos primates no humanos en fase senil se han descrito, con mayor o menor intensidad, tanto cambios neuropatológicos como alteraciones en el comportamiento social o en las capacidades de aprendizaje y memoria51, pero solo algunos pocos primates no humanos han sido estudiados comportamentalmente en vida y anatomopatológicamente tras su fallecimiento52; (estudios en curso de los autores de la monografía –ver sección 5–), aun cuando sean estos casos los más valiosos para abordar el problema de la posible EA en primates no humanos. En algunos de estos pocos estudios se ha encontrado que existía, de manera genérica, una muy marcada diferencia en comportamiento social, en realización de tareas aprendidas y en aprendizaje de tareas nuevas, entre primates seniles sin alteraciones amiloideas y con escasas pérdidas neuronales y otros individuos de la misma especie con alteraciones amiloideas y más acusadas pérdidas neuronales52. Sin embargo, estos resultados no pueden considerarse como confirmación de la existencia de un modelo universal dual de involución senil aplicable a todos los primates (involución senil fisiológica e involución senil patológica-EA) porque se han encontrado en otros estudios, por una parte, diferencias significativas entre humanos ancianos y primates no humanos longevos53–60, y por otra parte, que otros primates no humanos estudiados más recientemente61 presentan alteraciones neuropatológicas sin grandes problemas comportamentales. Todo ello, como se discutirá en la segunda parte de la monografía, muestra que existen diferentes correlaciones entre las alteraciones comportamentales y las lesiones neuropatológicas y que pueden existir distintos estadios clínico-patológicos, así como distintos modelos de envejecimiento en el conjunto de los primates, incluyendo el hombre.
Expectativa de vida en estas especies animales y paso de la madurez a la senilidadUna de las cuestiones que hay que resolver antes de realizar estudios sobre estos posibles modelos animales, es conocer a partir de qué edad cada especie de mono se considera senil o de edad avanzada. Los resultados obtenidos en el estudio de pequeñas colonias o de animales aislados no se pueden generalizar. La expectativa de vida varía mucho entre las especies y depende no solo de la especie y la subespecie, sino también, de manera muy notable, de factores intrínsecos (familiares e individuales) y extrínsecos (especialmente el régimen de vida). El régimen de vida es un factor de primordial importancia para establecer la esperanza de vida de una determinada especie. En especial podría decirse que para cada especie podrían considerarse dos valores de esperanza de vida, uno en cautividad (o semilibertad controlada) y otro en libertad. Siempre es superior la expectativa de vida en el primer caso (salvo que exista una total inadaptación a la cautividad) que en el segundo, debido a los cuidados sanitarios y a la adecuada alimentación. Estos dos valores teóricos son modificados en una importante proporción (superior al 30% en algunos casos) por diversos factores como son la amplitud de los cuidados sanitarios y del control de la alimentación, en los animales en cautividad o semilibertad controlada, y las características de los hábitat, en los animales en libertad. En animales envejecidos cautivos, tiene especial importancia la prevención de la desnutrición debida a problemas bucodentales o digestivos (usando dietas blandas y enriquecidas con suplementos dietéticos) y la prevención de enfermedades infecciosas. En animales libres en diferentes hábitat, son de especial importancia la salubridad, la existencia de depredadores y la disponibilidad de agua y alimento. Si problemático es el cálculo de la expectativa de vida, más lo es el del paso de la madurez a la senilidad.
Muchos de los estudios que se han llevado a cabo sobre este tema se han realizado en macacos (Rhesus, Cynomolgus y Arctoides), y por ello muchos autores los consideran como el modelo tipo de primate no humano. El mono Rhesus (Macaca mulatta) es natural de Asia y se distribuye de manera natural por Afganistán, China y Tailandia, desde el nivel del mar hasta 3.000 m de elevación. En cautividad o semilibertad, así como por reintroducción en nuevos hábitats, se puede encontrar por todo el mundo. Su expectativa de vida y su edad de transición de la madurez a la senilidad son temas controvertidos: se puede considerar de manera genérica que su esperanza de vida en cautividad o semilibertad oscila entre los 35 y los 40 años, pero se aceptan como seniles a los individuos que tienen más de 20 años y de «edad extremadamente avanzada» a los que llegan a la treintena53,54,58,59. Para su comparación se considera que el primate no humano más anciano estudiado es un chimpancé de 59 años de edad criado en un laboratorio53. La variación en la longevidad entre determinados individuos de las especies del género Macaca criados en centros de investigación, reservas o espacios protegidos (por ejemplo, los cayos y pequeñas islas del caribe), es muy acusada60,61. Actualmente en EE.UU. los animales de experimentación o los utilizados en ciertas actividades deben pasar a reservas donde se les cuida hasta el final de sus días; en ellos, pueden documentarse casos de gran longevidad. El chimpancé más anciano del mundo reside en el CHEETA Primate Sanctuary (Creative Habitats and Enrichment for Endangered Threatened Apes) de Palm Springs, California. Este chimpancé se consideraba uno de los varios que originalmente participó en las películas de Tarzán entre 1930 y 1940, y aunque una investigación periodística desacreditó este extremo, concluyó en que sobrepasaba los 50 años62, acercándose al caso mejor documentado de chimpancé ya mencionado53. Paradójicamente, aunque puede ser el mono Rhesus el primate más usado en los estudios sobre senilidad, en ninguno de los trabajos publicados se ofrece una clara definición de senilidad fisiológica o patológica en base a características o valores paramétricos bien determinados, ni en el terreno morfológicos ni en el comportamental. No se tiene una base que sirva para caracterizar a los individuos en estudio con independencia de su edad. Por otra parte, el número de animales en los estudios publicados es siempre muy reducido y poco representativo de las poblaciones en libertad.
Frente a esta dispersión de datos relativos a «senilidad» en macacos, otras especies parecen ofrecer mayor homogeneidad en su curso vital aunque siempre las condiciones medioambientales influyan de manera importante en la longevidad y en el proceso de involución senil. Un buen ejemplo lo tenemos en las colonias de «mono verde» («Caribean vervet», Chlorocebus o Cercopithecus aethiops) que habitan en Saint Kitts (isla del Caribe Oriental), que comprenden unos 30.000 individuos y que son estudiados y controlados por la Behavioural Science Foundation (BSF) desde 196861,63,64. Los primeros monos de St. Kitts llegaron de África hacia el año 1630 en barcos negreros y se aclimataron rápidamente en todas las islas caribeñas. Estos animales omnívoros viven entre 20 y 30 años libres en las islas o en cautividad, superando en 5-10 años la expectativa de vida de sus ancestros de África Occidental ya que no están expuestos a los virus patógenos que diezman las poblaciones de estos primates africanos62. Esta especie de primate puede llegar a ser de primordial interés en el estudio de las enfermedades neurodegenerativas si se caracteriza bien su proceso de envejecimiento en el que aparece siempre acumulación de amiloide64.
Frente a la prolongada longevidad de los macacos, que dificulta un estudio longitudinal de las afecciones, otras especies tienen una esperanza de vida mucho más reducida, como el lémur ratón (Microcebus murinus), pequeño simio de unos 100 gramos de peso que puede ser criado en pequeñas colonias en semilibertad65. Sin embargo, en estos animales se manifiesta con gran intensidad la dependencia del proceso de envejecimiento a factores ambientales pues la longevidad en su medio ambiente natural es de 3-4 años, mientras en cautividad o semilibertad superan los 10-13 años de vida51,65. Estos cambios en su proceso de envejecimiento, junto a especiales características de la localización de sus cambios neuropatológicos cerebrales, que se detallan más adelante57, hacen discutible este modelo.
Involución morfofuncional «fisiológica» cerebral en primates no humanosDe manera general, se puede decir que las alteraciones que se describen en humanos seniles1,66–72 son observadas también en los primates no humanos. Los aspectos más estudiados, dentro de lo que podríamos definir como «senilidad fisiológica» (involución morfológica y funcional del cerebro con pérdidas leves y puntuales de ciertas capacidades cognoscitivas o comportamentales) se resumen en la tabla 2, y giran en torno a la distrofia neuronal (alteraciones en soma, dendritas y axones, con disminuciones de contactos sinápticos) y la gliosis73–94.
Alteraciones morfológicas seniles «fisiológicas» en primates no humanos
| Alteración morfofuncional | Observaciones |
| Pérdida de neuronas corticales (cortex cerebral e hipocampo) | Existen bastantes estudios con resultados muy contradictorios: se señalan desde pérdidas neuronales significativas73 a la preservación del número de neuronas74–77, incluso en animales con déficit cognoscitivos78. Parece más evidente la pérdida en corteza perfrontal y CA1 del hipocampo73. La involución de algunas áreas se puede correlacionar con la involución senil cognitiva pero no con otras79 |
| Alteraciones de cuerpos neuronales | Formación de vacuolas irregulares y protusiones en neuronas piramidales corticales pero no en el giro dentado hipocampal77,80 |
| Alteraciones de procesos neuronales y sinapsis | Se describen grandes modificaciones en dendritas, axones y sinapsis en corteza prefrontal, visual e hipocampo de monos ancianos80–88. Se consideran las alteraciones más importantes80–84, que, incluso, preceden a las restantes alteraciones neuropatológicas85 |
| Alteraciones del sistema colinérgico | Disminución variable (incluso inapreciable89) de neuronas en septum y Núcleo Basalis de Meynert (nbM). Hipertrofia de algunas neuronas incluso en monos con alteraciones cognoscitivas90,91 |
| Pérdida de neuronas subcorticales | Existen muy pocos estudios, salvo en lo relacionado con la inervación colinérgica (ver anterior). Involución de núcleos troncoencefálicos y de sistemas reticulares como locus coeruleus y núcleo dorsal del Rafe92,93 |
| Alteraciones de la mielinización | Desmielinización en axones de neuronas corticales que se manifiesta como disminución del volumen de la materia blanca76,90,94 |
La mayoría de los trabajos dedicados a investigar la posible existencia de procesos neurodegenerativos relacionados con la EA se centran en la búsqueda de cambios neuropatológicos similares a placas amiloides u ovillos neurofibrilares. Solo en un escaso porcentaje se han estudiado en paralelo otros parámetros morfológicos o bioquímicos, tal como estamos llevando a cabo en una colonia de macacos de cola de tirabuzón (sección 5). En la tabla 3 se recogen las características neuropatológicas generales de los primates no humanos que han sido estudiados y que han proporcionado los resultados más esclarecedores para concluir si existe o no EA en estos animales.
Alteraciones morfológicas seniles «patológicas» (tipo Alzheimer) en primates no humanos
| Alteración morfofuncional | Observaciones |
| Amiloide en placas o en depósitos difusos no vasculares | Se han descrito, con mayor o menor densidad y con diferentes aspectos y localizaciones dependiendo de las especies, depósitos amiloideos en individuos de todas las especies de primates no humanos51,56,59,62,64,85,95–98, aunque la APP y el péptido amiloide sean similares a los encontrados en los mamíferos de órdenes evolutivos anteriores que no forman depósitos55. Predomina A-beta4053 y se asocia en los depósitos a ApoE497,99 y puede co-expresarse con tau en prosimios100. La relación con los depósitos vasculares es muy variable101,102. Aumentan la carga amiloidea con la edad, principalmente en lóbulo frontal y parietal. Poca densidad de depósitos en lóbulo occipital, corteza prefrontal y giro parahipocampal. No hay relación entre número de placas y daño cognoscitivo95,101 a amiloidosis se puede inducir experimentalmente103–104 |
| Amiloide perivascular | Depósitos marcados sobre vasos sanguíneos en muchos pro-simios y simios menos evolucionados52,101,102, y escasas acumulaciones en algunos simios más evolucionados de edades avanzadas96–99 |
| Ovillos neurofibrilares (depósitos intraneuronales inmunopositivos a Tau fosforilada) | No suelen observarse en primates no humanos, salvo en pro-simios, donde es evidente la neuropatología asociada a proteína Tau (Microcebus murinus52,57). En simios es difícil de ver, pues incluso se dudaba de que existieran alteraciones neurofibrilares, que se han puesto de manifiesto en los últimos años (Chlorocebus aethiops64, Pan Troglodithes105 |
| Neuritas distróficas inmunopositivas a Tau fosforilada | Presentes en animales con mayores cambios involutivos y mayor afección amiloidea100,106,107 |
Acumulaciones de beta-amiloide similares a placas, con formas e inmunorreactividad de iguales y de distintos tipos a los descritos en humanos, y otros depósitos beta-amiloideos difusos no vasculares se encuentran en animales seniles de casi todas las especies de primates no humanos, aumentando la carga de amiloide según avanza la edad. Sin embargo, solo algunos cerebros de macacos y chimpancés muestran, sobre todo en áreas telencefálicas, cambios degenerativos en somas neuronales y distrofias en neuritas junto a estos depósitos de amiloide51,95–100. Además, en algunos de estos últimos animales, se ven disminuciones de la función de sistemas neurotransmisores específicamente relacionados con la EA, especialmente el sistema colinérgico95. Los depósitos amiloideos perivasculares pueden aparecer asociados o no a otros signos neuropatológicos dependiendo de la especie y de la edad del individuo, siendo más abundantes en pro-simios y algunas especies de simios del nuevo mundo menos evolucionados57. La edad de aparición de la neuropatología amiloidea, tipo de depósito, localización y relación con otros signos neuropatológicos varía de manera considerable de una especie a otra y, también, de un individuo a otro dentro de la misma especie, ya que existen descripciones muy diferentes debidas a diversos autores. Estos depósitos amilodeos no se observan en pro-primates del orden Scandentia, como Tupaia belangeri (musaraña de árbol, originaria del sudeste de Asia)55. Las formas de los acúmulos son muy variadas y dependen de la especie, no siguiendo un plan de presentación muy acorde con el grado de evolución. En el mono Rhesus, se observan placas neuríticas, principalmente en el parénquima de la corteza cerebral, en el mono ardilla, abundan los depósitos perivasculares y en los chimpancés se observan mayoritariamente placas difusas96–99. En todos los casos, incluído Tupaia, se comprobó que la secuencia del péptido A-beta es idéntica a la del humano, mostrando hasta un 98% de similitud y un 97% de identidad con la proteína humana. En general, en los primates no humanos se acumula A-beta40 en mayor proporción que en el humano53. Dos estudios han demostrado que en primates no humanos existe una única isoforma de ApoE asociada a depósitos de amiloide y que es análoga a ApoE4 humana98,99.
De manera diferente a lo que ocurre con los depósitos de amiloide, la presencia de ovillos neurofibrilares intraneuronales no suele observarse en los primates no humanos. Como excepción llamativa se pueden mencionar dos especies que se caracterizan por una alta concentración de proteína tau fosforilada y no fosforilada. Estas especies con aparente taupatía o tauopatía figuran entre las menos evolucionadas (Microcebus murinus) y las más evolucionadas (Chlorocebus aethiops)51,57,64. En general, las dendritas distróficas inmunopositivas a la proteína tau fosforilada se encuentran en los animales con mayores cambios involutivos y mayor afección amiloidea, mostrándose en íntima relación con depósitos amiloideos en la mayoría de las regiones cerebrales estudiadas100. Como más adelante se comentará, estudios realizados en los últimos tiempos con técnicas más sensibles, han encontrado alteraciones relacionadas con la proteína tau en simios del viejo mundo, aunque no de las características que tienen en los humanos.
El metabolismo de las proteínas que pueden originar depósitos beta-amiloideos o neurofibrilares solo ha sido muy parcialmente estudiado en monos, pero parece que sigue las pautas descritas en humanos100,108–112.
Alteraciones cognoscitivas-comportamentales en primates no humanos senilesEl envejecimiento normal en humanos se ve acompañado por disminuciones de una gran variedad de dominios funcionales mentales en diversos ámbitos. No en todos ellos el deterioro es similar en cada individuo. Si centramos nuestra atención en algunas de estas funciones cerebrales superiores, como la memoria, el aprendizaje, la flexibilidad cognoscitiva (capacidad para resolver un problema mediante distintas estrategias), la atención y la regulación de las capacidades motoras, parece que lo mismo puede ocurrir en algunos de los primates no humanos basándonos en estudios publicados. Incluso, como sucede en humanos, cuando ocurre un deterioro cerebral senil, se puede llegar a observar una mejora de algunas de sus funciones (capacidad de regulación motora, de aprendizaje, de búsqueda de alternativas para solucionar problemas, etc.) si se lleva a cabo un determinado entrenamiento52,54,113.
De forma similar a lo que ocurre en los humanos ancianos, los primates no humanos seniles tardan más en aprender nuevas tareas y en desarrollar nuevas habilidades. Esto se ha comprobado mediante pruebas comportamentales y de estudio de daños cognoscitivos tales como las pruebas de respuesta retardada, en la que el animal ha de memorizar una localización espacial o reconocer objetos52,54,113, o en las pruebas de flexibilidad cognoscitiva, en las que se fuerza a buscar soluciones alternativas para resolver un mismo problema114. La memoria reciente también se ve afectada, así como la memoria a largo plazo. Numerosos estudios con monos ancianos, especialmente macacos, han demostrado que estos animales tienen dificultades crecientes para recordar diversos tipos de información52,58,114–118, y muchos de los resultados son muy similares a los que se obtienen de humanos enfrentados a las mismas pruebas, como cuando se les hacía recordar diversas localizaciones de una casa que se iban iluminando alternativamente119. Los resultados de estos estudios también refuerzan la idea de que la memoria mejora con la práctica y con un entrenamiento determinado117,120. En otros casos se han encontrado claras diferencias. En muchos humanos se puede observar una importante pérdida de atención con la edad, pero en los monos, esta disfuncionalidad, aunque reconocida en algunas monografías, no parece tener las mismas características. Así mismo, en estudios sobre la velocidad de respuesta tras un estímulo no se han apreciado muchas diferencias entre monos ancianos y monos jóvenes52,54. De todos estos trabajos sobre pérdidas de memoria y mejoras de las mismas tras los entrenamientos, se desprende también una importante conclusión: existen variaciones muy importantes en los resultados de las pruebas llevadas a cabo en animales de una misma especie y rango de edad debido a «factores endógenos» propios de cada individuo. Esto, que también ocurre en humanos, quiere decir que los deterioros cognoscitivo-comportamentales no acaecen de forma homogénea y son difíciles de estudiar y cuantificar tanto en la clínica como en la investigación119–124.
Aunque todas las disminuciones de las funciones cerebrales antes referidas han sido bien documentadas, no se encuentran descripciones, en primates no humanos, de situaciones cognoscitivo-comportamentales equivalentes a la de la demencia humana, que ya no es solo una disminución de las funciones cognoscitivas sino que es la suma de graves alteraciones o aberraciones en todas las funciones cognoscitivas superiores. Solamente en algunos simios (macacos, en especial) en fase senil se han encontrado cambios muy marcados en el comportamiento social o en las capacidades de aprendizaje y memoria que parecen ser diferentes a los de los congéneres de su mismo rango de edad51–54. Muy escasos son los grupos de primates no humanos que han sido estudiados comportamentalmente en vida y anatomopatológicamente tras su fallecimiento, aunque sean estos trabajos los más valiosos para abordar el problema de la posible EA en primates no humanos. En estos pocos trabajos se ha encontrado que existía, generalmente, un significativo mayor transtorno en el comportamiento social, en la realización de tareas aprendidas y en el aprendizaje de nuevas tareas en los animales seniles con importantes alteraciones amiloideas y con acusadas pérdidas neuronales52,54. Muchos de estos animales presentaban, además, una gran disminución de neuronas colinérgicas en el núcleo de Meynert90,91.
FinanciaciónEl trabajo ha sido financiado en su mayor parte con fondos propios de los laboratorios implicados en el período 2010-2011, por una ayuda del Plan Nacional (CTQ 2009-09538).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.









![Imágenes de cerebros de primates no humanos en comparación con el cerebro humano. Se conserva en las fotografías la proporcionalidad real. Se observa que junto al aumento de tamaño de la masa cerebral, progresivamente aumenta el número de circunvoluciones cerebrales, así como el volumen del cortex prefrontal y frontal. Entre paréntesis figura la longitud media del cuerpo (sin incluir la cola en las especies que la tienen) del primate adulto. Las imágenes proceden de University of Wisconsin and Michigan State Comparative Mammalian Brain Collections [consultado 26 Abr 2011]. Disponible en: http://brainmuseum.org/index.html. Imágenes de cerebros de primates no humanos en comparación con el cerebro humano. Se conserva en las fotografías la proporcionalidad real. Se observa que junto al aumento de tamaño de la masa cerebral, progresivamente aumenta el número de circunvoluciones cerebrales, así como el volumen del cortex prefrontal y frontal. Entre paréntesis figura la longitud media del cuerpo (sin incluir la cola en las especies que la tienen) del primate adulto. Las imágenes proceden de University of Wisconsin and Michigan State Comparative Mammalian Brain Collections [consultado 26 Abr 2011]. Disponible en: http://brainmuseum.org/index.html.](https://static.elsevier.es/multimedia/02134853/0000002700000006/v1_201305151149/S0213485311002520/v1_201305151149/es/main.assets/thumbnail/gr4.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)
![Imágenes de cortes cerebrales coronales de primates no humanos en comparación con el cerebro de rata y humano. Se conserva la proporcionalidad real en las imágenes (en las tres primeras, se complementa con una imagen aumentada para una mejor observación). Se puede apreciar que junto al incremento de tamaño de la masa cerebral, progresivamente aumenta el número de circunvoluciones cerebrales, una característica de los primates no humanos frente a la lisencefalia de los roedores (Cfp=corteza frontoparietal), así como el volumen del cortex parietal (Cp) y temporal (Ct). El hipocampo (Hc) se sitúa en posición dorsal en los prosimios (Lémur catta), de manera similar a lo que ocurre en los roedores (rata), observándose en posición ventral en los simios, al igual que en el humano. Entre paréntesis figura la longitud media del cuerpo (sin incluir la cola en las especies que la tienen) del primate adulto. Las imágenes de primates no humanos proceden de University of Wisconsin and Michigan State Comparative Mammalian Brain Collections [consultado 26 Abr 2011]. Disponible en: http://brainmuseum.org/index.html . Imágenes de cortes cerebrales coronales de primates no humanos en comparación con el cerebro de rata y humano. Se conserva la proporcionalidad real en las imágenes (en las tres primeras, se complementa con una imagen aumentada para una mejor observación). Se puede apreciar que junto al incremento de tamaño de la masa cerebral, progresivamente aumenta el número de circunvoluciones cerebrales, una característica de los primates no humanos frente a la lisencefalia de los roedores (Cfp=corteza frontoparietal), así como el volumen del cortex parietal (Cp) y temporal (Ct). El hipocampo (Hc) se sitúa en posición dorsal en los prosimios (Lémur catta), de manera similar a lo que ocurre en los roedores (rata), observándose en posición ventral en los simios, al igual que en el humano. Entre paréntesis figura la longitud media del cuerpo (sin incluir la cola en las especies que la tienen) del primate adulto. Las imágenes de primates no humanos proceden de University of Wisconsin and Michigan State Comparative Mammalian Brain Collections [consultado 26 Abr 2011]. Disponible en: http://brainmuseum.org/index.html .](https://static.elsevier.es/multimedia/02134853/0000002700000006/v1_201305151149/S0213485311002520/v1_201305151149/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)


