Existe un creciente número de estudios en esclerosis múltiple (EM) que abordan el uso terapéutico sintomático de la estimulación magnética transcraneal (EMT) en estos pacientes.
MétodosBúsqueda de artículos en PubMed, últimos libros y recomendaciones de las guías de práctica clínica y sociedades científicas publicadas más relevantes referentes al empleo de la EMT como terapia sintomática en la EM.
ConclusionesLos pulsos electromagnéticos excitatorios aplicados en el hemisferio cerebral afecto permiten optimizar la actividad cerebral funcional, incluyendo la transmisión de los impulsos nerviosos a través de la vía corticoespinal desmielinizada. Los diferentes estudios realizados sobre EMT han demostrado, sin poder definir nivel exacto de evidencia dada la ausencia de resultados replicados en un número suficiente de estudios controlados, de forma segura, la mejoría estadísticamente significativa de la espasticidad, la fatiga, la disfunción del tracto urinario inferior, la destreza manual, las alteraciones de la deambulación y los trastornos cognitivos relativos a la memoria de trabajo que aparecen en estos pacientes. Se precisa la realización de más ensayos clínicos controlados, aleatorizados, bien diseñados, que incluyan un mayor número de pacientes, para poder recomendar con un mayor nivel de evidencia y de forma generalizada la utilización adecuada de la EMT en los enfermos afectados por EM, la cual aporta su capacidad de adyuvancia sobre la acción de los otros tratamientos sintomáticos y fármacos inmunomoduladores. Así como estudios que investiguen específicamente la aplicación de la EMT repetitiva (EMTr) convencional sobre la fatiga, algo que no ha visto la luz hasta el momento.
A growing number of studies have evaluated the effects of transcranial magnetic stimulation (TMS) for the symptomatic treatment of multiple sclerosis (MS).
MethodsWe performed a PubMed search for articles, recent books, and recommendations from the most relevant clinical practice guidelines and scientific societies regarding the use of TMS as symptomatic treatment in MS.
ConclusionsExcitatory electromagnetic pulses applied to the affected cerebral hemisphere allow us to optimise functional brain activity, including the transmission of nerve impulses through the demyelinated corticospinal pathway. Various studies into TMS have safely shown statistically significant improvements in spasticity, fatigue, lower urinary tract dysfunction, manual dexterity, gait, and cognitive deficits related to working memory in patients with MS; however, the exact level of evidence has not been defined as the results have not been replicated in a sufficient number of controlled studies. Further well-designed, randomised, controlled clinical trials involving a greater number of patients are warranted to attain a higher level of evidence in order to recommend the appropriate use of TMS in MS patients across the board. TMS acts as an adjuvant with other symptomatic and immunomodulatory treatments. Additional studies should specifically investigate the effect of conventional repetitive TMS on fatigue in these patients, something that has yet to see the light of day.
Debido al creciente número de estudios contrastados que abordan el posible uso terapéutico de la estimulación magnética transcraneal (EMT) en la esclerosis múltiple (EM), hemos considerado apropiado elegir este tema para su desarrollo. Con esta premisa, hemos llevado a cabo una revisión sistemática de la literatura disponible acerca de esta opción diagnóstica y terapéutica de vanguardia. En lo referente a esta técnica prometedora, existe paulatinamente más evidencia científica en cuanto a su potencial capacidad de incidir de forma positiva en los síntomas que sufren estos pacientes, que a su vez causan con frecuencia un deterioro notable sobre su calidad de vida. Como métodos para elaborar el proyecto hemos realizado una búsqueda de artículos en PubMed, últimos libros y recomendaciones de las guías de práctica clínica y sociedades científicas publicadas más relevantes, referentes al empleo de la EMT como terapia sintomática en la EM, así como agente potenciador de la remielinización y sobre sus efectos a nivel del estrés oxidativo en el modelo murino de encefalomielitis autoinmune experimental (EAE).
Desarrollo¿Qué es la estimulación magnética transcraneal?ConceptoLa EMT representa una forma no invasiva de estimulación de la corteza cerebral y se erige como una herramienta técnica que amplía el abanico de posibilidades de estudio e investigación en neurociencias, y como una opción novedosa en el tratamiento de diversas enfermedades neuropsiquiátricas (Anexo 1. Material adicional en la web). Esta terapia vanguardista permite la estimulación segura, indolora e incruenta del tejido nervioso (corteza cerebral, médula espinal, vías motoras centrales y nervios periféricos), además de regular de forma controlada la actividad cerebral. Entre los cambios generados por la interacción de la EMT con la unidad celular-funcional cerebral que posee actividad eléctrica (la neurona) se encuentran los siguientes: electrofisiológicos (potenciales de membrana), bioquímicos y moleculares (señalización, neurotransmisores, genes, etc.) y celulares (crecimiento, diferenciación, etc.). Asimismo, la EMT también ejerce efectos sobre la conducta, el humor, la memoria, la mielinización y la neuroplasticidad1-4.
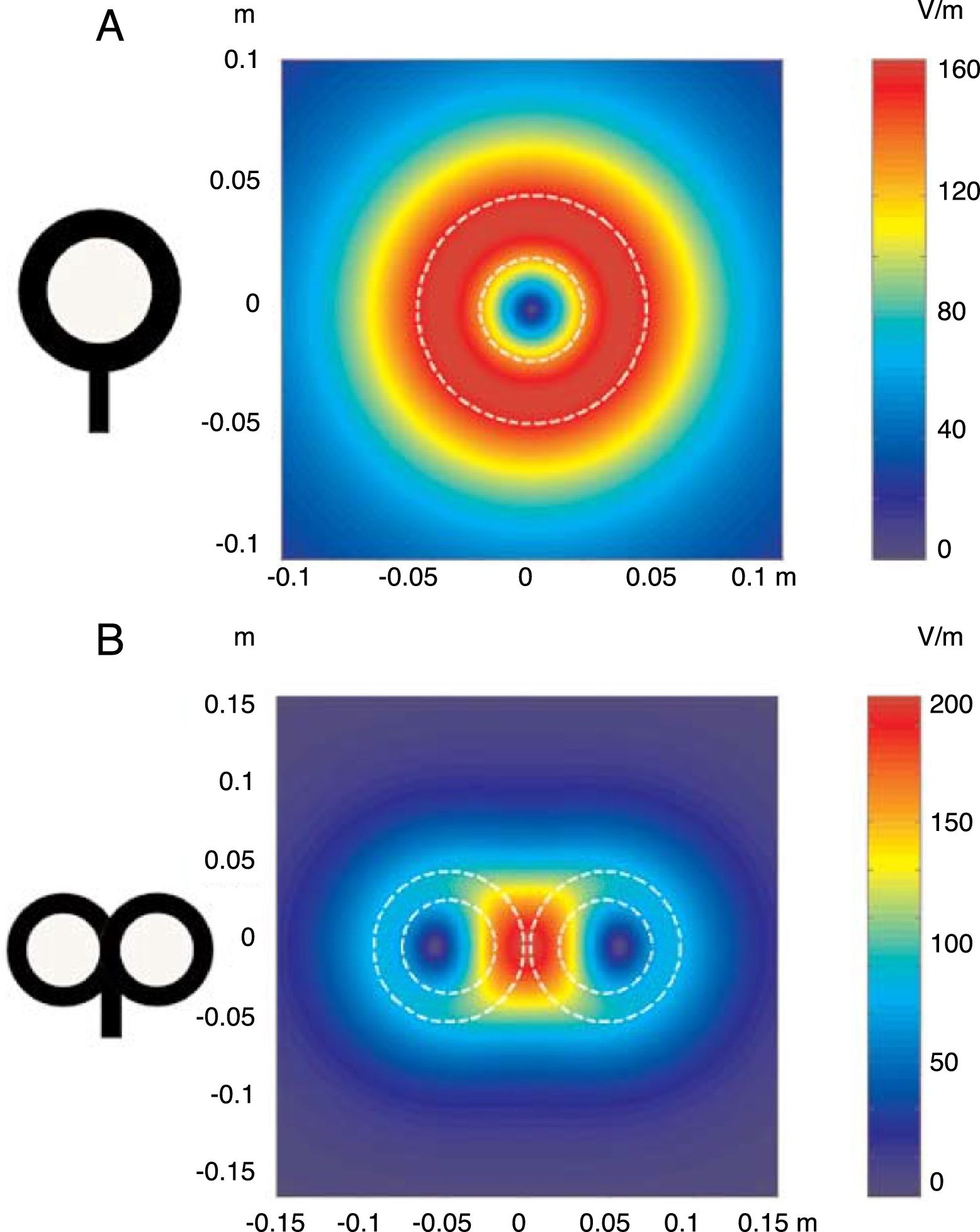
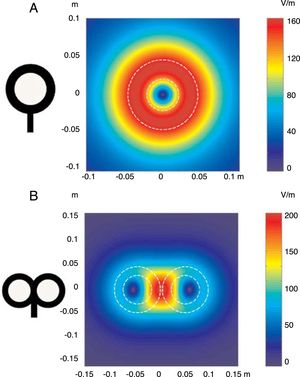
FundamentosLa EMT se basa en el principio de inducción electromagnética, descubierto por Michael Faraday en 1831. Dicho principio consiste en que todo campo eléctrico genera perpendicular a él un campo magnético, y viceversa (Anexo 2. Material adicional en la web). En la EMT se aplica un pulso de corriente eléctrica procedente de un condensador que fluye a través de una bobina de hilo conductor de cobre, recubierta de una carcasa de plástico, situada sobre la cabeza del paciente, que produce un campo magnético perpendicular a la misma. La frecuencia de cambio de este campo magnético determina la inducción de una corriente eléctrica secundaria en cualquier material conductor cercano. En el momento en que un pulso de corriente es conducido por la bobina de estimulación, se establece un campo magnético que pasa a través del cuero cabelludo y la calota craneal sin atenuarse (solamente decae con el cuadrado de la distancia). Las bobinas de estimulación más utilizadas son la circular y la que tiene forma de 8 (también llamada de mariposa). La bobina circular produce un campo eléctrico más amplio, permitiendo la estimulación simultánea de los dos hemisferios cerebrales. En cambio, la bobina en forma de 8 determina un campo electroestimulador más localizado (fig. 1). Estos pulsos magnéticos de intensidad específica dan lugar a una despolarización selectiva de neuronas de la corteza cerebral, ubicadas 1,5-2cm por debajo de la bóveda craneal. La corriente eléctrica actúa sobre las neuronas inhibiendo o estimulando sus efectos, modulando la energía obtenida a partir de sus orgánulos mitocondriales y afectando, en definitiva, a su función como mensajeros de señales eléctricas y a su supervivencia. Todo ello dependerá de la forma, del tamaño, del tipo y de la orientación de la bobina, de la fuerza (intensidad) del campo magnético y de la frecuencia y la duración de los pulsos magnéticos transferidos (fig. 2A y B)1-11:
- ∘
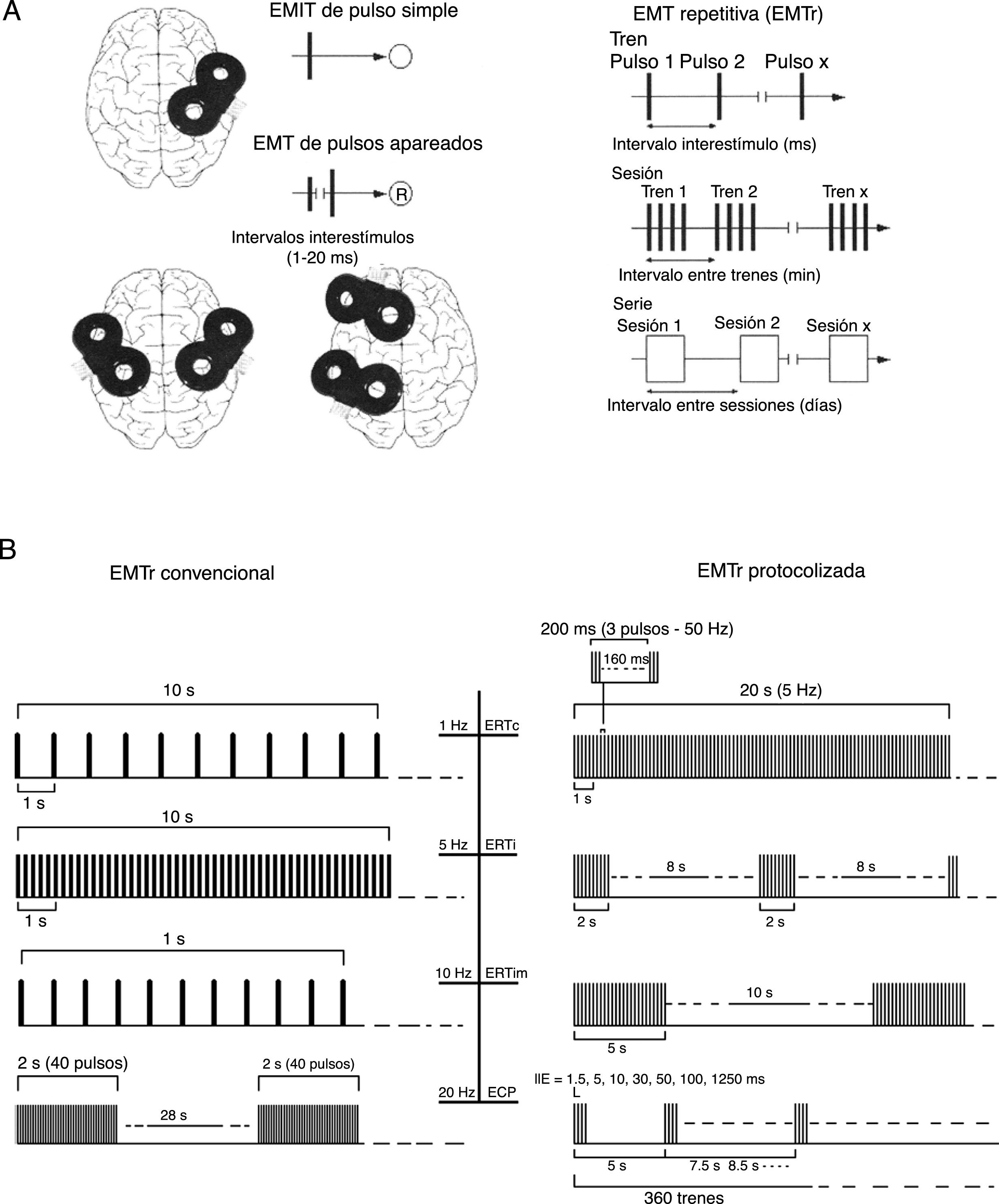
La EMT simple (de pulso único) produce un solo estímulo sobre una determinada región cerebral que despolariza neuronas corticales, originando un potencial evocado motor (PEM) en un área muscular del hemicuerpo contralateral.
- ∘
La EMT de pulsos pareados o apareados genera dos estímulos de idéntica o diferente intensidad (separados por un intervalo de varios milisegundos [ms]), los cuales se aplican sobre un área o sobre diferentes áreas corticales. Esta técnica permite explorar la excitabilidad intra y corticocortical, además de la integridad de la conectividad interhemisférica y el tiempo de conducción transcalloso.
- ∘
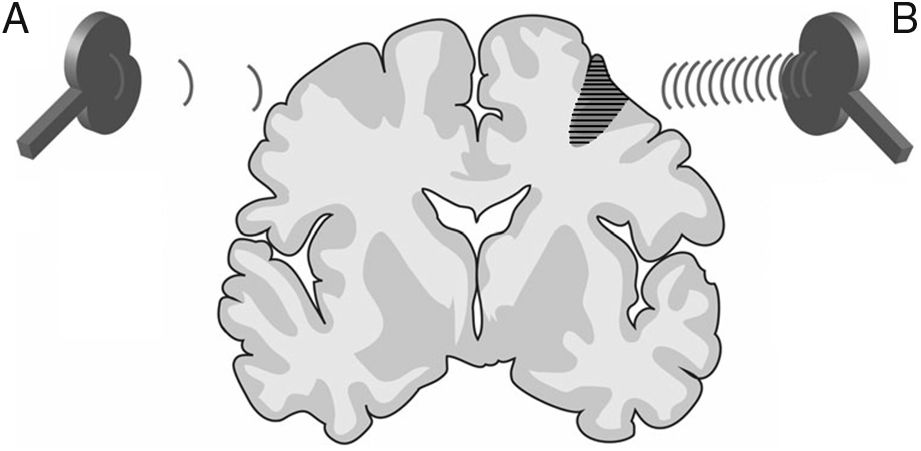
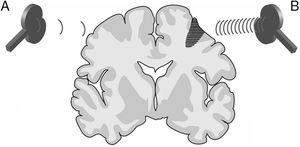
La estimulación magnética transcraneal repetitiva (EMTr) crea un tren de pulsos de baja frecuencia (≤1Hz, con un rango de 0,5-1Hz) o alta frecuencia (≥5Hz, con un rango de 5-20Hz), durante tiempos muy cortos (ms), proporcionando la capacidad de producir cambios en la excitabilidad corticoespinal, ocasionando efectos reguladores neuronales que perduran más allá del tiempo que abarca la propia sesión de EMTr. Estas propiedades la han convertido en la modalidad de EMT más empleada con fines terapéuticos (fig. 3).
Figura 3.Imagen representativa de un corte coronal de un cerebro humano. Modalidades de estimulación magnética transcraneal repetitiva (EMTr) para fomentar la neuroplasticidad. A)EMTr de baja frecuencia (≤1Hz) en el hemisferio cerebral sano, contralateral a una lesión corticosubcortical (zona sombreada más oscura con rayas horizontales), para disminuir la inhibición recíproca ejercida sobre el hemisferio afecto. B)EMTr de alta frecuencia (≥5Hz) en el hemisferio ipsilateral a la lesión para estimular la actividad neuronal y favorecer la reorganización de las redes interneuronales. Adaptada de Edwardson et al.9.
Distribución de los campos eléctricos inducidos por una bobina de estimulación circular (A) y una bobina en forma de 8 (B). La bobina circular tiene 41,5mm de diámetro en la espira interior, 91,5mm en la espira exterior (promedio de 66,5mm) y 15 espiras de hilo de cobre. La bobina en forma de 8 tiene 56mm de diámetro en la espira interior, 90mm de diámetro en la espira exterior (promedio de 73mm) y 9 espiras de hilo de cobre en cada ala. La morfología externa de cada espira se dibuja con líneas blancas discontinuas sobre la imagen de los campos inducidos. La amplitud del campo eléctrico se calcula para un plano 20mm por debajo en un modelo realístico de la bobina (di/dt=A/μs). di/dt representa la derivada de la intensidad de la corriente con respecto al tiempo (pendiente de crecimiento de la corriente), cuya relación viene dada en amperios por microsegundo (A/μs). Si una intensidad pasa de 0 a 40A en 2μs, se obtiene una relación di/dt=40A/2μs; simplificando, 20A/μs.m: metros; V/m: voltios/m. Adaptada de Pascual-Leone y Tormos-Muñoz2.
A) Esquema iconográfico de las modalidades de aplicación de la EMT: pulsos simples, pulsos pareados en una o dos áreas corticales diferentes del cerebro y EMTr (lenta [de baja frecuencia] ≤1Hz y rápida [de alta frecuencia] ≥5Hz). EMT: estimulación magnética transcraneal; EMTr: estimulación magnética transcraneal repetitiva; ®: respuesta. Adaptada de Pascual-Leone y Tormos-Muñoz2.
B) Panel izquierdo (EMTr convencional [aplicación de pulsos únicos de EMT repetidos regularmente]). Desde la parte superior: ejemplos de 10s de EMTr a 1Hz (primer trazado) y a 5Hz (segundo trazado); 1s de EMTr a 10Hz y ejemplo típico de aplicación de EMTr a 20Hz para fines terapéuticos (trenes de 2s entrelazados por una pausa de 28s). Panel derecho (EMTr protocolizada [aplicación repetitiva de ráfagas cortas de EMTr a una frecuencia interna alta intercalada por breves pausas sin estimulación]). Desde la parte superior: 20s de ERTc (primer trazado); ERTi (segundo trazado) y ERTim (tercer trazado). El cuarto trazado representa protocolos de ECP.
ECP: estimulación de cuádruple pulso; ERT: estimulación de ráfagas theta; ERTc: estimulación de ráfagas theta continua; ERTi: estimulación de ráfagas theta intermitente; ERTim: estimulación de ráfagas theta intermedia; IIE: intervalos interestímulo. Adaptada de Rossi et al.5.
Como tipos especiales de EMT se identifican:
- 1.
Estimulación de ráfagas theta (ERT) (theta burst). Se trata de otra forma de EMTr que se caracteriza por la aplicación de frecuencias ≥50Hz de la siguiente forma: pulsos de EMT administrados a razón de ráfagas de 3 pulsos de 50Hz cada 200ms. Presenta dos modalidades con diferentes protocolos posibles, si bien la mayoría tratan de replicar los dos originales diseñados por Huang et al.7:
- a)
Intermitente (de naturaleza excitatoria): 600pulsos administrados en 20 trenes de 2s de ráfagas theta (partiendo del patrón de 3pulsos cada 200ms por ráfaga, en esta modalidad que emplea trenes de 2s de ráfagas equivaldría a 30pulsos/tren) cada 10s (es decir, 2s de ráfagas theta seguidas de 8s de descanso), lo cual deriva en una potenciación a largo plazo de la neuroplasticidad.
- b)
Continua (de esencia inhibitoria): aplicación de trenes de ráfagas theta (3 pulsos de 50Hz cada 200ms), a 5Hz durante 20s (300pulsos en total) o 40s (600pulsos en total). Con un resultado de un decremento en la excitabilidad cortical, constatado por una reducción prolongada del tamaño del PEM.
- a)
- 2.
Estimulación de cuádruple pulso (ECP): tipo de EMTr caracterizada por repetición de trenes de cuatro pulsos monofásicos separados por intervalos interestímulos de 1,5-1.250 ms, produciendo bien una facilitación (a intervalos cortos) o una inhibición (a intervalos más largos) cortical, probablemente a través de una acción sobre circuitos excitatorios intracorticales (Hamada et al.8).
- 3.
Estimulación de extremada baja frecuencia (EEBF): definida por una aplicación continua a 60 Hz y 0,7 militeslas (mT) y utilizada de manera experimental en modelos animales, con resultados verdaderamente sorprendentes en procesos que simulan patologías como las enfermedades de Huntington y Parkinson, así como procesos desmielinizantes (Guerriero y Ricevuti11).
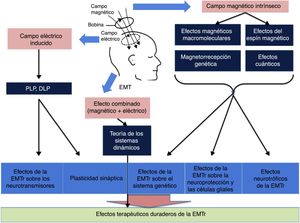
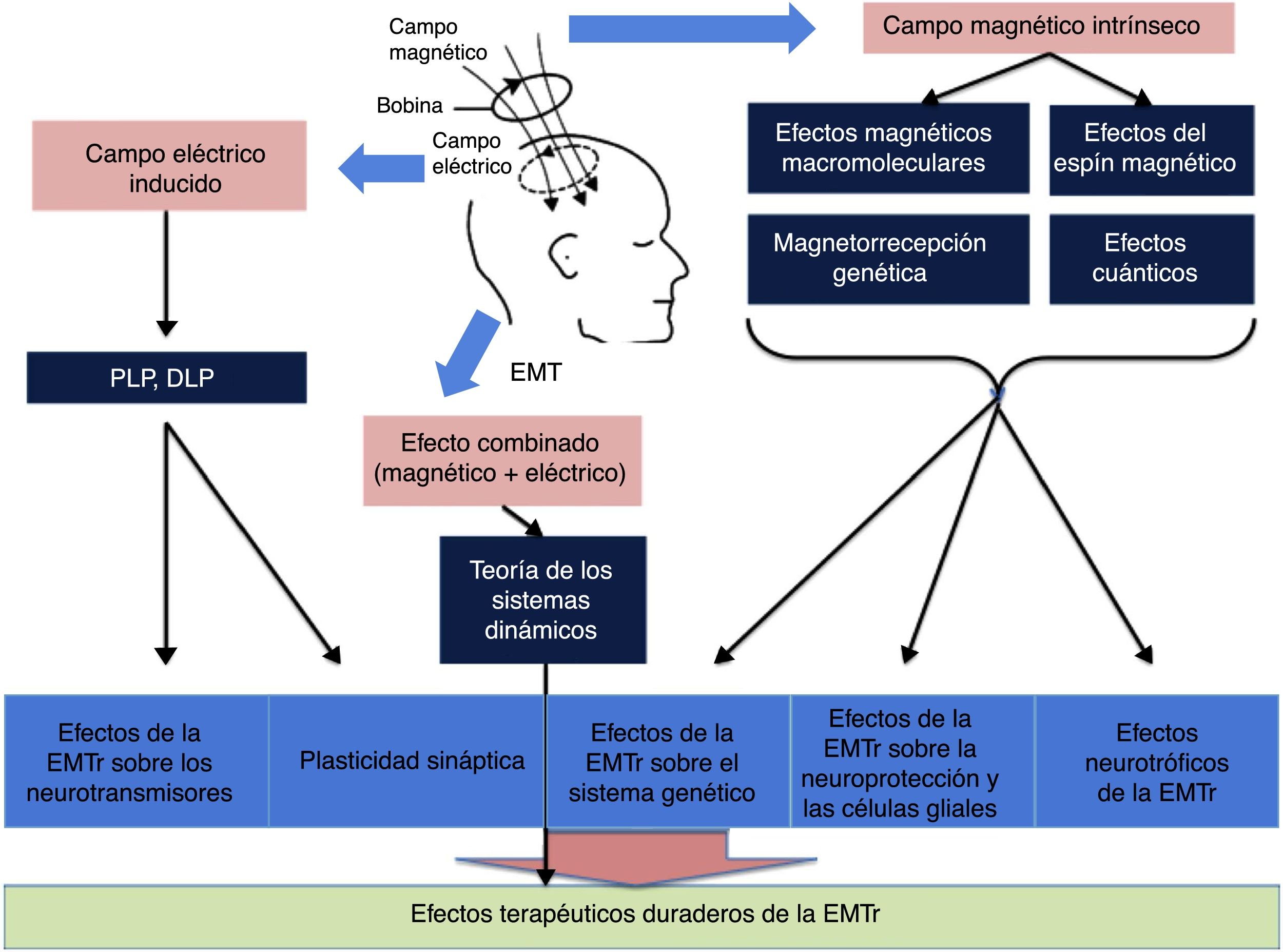
Los mecanismos más profundos (bioquímicos, moleculares y celulares) por los que la EMTr produce sus efectos terapéuticos están empezando a descubrirse y entenderse (fig. 4)12. La mayoría de los investigadores consideran que parte de los efectos terapéuticos duraderos de la EMTr están probablemente relacionados con dos fenómenos: la potenciación a largo plazo (PLP) y la depresión a largo plazo (DLP)13. Ambos fenómenos se deben a cambios celulares y moleculares implicados en la neuroplasticidad generados por el campo eléctrico inducido. La EMTr favorece estos mecanismos activando en una primera vía los receptores NMDA (N-metil-D-aspartato) y AMPA (α-amino-3-hidroxi-5-metilo-4-isoxazolpropiónico) —ambos receptores para el glutamato permiten la entrada de calcio en la neurona, lo que genera una cascada de señales y la activación de segundos mensajeros que participan en la neuroplasticidad—, así como modulando la liberación de ciertos neurotransmisores como dopamina y serotonina1. Por otro lado, el campo magnético intrínseco, a través de efectos magnéticos macromoleculares, del espín o rotación magnética, de magnetorrecepción genética y cuánticos, sería la base de sustentación para la influencia de la EMTr sobre la expresión de genes que codifican el BDNF y el factor de crecimiento nervioso, así como a nivel de las células gliales inhibiendo mecanismos apoptóticos, junto con activación de fenómenos neurotróficos (germinación y crecimiento de las dendritas neuronales) a través del BDNF. Por último, la acción combinada electromagnética, a través de la teoría de los sistemas dinámicos, se sumaría a la acción de los campos eléctrico y magnético por separado para dar lugar a los efectos terapéuticos duraderos de la EMTr12,13.
Esquema general de la influencia de los campos magnético y eléctrico. DLP: depresión a largo plazo; EMT: estimulación magnética transcraneal; EMTr: estimulación magnética transcraneal repetitiva; PLP: potenciación a largo plazo. Adaptada de Chervyakov et al.12.
Hoy en día se conoce que la EMTr, incidiendo favorablemente en la neuroplasticidad, confiere efectos neuroprotectores que ayudan, al menos temporalmente, a personas afectadas por diversas enfermedades neuropsiquiátricas. Por todo ello, se ha investigado el posible uso de la EMTr como tratamiento coadyuvante de las siguientes enfermedades y trastornos (si bien aún se precisan estudios más amplios y mejor diseñados para clarificar el nivel de evidencia exacto de la aplicación de la EMTr en gran parte de ellos)1,14-29:
- •
Procesos psiquiátricos: trastornos del estado de ánimo (depresión mayor resistente al tratamiento farmacológico, depresión postparto, distimia, manía, trastorno bipolar, etc.), esquizofrenia, trastornos de ansiedad (trastorno obsesivo-compulsivo, trastorno por estrés postraumático, etc.), autismo, trastorno por déficit de atención e hiperactividad, disfemia, trastornos por abuso de sustancias, enuresis nocturna monosintomática, etc.
- •
Enfermedades neurológicas: ictus, epilepsia farmacorrefractaria, enfermedad de Parkinson, temblor esencial, enfermedad de Huntington, enfermedad de Alzheimer, distonía focal, traumatismo craneoencefálico, trastornos de la marcha, migraña con aura, neuralgia del trigémino, EM, esclerosis lateral amiotrófica, etc.
- •
Otros procesos nosológicos: dolor crónico en el síndrome del miembro fantasma, dolor neuropático, fibromialgia, dolor visceral, síndrome de dolor regional complejo tipo I (antigua distrofia simpático-refleja), dolor facial atípico, tinnitus, etc.
Las principales contraindicaciones relativas que la EMT tiene son mujeres en período de gestación y niños menores de 2años. En cuanto a las absolutas se encuentran: pacientes con epilepsia no controlada y enfermos con dispositivos electrónicos corporales (marcapasos, desfibriladores implantables, estimuladores del nervio vago, electrodos de estimulación cerebral profunda, bombas de insulina, etc.), elementos ferromagnéticos intracraneales y/o en la superficie de 30cm alrededor del área de tratamiento (placas, tornillos, válvulas de derivación ventriculoperitoneal, stents, bisutería, implantes cocleares y/o dentales, etc.; es segura en pacientes portadores de componentes de titanio, por ejemplo coils o espirales endovasculares a nivel de aneurismas encefálicos)5,30-32.
Efectos secundariosLa EMT es una técnica segura5,33. Algunos pacientes pueden experimentar efectos adversos tras su aplicación, que se consideran leves y pasajeros, tales como dolores a nivel cefálico y/o cervical, y que, en la infrecuente situación de persistencia, se mitigan mediante la toma de analgésicos convencionales. No obstante, se ha descrito un caso de un episodio de cefalea trigémino-autonómica tras la administración de EMTr de alta frecuencia, el cual cedió tras la suspensión de las sesiones de EMTr y la toma continuada de indometacina 50mg/día34. Por otro lado, el riesgo de presentar crisis epilépticas durante la EMTr es muy bajo y no se ha demostrado que la EMTr incremente el riesgo de desarrollar crisis epilépticas en pacientes epilépticos conocidos y controlados adecuadamente con tratamiento antiepiléptico, una vez finalizada la sesión de estimulación; el riesgo de desarrollar otros eventos adversos es en estos pacientes similar al inherente a la aplicación de la EMTr en otras condiciones en sujetos sanos35. En lo que respecta a los pacientes con EM, se ha demostrado que la EMT puede aumentar el riesgo de desencadenar crisis epilépticas, por lo que debe evitarse en los pacientes con historia de epilepsia no controlada y debe usarse con precaución en pacientes con EM que presentan lesiones corticales y/o extensas lesiones yuxtacorticales36,37.
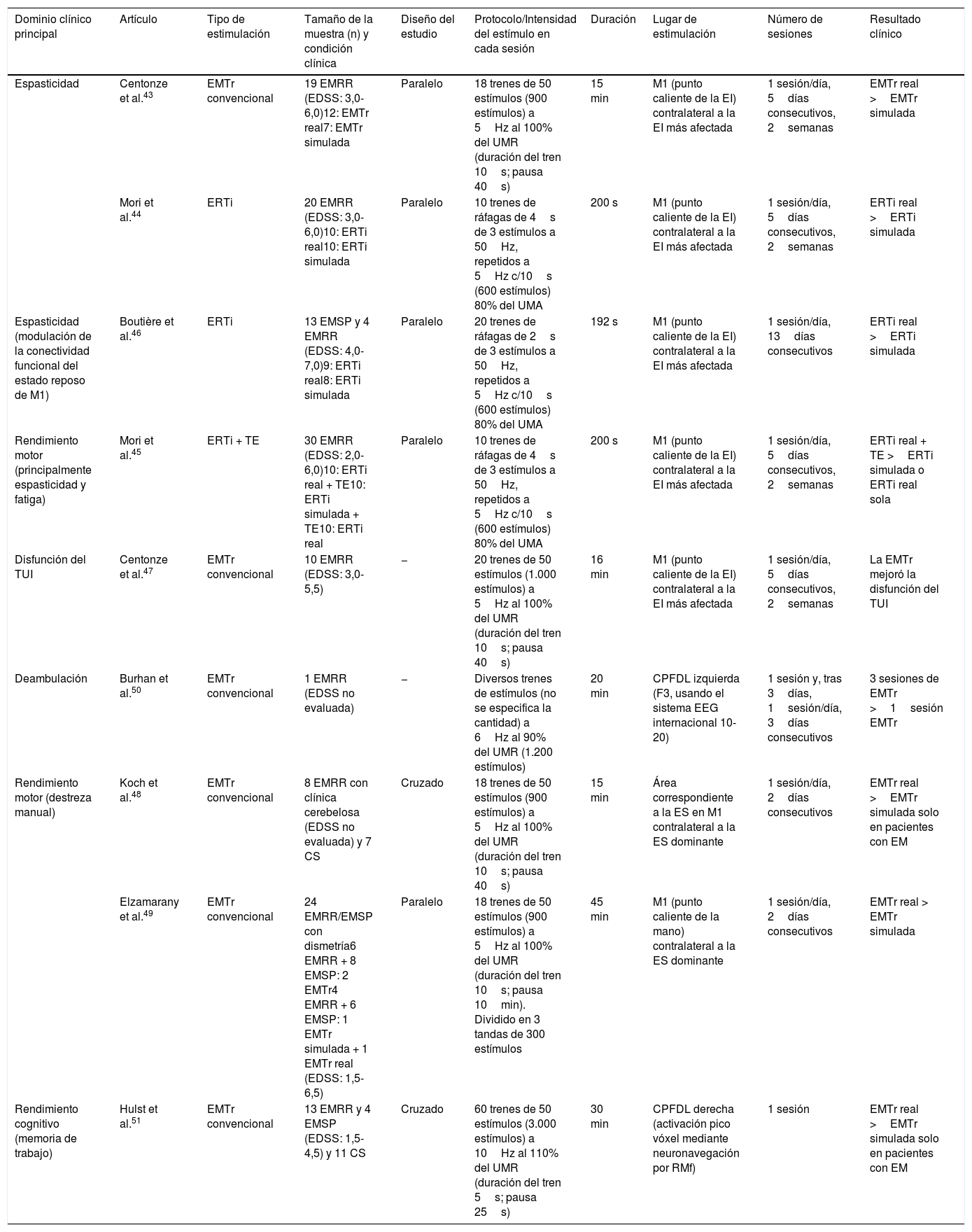
Aplicaciones terapéuticas de la EMTr en la esclerosis múltipleLa EM es una enfermedad desmielinizante del SNC, hoy en día incurable, que representa en la actualidad la causa más frecuente de discapacidad neurológica no traumática en adultos jóvenes38-41. Los trastornos motores tales como fatiga, espasticidad y alteraciones de la marcha y la destreza manual son comunes en la EM y conducen a la generación de discapacidad y deterioro en la calidad de vida de los pacientes. Algunas terapias novedosas han mejorado el manejo de esta enfermedad. Sin embargo, los fármacos actualmente disponibles para la EM son parcialmente efectivos en algunos pacientes, sobre todo en aquellos con formas progresivas de la enfermedad, y generalmente no en todos los casos modifican su curso progresivo, por lo que todavía se necesitan alternativas terapéuticas36,40. La EMT es un método no invasivo que, al crear un campo magnético con una bobina de estimulación cerca de la región cefálica del paciente, provoca la aparición de pequeñas corrientes eléctricas en la región cerebral inmediatamente subyacente a la bobina que ejercen algunos efectos beneficiosos42, siendo la modalidad más ampliamente utilizada la EMTr, aunque también la ERT y la EEBF. Otras aplicaciones potencialmente útiles de la administración de la EMTr en la EM tienen como objetivo lograr la neuromodulación con una finalidad terapéutica. En los últimos dos decenios numerosos estudios han evaluado el efecto terapéutico de la EMTr en diferentes condiciones neuropsiquiátricas (ver apartado «Aplicaciones terapéuticas globales»), y su uso está aprobado, desde octubre de 2008, por la estadounidense Food and Drug Administration (FDA) en el tratamiento de la depresión resistente a al menos un fármaco antidepresivo14,40. En este ámbito de intervención neuroterapéutica existen una serie de estudios pivotales que han demostrado tanto una mejoría de la espasticidad (tabla 1) (Centonze et al.43, Mori et al.44,45, Boutière et al.46) como de la disfunción urinaria (Centonze et al.47), la destreza manual (Koch et al.48, Elzamarany et al.49), la deambulación (Burhan et al., 201550) y la memoria de trabajo, la activación cerebral y la conectividad funcional (Hulst et al.51) después de la aplicación del tratamiento con EMT en sus diferentes modalidades en los pacientes con EM, fundamentalmente la EMTr, que se comentarán más detenidamente a continuación. En lo que respecta a la fatiga (Mori et al.45), llevaron a cabo un estudio para evaluar si la EMT, en la modalidad de la ERTi mejoraba los efectos de la terapia física en pacientes sobre la discapacidad en pacientes con EM, encontrándose un efecto positivo sobre la fatiga, sin haberse replicado dichos resultados en otro estudio con ERTi, ni tampoco habiéndose evaluado de forma específica los efectos de la aplicación de la EMT en la modalidad de EMTr convencional como estrategia terapéutica sobre este síntoma en pacientes con EM, quedando pendientes de ser determinados los posibles resultados beneficiosos de la EMTr convencional en este contexto sintomático52.
Estudios pivotales realizados sobre la aplicación terapéutica de la estimulación magnética transcraneal repetitiva (EMTr) en pacientes con esclerosis múltiple (EM)
| Dominio clínico principal | Artículo | Tipo de estimulación | Tamaño de la muestra (n) y condición clínica | Diseño del estudio | Protocolo/Intensidad del estímulo en cada sesión | Duración | Lugar de estimulación | Número de sesiones | Resultado clínico |
|---|---|---|---|---|---|---|---|---|---|
| Espasticidad | Centonze et al.43 | EMTr convencional | 19 EMRR (EDSS: 3,0-6,0)12: EMTr real7: EMTr simulada | Paralelo | 18 trenes de 50 estímulos (900 estímulos) a 5Hz al 100% del UMR (duración del tren 10s; pausa 40s) | 15 min | M1 (punto caliente de la EI) contralateral a la EI más afectada | 1 sesión/día, 5días consecutivos, 2semanas | EMTr real >EMTr simulada |
| Mori et al.44 | ERTi | 20 EMRR (EDSS: 3,0-6,0)10: ERTi real10: ERTi simulada | Paralelo | 10 trenes de ráfagas de 4s de 3 estímulos a 50Hz, repetidos a 5Hz c/10s (600 estímulos) 80% del UMA | 200 s | M1 (punto caliente de la EI) contralateral a la EI más afectada | 1 sesión/día, 5días consecutivos, 2semanas | ERTi real >ERTi simulada | |
| Espasticidad (modulación de la conectividad funcional del estado reposo de M1) | Boutière et al.46 | ERTi | 13 EMSP y 4 EMRR (EDSS: 4,0-7,0)9: ERTi real8: ERTi simulada | Paralelo | 20 trenes de ráfagas de 2s de 3 estímulos a 50Hz, repetidos a 5Hz c/10s (600 estímulos) 80% del UMA | 192 s | M1 (punto caliente de la EI) contralateral a la EI más afectada | 1 sesión/día, 13días consecutivos | ERTi real >ERTi simulada |
| Rendimiento motor (principalmente espasticidad y fatiga) | Mori et al.45 | ERTi + TE | 30 EMRR (EDSS: 2,0-6,0)10: ERTi real + TE10: ERTi simulada + TE10: ERTi real | Paralelo | 10 trenes de ráfagas de 4s de 3 estímulos a 50Hz, repetidos a 5Hz c/10s (600 estímulos) 80% del UMA | 200 s | M1 (punto caliente de la EI) contralateral a la EI más afectada | 1 sesión/día, 5días consecutivos, 2semanas | ERTi real + TE >ERTi simulada o ERTi real sola |
| Disfunción del TUI | Centonze et al.47 | EMTr convencional | 10 EMRR (EDSS: 3,0-5,5) | − | 20 trenes de 50 estímulos (1.000 estímulos) a 5Hz al 100% del UMR (duración del tren 10s; pausa 40s) | 16 min | M1 (punto caliente de la EI) contralateral a la EI más afectada | 1 sesión/día, 5días consecutivos, 2semanas | La EMTr mejoró la disfunción del TUI |
| Deambulación | Burhan et al.50 | EMTr convencional | 1 EMRR (EDSS no evaluada) | − | Diversos trenes de estímulos (no se especifica la cantidad) a 6Hz al 90% del UMR (1.200 estímulos) | 20 min | CPFDL izquierda (F3, usando el sistema EEG internacional 10-20) | 1 sesión y, tras 3días, 1sesión/día, 3días consecutivos | 3 sesiones de EMTr >1sesión EMTr |
| Rendimiento motor (destreza manual) | Koch et al.48 | EMTr convencional | 8 EMRR con clínica cerebelosa (EDSS no evaluada) y 7 CS | Cruzado | 18 trenes de 50 estímulos (900 estímulos) a 5Hz al 100% del UMR (duración del tren 10s; pausa 40s) | 15 min | Área correspondiente a la ES en M1 contralateral a la ES dominante | 1 sesión/día, 2días consecutivos | EMTr real >EMTr simulada solo en pacientes con EM |
| Elzamarany et al.49 | EMTr convencional | 24 EMRR/EMSP con dismetría6 EMRR + 8 EMSP: 2 EMTr4 EMRR + 6 EMSP: 1 EMTr simulada + 1 EMTr real (EDSS: 1,5-6,5) | Paralelo | 18 trenes de 50 estímulos (900 estímulos) a 5Hz al 100% del UMR (duración del tren 10s; pausa 10min). Dividido en 3 tandas de 300 estímulos | 45 min | M1 (punto caliente de la mano) contralateral a la ES dominante | 1 sesión/día, 2días consecutivos | EMTr real > EMTr simulada | |
| Rendimiento cognitivo (memoria de trabajo) | Hulst et al.51 | EMTr convencional | 13 EMRR y 4 EMSP (EDSS: 1,5-4,5) y 11 CS | Cruzado | 60 trenes de 50 estímulos (3.000 estímulos) a 10Hz al 110% del UMR (duración del tren 5s; pausa 25s) | 30 min | CPFDL derecha (activación pico vóxel mediante neuronavegación por RMf) | 1 sesión | EMTr real >EMTr simulada solo en pacientes con EM |
CPFDL: corteza prefrontal dorsolateral; CS: controles sanos; EDSS: escala ampliada del estado de discapacidad de Kurtzke; EI: extremidad inferior; EM: esclerosis múltiple;
EMTr: estimulación magnética transcraneal repetitiva; ERTi: estimulación de ráfagas theta intermitente; ES: extremidad superior; RMf: resonancia magnética funcional; RR: remitente-recurrente; SP: secundaria progresiva; TE: terapia con ejercicios; TUI: tracto urinario inferior; UMA: umbral motor activo; UMR: umbral motor en reposo. Adaptada de Iodice et al.39.
Centonze et al.43, con el objetivo de investigar si la EMTr era capaz de modificar la espasticidad en la EM, emplearon los protocolos EMTr de alta (5Hz) y baja frecuencia (1Hz), así como de EMTr simulada a nivel de la corteza motora primaria (M1), en 19 pacientes con EM remitente-recurrente (EMRR) (criterios de McDonald [McDonald et al.53), una puntuación en la escala ampliada del estado de discapacidad (EDSS) de Kurtzke54 entre 3,0 y 6,0 y una espasticidad con afectación predominante o exclusiva de una extremidad inferior. En primer lugar se aplicó una sola sesión de protocolos de EMTr de alta (5Hz) y baja frecuencia (1Hz) para comprobar los posibles efectos transitorios de ambos tratamientos sobre la relación H/M (índice neurofisiológico fiable de la excitabilidad a nivel espinal), el reflejo H y la respuesta M, además de en la amplitud y la latencia del PEM y en el tiempo de conducción motora central (TCMC). En un ensayo posterior se aplicaron sesiones repetidas de EMTr de 5Hz durante un período de 2semanas para inducir una posible mejoría clínica persistente de la espasticidad de las extremidades inferiores, cuantificada neurofisiológicamente mediante la relación H/M, el reflejo H y la respuesta M, así como clínicamente mediante la escala modificada de Ashworth (EMA)55. Como resumen de los hallazgos, se puede inferir que una sola sesión de EMTr de 5Hz sobre la región de M1 que involucra a la extremidad inferior inhibió el reflejoH (reduciendo la actividad refleja a nivel de la médula espinal) e incrementó la amplitud del PEM, disminuyendo por tanto la relación de la amplitud H/M e incrementando la excitabilidad corticoespinal medida de forma indirecta mediante la amplitud del PEM, mientras que la EMTr de 1Hz tuvo el efecto contrario. Las sesiones individuales no indujeron ningún efecto sobre la espasticidad. Asimismo, se observó una mejoría significativa de la espasticidad de las extremidades inferiores cuando se repitieron las sesiones de EMTr de 5Hz durante un período de 2semanas, siendo la mejoría clínica duradera (al menos 7días tras finalizar el tratamiento con EMTr real). Sin embargo, no se obtuvo ningún efecto después de la EMTr simulada de 2semanas. Como conclusiones, los autores de dicho estudio afirmaron que la EMTr excitatoria podría servir como herramienta terapéutica para mejorar la espasticidad en pacientes con EM, siendo posible que los efectos beneficiosos de la EMTr sobre la espasticidad pudieran estar facilitados, al menos en parte, por la modulación duradera de circuitos espinales complejos como el que media la vía corticoespinal en el control presináptico de las fibras aferentes sensitivasIa a nivel del REM. Sin descartarse una posible mediación adyuvante de vías transcallosas en el efecto modulador obtenido, así como tampoco la activación de otros circuitos sensitivos durante la inducción de los PEM mediante la EMTr, precisándose la realización de más estudios para dilucidar esta hipótesis causal43.
La ERTi disminuye la espasticidad en la esclerosis múltipleMori et al.44 realizaron un estudio con el objetivo de evaluar si un protocolo de EMTr, en este caso la ERTi, era eficaz en la modulación de la espasticidad de las extremidades inferiores de estos pacientes. Para ello, 20 pacientes con EMRR (criterios de McDonald et al.53), con una EDSS54 entre 3,0 y 6,0 y espasticidad predominante o exclusiva a nivel de un miembro inferior, fueron pseudoaleatorizados a recibir durante 2semanas sesiones diarias de ERTi real o simulada. Como métodos de evaluación de la espasticidad se usaron la relación de amplitud H/M del músculo sóleo y la EMA55, antes y después de los protocolos de ERTi. Como resultados, los pacientes que recibieron ERTi real mostraron una reducción significativa de la relación de amplitud H/M tras la primera semana de ERTi real (S2) y de la puntuación de la EMA55 tras la segunda semana de ERTi real (S3), persistiendo hasta 2semanas después de finalizar el protocolo de ERTi real (S5) en el caso de la relación H/M y una semana después en cuanto a la puntuación de la EMA55 (S4). El estudio concluyó que la ERTi es un protocolo seguro, no invasivo, bien tolerado y factible como herramienta prometedora para el tratamiento de la espasticidad en la EM44.
La ERTi potencia los efectos de la terapia física sobre la espasticidadMori et al.45, basándose en que la terapia con ejercicios (TE) puede ser beneficiosa y que la ERTi induce cambios a largo plazo de la excitabilidad de la corteza cerebral y es capaz de reducir la espasticidad en pacientes con EM discapacitados, analizaron si la combinación de ERTi y un programa de TE podía mejorar la discapacidad motora en estos pacientes. Para ello confeccionaron un ensayo clínico, doble ciego, controlado con ERTi simulada, reclutando a 30 pacientes con EMRR (criterios de McDonald et al.53) con una EDSS54 entre 2,0 y 6,0 y espasticidad predominante o exclusiva a nivel de una extremidad inferior, siendo aleatorizados a recibir 3 intervenciones: ERTi real +TE, ERTi simulada +TE y ERTi sola. Antes y después de las 2semanas de tratamiento se tomaron medidas de la espasticidad (EMA55 y escala de severidad de espasticidad en la EM de 88ítems [MSSS-88]), la fatiga (escala de severidad de la fatiga [FSS]), las actividades básicas de la vida diaria (ABVD) (índice de Barthel) y de la calidad de vida relacionada con la salud (escala de la calidad de vida en EM de 54ítems [MSQoL-54]). En cuanto a los resultados, se demostró que la ERTi real +TE redujeron las puntuaciones en la EMA55, la MSSS-88 y la FSS, mientras que en el índice Barthel y el MSQoL-54 (compuesto físico) aumentaron, traduciendo una mejoría. La ERTi real sola únicamente redujo la puntuación en la EMA55, mientras que ninguna de las escalas medidas mostró cambios significativos tras la aplicación de la ERTi simulada +TE. Como conclusión, se pudo inferir que la ERTi asociada a la TE constituye un enfoque terapéutico prometedor para la rehabilitación motora de pacientes con EM, ya que puede incidir favorablemente tanto sobre los síntomas negativos (fatiga) como sobre los síntomas positivos (espasticidad)45.
La ERTi reduce la espasticidad en la esclerosis múltiple a través de la modulación de la conectividad funcional del estado reposo de la corteza motora primaria (M1)Boutière et al.46, partiendo de la premisa de que la ERTi administrada a nivel de M1 mejora transitoriamente la espasticidad de miembros inferiores en la EM, diseñaron un estudio con el objetivo de evaluar si la modulación de la espasticidad inducida por la ERTi se encontraba potenciada por la reorganización funcional de la M1 ipsilateral y contralateral a la estimulación. Dicho estudio fue diseñado de forma longitudinal durante 5semanas con la utilización de una resonancia magnética funcional (RMf) del estado de reposo, contando con dos grupos de pacientes con EM que fueron aleatorizados a recibir sesiones de ERTi real o simulada. Para ello se incluyó en el estudio un total de 17 pacientes con EM (13 con EM secundaria progresiva [EMSP] y 4 con EMRR), criterios de McDonald (modificados en 2010 por Polman et al.56) con una EDSS54 entre 4,0 y 7,0, una espasticidad que afectaba predominantemente o exclusivamente a un miembro inferior y una EMA55 ≥2, sin encontrarse en tratamiento con corticosteroides y ningún brote dentro de los 2meses previos a la inclusión y sin haber recibido toxina botulínica dentro de los 6meses anteriores a la inserción. Todos los pacientes se sometieron a un programa estandarizado de rehabilitación funcional durante 5días a la semana a lo largo de 5semanas. La espasticidad se evaluó para cada paciente en tres momentos: justo antes de iniciar la rehabilitación y la ERTi (semana 0 [S0]), al día siguiente de la última sesión de ERTi (semana 3 [S3]) y al final del programa de rehabilitación de 5semanas (semana 5 [S5]). En este estudio, la puntuación de la escala visual analógica (EVA) varió de 0 (sin espasticidad) a 100 (la peor espasticidad posible) y los pacientes evaluaron su grado percibido de espasticidad durante las 24h anteriores. Se calculó el cambio de puntuación cruda en cada punto de tiempo en cada paciente restando el valor del estado basal (EVAS0) del valor en la S3 y en la S5, y se definió como ΔEVAS3-S0 y ΔEVAS5-S0. Por otro lado, a todos los pacientes se les realizaron 3 exploraciones de RM (S0, S3 y S5). De acuerdo con la hipótesis de que la ERTi de M1 induce cambios funcionales en las cortezas motoras ipsilateral y contralateral a la estimulación, se obtuvo el grado k de ambos lóbulos paracentrales en pacientes (región del atlas anatomical automatic labelling [AAL], correspondiente al área objetivo real). Además, se calculó el índice de lateralidad (ILk) de los lóbulos paracentrales estimulados y no estimulados con el fin de evaluar la modulación potencial del equilibrio interhemisférico46.
Como resumen de los resultados se puede concluir que al final del período de estimulación la mejoría de la espasticidad fue mayor en el grupo de la ERTi real que en el grupo de ERTi simulada, a través de la EVA (p=0,026). La ERTi tuvo un efecto significativo sobre el equilibrio interhemisférico del grado de conectividad entre la M1 ipsilateral a la estimulación y su homóloga contralateral (p=0,008) entre la situación basal y S3. Asimismo, y de forma reseñable, los cambios en el equilibrio interhemisférico se correlacionaron con la mejoría de la espasticidad (rho=0,56, p=0,015). De forma global, este estudio revela los siguientes hallazgos: 1)la combinación de sesiones repetidas de ERTi centrada en M1 y la rehabilitación física es más eficaz en la espasticidad que la rehabilitación física sola; 2)la mejoría de la espasticidad relacionada con la ERTi se asocia con la reorganización transitoria funcional bilateral de las cortezas motoras primarias (M1s) homólogas, y 3)la ERTi induce un desequilibrio entre los grados de conectividad de las dos cortezas motoras primarias en favor de la M1 contralateral. En consecuencia, la M1 estimulada se encuentra hipoconectada a otras regiones cerebrales comparada con la M1 contralateral no estimulada. La principal limitación de este estudio es la pequeña muestra de pacientes. Si bien estos resultados deben ser confirmados por investigaciones adicionales en cohortes más grandes de pacientes, este estudio sugiere que la ERTi puede ser un método prometedor para el manejo de la espasticidad en la EM y aporta claves relevantes para la mejor comprensión de los mecanismos cerebrales subyacentes46.
Disfunción del tracto urinario inferiorEl principal estudio diseñado hasta la fecha en este sentido fue realizado por Centonze et al.47, en el cual se evaluaron los efectos de la EMTr de 5Hz sobre M1 en 10 pacientes con EMRR (criterios de McDonald et al.53) (EDSS54 3,0-5,5), con afectación sintomática del tracto urinario inferior (TUI), ya fuera en la fase de llenado o en la fase de vaciado vesical. Como resumen de los hallazgos encontrados, se evidenció que la EMTr de 5Hz aplicada a nivel de M1 5días consecutivos/semana, durante 2semanas, mejoró la fase de vaciado vesical sin causar efectos en la fase de llenado del ciclo de la micción, lo que sugiere que el aumento de la excitabilidad de la vía corticoespinal podría ser útil para mejorar la contracción del músculo detrusor y/o la relajación del esfínter uretral externo (EUE) en pacientes con EM y disfunción vesical. Este estudio representa la primera —y hasta ahora la única— evidencia consistente de que la EMTr es capaz de influir en la actividad vesical en pacientes con EM. Estos resultados indican que el aumento de la excitabilidad de la vía corticoespinal tras la aplicación de la EMTr excitatoria facilita preferentemente la contracción del músculo detrusor y/o la relajación del EUE en lugar de aumentar la actividad muscular del EUE.
Destreza manualMejoría de la destreza manual en pacientes con esclerosis múltiple y afectación a nivel cerebeloso tras aplicación de la EMTr a nivel de M1Koch et al.48 evaluaron los efectos de la EMTr de 5Hz sobre la M1 izquierda en 8 pacientes con EMRR (criterios de McDonald et al.53) y semiología cerebelosa (dismetría, disartria, temblor intencional, trastornos de la marcha y el equilibrio y adiadococinesia) utilizando 7 controles sanos (CS), basándose en que los pacientes con EM desarrollan con frecuencia síntomas debidos a lesiones cerebelosas, como la dismetría, que conducen al deterioro de la destreza manual (Alusi et al.57). Para cuantificar la destreza manual se empleó la tarea del tablero ranurado (TTR) de 9hoyos (Miall y Christensen58). Los resultados del estudio evidenciaron que la EMTr de 5Hz mejoró significativamente la destreza manual en estos pacientes tras detectarse una reducción significativa del tiempo necesario para completar la TTR de 9hoyos con la mano dominante (la derecha) inmediatamente después (p<0.01) y 10min después (p<0,01), pero no 20min después (p>0,1), sin afectarse el tiempo requerido para la realización de la tarea en los CS. Además, el efecto transitorio inducido por la EMTr se observó solo en el en el grupo de pacientes con EM que sufrían dismetría en t1 y t248.
Dado que estos pacientes no presentaban disfunción de la vía piramidal, es posible que la recuperación de los síntomas debidos a la disfunción cerebelosa se debiera a la modulación de las proyecciones córtico-pontino-cerebelosas (Eccles et al.59, Schwarz y Thier60). A su vez, de forma coadyuvante, puede que la EMTr de 5Hz contrarrestara la reducción de la conducción cerebelosa secundaria a la desmielinización, que probablemente contribuía al deterioro de la destreza manual. Por lo tanto, la EMTr de 5Hz aplicada sobre M1 podría ser un enfoque útil para tratar el deterioro funcional cerebeloso en pacientes con EM. Sin embargo, dado que los beneficios de dicho estudio fueron solo transitorios, se consideró que serían precisos estudios adicionales con sesiones repetidas de EMTr para verificar si esto podría conllevar una posible mejoría clínica persistente de la disfunción cerebelosa en pacientes con EM48.
Mejoría de la destreza manual en pacientes con EMRR y EMSP tras aplicación de la EMTr a nivel de M1Elzamarany et al.49, partiendo de la base de que por un lado la corteza motora recibe una aferencia excitatoria del cerebelo que se ve reducida en pacientes con lesiones cerebelosas y que por otro la EMTr induce la facilitación cortical que puede contrarrestar la reducción del impulso cerebeloso excitador sobre la corteza motora, elaboraron un estudio para determinar si la EMTr de alta frecuencia aplicada a nivel de M1 en pacientes con EMRR y EMSP con déficit cerebeloso podía resultar en una mejoría de la destreza manual, evaluada por una reducción en el tiempo necesario para completar la TTR de 9hoyos y en la puntuación del sistema funcional cerebeloso de la EDSS54, justo después de la EMTr y un mes después. En dicho estudio se reclutó a 24 pacientes con EMRR y EMSP, criterios de McDonald et al.53, que padecían ataxia, con una EDSS54 entre 1,5 y 6,5, y 10CS. Los pacientes fueron divididos aleatoriamente en los gruposA oB, mientras que los CS formaron el grupoC. En el grupoA se administraron 2 sesiones de EMTr real de 5Hz durante 2días consecutivos. En el grupoB se aplicó una sesión de EMTr real de 5Hz seguida por una sesión de EMTr simulada al día siguiente. El grupoC recibió 2sesiones de EMTr real de 5Hz durante 2días consecutivos. La destreza manual se cuantificó a través de la TTR de 9hoyos49.
Como resumen de los resultados, los pacientes del grupoA mostraron una mejoría significativa en el tiempo necesario para terminar la TTR de 9hoyos (p=0,002) y en su puntuación del sistema funcional (PSF) cerebeloso (p=0,000) justo después de la segunda sesión de EMTr y un mes después. Los pacientes con EMRR mostraron una mejoría mayor que los pacientes con EMSP. En cambio, los pacientes del grupoB no experimentaron ninguna mejoría en la TTR de 9hoyos o en la PSF cerebeloso. Y el grupoC tampoco exhibió una mejoría en la TTR de 9hoyos justo después de las sesiones de EMTr o un mes después de las 2sesiones de EMTr49.
El mecanismo por el que EMTr mejoró la destreza manual en este estudio puede ser debido a la facilitación directa de la corteza motora, que se encuentra inhibida en las lesiones cerebelosas. La reversión de la inhibición postexcitatoria que se produce después de la EMTr a nivel de la corteza motora en pacientes con lesiones cerebelosas se había reportado en un estudio previo, lo que sugiere que las lesiones cerebelosas activan interneuronas inhibitorias corticales o causan una interrupción de una actividad excitatoria de origen cerebeloso normalmente tónica a nivel de la corteza motora (Oechsner y Zangemeister61). Sin embargo, se necesitan más estudios para verificar si esta mejoría podría variar dependiendo de la causa de las lesiones cerebelosas; por ejemplo, por causas hereditarias, inflamatorias o vasculares. Otros estudios también deben comparar la eficacia del tratamiento con EMTr con otras intervenciones a dicho nivel, tales como fármacos o fisioterapia. Además, para identificar con precisión el mecanismo de la eficacia de la EMTr podrían usarse modalidades de neuroimagen como imágenes del espectro de difusión o RMf49.
DeambulaciónBurhan et al.50 realizaron un ensayo basándose en los estudios de investigación que informaban que las personas con EM presentan un deterioro significativo en la velocidad de la marcha, la cadencia y la longitud del paso en comparación con los CS (Givon et al.62; Kurtzke54; Nelson63). Para ello se investigó el efecto de la EMTr de alta frecuencia (6Hz), aplicada a nivel prefrontal, sobre los parámetros de la marcha en un varón de raza blanca de 51años de edad con historia de EMRR de 4años de evolución y con una afectación residual discapacitante consistente en debilidad espástica de miembros superiores e inferiores, diplopía, nistagmo y algunos déficits cognitivos, principalmente a nivel atencional. La RM del paciente mostró una importante afectación de la sustancia blanca, incluidas las regiones prefrontal y parietal del hemisferio cerebral izquierdo (áreas relevantes para la atención). Empleando el sistema de localización electroencefalograma (EEG) internacional 10-20 para identificar la ubicación de F3 que por lo general corresponde a la corteza prefrontal dorsolateral (CPFDL) izquierda (Herwig et al.64), el paciente recibió una sesión y, tras 3días, 3sesiones consecutivas diarias de EMTr. Los datos de la marcha se recogieron en 2puntos de tiempo: a)antes (situación basal1) e inmediatamente tras una sesión de EMTr, y b)antes (situación basal2) e inmediatamente después de 3 sesiones de EMTr diarias consecutivas. En resumen, no hubo diferencias estadísticamente significativas antes y después de una sesión de EMTr en el tiempo y la velocidad de desplazamiento, pero el cambio de la cadencia sí fue significativo (t(2)=−4,99, p<0,05). Se encontraron diferencias estadísticamente significativas antes y después de las 3 sesiones de EMTr diarias consecutivas en el tiempo deambulación (t(2)=8,32, p<0,05), la velocidad (t(2)=−4,59, p<0,05) y la cadencia (t(2)=−7,57, p<0,05). El análisis de los datos mostró que la variabilidad del tiempo de zancada, medida como el tiempo transcurrido entre el primer contacto de dos pisadas consecutivas de un mismo pie, se redujo tras una sesión de EMTr del 5,02% de CoV (coeficiente de variación) al 4,6% de CoV. Sin embargo, se incrementó después de que el paciente recibiera las 3 sesiones de EMTr consecutivas de 4,64% de CoV a 5,34% de CoV50.
En general, los resultados indicaron que la modulación de la excitabilidad de la CPFDL izquierda, utilizando la EMTr de alta frecuencia, resultó en un cambio significativo en los parámetros de la marcha en un paciente con EM, de forma segura, siendo este estudio el primero en demostrar e informar del efecto beneficioso sobre la marcha de la EMTr excitatoria aplicada a nivel de la CPFDL en pacientes con EM. El mecanismo subyacente del efecto de la EMTr es probable que esté relacionado con la mejoría de la excitabilidad de la CPFDL izquierda, que a su vez ejerce un control sobre el aspecto volitivo de la marcha. La corteza prefrontal está funcionalmente conectada al núcleo caudado, y existe evidencia de un aumento de la transmisión dopaminérgica en el núcleo caudado como resultado de la estimulación cortical prefrontal con EMTr (Strafella et al.65), que podría ser un posible mecanismo por el que se produce este efecto. Por otra parte, aunque la variabilidad del tiempo de zancada disminuyó tras una sesión de EMTr, aumentó después de 3sesiones de EMTr. Esto es sumamente importante, ya que tiene una implicación en el riesgo de caídas debido a que existe una correlación directamente proporcional entre la variabilidad del tiempo de zancada y el riesgo de caídas (Montero-Odasso et al.66,67). Esto podría estar relacionado con el tiempo y la velocidad de la deambulación, es decir, cuanto más rápido sea el paso, más variabilidad existe en el tiempo de zancada y, por lo tanto, más riesgo de caídas. Sin embargo, hubo una corta diferencia de tiempo (3días) entre la sesión de EMTr y el comienzo de las 3sesiones diarias consecutivas de EMTr. Esto dio lugar a que se estableciera una nueva situación basal, que fue mayor en el tiempo de deambulación y menor en la velocidad en comparación con la primera situación basal. La existencia de estas diferencias es difícil de interpretar. Así pues, se necesita realizar más estudios de investigación en este ámbito. Además, no se pudo evaluar el impacto a largo plazo de la EMTr en la marcha porque no se realizó ningún seguimiento para este caso50.
Memoria de trabajo, activación cerebral y conectividad funcionalHulst et al.51 diseñaron el primer estudio que analizó los efectos de la EMTr de alta frecuencia sobre el rendimiento cognitivo en pacientes con EM mediante su aplicación a nivel de la CPFDL derecha para evaluar el rendimiento de la memoria de trabajo, midiendo la activación cerebral y la conectividad cerebral relacionadas con la tarea mediante el uso de RMf. Este estudio se fundamentó en la frecuente presencia de déficits cognitivos en la EM, llegando a afectar hasta al 70% de pacientes (Chiaravalloti y DeLuca68), sin disponer actualmente de opciones terapéuticas específicas al respecto. Asimismo, de forma más específica, los problemas con la memoria de trabajo son frecuentes (Chiaravalloti y DeLuca68; Benedict et al.69) y son más prominentes en pacientes con una alta carga lesional a nivel frontal (Foong et al.70; Sperling et al.71). Los estudios de RMf sobre el desempeño de la memoria de trabajo evidencian una hiperactivación frontal (Mainero et al.72; Staffen et al.73; Sweet et al.74; Rocca et al.75; Cader et al.76) y un aumento de la conectividad interhemisférica frontal en pacientes con EM sin deterioro cognitivo en comparación con CS, reflejando una reorganización funcional cerebral.
Para ello reclutaron a 17 pacientes con EM clínicamente definida (EMCD), 13 pacientes con EMRR y 4 con EMSP (criterios diagnósticos de McDonald [revisados por Polman et al.77]) y 11CS que fueron sometidos a 3sesiones experimentales (situación basal, EMTr real y EMTr simulada), incluyendo todas la tarea N-back (3 cargas de trabajo: N1, N2, N3; y la condición control: N0) dentro de un equipo de RM, para confeccionar un ensayo clínico, controlado, aleatorizado, cruzado y simple ciego. Antes de la adquisición de imágenes se aplicó la EMTr real (10Hz) a nivel de la CPFDL derecha. Posteriormente se analizaron los cambios en la activación funcional cerebral completa y la conectividad funcional con la CPFDL derecha. El sitio de estimulación de la EMTr real se definió como la activación pico vóxel de la CPFDL derecha (es decir, cuando todos los vóxeles se activaban significativamente más en las tres cargas diferentes de tareas de N-back [1-back, 2-back y 3-back combinado] en comparación con la condición de control, 0-back; contraste N123>N0). Dicha tarea N-back de memoria de trabajo visuoespacial se componía de tres cargas de tarea en aumento (N1, N2 y N3) y una condición de control (N0) (De Vries et al.78). En cada ensayo (de 2,8s de duración) apareció un punto amarillo aleatoriamente en la pantalla del ordenador a la izquierda, derecha, parte inferior o parte superior de un rombo gris con 4círculos azules. La ubicación en el rombo correspondía a 4lugares similares en una caja de respuesta compatible con RM controlada con 2mandos de 2botones (para los dedos pulgar e índice de cada mano) con la recogida de datos en un ordenador de presentación de estímulos. Durante la condición N0 se pidió a los participantes que respondieran inmediatamente presionando el botón correspondiente. Durante las condiciones Nx, los participantes tenían que indicar dónde se encontraba el punto amarillo, uno (N1), dos (N2) o tres (N3) ensayos antes, mientras que de forma simultánea debían recordar las nuevas ubicaciones de dicho punto a medida que se continuaba la tarea. Las principales medidas de resultado conductuales fueron el número absoluto de respuestas correctas y el tiempo de reacción para cada carga de tarea.
Todos los participantes se sometieron a extensas pruebas neuropsicológicas específicamente destinadas a investigar la función de la memoria de trabajo que se evaluó con el intervalo de dígitos y la secuenciación letra-número, ambos extraídos de la Wechsler Adult Intelligence Scale (Wechsler79) (Hulst et al.80). Para evaluar la conectividad cerebral, esta se calculó utilizando un modelo de interacción psicofisiológica generalizada (Generalized Psychological-Physiological Interaction [GPPI]) para identificar los vóxeles (cerebro entero) que estaban relacionados con la activación en una región de semillas, en un contexto psicológico determinado, mientras se controlaban otras variables de tarea (O’Reilly et al.81). Para cada participante, individualmente, se definió una región de semillas calculando una esfera de 6mm alrededor del pico vóxel basal de la activación relacionada con la tarea, en la CPFDL derecha en el espacio estándar. La serie de tiempo dentro de esta región de semillas sirvió como el regresor fisiológico. Como regresores psicológicos se utilizaron la respuesta Blood Oxygen Level Dependent (BOLD) de los tres contrastes de la tarea N-back (N1>N0, N2>N0 y N3>N0), resultando en 3 análisis GPPI por sesión. Posteriormente, para realizar un análisis de grupo, todas las regiones individuales de la semilla de la CPFDL derecha se combinaron en una máscara común. Utilizando esta máscara común se calcularon las diferencias en la conectividad entre los grupos y entre las sesiones. En cuanto a los resultados iniciales del estudio, los pacientes y los CS no difirieron significativamente en cuanto a edad, sexo, dominancia manual, coeficiente intelectual premórbido y nivel educativo. Los parámetros de la EMTr (p.ej., las intensidades de EMTr aplicadas basadas en el umbral motor en reposo [UMR] y el orden de EMTr simulada y EMTr real) tampoco difirieron entre los pacientes con EM y los CS. Los pacientes con EM difirieron significativamente de los CS con respecto a las medidas de ansiedad y depresión. Es importante señalar que 14/17 pacientes tuvieron valores subclínicos en la Escala Hospitalaria de Ansiedad y Depresión (HADS) (estableciendo el valor ≤10 como punto de corte para definir el estadio subclínico). En cuanto a la RM estructural, no hubo diferencias entre los pacientes con EM y los CS en el volumen cerebral total normalizado, el volumen de sustancia gris o el volumen de sustancia blanca. Como resumen del resto de resultados presentados en este estudio se puede inferir que:
- ∘
En cuanto a la activación relacionada con la tarea, en ambos grupos y en todas las diferentes condiciones de carga de tareas se encontró un efecto consistente de la tarea para la red frontoparietal bilateral. En situación basal, los pacientes con EM, en comparación con los CS, mostraron una mayor activación frontal relacionada con la tarea (CPFDL izquierda, N2>N0) y en el área polar temporal derecha (N3>N0) (datos no presentados en el artículo) durante la tarea de memoria de trabajo, sugiriendo una reorganización funcional que desapareció después de la aplicación de la EMTr real. Esto engarzaría con la hipótesis de que una mayor activación sería una forma de compensación de los posibles problemas cognitivos (subclínicos) (Sperling et al.71; Mainero et al.72; Staffen et al.73). En la situación basal tampoco se detectaron diferencias entre los grupos en N1>N0 y no se observaron diferencias en la conectividad entre la CPFDL derecha (zona estimulada) y otras áreas cerebrales entre los pacientes con EM y los CS. Asimismo, después de la EMTr real los pacientes con EM mostraron una mayor activación del lóbulo parietal inferior izquierdo en comparación con los CS durante N1>N0. No se detectaron diferencias en la activación frontal entre los dos grupos. Después de la EMTr simulada se constató una mayor activación durante N2>N0 en los pacientes con EM en el giro frontal superior izquierdo y las regiones parietales en comparación con los CS (datos no presentados en el artículo).
- ∘
La precisión de la tarea N-back (cargas N2 y N3) mejoró solo después de la EMTr real comparada con la situación basal (p=0,029 y p=0,015, respectivamente), únicamente en los pacientes con EM. Sin embargo, la precisión de los pacientes con EM después de la aplicación de la EMTr real no fue significativamente diferente de la precisión después de la EMTr simulada (p=0,077). Los autores aluden que quizá la aplicación de sesiones de estimulación múltiples combinada con un mayor tamaño muestral podría haber convertido esta diferencia en estadísticamente significativa (Rossi et al.5). Por otro lado, el hecho de que la mejoría de la precisión y del tiempo de reacción en la tarea de la memoria de trabajo tras la EMTr real únicamente se objetivara en los pacientes con EM reforzaría indirectamente la teoría de que cualquier alteración en la activación cerebral de la situación sana es desfavorable para el funcionamiento posterior en el caso de desarrollar EM (Chiaravalloti et al.82; Schoonheim et al.83).
- ∘
La conectividad funcional relacionada con la tarea (N1>N0) aumentó en los pacientes con EM entre la CPFDL derecha, la cabeza del núcleo caudado derecho, el putamen derecho, el giro cingulado anterior izquierdo, el giro paracingulado bilateral y el polo frontal izquierdo, tras la EMTr real. Los resultados post hoc del análisis GPPI fueron analizados más a fondo: se aumentó la capacidad de visualizar las diferencias significativas en la conectividad funcional después de la EMTr real en comparación con la EMTr simulada, es decir, dentro de la máscara de diferencias corregida por el grupo (contraste EMTr real vs. EMTr simulada N1>N0). Se extrajeron las estimaciones de parámetros de conectividad media para N1>N0, N2>N0 y N3>N0 de cada modelo de análisis de RMf individual. Los cambios inducidos por la EMTr real se definieron como las diferencias que se observaban después de la aplicación de la EMTr real, pero no después de la EMTr simulada, ambas en comparación con la situación basal. Adicionalmente, se contrastaron las condiciones reales y simuladas. Finalmente, el análisis post hoc reveló que las estimaciones de los parámetros de conectividad de los pacientes a nivel de la CPFDL derecha aumentaron con el incremento de la carga de tareas en todas las sesiones. Por otra parte, la conectividad después de la EMTr real fue significativamente mayor que después de la EMTr simulada en todas las cargas de tareas (N1>N0: p<0,001; N2>N0: p=0,001; N3>N0: p=0,003). En los CS no se detectaron diferencias en la conectividad, por lo que este análisis post hoc solo se pudo completar en el grupo de pacientes con EM. Se especula que estos cambios pudieran estar relacionados con la normalización de la activación frontal, que tiende a ser más parecida a la de los CS en situación basal. Es decir, los cambios frontales después de la EMTr real (disminución de la activación cerebral y aumento de la conectividad funcional) reflejarían una mejoría de la eficiencia del procesamiento frontal durante una tarea de memoria de trabajo. Aunque estos hallazgos deben interpretarse con precaución, pueden representar un cambio inducido por la EMTr en la eficiencia de la red neuronal cerebral en pacientes con EM, desplazando la función cerebral hacia la situación sana. Esto podría implicar un papel potencialmente relevante de la EMTr en la rehabilitación cognitiva en la EM.
Aunque la experiencia preliminar con la EMTr en la EM parece prometedora, se sabe poco sobre los mecanismos y las vías subyacentes a este efecto terapéutico (Medina-Fernández et al.40). Recientemente, el grupo del Dr. Túnez (Escribano et al.84; Medina-Fernández et al.85-87) ha publicado los resultados de varios estudios empleando un modelo de rata con EAE, concluyendo que este modelo induce un deterioro motor. Acompañando a los cambios clínicos, en este modelo destacó la importancia del estrés oxidativo, así como su posible relación con la microbiota. Además, se observó la existencia de neuroinflamación y pérdida celular por necrosis y apoptosis en el cuerpo estriado de las ratas con EAE, siendo la EEBF capaz de atenuar dichos síntomas motores, el estrés oxidativo y el daño cerebral, gracias a su capacidad de potenciar el sistema antioxidante a través de la vía del Nrf2, la cual se encuentra a su vez estrechamente vinculada al efecto protector contra la neurotoxicidad inducida por el A3-NP (Guerriero y Ricevuti11; Medina-Fernández et al.86). Los hallazgos anteriores proponen que la EEBF puede ser de considerable interés terapéutico en el modelo de EAE de rata. Actualmente el grupo del Dr. Túnez está trabajando sobre esta hipótesis con resultados prometedores en relación con el deterioro motor en la EAE, que debería apoyar la futura implementación terapéutica de la EMT, en su variante de EEBF, en pacientes con EM40. En el último estudio publicado por este grupo realizado en este ámbito, Medina-Fernández et al.87 compararon el efecto de la EMT, en la modalidad de EEBF, con respecto al ejercido por natalizumab (NTZ), dimetilfumarato (DMF) y dexametasona (DXM) en la puntuación clínica y el estrés oxidativo producidos por la inoculación de una dosis única de la glucoproteína de la mielina del oligodendrocito (MOG) en la cola de ratas de la cepa Dark Agouti. Tanto la EEBF como los tratamientos farmacológicos atenuaron los cambios causados por la MOG, si bien la EEBF consiguió ejercer dicha atenuación de una forma más significativa. Estos resultados de nuevo refrendan la acción antioxidante y neuroprotectora de la EMT, junto con un nivel de actividad más alto que otros tratamientos farmacológicos como NTZ, DMF y DXM87.
ConclusionesLa EMT ha demostrado tener el potencial de erigirse como una aliada técnica, de vanguardia, fiable, segura y efectiva para tratar algunos de los síntomas acaecidos en los sujetos con EM. Los pulsos electromagnéticos excitatorios aplicados en el hemisferio cerebral afecto nos brindan la posibilidad de optimizar la actividad cerebral funcional, incluyendo la transmisión de los impulsos nerviosos a través de la vía corticoespinal desmielinizada. Los diferentes estudios realizados sobre la EMT en EM han demostrado, sin poder definir el nivel exacto de evidencia dada la ausencia de resultados replicados en estudios controlados, la mejoría estadísticamente significativa de la espasticidad (EMTr y ERTi), la fatiga (ERTi), la disfunción del tracto urinario inferior (EMTr), la destreza manual (EMTr), las alteraciones de la deambulación (EMTr) y los trastornos cognitivos relativos a la memoria de trabajo (EMTr) que aparecen en estos pacientes, y ello probablemente gracias a su facultad para ayudar a promover la regeneración cerebral por el mecanismo de neuroplasticidad. Son de gran interés los hallazgos revelados por el grupo de Túnez sobre el efecto neuroprotector de la EMT, a través de la EEBF en la EAE, un modelo experimental válido de tipo EM que, por un lado, palía de forma efectiva el deterioro motor, disminuyendo la proliferación astrocitaria como respuesta al ataque autoinmune, junto con un incremento de la densidad celular cerebral y una disminución del número de núcleos picnóticos85, y por otro lado, a nivel del estrés oxidativo en la EAE, donde han conseguido poner de relieve una optimización de las habilidades motoras inducidas por la EMT y caracterizada como una disminución del daño oxidativo y celular, y un incremento de la densidad celular cerebral86, así como un nivel de actividad más elevado en su capacidad de acción antioxidante y neuroprotectora con respecto a otros tratamientos farmacológicos87.
Por último, la confección de guías específicas que aborden el empleo de la EMT como tratamiento suplementario en esta patología, además de identificar pacientes subsidiarios a recibirla, es fundamental para garantizar su correcta implementación y la consecución de un balance riesgo-beneficio favorable. Por el momento se desconocen la duración más adecuada del tratamiento, el momento exacto de intervención y el protocolo estandarizado más idóneo, y el ámbito de su aplicación principal es a nivel experimental. Seguramente en los años venideros, con el advenimiento de más estudios prospectivos, mejor diseñados, con muestras más amplias de pacientes y mayores tiempos de seguimiento, se obtendrá un nivel de evidencia científico que permita clarificar estas incógnitas y con ello la implementación de la EMT en el armamentarium terapéutico del paciente con EM, como estrategia de tratamiento adyuvante con respecto a los ya existentes y los próximamente disponibles. Y probablemente, en un futuro no muy lejano, se realizarán estudios basados en la aplicación de la modalidad de EMTr convencional sobre un síntoma tan discapacitante como representa la fatiga. Un problema fundamental por solventar en el futuro es la gran variabilidad interindividual en cuanto a la eficacia de la EMTr aplicada en estos pacientes.
FinanciaciónNuestro trabajo ha sido redactado libremente, sin financiación por ninguna empresa o entidad pública o privada.
Conflicto de interesesNo existen conflictos de intereses.




![A) Esquema iconográfico de las modalidades de aplicación de la EMT: pulsos simples, pulsos pareados en una o dos áreas corticales diferentes del cerebro y EMTr (lenta [de baja frecuencia] ≤1Hz y rápida [de alta frecuencia] ≥5Hz). EMT: estimulación magnética transcraneal; EMTr: estimulación magnética transcraneal repetitiva; ®: respuesta. Adaptada de Pascual-Leone y Tormos-Muñoz2. B) Panel izquierdo (EMTr convencional [aplicación de pulsos únicos de EMT repetidos regularmente]). Desde la parte superior: ejemplos de 10s de EMTr a 1Hz (primer trazado) y a 5Hz (segundo trazado); 1s de EMTr a 10Hz y ejemplo típico de aplicación de EMTr a 20Hz para fines terapéuticos (trenes de 2s entrelazados por una pausa de 28s). Panel derecho (EMTr protocolizada [aplicación repetitiva de ráfagas cortas de EMTr a una frecuencia interna alta intercalada por breves pausas sin estimulación]). Desde la parte superior: 20s de ERTc (primer trazado); ERTi (segundo trazado) y ERTim (tercer trazado). El cuarto trazado representa protocolos de ECP. ECP: estimulación de cuádruple pulso; ERT: estimulación de ráfagas theta; ERTc: estimulación de ráfagas theta continua; ERTi: estimulación de ráfagas theta intermitente; ERTim: estimulación de ráfagas theta intermedia; IIE: intervalos interestímulo. Adaptada de Rossi et al.5. A) Esquema iconográfico de las modalidades de aplicación de la EMT: pulsos simples, pulsos pareados en una o dos áreas corticales diferentes del cerebro y EMTr (lenta [de baja frecuencia] ≤1Hz y rápida [de alta frecuencia] ≥5Hz). EMT: estimulación magnética transcraneal; EMTr: estimulación magnética transcraneal repetitiva; ®: respuesta. Adaptada de Pascual-Leone y Tormos-Muñoz2. B) Panel izquierdo (EMTr convencional [aplicación de pulsos únicos de EMT repetidos regularmente]). Desde la parte superior: ejemplos de 10s de EMTr a 1Hz (primer trazado) y a 5Hz (segundo trazado); 1s de EMTr a 10Hz y ejemplo típico de aplicación de EMTr a 20Hz para fines terapéuticos (trenes de 2s entrelazados por una pausa de 28s). Panel derecho (EMTr protocolizada [aplicación repetitiva de ráfagas cortas de EMTr a una frecuencia interna alta intercalada por breves pausas sin estimulación]). Desde la parte superior: 20s de ERTc (primer trazado); ERTi (segundo trazado) y ERTim (tercer trazado). El cuarto trazado representa protocolos de ECP. ECP: estimulación de cuádruple pulso; ERT: estimulación de ráfagas theta; ERTc: estimulación de ráfagas theta continua; ERTi: estimulación de ráfagas theta intermitente; ERTim: estimulación de ráfagas theta intermedia; IIE: intervalos interestímulo. Adaptada de Rossi et al.5.](https://static.elsevier.es/multimedia/02134853/0000003700000003/v1_202203290758/S0213485318301531/v1_202203290758/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)