El hipoestrogenismo produce estrés oxidativo (EO) y cambios en las neuronas del hipocampo (H) y reduce la densidad de las espinas dendríticas (ED). Estas alteraciones repercuten en la respuesta plástica del H. La terapia de sustitución intraperitoneal con estrógenos revierte estos efectos, pero no se sabe si ocurre lo mismo con la tibolona (TB). El objetivo fue comprobar los efectos neuroprotectivos de la TB administrada por vía oral a largo plazo y su capacidad para revertir la poda de ED de las neuronas piramidales (NP) del CA1 del H.
MétodosRatas Sprague Dawley jóvenes: distribuidas en 3 grupos: control en proestro (Pro) y 2 grupos ovariectomizados (Ovx), uno suplementado con dosis diaria de TB (1mg/kg), OvxTB, y otro con vehículo (OvxV), por 40 días. Se analizaron la peroxidación de lípidos y la densidad de las ED en 3 segmentos de la dendrita apical de las NP del CA1 del H.
ResultadosLa TB no redujo la peroxidación de lípidos en el H, pero recuperó la poda de espinas en las NP del CA1 del H, producida por la ovariectomía.
ConclusionesLa terapia de sustitución estrogénica en el hipoestrogenismo por ovariectomía tiene un efecto protector.
Oestrogen deficiency produces oxidative stress (OS) and changes in hippocampal neurons and also reduces the density of dendritic spines (DS). These alterations affect the plastic response of the hippocampus. Oestrogen replacement therapy reverses these effects, but it remains to be seen whether the same changes are produced by tibolone (TB). The aim of this study was to test the neuroprotective effects of long-term oral TB treatment and its ability to reverse DS pruning in pyramidal neurons (PN) of hippocampal area CA1.
MethodsYoung Sprague Dawley rats were distributed in 3 groups: a control group in proestrus (Pro) and two ovariectomised groups (Ovx), of which one was provided with a daily TB dose (1mg/kg), OvxTB and the other with vehicle (OvxV), for 40 days in both cases. We analysed lipid peroxidation and DS density in 3 segments of apical dendrites from PNs in hippocampal area CA1.
ResultsTB did not reduce lipid peroxidation but it did reverse the spine pruning in CA1 pyramidal neurons of the hippocampus which had been caused by ovariectomy.
ConclusionsOestrogen replacement therapy for ovariectomy-induced oestrogen deficiency has a protective effect on synaptic plasticity in the hippocampus.
El incremento de los radicales libres, la disfunción mitocondrial y el estrés oxidativo (EO) como mecanismos interdependientes se han propuesto como los principales factores que producen daño cerebral al promover reacciones en cadena en presencia de iones metálicos catalíticos dañando a los fosfolípidos de las membranas, a las proteínas y, principalmente, al ADN de la célula1-3. El EO junto con la inflamación se incrementan con la edad, así como la función inmunitaria innata y la comunicación neuronal con las células gliales, que son eventos críticos en el envejecimiento del cerebro y las enfermedades neurodegenerativas como el Alzheimer4,5. Por la edad, en el humano y en primates, ocurren cambios en la morfología de las neuronas corticales e hipocampales, manifestados como reducciones en la complejidad y longitud del árbol dendrítico, y de los sitios postsinápticos o espinas dendríticas (ED)6. Las ED son complejos morfológicamente especializados para la interacción sináptica y se han estudiado in vitro, encontrando que tanto el número como el tipo de espinas son altamente mutables sobre una escala de tiempo de segundos a días por diversos mecanismos intrínsecos que ejercen un control dinámico sobre ellas7. In situ, estos cambios en el tipo y en la densidad de espinas ocurren bajo condiciones fisiológicas y patológicas, las cuales han sido ligadas con alteraciones funcionales de los circuitos neuronales y pérdida de la memoria8,9. Las ED representan la región postsináptica de entrada excitatoria de las neuronas que responden a la estimulación con cambios en su densidad y en su tipo; el mecanismo por el cual estos cambios ocurren son a través de la activación de los genes primarios agregados al efecto de los factores de crecimiento; ambos modifican la citoarquitectura membranal, dando como resultado la generación de nuevas espinas o bien la maduración de las ya existentes10.
Por otra parte, en la mujer, diversas actividades pueden contribuir a los cambios o modificaciones que ocurren en estas entradas de información, como el proceso de envejecimiento, pérdida de la memoria, la homeostasis redox y la disminución de los niveles circulantes de estradiol. Para reducir estas alteraciones relacionadas con la disminución de hormonas circulantes durante la menopausia, se han probado diversas terapias sustitutivas con productos que tienen acción estrogénica (fitoestrógenos; 17-β-estradiol, progestágenos, acetato de medroxiprogesterona)11,12 y derivados estrogénicos como la tibolona (TB), la cual es el precursor de metabolitos hidroxilados. En vivo, este se comporta como estrógenos en el hígado y el endometrio, y puede tener acción como progestágeno y actividad androgénica (bajando triglicéridos y colesterol) y protege contra la pérdida de la masa ósea13. En 2008, de Aguiar et al.14 reportaron los efectos del valerato de estradiol (VE, 0,3mg/kg) y 2 concentraciones de TB (0,5 y 1,0mg/kg) sobre el EO en el cerebro y en la bioquímica de la sangre en ratas hembras ovariectomizadas, en 3 estados: joven, adulto y viejo. Encontraron disminución del hidroperóxido de lípido en la corteza cerebral de ratas jóvenes y viejas, y ambas dosis de TB produjeron un incremento de la capacidad antioxidante total en comparación con los niveles obtenidos en las ratas hembras adultas tratadas con VE y las ovariectomizadas en todos los tratamientos mostraron los niveles más bajos de la capacidad antioxidante total en el hipocampo comparadas con sus controles. El EO fue más alto en las viejas comparadas con las jóvenes y las ovariectomizadas tratadas con TB (1,0mg/kg), en donde se aumentaron los niveles de lípidos de baja densidad comparados con los animales control y con los tratados con EV. En este estudio, el objetivo fue comprobar los efectos antioxidantes y neuroprotectores implicados en la actividad farmacológica de la TB, administrada por vía oral a largo plazo, y si este tratamiento es capaz de revertir el EO y la poda de ED de las células piramidales del CA1 en el hipocampo.
MetodologíaAnimalesEl protocolo se realizó conforme con las normas internacionales para el manejo y uso de animales de experimentación establecidas por los National Institutes of Health y la National Academy of Science, y aprobado por el Comité de Bioética del Instituto de Neurobiología (INB) de la Universidad Nacional Autónoma de México. Un total de 30 ratas hembras Sprague-Dawley (200 a 250 g de peso) fueron utilizadas para los diferentes procedimientos. Las ratas se alojaron individualmente en jaulas de policarbonato (45×24×21cm), con aserrín limpio como material de habitación y teniendo libre acceso a la alimentación (comida estándar Purina®, fórmula de 5001) y agua purificada durante todo el experimento. Se mantuvieron bajo condiciones de ciclo de luz/oscuridad 12h/12h (luces encendidas a las 7:00 am), a una temperatura de entre 22 y 23°C y con un 40-50% de humedad.
Diseño experimental y obtención de las muestrasSe diseñó un estudio experimental, aleatorizado, doble ciego y controlado con placebo con un total de 30 ratas hembras de la cepa Sprague-Dawley de 200 a 250 g de peso, las cuales fueron divididas en 3 grupos con las siguientes características: grupo 1, animales controles en etapa de proestro (Pro); grupo 2, ratas ovariectomizadas (Ovx) y tratadas con vehículo (solución salina) cada 24h por 40 días (OvxV), y grupo 3, animales con Ovx y suplementadas con TB a una dosis de 1mg/kg de peso cada 24h por 40 días (OvxTB). Pasado este tiempo y después de la administración del tratamiento, los animales fueron sacrificados por decapitación para la obtención del cerebro, que se colocó en una matriz calibrada de metal, se seccionó para separar en forma aleatoria ambos hemicerebros para los análisis bioquímico y morfométrico.
Cuantificación de la peroxidación de lípidosPara cuantificar los productos finales de la peroxidación de lípidos (PL), se utilizó la técnica descrita por Triggs y Willmore15. Se separó el hipocampo de uno de los hemisferios cerebrales, el cual fue homogenizado en 3ml de solución salina (0,9% NaCl), se tomó una alícuota de 1ml y se le añadieron 4ml de una mezcla de cloroformo/metanol (2:1 v/v) y las muestras se dejaron incubar durante 30min en hielo para permitir la separación de la fase clorofórmica que contenía que contenía los productos finales fluorescentes de la PL; posteriormente, se obtuvo una alícuota de 1ml que fue leída en un espectrofotómetro de luminiscencia Perkin Elmer L5500B a 370nm de excitación y 430nm de emisión. La sensibilidad del espectrofotómetro fue ajustado a 330 U de fluorescencia con una solución estándar de quinina (0,1μg/ml). Los resultados fueron expresados en unidades de fluorescencia por gramo de tejido fresco.
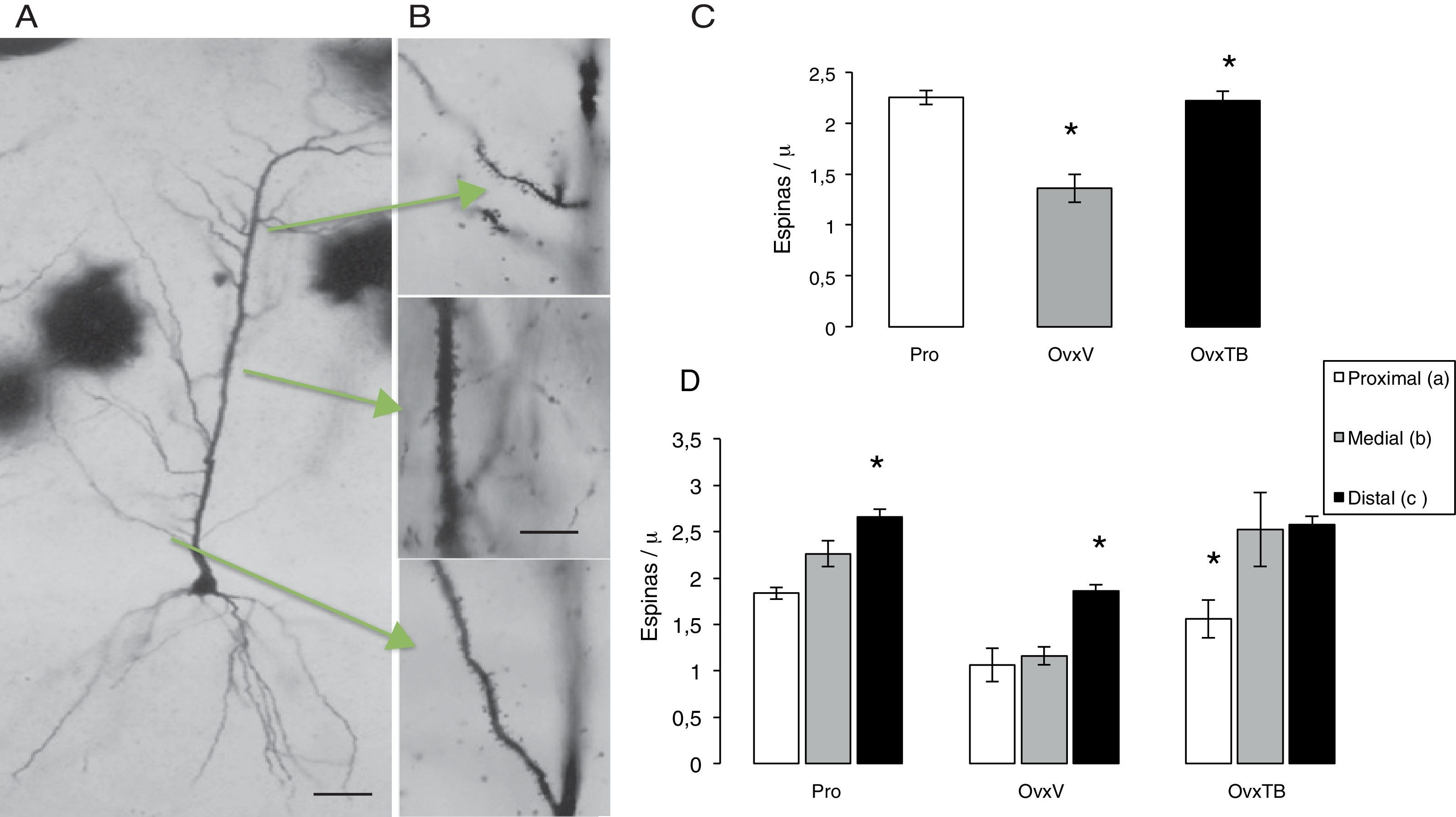
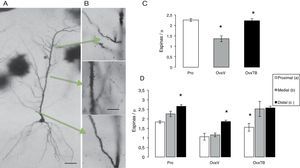
Análisis morfométrico de la densidad de las espinas dendríticasSe procesaron 6 hemicerebros, con la técnica de Golgi rápido16; se fijaron por inmersión en formalina al 10% en PBS, después de 72 h; se obtuvieron bloques rostrales de 4mm de ancho abarcando el área de hipocampo dorsal (bregma 2,8-4,2) y colocados durante 13 días en una solución de dicromato de potasio al 4,5% con ácido ósmico al 1% (8:1), diferenciados en nitrato de plata al 0,75% durante 24h, seguida de su deshidratación en alcoholes graduales (50% hasta alcohol etílico absoluto y éter) por 30min en cada uno. Se obtuvieron cortes coronales de 120μm en un microtomo de deslizamiento (Leitz Wetlar 47160), previa inclusión en nitrocelulosa de baja viscosidad. Su deshidratación se hizo en alcoholes graduales y su aclaramiento en terpinol, seguido de xileno y su montaje con entellan. En las preparaciones así obtenidas de cada sujeto experimental, se seleccionaron aquellas neuronas piramidales (NP) del CA1 del hipocampo que mostraban su árbol dendrítico completo, el soma piramidal y dendritas basales (fig. 2 A). Las mediciones se efectuaron evitando que el observador conociera el grupo experimental, asignando un número al azar a cada preparación. Se midieron aquellas NP que pudieran ser observadas en un plano focal que las permitiera ver claramente a 10X, con una impregnación homogénea y cuyas dendritas apicales estuvieran completas hasta su término en el stratum lacunosum moleculare (SLM). Estas NP del CA1 se caracterizan por tener de 3 a 5 dendritas basales primarias y un árbol dendrítico apical que asciende hasta el SLM con ramas secundarias sobre el stratum radiatum. Las dendritas se dividieron en 3 segmentos representativos de sus aferencias principales (fig. 2 B). El proximal de 100μm (comisurales y zona principal de entradas inhibitorias). El segmento medial entre 150μm del soma y el límite de 350μm (comisurales de Shaffer). El segmento distal se localizó en el inicio de la curvatura de la dendrita sobre el SLM (aferencias del patrón perforante)17 y el número de las espinas se contó en segmentos de 10μm a 100X en cada dendrita.
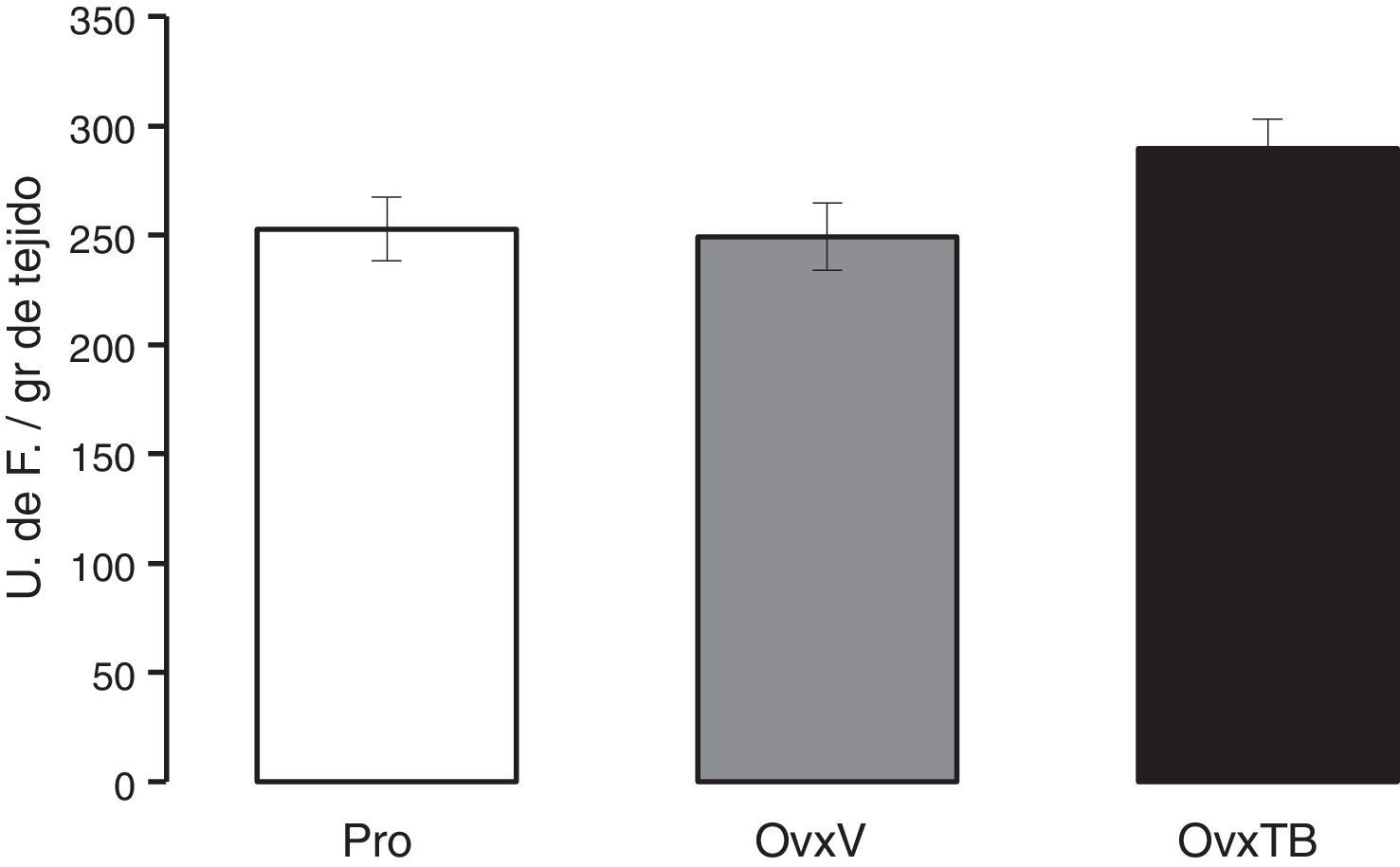
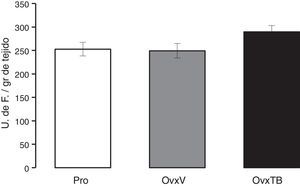
Gráfica en donde se muestran los valores promedio±error estándar de 10 animales por grupo. Los resultados se expresan en unidades de fluorescencia por gramo de tejido fresco.
OvxV: ovariectomizados con vehículo (OvxV); OvxTB: ovariectomizados tratados con Tibolona (1 mg/kg); Pro: animales en proestro.
Todos los valores fueron analizados con la prueba de Levene para determinar la homogeneidad de la variancia y utilizar una estadística paramétrica. Posteriormente, el análisis estadístico de los resultados de la PL se llevó a cabo con la prueba de análisis de variancia (ANDEVA) de una vía seguida de una prueba post hoc de Tukey; se tomó como diferencia estadísticamente significativa una valor de p ≤ 0,05. Para el análisis del total de espinas en los grupos de tratamiento se realizó con un ANDEVA de una vía, en donde el factor independiente es el tratamiento y el dependiente el promedio del número total de espinas en cada uno de los segmentos estudiados. Seguida de una prueba post hoc de Tukey con una p ≤ 0,05.
ResultadosPeroxidación de lípidosLos resultados obtenidos del efecto de la TB sobre la los niveles de la PL presente en el hipocampo de ratas con Ovx se muestran en la figura 1. Los resultados están dados como el valor promedio±error estándar de 10 animales por grupo y están expresados en unidades de fluorescencia por gramo de tejido fresco. Se puede observar que no existen diferencias estadísticamente significativas entre los valores promedio de los 3 grupos evaluados (Pro, OvxV y OvxTB), 40 días después de la administración de los tratamientos. ANDEVA de una vía (F2,25=2,429, p=0,107).
Efectos sobre la densidad total de espinas dendíticasEl ANDEVA de una vía realizado para la densidad total de espinas, donde se incluyen todos los segmentos (fig. 2 C), muestra diferencias estadísticamente significativas entre los diferentes grupos de tratamiento (F2,9=2.323,306, p<0,003). La prueba post hoc de Fisher indicó que el grupo OvxV posee menor densidad de espinas dendríticas comparadas con el grupo OvxTB y con el grupo control en etapa de proestro (Pro) con valores de p=0,003 y 0,002, respectivamente.
A) Fotomicrografías de una célula piramidal completa del CA1 del hipocampo. B) Las flechas indican los segmentos estudiados, así como las abreviaturas que representan la entrada de información. En B los segmentos dendríticos a 40X. En las gráficas C y D se indica la media±error estándar del total de espinas/“m lineal y en los 3 grupos: proestro (Pro), ovariectomizados tratados únicamente con vehículo (OvxV) y ovariectomizados tratados con tibolona (OvxTB). Nótese en la gráfica C las reducciones significativas (*p < 0,005) del grupo OvxV vs. los grupos OvxTB y Pro. En las gráficas de los segmentos en los 3 grupos (D), se indican reducciones significativas (*) entre el segmento c vs. a y b en los grupos Pro y OvxV y entre los segmentos a vs. b y c en el grupo OvxTB.
AC: comisurales de asociación; PP: patrón perforante; SC: colaterales de Schaffer.
El ANDEVA de 2 vías realizado para la densidad de espinas dendríticas en cada uno de los segmentos revela diferencias estadísticamente significativas respecto al tratamiento (F2,27=2.2946,00; p<0,001) entre los diferentes grupos. En la figura 2 C, se muestran las diferencias estadísticamente significativas respecto a cada uno de los segmentos estudiados (F2,27=17,39; p<0,001), pero no hay diferencias en la intersección entre ellos. La prueba post hoc de Fischer muestra que el grupo Pro aumenta la densidad de espinas en los segmentos proximal, medial y distal, mientras que los animales OvxTB muestran diferencias significativas en la densidad de espinas del segmento proximal con respecto al segmento distal. Además, los animales Ovx tuvieron diferencias significativas en la densidad de espinas del segmento distal con respecto a los segmentos proximal y medial (p<0,02) para cada uno de los casos. Esto permite inferir que el segmento distal es el que no se encuentra afectado por el tratamiento o que posee mayor resistencia a los cambios de niveles hormonales derivados de estrógenos.
DiscusiónLos resultados mostraron que el tratamiento con TB no tuvo efecto sobre la PL en los 3 grupos estudiados, lo que concuerda con lo reportado por de Aguilar et al. (2008)14, quienes administraron 2 dosis (0,5mg/kg y 1mg/kg) de TB por 12 semanas a ratas adultas ovariectomizadas y no encontraron efecto sobre los niveles de PL, concluyendo que la TB no incide sobre el daño oxidativo generado por efecto de la ovariectomía. Sin embargo, en este estudio, la dosis de TB (1mg/kg) administrada al grupo Ovx, durante 40 días, revirtió la poda de las espinas provocada por la ovariectomía. En la evaluación histológica del conteo de espinas realizada en los segmentos proximal, medial y distal en las células piramidales del CA1 del hipocampo de ratas ovariectomizadas mostró una reducción en la cantidad de espinas, lo que indica que las ED como sitios postsinápticos son altamente sensibles a la falta de estrógenos. En estudios previos, realizados por nuestro grupo y por otros18-20, se ha reportado que la distribución de las ED es heterogénea, dependiendo del segmento estudiado. Se sabe que en el segmento distal existe un mayor número de espinas en comparación con el segmento proximal; esta distribución fue observada nuevamente en los 3 grupos estudiados en este trabajo. Por otra parte, se comprobó que el grupo Ovx mostró un menor número de espinas, aunque conservando el mismo patrón de distribución normal, es decir, hay una mayor reducción de espinas en el segmento distal (en donde hay más espinas) que en el segmento proximal (donde de manera normal hay menos espinas). Asimismo, la suplementación oral de TB recupera la pérdida de espinas en esta área plástica cerebral que participa en la regulación de los procesos de aprendizaje y memoria. El mecanismo por el cual la TB ejerce este efecto no se conoce, ya que es el primer trabajo donde se describe la capacidad de la TB para inhibir la reducción en el número de espinas en las células piramidales del CA1 del hipocampo. En relación con el efecto de la TB, solo existe un reporte por Espinoza Raya et al. (2012)21, en el cual se demuestra que el tratamiento con TB mejora el aprendizaje de ratas ovariectomizadas. Los autores reportan que el mecanismo puede estar relacionado con la modulación de la función colinérgica y del sistema serotonérgico, ya que se observó un aumento del contenido de triptófano hidroxilasa por efecto del tratamiento con TB. Sobre la base de esta información, es probable que la TB ejerza su efecto neuroprotector tanto por la regulación de la síntesis de neurotransmisores involucrados en la memoria y el aprendizaje, como por las vías de señalización relacionadas con las ED.
Por otra parte, en el humano, se infiere que técnicas terapéuticas con estrógenos sintéticos pueden modificar la diversas actividades fisiológicas a nivel de órganos sistémicos como del cerebro y huesos; sin embargo, aún se discuten los efectos de los compuestos, como la TB, en vista de los importantes efectos secundarios que se reportan10 después de la menopausia y en asociación entre los niveles de tejido y las funciones cerebrales, así como de la distribución de sus metabolitos mono y trisulfatados22.
En este estudio, aunque no se encontró la respuesta antioxidante del tratamiento con TB, hubo una recuperación o rescate de la poda de ED producida por la ovariectomía a lo largo de la dendrita apical de las neuronas piramidales del CA1, dato que se relaciona con diversos estudios de plasticidad hipocampal con tratamientos con estrógenos exógenos, considerándose estos cambios plásticos como fluctuaciones inherentes al cambio de las concentraciones hormonales en el plasma a lo largo del ciclo estral18,19. Es interesante que la ovariectomía afecta a los 3 segmentos estudiados (proximal, medial y distal), mientras que el tratamiento con TB tiene un efecto diferencial sobre el segmento proximal donde la densidad de espinas dendríticas no es capaz de recuperarse después de la administración por 40 días de esta la hormona sintética. Estos resultados permiten indagar en un futuro cuáles serían los mecanismos de neuroprotección específicos de la TB que favorecen la plasticidad cerebral y qué relación podríamos encontrar con respecto al segmento proximal y los receptores a estrógenos que se expresan en esta zona determinada, que es la vía de entrada comisural de información proveniente de las colaterales de Shaffer, afectando al intracircuito del hipocampo para el paso de información de memoria de corto a largo plazo.
FinanciaciónEste trabajo fue financiado parcialmente por el CONACYT (Becas: 173299 y 17276), Programa de Doctorado de Ciencias Biomédicas (PDCB), DGAPA-UNAM y PROMEP UGTO-PTC-324. Programa para el mejoramiento del profesorado (PROMEP), Universidad de Guanajuato.
Conflicto de interesesLos autores declaran que no existe ningún conflicto de intereses.
Los autores desean agradecer A. Aguilar Vázquez, M. García Servín y a L. López Villanueva por su ayuda con el cuidado de los animales.