Muchos estudios han demostrado que la deficiencia de hierro modifica el funcionamiento normal del sistema nervioso central, alterando las habilidades cognitivas. Ante una situación de daño celular en el sistema nervioso central existen mecanismos neuroprotectores, como la producción de factores neurotróficos, los cuales son esenciales para un funcionamiento adecuado del tejido nervioso. El factor de crecimiento de insulina tipo II (IGF-II) es un factor neurotrófico que recientemente se ha involucrado en el funcionamiento normal de los procesos cognitivos en modelos animales; sin embargo, el impacto de la deficiencia de hierro sobre la expresión y funcionamiento de esta molécula aún no ha sido determinado.
MétodosSe emplearon cultivos primarios mixtos de células del sistema nervioso central, en los que se simuló la deficiencia de hierro empleando deferoxamina y se determinó la expresión de IGF-I, IGF-II, IGF-IR e IGF-IIR por medio de western-blot.
ResultadosSe observó un incremento en la expresión de IGF-II y una disminución en la expresión de IGF-IIR en cultivos primarios mixtos deficientes en hierro. No se observaron cambios en la expresión de dichas proteínas en cultivos individuales de microglía o neuronas en las mismas condiciones. No se encontraron diferencias en la expresión de IGF-I e IGF-IR en condiciones de deficiencia de hierro.
ConclusionesLa deficiencia de hierro in vitro induce un incremento en la expresión de IGF-II en cultivos mixtos de células gliales, lo que puede favorecer la homeostasis del tejido cerebral en situaciones de disminución en la disponibilidad de hierro.
Many studies have demonstrated that iron deficiency modifies the normal function of the central nervous system and alters cognitive abilities. When cellular damage occurs in the central nervous system, neuroprotective mechanisms, such as the production of neurotrophic factors, are essential in order for nervous tissue to function correctly. Insulin-like growth factor II (IGF- II) is a neurotrophic factor that was recently shown to be involved in the normal functioning of cognitive processes in animal models. However, the impact of iron deficiency on the expression and function of this molecule has not yet been clarified.
MethodsMixed primary cell cultures from the central nervous system were collected to simulate iron deficiency using deferoxamine. The expression of IGF-I, IGF-II, IGF-IR, and IGF-IIR was determined with the western blot test.
ResultsWe observed increased expression of IGF-II, along with a corresponding decrease in the expression of IGF-IIR, in iron-deficient mixed primary cell cultures. We did not observe alterations in the expression of these proteins in isolated microglia or neuronal cultures under the same conditions. We did not detect differences in the expression of IGF-I and IGF-IR in iron-deficient cultures.
ConclusionsIn vitro iron deficiency increases the expression of IGF-II in mixed glial cell cultures, which may have a beneficial effect on brain tissue homeostasis in a situation in which iron availability is decreased.
El hierro es un micronutriente esencial para el desarrollo y funcionamiento del sistema nervioso central (SNC); sin embargo, su carencia en la dieta y las consecuencias que ocasiona siguen siendo un problema de salud a nivel mundial1. La UNICEF calcula que casi 2.000 millones de personas en el mundo padecen esta deficiencia, afectando a la población infantil en un 20 al 25%2. El hierro es fundamental en el SNC debido a que participa en los procesos de migración y diferenciación celular, mielinización, sinaptogénesis, gliogénesis y neurogénesis, así como la síntesis de neurotransmisores, que en conjunto permiten el funcionamiento adecuado de las diferentes regiones cerebrales3–5. La deficiencia de hierro tiene un efecto negativo sobre estos procesos, ocasionando alteraciones de las funciones neurológicas y cognitivas en todas las edades6,7 al afectar estructuras importantes del cerebro, como el hipocampo y la corteza cerebral8.
Durante el desarrollo del SNC debe existir un equilibrio entre los factores externos, como el hierro aportado en la dieta, y los factores internos, que incluyen los factores de crecimiento, los cuales son moléculas que controlan los procesos de proliferación, diferenciación y supervivencia celular9,10, activan vías de señalización para modular la transcripción génica y favorecen la transducción de señales extracelulares11,12. Estudios recientes en animales han demostrado que el factor de crecimiento de insulina tipo II (IGF-II) es uno de los factores que actúa como protector ante el daño neuronal o glial, y participa como inductor en la generación y diferenciación de nuevas células, mejorando los procesos cognitivos13. El IGF-II se encuentra distribuido en diversas estructuras del SNC, incluyendo hipocampo, hipotálamo, estriado, corteza cerebral y cerebelo14,15, y requiere de la activación de su receptor específico (IGF-IIR) para favorecer sus efectos biológicos16,17. Sin embargo, a pesar de la importancia del IGF-II como factor neurotrófico y del impacto negativo que tiene la deficiencia de hierro sobre los procesos cognitivos, hasta el momento se desconoce el efecto que tiene la deficiencia de hierro sobre la expresión de esta molécula y su receptor.
Este estudio tuvo como finalidad identificar cambios en la expresión de IGF-II y de su receptor en cultivos primarios de células del SNC, en condiciones de deficiencia de hierro, para contribuir a la comprensión de las alteraciones moleculares que promueven los déficits cognitivos que ocurren como consecuencia de esta patología.
Sujetos, material y métodosLos experimentos fueron realizados en el Laboratorio de Neuroquímica, de la Facultad de Medicina, Universidad Autónoma del Estado de México, en el periodo agosto 2012-julio 2013.
Ratones BALB/cSe criaron parejas de ratones BALB/c durante 3 semanas, bajo condiciones estándar (alimento y agua natural purificada ad libitum; ciclo de luz-oscuridad de 12:12h; temperatura promedio de 20°C). Las hembras preñadas fueron separadas y mantenidas bajo las mismas condiciones de crianza y bajo observación hasta el nacimiento de la camada. Los ratones recién nacidos (<24h de vida) fueron empleados para el establecimiento de los cultivos celulares primarios.
Disección de tejido cerebral y obtención de células neuronales y glialesSe emplearon 4-8 ratones neonatos (<24h de vida), los cuales fueron colocados sobre placas de enfriamiento y sacrificados por decapitación. El tejido cerebral se colocó en medio de digestión (DMEM+0,25 tripsina/EDTA) y se incubó durante 1h en condiciones estándar (37°C, 5% CO2), para degradar el tejido conectivo. El proceso de digestión se detuvo con medio de cultivo completo (DMEM+FBS 10%) y las células obtenidas se centrifugaron durante 10min a 1.200rpm.
Cultivo mixto de células del sistema nervioso centralLas células purificadas se cultivaron a una densidad de 1–1,2x105cél/cm2 de área de cultivo; se colocaron en incubación bajo condiciones estándar (37°C, 5% CO2) durante 10-15 días, hasta alcanzar una confluencia >80%.
Cultivo de neuronasA partir del cultivo mixto de células gliales, una vez transcurridas 24h se obtuvo el sobrenadante y se centrifugó, para obtener las células no adherentes, las cuales se cultivaron a una densidad de 1 a 1,2x105cél/cm2 en placas de cultivo preparadas previamente con poli-L-lisina, y medio de cultivo neurobasal, adicionado con suplemento B-27 y 5% FBS. El cultivo se mantuvo en incubación bajo condiciones estándar (37°C, 5% CO2) durante 10-15 días.
Cultivo de células de la microglíaA partir del cultivo mixto, una vez obtenida la confluencia deseada, se adicionó tripsina/EDTA 0,25mM durante 30 a 45min para inducir la separación de los astrocitos. Una vez separadas las células, se obtuvo y se centrifugó el sobrenadante a 1.200rpm a 21°C durante 5min, y se procedió a cultivarlas a una densidad de 1–1,2x105cél/cm2 de área de cultivo. Se adicionó medio de cultivo completo (DMEM+FBS 8%) y se mantuvieron bajo condiciones estándar (37°C, 5% CO2), hasta alcanzar una confluencia >80%.
Establecimiento de los cultivos celulares deficientes de hierroLos cultivos celulares correspondientes fueron tratados con deferoxamina (100μM), durante 24h, para crear las condiciones de deficiencia de hierro en el medio. Los cultivos suficientes en hierro no recibieron tratamiento alguno.
Extracción y dosificación de proteínasPara la extracción de proteínas de los cultivos celulares, se añadieron 50–80μL de buffer de lisis adicionado con inhibidores de proteasas y fosfatasas (+ 20μL IP 50X+100μL NaF 50mM+20μL PMFS 1mM+20μL Na3VO4 2mM) en cada pozo y se procedió al raspado de las células, las cuales se colectaron en tubos de 1,5mL, manteniéndolas en hielo durante 45min con agitación. Posteriormente, se centrifugaron a 13.000rpm a 4°C durante 20min, para obtener las proteínas en el sobrenadante. El botón de restos celulares fue eliminado. La dosificación de proteínas se realizó con el método de Bradford previamente descrito en el Quick Start™ Bradford Protein Assay de BIO-RAD.
Análisis de expresión de proteínas por western-blotSe preparó un gel de corrimiento del 10% para la detección de las proteínas de interés. Previo al uso de las proteínas dosificadas, se determinó la expresión de actina (Sigma-Aldrich) como control para la cantidad de muestra empleada, utilizando un anticuerpo monoclonal de ratón antiactina a una concentración de 1:2.000. Posteriormente, se realizó el corrimiento de muestras control (con hierro normal) y las muestras problema (con deficiencia de hierro), empleando 60μg de proteína para cada una. Terminado el corrimiento, se realizó la transferencia de las proteínas hacia una membrana de PVDF. Al término de la transferencia se lavó la membrana y se bloqueó con leche al 5% durante 1h. Para la detección de IGF-IIR, se empleó un anticuerpo primario policlonal de conejo antirratón (Santa Cruz Biotechnology) a una concentración de 1:250, mientras que para IGF-II se empleo el anticuerpo policlonal de conejo antirratón para IGF-II (Abcam) a una concentración de 1:1.500, durante toda la noche en agitación a 4°C. Como anticuerpo secundario se utilizó un anticuerpo policlonal de ratón anticonejo (Thermo) a una concentración de 1:2.000 para IGF-IIR e IGF-II, durante 90min a temperatura ambiente. Finalmente, la membrana se reveló mediante el método colorimétrico con diaminobenzidina+peróxido de hidrógeno en PBS, en agitación, durante 15 a 30min.
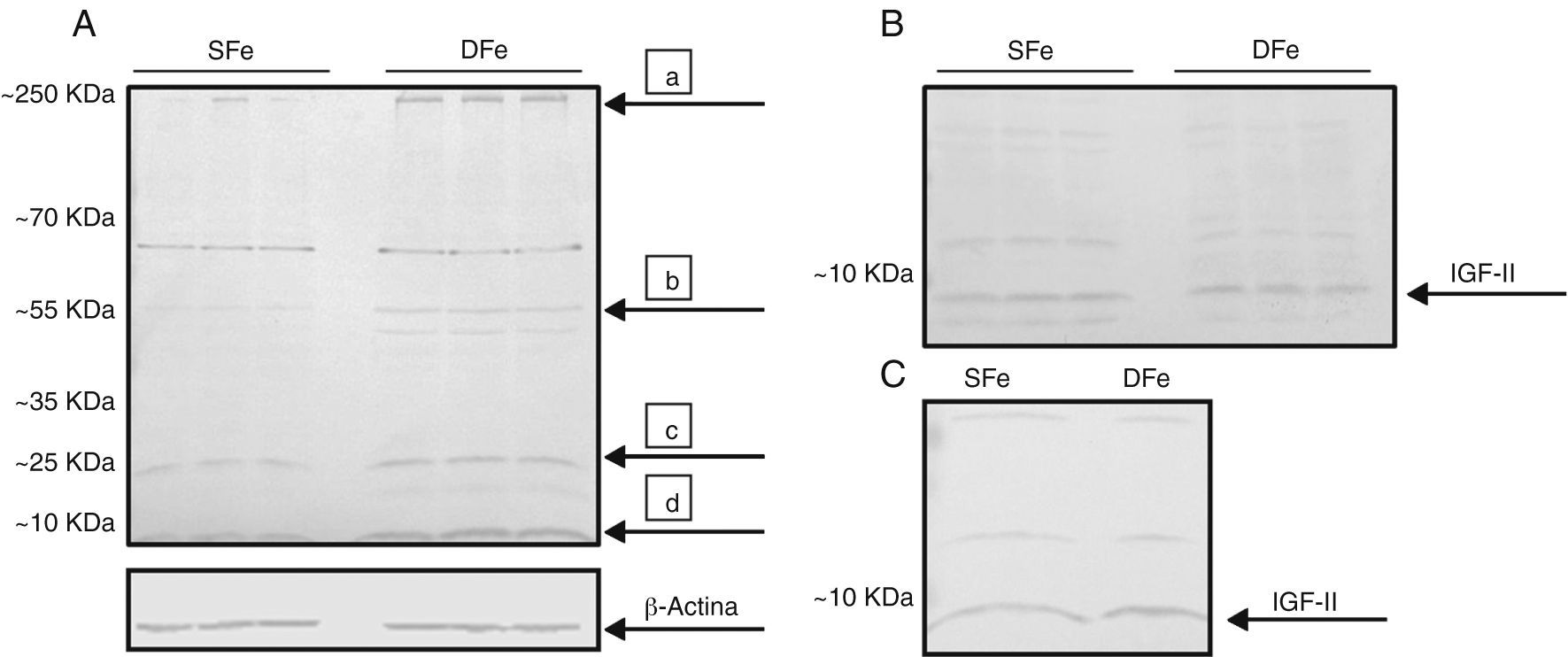
ResultadosExpresión de factor de crecimiento de insulina tipo II en condiciones de deficiencia de hierroPara determinar el efecto de la deficiencia de hierro sobre células derivadas del SNC, se analizaron las diferencias en la expresión de IGF-II en los cultivos primarios mixtos de células gliales deficientes de hierro y sus controles. Se detectó una banda con un peso molecular aproximado <10KDa, correspondiente al peso molecular de 7,5KDa esperado para la molécula de IGF-II madura (fig. 1). La expresión de esta banda se observó incrementada en los cultivos con deficiencia de hierro con respecto a los cultivos control. Adicionalmente, se observó consistentemente la presencia de bandas con pesos moleculares entre 20 y 70KDa, así como bandas en un peso >250KDa (fig. 1). Estas proteínas mostraron un comportamiento similar al del IGF-II, incrementando su expresión en los cultivos deficientes de hierro, con excepción de la banda con peso de ∼70KDa, la cual no mostró cambios en estas condiciones.
Análisis de expresión de IGF-II de cultivos de células del SNC de ratones BALB/c por western-blot. (A) Cultivos mixtos con hierro suficiente (SFe) o hierro deficiente (DFe). Las flechas indican las principales proteínas encontradas: a) IGFBP-3, b) IGFBP-2, c) IGFB4, d) IGFII. (B) Cultivos de células de la microglía, SFe y DFe. (C) Cultivos de células neuronales SFe y DFe. B-actina se muestra como control de carga.
Para determinar la población celular responsable del incremento en la expresión de IGF-II en los cultivos mixtos, se analizó la expresión de IGF-II en cultivos aislados de microglía y neuronas; sin embargo, en estos cultivos no se observaron diferencias en la expresión de IGF-II en condiciones de deficiencia de hierro. De igual forma a los cultivos mixtos, se detectaron bandas de ∼20 y 55KDa, para ambos tipos celulares, además de otras bandas de ∼35 y 70KDa en las neuronas. Estas bandas tampoco mostraron diferencias en su expresión en condiciones de deficiencia de hierro.
En función de los resultados obtenidos observamos que la deficiencia de hierro induce un incremento en la expresión de IGF-II en cultivos mixtos de células del SNC, pero no en poblaciones celulares separadas de microglía o neuronas.
Expresión de receptor específico del factor de crecimiento de insulina tipo II en cultivos mixtos de células glialesUna vez detectadas las alteraciones en la expresión de IGF-II, nos propusimos determinar si el efecto encontrado se aplicaba también al receptor para dicha molécula. El análisis de la expresión de receptor de IGF-II en cultivos mixtos de células gliales mostró una banda con peso molecular >250KDa, la cual puede corresponder a IGF-IIR (∼300KDa), en células cultivadas con concentraciones normales del nutriente; por el contrario, la expresión de esta molécula se observó disminuida, al punto de ser prácticamente inexistente, en condiciones de deficiencia de hierro (fig. 2). Adicionalmente, detectamos consistentemente una banda de ∼70KDa, la cual no mostró cambios en su expresión en los cultivos deficientes de hierro. Esta banda no corresponde al peso molecular reportado para la molécula. Estos resultados indican que la deficiencia de hierro disminuye la expresión de IGF-IIR en cultivos mixtos de células del SNC.
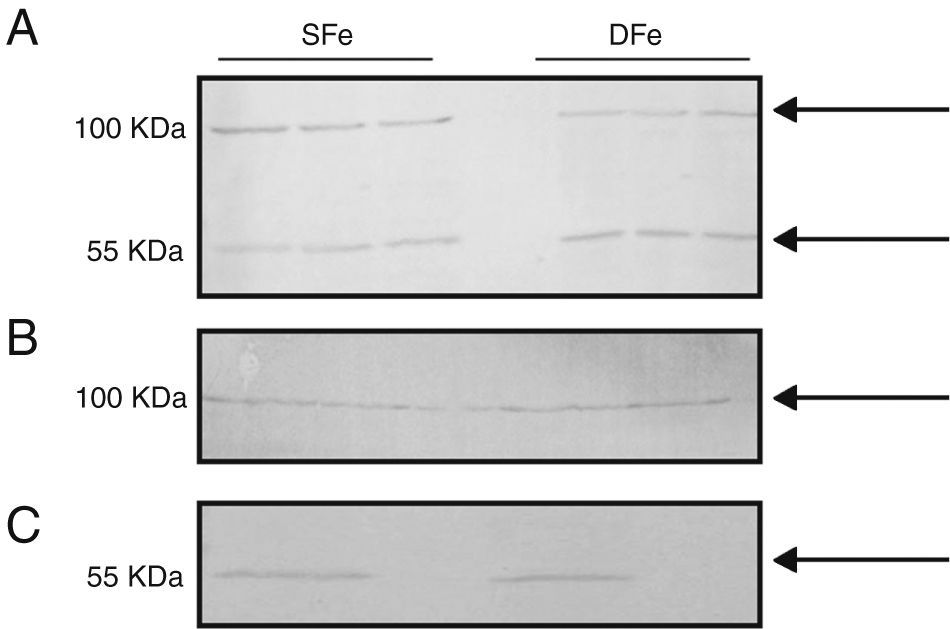
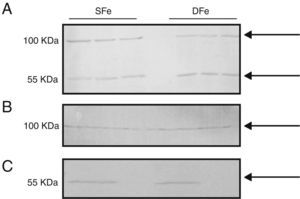
Expresión de factor de crecimiento de insulina tipo I y de receptor específico del factor de crecimiento de insulina tipo I en cultivos mixtos de células gliales y poblaciones separadas de microglía y neuronasCon el fin de comparar la expresión de IGF-II y su receptor con la de otro factor de crecimiento relacionado de manera muy cercana con el mismo, se analizó la expresión de IGF-I e IGF-IR en los cultivos celulares del SNC. No se pudieron observar diferencias en la expresión de IGF-I en los cultivos celulares deficientes de hierro, debido a que las bandas detectadas se encontraron con peso molecular de ∼50KDa y ∼100KDa, las cuales no corresponden al peso molecular esperado para IGF-I (7,6KDa) (fig. 3). Adicionalmente, se realizó la búsqueda de la expresión en poblaciones celulares separadas de microglía y neuronas, en las cuales tampoco se detectó la banda esperada <10KDa. No se detectaron diferencias en la expresión de las proteínas de 50 o 100KDa en condiciones de deficiencia de hierro.
Expresión de IGF-I en cultivos celulares del SNC de ratones BALB/c por western-blot. (A) Cultivos mixtos de células gliales, (B) cultivos de células de la microglía, (C) cultivos de células neuronales. Cultivos con hierro suficiente (SFe) o con hierro deficiente (DFe). Las flechas indican las bandas detectadas por el anticuerpo.
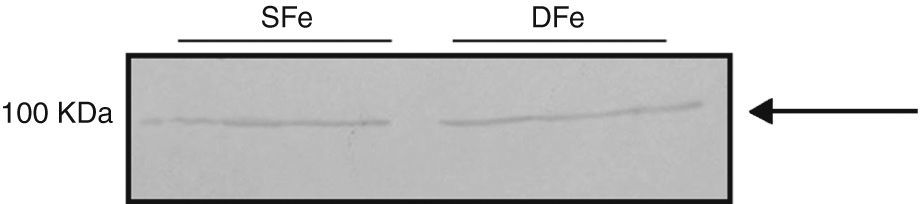
Con respecto al receptor IGF-IR, se detectó una banda de ∼100KDa en los cultivos celulares mixtos, la cual puede corresponder a IGF-IRβ con un peso molecular de 97KDa. Adicionalmente se detectó una banda de ∼50KDa. No observamos diferencias en la expresión de esta proteína en condiciones de deficiencia de hierro (fig. 4).
DiscusiónUna dieta adecuada es trascendental en etapas tempranas del desarrollo para favorecer el crecimiento y desarrollo del SNC18. Existe evidencia del vínculo entre los micronutrimentos de la dieta y la función de los factores neurotróficos19–22.La deficiencia de vitamina A disminuye la expresión de BDNF y NGF en el SNC19,23. Igualmente, existe una relación de la vitamina B con un incremento en las concentraciones de BDNF en el SNC24,25, y los antioxidantes, como las vitaminas E y C, pueden favorecer los efectos protectores de BDNF y CNTF en el tejido nervioso22,26,27. Sin embargo, existe poca evidencia con respecto a la relación que existe entre la deficiencia de hierro y la expresión de factores neurotróficos específicos, más allá del BDNF.
Con relación a los IGF, se ha demostrado que la deficiencia de hierro puede modificar la expresión de IGF-I en ratones, alterando la vía de señalización de mTOR, regulada por la vía de Akt28,29, ocasionando una disminución de la señalización mediada por IGF-I, y afectando la proliferación, supervivencia y mielinización neuronal30. Cuando la carencia del metal es corregida con hierro complementario, se pueden normalizar las concentraciones de IGF-I; sin embargo, esto no ocurre para IGF-II30,31, así que a pesar de ser constituyentes de la misma familia pueden tener respuestas diferentes, desde la regulación genética a sus efectos en la homeostasis celular.
Este estudio demuestra que la deficiencia de hierro ocasiona un incremento en la expresión de IGF-II en cultivos primarios de células del SNC. Es importante notar que otros estudios han demostrado que la expresión de BDNF disminuye en condiciones de deficiencia de hierro32, lo que sugiere la posibilidad de que la expresión de IGF-II puede verse estimulada ante una situación de estrés del tejido cerebral por carencia del nutrimento, favoreciendo un efecto neuroprotector mediado por este factor neurotrófico. El aumento en la expresión de IGF-II bajo efecto de la deficiencia de hierro se observó principalmente en cultivos celulares mixtos, es decir, aquellos que estaban constituidos por neuronas, astrocitos, células de la microglía, oligodendrocitos e incluso células endoteliales, lo cual puede significar que las diferentes poblaciones celulares interaccionan, creando un ambiente favorable para que IGF-II pueda incrementar su expresión bajo condiciones de deficiencia del metal. Este punto estaría demostrado en el hecho de que no fue posible observar diferencias en la expresión de IGF-II en condiciones de deficiencia de hierro cuando se emplearon cultivos aislados de microglía o neuronas. Asimismo, dado que la gran mayoría de las células que se obtienen en los cultivos mixtos son astrocitos, es posible que el incremento en la expresión de IGF-II observado en condiciones de deficiencia de hierro pueda deberse a la actividad de esta población celular, lo cual está siendo analizado actualmente.
Las bandas adicionales detectadas en el análisis por western-blot, con pesos moleculares de ∼20, 50 y 70KDa, son similares a lo reportado por Walter et al. en su estudio33, por lo que se considera que pueden corresponder a IGF-II unido a proteínas de unión a IGF (IGFBP). Debido a que el transporte y la actividad de los IGF son modulados temporal y localmente por estas proteínas de unión34, estas proteínas pueden formar complejos con los IGF para regular su aclaramiento renal, transportarlos en los compartimentos vasculares y modular su interacción con los receptores de superficie celular34,35. Entre las proteínas con mayor concentración que se han encontrado en el SNC intacto, especialmente en el plexo coroideo y meninges, se encuentran la IGFBP-2, -4, -5 y -636,37, pero en condiciones patológicas IGFBP-2, -3 y -6 han sido encontradas en el líquido cefalorraquídeo, y han sido relacionadas con el transporte de IGF-II38,39. En este sentido, la banda de proteína con peso molecular de ∼20KDa puede corresponder a IGFBP–4, el cual ha sido aislado en 2 formas, de 24 y 29KDa, respectivamente40. En el SNC se ha observado en el epéndimo, plexos coroideos, meninges y tractos nerviosos mielinizados, y cuando existe alguna lesión se llega a encontrar en neuronas, astrocitos, microglía y macrófagos41. Por otro lado, las bandas halladas con pesos inferiores o cercanos a 50KDa pueden corresponder a IGFBP–2 o IGFBP–3, con un peso molecular de 32 a 34KDa y 53KDa, respectivamente, que están presentes en el líquido cefalorraquídeo42,43, plexos coroideos, tractos nerviosos corticales, epéndima y meninges, y cuando existe alguna lesión en el tejido cerebral puede incrementar su expresión en neuronas, astrocitos y macrófagos41. IGFBP-2 muestra mayor afinidad por IGF-II, en comparación con IGF-I 44, mientras que IGFBP-3 tiene mayor afinidad por IGF-I45. Es importante notar que la banda con un peso molecular de 70KDa puede corresponder también a IGFBP–3, que se ha encontrado con isoforma con alto peso molecular46.
Por último, se detectó una banda con peso molecular >250KDa, la cual puede corresponder a IGF-II adherido a su receptor, que tiene un peso molecular de ∼300KDa17. En general, las bandas adicionales mostraron un incremento en su expresión en condiciones de deficiencia de hierro, con excepción de la banda de 70KDa, la cual no tuvo cambios en su expresión. Si estas proteínas corresponden a IGFBP, pueden reforzar la importancia que tienen estas proteínas en la regulación y modulación de la función de los IGF, no solo en condiciones fisiológicas, sino bajo situaciones patológicas.
Se sabe que las múltiples funciones del IGF-II son mediadas por 2 tipos de receptores principalmente, que son el IGF-IR y el IGF-IIR, con diferente afinidad47. La afinidad más alta para IGF-II es por su receptor específico IGF-IIR, el cual participa en la señalización de IGF-II para mediar la respuesta metabólica en neuronas16,48. La importancia de IGF-IIR radica en que se ha observado que la mejora de las funciones cognitivas dependiente de IGF-II requiere principalmente de IGF-IIR13. En comparación con el incremento de la expresión de IGF-II observado en condiciones de deficiencia de hierro, se evidenció una disminución de la expresión de IGF-IIR en las mismas condiciones. Se ha demostrado que la adición de IGF-II in vitro induce la expresión de IGF-IIR sobre la superficie celular de cultivos neuronales49,50, lo que sugiere la posibilidad de que las concentraciones de IGF-II modulan la expresión de su receptor en células del SNC, de tal forma que si disminuyen las concentraciones de IGF-II, se incrementan las de su receptor específico, y viceversa; de manera que IGF-IIR puede compensar la disminución o aumento de IGF-II y activar vías de señalización que promueven los procesos celulares involucrados en el crecimiento y desarrollo del SNC ante situaciones patológicas, como la deficiencia de hierro. Estos resultados contrastan con estudios sobre IGF-I y su receptor, donde se ha observado que la deficiencia de hierro disminuye la expresión de IGF-I, sin alterar la expresión de IGF-IR51.
Coincidiendo con Fushimi et al.49, se detectaron bandas adicionales, con pesos moleculares de ∼70 y 80KDa, las cuales no mostraron diferencias en su expresión en condiciones de deficiencia de hierro. Sin embargo, se observó un incremento de la banda de ∼60KDa en las mismas condiciones. Las bandas con menor peso molecular pueden corresponder a la fragmentación del receptor durante el procedimiento de lisis celular, o a la falta de especificidad del anticuerpo policlonal empleado durante el estudio.
Finalmente, se analizó la expresión de IGF-I e IGF-IR en cultivos mixtos de células gliales, debido en parte a que la unión funcional de IGF-II a las células puede ser modificada tanto por IGFBP como por IGF-IR47,52, además de comparar la respuesta de IGF-II con la de IGF-I y sus respectivos receptores en condiciones de deficiencia de hierro. Se sabe que IGF-I, de manera similar a IGF-II, favorece el crecimiento y desarrollo de neuronas e incluso tiene efectos protectores en situaciones de hipoxia e hipoglucemia53; sin embargo, tienen algunas diferencias en su distribución54, aunque ambos están ampliamente distribuidos en el tejido cerebral. Existen reportes en los que la deficiencia de hierro disminuye las concentraciones en plasma de IGF-I55. También se ha reportado que esta condición afecta la señalización mediada por IGF-I con sus consecuente afectación en las poblaciones celulares30, e incluso, puede incrementar la expresión de la molécula y de su receptor41. Sin embargo, no fue posible observar diferencias en la expresión de esta molécula en condiciones de deficiencia de hierro, debido a que el anticuerpo empleado no permitió la detección de la banda esperada con un peso <10KDa. El análisis de la expresión de IGF-I detectó bandas adicionales, con pesos moleculares ∼100 y 55KDa, en el cultivo mixto: ∼100KDa en células gliales y ∼55KDa en neuronas. Estas bandas pueden corresponder a la unión de IGF-I con IGFBP, o a la unión de la molécula con IGF-IR45,56, aunque esto no se ha determinado con ningún resultado. En cualquier caso, no se observó una diferencia en la expresión de estas proteínas en condiciones de deficiencia de hierro.
La banda de ∼100KDa detectada en el análisis de expresión de IGF-IR puede corresponder a la subunidad beta de IGF-IR, la cual tiene un peso molecular de 97KDa. De manera adicional, encontramos otra banda con un peso molecular de ∼55KDa, que puede deberse a la fragmentación del receptor durante el proceso de lisis celular. En ninguno de los casos se observaron diferencias en la expresión de esta proteína en condiciones de deficiencia de hierro. Es importante notar que los resultados obtenidos en este estudio en cuanto a la expresión de IGF-I e IGF-IR contrastan con las observaciones de Tran et al.30, quienes sí observaron modificaciones en la expresión de estas moléculas en condiciones de deficiencia de hierro.
Cabe mencionar que existen otros factores que no fueron considerados en el estudio, como el tiempo de exposición a la deficiencia de hierro. Se sabe que esta condición es una patología crónica que afecta el SNC desde etapas tempranas del desarrollo y puede perdurar hasta la etapa adulta51,57. Previamente se ha observado que la expresión de IGF-II, IGF-IIR e incluso IGFBP tenían una respuesta diferente durante la fase aguda en comparación con la fase crónica de este padecimiento, cuando el cerebro tiene alguna lesión. En la fase aguda las concentraciones de IGF-II además de IGFBP-2, -3 y -6, se incrementan en el líquido cefalorraquídeo, mientras que en la fase crónica disminuyen su concentración33. Debido a que en este estudio se analizó el efecto de una deficiencia aguda del metal sobre poblaciones celulares particulares, es necesario aún determinar el efecto de una deficiencia crónica del metal, no solo sobre los cultivos celulares, sino con estudios in vivo.
Los resultados obtenidos en este estudio indican que la deficiencia de hierro in vitro ocasiona un incremento en la expresión de IGF-II en cultivos primarios mixtos de células derivadas del SNC, el cual va acompañado de una disminución en la expresión del receptor IGF-IIR. El incremento en la expresión de esta molécula bajo condiciones de deficiencia de este elemento puede desempeñar un papel neuroprotector, favoreciendo la homeostasis del tejido nervioso en condiciones patológicas.
FinanciaciónEl proyecto fue financiado por el Programa de Mejoramiento del Profesorado (PROMEP) de la Secretaría de Educación Pública (SEP), México. EMG contó con una beca de estudios de posgrado del Consejo Nacional de Ciencia y Tecnología (CONACYT).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los avances iniciales del proyecto se presentaron en la modalidad cartel en el congreso “Experimental Biology 2013”.