Los trastornos primarios de la presión intracraneal incluyen la hipertensión intracraneal idiopática y la hipotensión intracraneal espontánea. El diagnóstico y tratamiento de ambas entidades ha presentado un avance destacable en los últimos años, por lo que desde el Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología consideramos necesaria la elaboración de este documento de consenso con la inclusión de algoritmos diagnósticos y terapéuticos para mejorar su manejo en la práctica diaria.
Este documento ha sido redactado por un comité de expertos del Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología tras realizar una revisión sistemática de la bibliografía, incorporando la experiencia de los participantes y estableciendo unas recomendaciones prácticas con niveles de evidencia y grados de recomendación.
Primary intracranial pressure disorders include idiopathic intracranial hypertension and spontaneous intracranial hypotension. These two entities have presented a remarkable advance in diagnostic and therapeutic techniques in recent years. Therefore, the Spanish Society of Neurology's Headache Study Group considered it necessary to prepare this consensus document with the inclusion of diagnostic and therapeutic algorithms to facilitate and improve their management in clinical practice.
This document was created by a committee of experts of the Spanish Society of Neurology's Headache Study Group based on a systematic review of the literature, incorporating the experience of the participants, and establishing practical recommendations with levels of evidence and grades of recommendation.
Las cefaleas atribuidas a cambios en la presión intracraneal, tanto el aumento como la disminución de la presión del líquido cefalorraquídeo (LCR), están incluidas en The International Classification of Headache Disorders 3rd edition (ICHD-3)1 en el grupo de cefaleas atribuidas a trastorno intracraneal no vascular.
En este grupo se incluyen dos entidades debidas a trastornos de la presión intracraneal primarios que son la hipertensión intracraneal idiopática (HII) y la hipotensión intracraneal espontánea (HIE), de creciente interés en los últimos años.
Desde el Grupo de Estudio de Cefaleas de la Sociedad Española de Neurología (GECSEN) se ha elaborado este documento de consenso sobre los trastornos de la presión intracraneal, partiendo de una revisión sistemática cualitativa de la bibliografía, en base a la evidencia científica disponible en bases de datos como Pubmed, Cochrane Library Plus y MESH desde 1990 hasta 2023. Asimismo, se han valorado las guías de práctica clínica, los documentos de consenso más recientes y se ha incorporado la experiencia de los participantes. El objetivo de esta revisión es proporcionar al clínico una serie de recomendaciones prácticas para el adecuado manejo diagnóstico y terapéutico de estas entidades, que se deberá adaptar a la experiencia y características de cada centro. Para establecer los niveles de evidencia (NE) y los grados de recomendación (GR) de las actuaciones terapéuticas se han seguido los utilizados en el último manual de práctica clínica en cefaleas del GECSEN2, especificados en la tabla 1.
Niveles de evidencia (NE) y grados de recomendación (GR)
| NE I | Ensayos clínicos controlados, prospectivos y con evaluación ciega realizados sobre población representativaRevisiones sistemáticas de ensayos clínicos controlados en población representativaEn ambos se requieren las siguientes características:a) Muestreo aleatorizadob) Objetivos claramente definidosc) Criterios de exclusión/inclusión claramente definidosd) Adecuado control de pérdidas de seguimientoe) Las características basales de los pacientes son explícitas en el texto y equivalentes entre los grupos o las diferencias han sido ajustadas estadísticamente |
| NE II | Estudios de cohortes prospectivos en una población representativa con evaluación ciega que reúne los criterios a-e. Ensayos clínicos controlados, prospectivos y con evaluación ciega realizados sobre población representativa que no cumple alguno de los criterios a-e |
| NE III | Todos los demás estudios controlados en una población representativa en los que la evaluación es independiente del tratamiento del paciente |
| NE IV | Estudios no controlados, series de casos, casos aislados u opiniones de expertos |
| GR A | Recomendación definitivamente efectiva, ineficaz o peligrosa. Requiere al menos un estudio concluyente de Nivel I o dos estudios convincentes de Nivel II |
| GR B | Recomendación probablemente efectiva, ineficaz o peligrosa. Requiere al menos un estudio concluyente de Nivel II o varios estudios de Nivel III |
| GR C | Recomendación posiblemente efectiva, ineficaz o peligrosa. Requiere al menos dos estudios concluyentes de Nivel III |
| GECSEN | Recomendación eventualmente efectiva, ineficaz o peligrosa. No reúne los requisitos mínimos para Grado C, pero es una recomendación de consenso por parte de los miembros del grupo elaborador del presente documento |
El LCR es esencial para el funcionamiento del sistema nervioso central. Los cambios en su composición, flujo o presión pueden causar una gran variedad de síntomas y signos neurológicos. Se distribuye en el sistema ventricular y subaracnoideo craneal y espinal y tiene dos funciones principales: reducir el peso cerebral efectivo de 1.500g a unos 50g para evitar lesiones mecánicas y proporcionar un medio para la transferencia de nutrientes y productos de desecho.
En adultos sanos, el LCR tiene un volumen de 125-150ml. El 80% del LCR se produce en los plexos coroideos en los ventrículos laterales, tercero y cuarto, el resto se produce en el epéndimo, aracnoides y el propio tejido cerebral3.
La circulación dinámica del LCR está impulsada por su secreción a un ritmo de aproximadamente 25ml/h. Este flujo constante de LCR desplaza a los detritus antiguos asegurando un entorno estable.
El LCR producido en los ventrículos laterales fluye a través de los agujeros de Monro (intraventriculares) hacia el tercer ventrículo y desde ahí al cuarto ventrículo a través del acueducto de Silvio. El LCR drena desde el cuarto ventrículo a través de los agujeros de Luschka y de Magendie hacia el espacio subaracnoideo, cerca de la cisterna pontina.
La eliminación del LCR se lleva a cabo mayoritariamente a través de las granulaciones aracnoideas, proyección de las células de la aracnoides sobre los senos vasculares que alberga la duramadre. Estos senos desembocarán directamente en el torrente sanguíneo venoso. Una vía menor de eliminación se produce a través del espacio subaracnoideo de los bulbos olfatorios, que se continúa con un espacio alrededor de los nervios olfatorios (por lo tanto, queda muy cerca de la mucosa olfatoria y del espacio aéreo de la nariz). Desde esta región pasa a los ganglios linfáticos de la zona. Una tercera vía de eliminación es a través del sistema glinfático, un sistema de canales descubierto recientemente que está formado por astrocitos situados alrededor de las arterias de la piamadre. Su función es proporcionar una ruta de entrada para el LCR a cambio del líquido intersticial del encéfalo y la médula espinal. Esto significa que pequeñas cantidades de LCR entran al tejido nervioso, mientras que la misma cantidad de líquido intersticial sale del espacio subaracnoideo para ser eliminada a través de los senos venosos durales4,5.
Determinación de la presión del LCR y parámetros de normalidadLa medición de la presión de LCR es una parte fundamental de la punción lumbar. Debe medirse con el paciente en decúbito lateral, con una aguja espinal de pequeño calibre con el fin de minimizar la filtración de LCR. La presión normal de apertura del LCR oscila en el 95% de los pacientes entre 100 y 250mm de LCR y se mide con un manómetro conectado a la aguja y situando el 0 a la altura de las apófisis espinosas. La presión de LCR registrada en el manómetro representa la presión venosa transmitida desde el lado derecho del corazón a través de los senos venosos, por lo que puede haber fluctuaciones en la presión con la respiración o las maniobras de Valsalva6. Para evitarlas, se recomienda que, una vez se haya realizado la punción de forma exitosa, el paciente extienda simétricamente las extremidades inferiores, para que no compriman el abdomen. Si no es posible la realización de la punción en decúbito lateral, se podría hacer con el paciente sentado, aunque es poco recomendable, ya que existe riesgo de enclavamiento, de síncope y la presión de LCR sería más alta por lo que se deberían utilizar tablas de equivalencia de la presión en sedestación6.
Hipertensión intracraneal idiopáticaEpidemiologíaLa incidencia anual de HII se sitúa en torno a 1-2 casos por cada 100.000 habitantes/año7, aunque existen discrepancias entre los estudios epidemiológicos realizados en diferentes zonas geográficas7–9. En mujeres con edades comprendidas entre los 15 y los 44 años, la incidencia se eleva hasta 3,3-28 pacientes por cada 100.000 habitantes/año y aún más en mujeres con obesidad8. Considerando que el aumento de peso es el principal factor de riesgo para el desarrollo de esta enfermedad, el incremento de las tasas de obesidad en la población probablemente provocará un incremento progresivo de la incidencia y la prevalencia de HII10,11.
La HII también puede aparecer en varones, niños, ancianos o pacientes con normopeso, pero en estos casos es particularmente importante descartar causas secundarias. En la edad pediátrica la diferencia entre sexos no es tan clara y la tasa de obesidad en este grupo etario no es distinta de la de los controles sanos12. En edades por encima de los 45 años, también se difumina la diferencia entre sexos por la elevada prevalencia de obesidad. En los hombres con HII la distribución por edades es similar y la obesidad sigue siendo el factor de riesgo más importante, aunque con una prevalencia menor que en las mujeres13. Algunos autores han sugerido un posible componente genético, dado que hasta un 5% de pacientes tienen historia familiar positiva, cifra mayor que la prevalencia de HII entre la población obesa14.
EtiopatogeniaEl mecanismo subyacente para el desarrollo de la HII aún no se conoce por completo. Hay numerosos factores que podrían contribuir, entre los que destacan la alteración de la dinámica del LCR y el aumento de la presión de los senos venosos. Además, la relación claramente demostrada entre la HII, el sexo femenino y la obesidad han llevado a plantear hipótesis con respecto al papel potencial de los factores hormonales y metabólicos.
Alteración de la dinámica de LCR y aumento de la presión venosaLa obstrucción de la reabsorción del LCR a nivel de las granulaciones aracnoideas y/o en las zonas de drenaje linfático es actualmente una de las principales hipótesis para el desarrollo de HII15. La reabsorción del LCR depende del gradiente de presión entre los senos venosos y el espacio subaracnoideo. Por ello un aumento de la presión venosa conllevaría una disminución de las tasas de reabsorción16. El aumento de la presión en los senos venosos es un factor fisiopatológico que ha ido ganando importancia. Sin embargo, en la actualidad no está claro si se trata de la etiología primaria de la enfermedad o una consecuencia de esta15.
Es necesario un gradiente de presión entre 3 y 5mmHg entre el espacio subaracnoideo y los senos venosos para facilitar el drenaje de LCR a través de las granulaciones aracnoideas. Debido a ello, el aumento de la presión en los senos venosos podría impedir la reabsorción de LCR. Las estenosis de los senos venosos, sobre todo en el seno trasverso, se detectan frecuentemente en pacientes con HII. Sin embargo, un estudio retrospectivo detectó que no había una asociación significativa entre el grado de estenosis y la presión de apertura del LCR16 y además se observó cómo, en algunos casos, tras corregir la presión intracraneal, la estenosis mejoraba17.
Factores metabólicos y hormonalesEl aumento del peso está asociado con el aumento del desarrollo o recurrencia de la HII, tanto en personas obesas como no obesas, y existe una mejoría de la enfermedad con la reducción del peso15. Sin embargo, el aumento del índice de masa corporal (IMC) no parece ser suficiente para explicar esta relación.
La obesidad se percibe cada vez más como una patología inflamatoria y se han detectado un aumento de mediadores proinflamatorios en el LCR de pacientes con HII como leptina, CCL2, IL-2 e IL-17 entre otras18,19. El aumento de la leptina en pacientes con un exceso de grasa corporal podría facilitar la hipersecreción de LCR en el epitelio de los plexos coroideos a través de un aumento de la actividad de la ATPasa Na+/K+17. Por otro lado, existe una asociación entre el exceso androgénico y la HII, encontrándose una elevación de los niveles de testosterona y androstendiona que se relaciona con un inicio más precoz de la enfermedad16.
Se está investigando el papel potencial de las incretinas como el glucagón-like peptide-1 (GLP-1) en la regulación del LCR, dado que el GLP-1 podría actuar sobre el plexo coroideo y en modelos animales la administración de un agonista de receptor GLP-1ha demostrado reducir la HII por inhibición de la actividad ATPasa Na/K. Finalmente, existen otros factores metabólicos implicados como el sistema angiotensina-aldosterona o el corticoideo17.
Manifestaciones clínicasLa cefalea afecta al 90% de los pacientes, suele ser el motivo de consulta y condiciona la calidad de vida17. Las características del dolor son inespecíficas, aunque puede acompañarse de síntomas de alarma (cefalea progresiva, precipitación por las maniobras de Valsalva o empeoramiento con cambios posturales). Habitualmente se describe una cefalea holocraneal de predominio frontal o retroorbitario con características pulsátiles u opresivas y que se acompaña de náuseas y a veces vómitos, hasta el 70% puede presentar características de migraña16,20. El dolor es de predominio matutino, no responde adecuadamente al tratamiento analgésico y típicamente empeora con las maniobras de Valsalva. Se estima que hasta un tercio de los pacientes presentan cefalea por uso excesivo de medicación analgésica16,19,20. El dolor tiene una intensidad moderada-grave que no necesariamente se correlaciona con las cifras de PIC7,10. De hecho, hasta un 60% de los pacientes presentan cefalea persistente a pesar de la normalización de las cifras de PIC11,19.
La sintomatología visual afecta a más del 70% de los pacientes19. El síntoma más frecuente es la aparición de episodios repetidos de visión borrosa unilateral o bilateral de menos de un minuto de duración (denominados oscurecimientos visuales), que se desencadenan por los cambios posturales, maniobras de Valsalva, exposición a luz intensa o movimientos oculares. Los oscurecimientos visuales se explican por una isquemia transitoria del nervio óptico y son más frecuentes en los pacientes con papiledema más grave. Los pacientes pueden describir fotopsias que se desencadenan por cambios de posición y maniobras de Valsalva. La pérdida de visión periférica ocurre en el 40%, aunque no es percibida por los pacientes, y generalmente se detecta al realizar una campimetría14. En algunos casos, los pacientes refieren pérdida de visión de forma aguda y progresiva que obliga a instaurar tratamiento de forma rápida por el riesgo de ceguera19. La diplopía en el plano horizontal (intermitente o continua) afecta aproximadamente a un 30% de los pacientes y se produce por la afectación del sexto par craneal unilateral o bilateral14,20,21.
Más de la mitad de los pacientes refieren acúfenos. Lo describen como un «murmullo», es unilateral y típicamente se atenúa con la compresión yugular ipsilateral14,20. Se considera que el acúfeno se produce por la existencia de un flujo turbulento a nivel del seno transverso que está estenosado. Otros síntomas descritos en la hipertensión intracraneal incluyen afectación del nervio olfatorio, parálisis facial, dolor en cuello y dolor lumbar14,20,21. En una cohorte de 31 pacientes con HII se detectaron déficits cognitivos que persistían 3 meses después de la normalización de las cifras de presión intracraneal22. Hasta un 25% de los pacientes pueden estar asintomáticos y la HII se diagnostica tras detectar de forma incidental un edema de papila bilateral21.
DiagnósticoCriterios diagnósticosEn las tablas 2 y 3 se indican los criterios de Dandy modificados para el diagnóstico de la HII23 y los criterios de la ICHD-3 para la cefalea atribuida a HII1, respectivamente.
Criterios de Dandy modificados
| 1. Signos o síntomas de hipertensión intracraneal |
| 2. Ausencia de focalidad |
| 3. No alteración de la atención o consciencia |
| 4. No otra etiología que justifique el aumento de presión de apertura del LCR y al menos uno de los siguientes: |
| - Acúfeno pulsátil |
| - Paresia del VI nervio craneal |
| - Papiledema |
| - No existencia de drusas y otras anormalidades en el FO |
| - Se ha excluido estenosis o trombosis de senos con la técnica adecuada |
| - Silla turca parcialmente vacía y presencia de LCR en la vaina del nervio óptico |
FO: fondo de ojo; LCR: líquido cefalorraquídeo.
Fuente: Friedman et al.23.
Criterios de diagnóstico de la cefalea atribuida a hipertensión intracraneal idiopática. 7.1.1 (ICHD-3)
| A. Cefalea nueva o agravamiento significativo de una cefalea preexistente que cumple el criterio C |
| B. Las dos características siguientes: |
| 1. Se ha diagnosticado hipertensión intracraneal idiopática |
| 2. La presión del LCR supera los 250mm LCR (o 280mm LCR en niños obesos) |
| C. Cualquiera de las características siguientes: |
| 1. La aparición de la cefalea o su agravamiento significativo guarda una relación temporal con la hipertensión intracraneal idiopática, o condujo a su descubrimiento |
| 2. La cefalea presenta una de las características siguientes, o ambas: |
| a) Acúfeno pulsátil |
| b) Papiledema |
| D. No atribuible a otro diagnóstico de la ICHD-3 |
LCR: líquido cefalorraquídeo.
El diagnóstico diferencial será diferente en función de si existe o no papiledema. En el primer supuesto habría que descartar causas secundarias que cursen con incremento de presión intracraneal (tabla 4): obstrucciones del flujo venoso (la trombosis de senos venosos cerebrales es la principal entidad a descartar, pero hay que tener en cuenta obstrucciones a nivel de la vena yugular), lesiones ocupantes de espacio, disminución de la absorción de LCR secundaria (infecciones del SNC, hemorragia subaracnoidea) y aumento de la producción de LCR. En pacientes sin papiledema en el momento del diagnóstico o si este ya se ha resuelto, se debería plantear el diagnóstico diferencial con cefaleas primarias, principalmente la migraña, ya que la expresión fenotípica del dolor en la HII puede ser indistinguible.
Causas secundarias de hipertensión intracraneal idiopática
| Diagnóstico diferencial de la HII con papiledema |
|---|
| 1. Obstrucción del flujo venosoTrombosis de senos venososTrombosis de vena yugular |
| 2. Lesiones ocupantes de espacio |
| 3. Disminución de la absorción de LCR secundariaHemorragia subaracnoideaInfecciones del SNC |
| 4. Aumento de la producción de LCR |
HII: hipertensión intracraneal idiopática; LCR: líquido cefalorraquídeo; SNC: sistema nervioso central.
Por otro lado, debemos tener en cuenta algunos fármacos o condiciones que pueden estar asociados al aumento de la presión intracraneal (se resumen en la tabla 5).
Fármacos y condiciones que pueden aumentar la presión intracraneal (PIC)
| Fármacos:TetraciclinasRetinoides (ác. transretinoico y derivados)Vitamina ALitioHormona del crecimientoPrivación de corticoesteroides |
| Insuficiencia renal |
| Hipercapnia |
| Hipertensión arterial maligna |
PIC: presión intracraneal.
La exploración neuroftalmológica en la HII debe incluir una funduscopia directa, exploración de la agudeza visual, pupilas, campimetría y la tomografía de coherencia óptica (OCT por sus siglas en inglés) siempre que sea posible.
En la fundoscopia puede observarse el papiledema que es el hallazgo más específico en el diagnóstico de HII. Suele ser bilateral y simétrico, aunque ocasionalmente puede ser asimétrico, en hasta un 7% de los pacientes. La fisiopatología subyacente es el edema de las fibras retinianas procedentes del disco óptico por alteración del flujo axoplásmico. Su gravedad se clasifica según la escala de Frisen modificada (tabla 6), y va desde la desaparición del pulso venoso en estadios más precoces, hasta la elevación del disco, asociada a hemorragias en astilla y en llama, manchas algodonosas y exudados retinianos. En estados evolucionados puede aparecer un disco atrófico21,24.
Escala de Frisen modificada (grados de papiledema)
| Grado 1 (papiledema mínimo) | Aparece un halo en forma de C en el borde nasal, sin borramiento del margen temporal |
| Grado 2 (papiledema leve) | El halo es de toda la circunferencia del disco óptico y aparece una elevación del borde nasal |
| Grado 3 (papiledema moderado) | Oscurecimiento de al menos un segmento de un vaso principal en su salida del disco, con todo el borde sobreelevado |
| Grado 4 (papiledema marcado) | Oscurecimiento completo de un vaso principal en su salida del disco, con elevación de toda la cabeza del nervio óptico y oscurecimiento del borde |
| Grado 5 (papiledema grave) | Oscurecimiento completo de todos los vasos sanguíneos del disco y de los que salen de él |
En cuanto a la campimetría, la más empleada es la perimetría de Humphrey y lo que encontramos en la mayoría de los pacientes es el aumento del tamaño del punto ciego fisiológico. En casos más graves se verá una reducción concéntrica del campo o la aparición de un escotoma, siendo el más frecuente el nasal inferior o el arcuato central.
En los últimos años ha cobrado gran protagonismo en el diagnóstico y seguimiento la OCT, que permite cuantificar el grosor de la capa de fibras nerviosas de la retina, que se correlaciona con la gravedad del papiledema, sobre todo en los casos más leves, y facilita el seguimiento. Esta técnica pierde utilidad en casos con atrofia óptica establecida, en los que se podría ver un adelgazamiento del complejo de células ganglionares de la retina y de la capa plexiforme interna21.
Pruebas de neuroimagenLa resonancia magnética (RM) craneal es la prueba fundamental en el diagnóstico, sobre todo para descartar otras causas de hipertensión intracraneal y debe incluir siempre una venografía, para descartar, principalmente, una trombosis de senos. Los hallazgos en RM pueden ser muy sugestivos, pero no son patognomónicos ni definitorios de HII. Los más típicos son la silla turca vacía parcial o total, en la órbita se suele observar un aplanamiento posterior del globo ocular o incluso un abombamiento de la papila hacia el vítreo, tortuosidad de los nervios ópticos con aumento del grosor de la vaina, pero todos ellos no son específicos, pues pueden encontrarse en individuos sanos, aun así, cuando se encuentran de forma combinada aumentan la sensibilidad24,25.
Venografía por RM o TCLa estenosis de uno o ambos senos transversos, sobre todo a nivel de su unión con el seno sigmoideo, es muy característica y puede aparecer en el 10-90% (según las series) de los casos, en todo caso con mayor prevalencia que la población general. Se hipotetiza que se debe a la compresión mecánica del seno por el aumento de la presión, aunque otros estudios sugieren que podrían tener una implicación en la etiopatogenia en el proceso o incluso agravarlo26.
TratamientoReducción de pesoExiste una fuerte asociación entre la HII y el aumento de peso. Un 57-100% de pacientes asocian obesidad15 pero, además, se ha descrito el desarrollo de HII en pacientes con aumento de peso de un 5-15% en los 2 a 12 meses precedentes al diagnóstico15,20.
La pérdida de peso constituye el único tratamiento modificador de la enfermedad establecido15,20,27,28 y, en ausencia de pérdida visual fulminante, es el tratamiento de primera línea recomendado (NE I, GR A).
No se ha establecido cuál es la pérdida de peso requerida para la remisión del cuadro ni tampoco el método óptimo para llevarla a cabo. Se aconsejan las estrategias dietéticas que, idealmente, deberían llevarse a cabo en un programa comunitario u hospitalario29. La cirugía bariátrica se plantea como una terapia duradera para inducir la remisión de la HII pues no solo conduce a una pérdida de peso de mayor cuantía sino también mantenida a largo plazo y con una mortalidad baja15,18.
Un metaanálisis sistemático de casos con HII tratados con cirugía bariátrica describe una resolución del papiledema en el 100%, frente a un 66,7% con dieta, y mejoría o resolución de la cefalea en un 90,2%, frente al 23,2% con dieta30. En 2021 se publicaron los resultados del ensayo clínico Idiopathic Intracranial Hypertension Weight Trial (IIH:WT) abierto aleatorizado y controlado que comparó la cirugía bariátrica con un programa comunitario de pérdida de peso (CWM) en pacientes con HII activa e IMC> 35kg/m2 y los resultados fueron favorables para la cirugía bariátrica con una respuesta mantenida durante dos años, con una diferencia en la reducción de la presión en – 8,2cm de LCR entre la cirugía bariátrica y el CWM, una diferencia de -26,6kg de peso entre ambas intervenciones y una diferencia en la mejoría de la calidad de vida con la escala 36-item Short Form Health Survey de 7.3 puntos a los 24 meses31.
Tratamiento médicoAcetazolamidaLa acetazolamida inhibe la anhidrasa carbónica y, como consecuencia, la producción de LCR por los plexos coroideos. Se ha estudiado en un ensayo clínico aleatorizado controlado, Idiopathic Intracranial Hypertension Treatment Trial (acetazolamida junto a dieta), en el que se describió una mejoría modesta en el campo visual de pacientes con pérdida visual leve, así como mejoría de la calidad de vida a los 6 meses32. Sin embargo, la última revisión Cochrane sobre el manejo de la HII concluyó que «hay evidencia insuficiente para recomendar o rechazar la eficacia de esta intervención o cualquier otro tratamiento disponible en la actualidad, para el manejo de pacientes con HII»33 (NE II, GR C).
La dosis óptima de acetazolamida no está bien establecida, aunque la más usada de inicio es 250mg 2-3 veces al día, con incrementos progresivos según tolerabilidad. No ha demostrado mejorar la cefalea y los efectos secundarios son frecuentes (diarrea, disgeusia, fatiga, náuseas, parestesias)34.
TopiramatoTopiramato tiene cierta actividad inhibitoria de la anhidrasa carbónica y además puede suprimir el apetito. Se ha comparado con la acetazolamida en un estudio abierto no controlado para el tratamiento de la HII35, con similar resultado sobre el campo visual, pero con mayor pérdida de peso. Su papel sería relevante en los casos de HII con cefalea de fenotipo migrañoso o migraña concomitante. La dosis inicial recomendada es de 25-50mg diarios con incremento progresivo hasta un máximo de 100mg dos veces al día21.
FurosemidaSe puede añadir, a dosis bajas o moderadas, a la acetazolamida para potenciar el efecto diurético, con controles periódicos de electrolitos en sangre y adición de suplementos de potasio. No se recomienda en monoterapia21.
Nuevas terapiasLos agonistas del glucagón-like peptide 1 (GLP-1) se han posicionado como una alternativa terapéutica. Hasta la fecha se ha demostrado que el receptor GLP-1 (GLP-1R) se expresa en el plexo coroideo humano. El tratamiento con el agonista exendina-4 modula el GLP-1R en el plexo coroideo de rata a través de la internalización del receptor inducida por agonistas, que aumenta la generación de AMPc y reduce la actividad de Na+/K+/ATPasa. La exendina-4 redujo la PIC de forma significativa en ratas en un ensayo clínico en el 60% a los 30 minutos de la administración36. Recientemente, se ha realizado un ensayo a doble ciego controlado con placebo con exenatide, en fase 2, en el que se ha demostrado la reducción de la presión intracraneal en 15 de las 16 pacientes que completaron el estudio sin haber presentado efectos secundarios serios, ha sido recién publicado en el momento en el que se escribe este artículo37.
Los inhibidores de la 11Beta Hidroxisteroide Deshidrogenasa tipo 1 (11ß -HSD1) han sido desarrollados para el tratamiento de la obesidad y el síndrome metabólico. Actualmente se está llevando a cabo un ensayo en fase 2 para comprobar la capacidad de este fármaco para reducir la secreción de LCR y, con ello, la presión intracraneal. Los inhibidores de 11ß-HSD1 no afectan el metabolismo de los glucocorticoides sistémicos, pero se ha demostrado que reducen la secreción de LCR porque disminuye la disponibilidad local de cortisol en el plexo coroideo con la subsiguiente reducción, mediada por el receptor de glucocorticoides, del gradiente osmótico y, por tanto, la presión intracerebral38.
Manejo de la cefalea debida a la HIILos pacientes deben ser informados desde el inicio de los efectos potenciales que puede tener el uso excesivo de medicación analgésica. Como tratamiento sintomático se pueden utilizar antiinflamatorios no esteroideos y, en especial, indometacina por su capacidad para reducir la presión intracraneal. Los opioides no se recomiendan y los bloqueos del nervio occipital pueden ser de utilidad en algunos casos. Hay que evitar tratamientos preventivos que puedan favorecer el aumento de peso como betabloqueantes, antidepresivos tricíclicos o flunarizina34.
Tratamiento quirúrgicoEl tratamiento quirúrgico debe valorarse en aquellos casos de HII sin mejoría o incluso empeoramiento a pesar del máximo tratamiento médico tolerado y, más precozmente, en aquellos con curso fulminante.
Punción lumbar evacuadoraLa realización de PLs de repetición no se recomienda como una estrategia terapéutica a largo plazo de la HII (NE II GR B). Se han descrito tasas de mejoría de pequeña magnitud de la cefalea (un punto sobre la escala numérica del dolor) en el 71% de los pacientes y también se ha estimado una probabilidad del 64% de exacerbar la cefalea en la primera semana pospunción. Además, el procedimiento puede conllevar al desarrollo de dolor lumbar agudo y crónico en algunos pacientes. Por todo ello, su uso se debería reservar para aquellos pacientes con HII fulminante en espera de una derivación del LCR, así como en gestantes a las que no se les pueda realizar cirugía20,34.
Válvulas y derivaciones peritonealesLas técnicas de derivación de LCR tienen una efectividad para disminuir el papiledema, el deterioro del campo visual y las cefaleas de un 78,9%, 66,8% y 69,8% respectivamente39 (NE II GR B). Se prefiere la derivación ventriculoperitoneal sobre la derivación lumboperitoneal por su mejor tolerabilidad (NE II GR B). En cualquier caso, esta técnica tiene una tasa de complicaciones relativamente alta (9,4%), entre las que se incluyen infección, obstrucción y migración del tubo de drenaje, lo que hace necesarias las revisiones frecuentes de la derivación. El uso de este tipo de técnicas para el tratamiento de los pacientes que presentan cefalea como único síntoma de la HII es controvertido, ya que estos pacientes presentan con frecuencia también migraña y existe un riesgo de que se produzca una cefalea por hipotensión licuoral (NE II GR B). Además, esta técnica presenta una tasa de fallo superior al 40%40.
StentingSe puede considerar el stent sobre el seno venoso transverso en pacientes que tienen una estenosis de dicho seno con un gradiente de presión>8mmHg y un aumento de la presión venosa en el seno sagital superior y en los senos venosos próximos a la estenosis (NE III, GR B). Se sabe que gradientes de presión transestenótica más elevados obtienen mejores resultados del procedimiento40 y que el grado de estenosis no parece relacionarse con la presión intracraneal ni predice el riesgo de pérdida visual18. Se ha propuesto que el stent reduciría la hipertensión venosa cerebral, lo que facilitaría un aumento en la absorción del LCR, una reducción de la hipertensión intracraneal y un alivio de los síntomas y signos39.
Esta técnica podría mejorar el papiledema, el campo visual y la cefalea en un 87,1%, 72,7% y 72,1%, respectivamente39. Sin embargo, estos resultados están sujetos a un sesgo de selección y no existen datos a largo plazo20. Entre sus potenciales complicaciones (presentes en el 2,3% de los pacientes) se encuentran la trombosis intra-stent, la hemorragia subdural y el desarrollo de estenosis recurrentes inmediatamente proximales al stent25. Además, hay que tener en cuenta que la implantación de un stent conlleva el uso de terapia antiplaquetaria durante más de 6 meses, lo que puede contraindicar este procedimiento en algunos pacientes con un riesgo hemorrágico alto34. Su tasa de fallo se sitúa alrededor del 11%25.
Fenestración de la vaina del nervio ópticoLa fenestración de la vaina del nervio óptico se considera un tratamiento efectivo a considerar especialmente cuando existe una afectación grave de la visión (NE II GR B). Consiste en crear una ventana en la porción retrolaminar de la vaina del nervio óptico que genera una fístula entre el espacio subaracnoideo y la cavidad orbitaria. Esto conlleva un descenso en la presión sobre el nervio óptico que reduce el papiledema y mejora la función visual. Es probablemente la técnica más efectiva para la mejoría del papiledema (90,5%), pero presenta unas tasas de efectividad más discretas en el campo visual (65,2%) y en la cefalea (49,3%)41. Las complicaciones del procedimiento (graves en aproximadamente el 2% de los pacientes) incluyen una pérdida visual transitoria o permanente (debida principalmente al traumatismo sobre el nervio óptico), una pupila tónica y diplopía. La tasa de fallo de la técnica se sitúa alrededor del 10%, pero no es inhabitual encontrar un empeoramiento de la visión tras un periodo de estabilización (hasta un tercio de los pacientes al primer año)42.
Actualmente, en nuestro medio, la indicación se reduciría a embarazadas y casos de HII fulminante en los que no se puede tener un acceso rápido a una derivación.
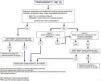
Conclusiones y propuesta de algoritmo de tratamiento quirúrgicoActualmente, no existe una clara evidencia científica acerca de las distintas opciones quirúrgicas en el tratamiento de la HII. Por ello, la elección del tipo de tratamiento quirúrgico sigue siendo controvertida y a menudo depende de la disponibilidad y experiencia de cada centro. La propuesta del GECSEN se presenta en la figura 1 y deberá adaptarse a las características de cada centro.
PronósticoNo se han publicado en la literatura series extensas de pacientes que permitan inferir cuál es la historia natural de esta enfermedad. Lo más frecuente es la progresión lenta en meses o incluso años. Si el tratamiento es efectivo, la evolución es habitualmente favorable, con mejoría y/o estabilización de la clínica. En algunos pacientes persiste el papiledema, la presión intracraneal elevada e incluso un ligero déficit visual residual15,43.
La pérdida de visión discapacitante es la morbilidad más importante asociada a la HII pero, afortunadamente, es inusual y oscila entre el 6 y 14% según las series, si bien se han descrito porcentajes mayores, hasta de un 24%43. Sus principales factores de riesgo son el grado de papiledema (grados 3, 4 y 5 de Frisen) y la pérdida de visión asociada o no a otros síntomas visuales43. Los oscurecimientos visuales transitorios y la pérdida de visión significativa como forma de presentación se comportan como factores de riesgo moderado o grave respectivamente.
Se han descrito también como factores de mal pronóstico el sexo masculino, la raza negra, una menor edad de inicio o el comienzo en la pubertad, la presión de apertura elevada, mayor grado de obesidad y/o importante ganancia de peso y la tensión arterial elevada. Paradójicamente, los hallazgos en la neuroimagen no son determinantes en la evolución44.
Por otro lado, la ausencia de remisión de los síntomas se ha relacionado con determinados parámetros oftalmológicos, como el menor grosor de las células ganglionares de la retina y de la capa de fibras nerviosas cuantificado mediante OCT43.
La recurrencia, entendida como el hallazgo de papiledema y/o presencia de síntomas sugestivos de hipertensión intracraneal idiopática con presión de apertura elevada, se ha descrito en el 8-38% de los pacientes años después de la remisión o la estabilización de los síntomas tras un largo periodo de tiempo. El principal factor predisponente en este caso es la ganancia de peso44. Finalmente, la cefalea puede persistir hasta en el 67% de los casos, es de carácter heterogéneo y puede estar presente también en aquellos pacientes en remisión45.
Hipotensión intracraneal espontáneaEpidemiologíaLa HIE es una entidad que puede aparecer a cualquier edad, incluyendo niños y adolescentes, pero afecta con mayor frecuencia a mujeres por encima de 35 años. No existen apenas datos epidemiológicos poblacionales de su incidencia dado que solo hay dos estudios realizado en el mismo centro. En el primero46 calculan la prevalencia en función de los pacientes atendidos en urgencias durante un período de 4 años y la estiman en 5 casos por 100.000 habitantes en un año. Este mismo grupo, en un estudio prospectivo47 describe una incidencia anual global de 3,7 casos por 100.000 para población global, con un claro predomino en mujeres (4,3 frente a 2,9 en varones). La incidencia podría ser superior, y la limitación de este estudio es que representa a una población muy determinada con unas características demográficas concretas. Los factores predisponentes se describen en la tabla 748.
Causas de hipotensión intracraneal
| Hipotensión intracraneal espontánea- Idiopática- Divertículos meníngeos- Enfermedades del tejido conectivo: síndrome de Marfan, síndrome de Ehlers-Danlos, hiperlaxitud articular, neurofibromatosis, síndrome de Lehman, poliquistosis renal- Desgarro dural espondilítico- Trauma trivialHipotensión intracraneal secundaria- Hipovolemia- Derivación de LCR- Fugas traumáticas de LCR- Postquirúrgico- Punción dural |
LCR: líquido cefalorraquídeo.
La terminología de HIE se considera que no es del todo correcta ya que no siempre es espontánea y, además, hay ocasiones en las que, a pesar de tener fugas de LCR, no siempre se tiene una presión baja (<60mm), de ahí que se haya propuesto la nomenclatura de hipovolemia de LCR49,50. Se considera que el mecanismo subyacente para la cefalea y las manifestaciones neurológicas es el desplazamiento caudal de las estructuras cerebrales y la tracción o distorsión de las terminaciones nerviosas sensibles al dolor en la duramadre craneal y su vasculatura51. Aunque existe cierta controversia sobre los mecanismos, hay actualmente tres que se consideran los más plausibles52,53:
- 1)
Divertículos meníngeos (42%): áreas de dehiscencia dural que permiten la protrusión de las leptomeninges a través de la dura, creando una bolsa frágil y propensa a la rotura. Son más frecuentes en columna torácica y lumbar superior, a lo largo de la raíz nerviosa o donde se une con el saco tecal. Algunos divertículos implican grandes desgarros meníngeos que producen una salida rápida de LCR mientras que en otros casos la salida suele ser más lenta y notable con las maniobras de Valsalva.
- 2)
Desgarros durales (27%): suelen estar causados por protuberancias discales calcificadas u osteofitos afilados que impactan sobre la duramadre produciendo un desgarro longitudinal. Son más frecuentes en la columna torácica o cervical inferior porque los discos calcificados suelen ser más comunes en esa localización. En este caso las fugas suelen ser rápidas, dando lugar a colecciones epidurales de LCR extensas.
- 3)
Fístulas venosas del LCR (3%): es probable que su prevalencia sea mayor a medida que se desarrollen técnicas con mayor fiabilidad para su identificación. En esta entidad, existe una conexión directa entre el espacio subaracnoideo espinal y una vena paraespinal drenante que permite una rápida pérdida de LCR hacia la circulación venosa. El LCR se reabsorbe normalmente a nivel de las raíces nerviosas espinales, con un transporte de LCR a través de la pared de las vellosidades aracnoideas regulado por vacuolas. La pérdida de volumen de LCR debida a las fístulas venosas del LCR no está regulada, lo que da lugar a un descenso del volumen de LCR y a una hipotensión intracraneal. Es más frecuente en la columna torácica y menos en la región lumbar y cervical. Se asocia a un divertículo perineural en aproximadamente el 80% de los casos.
Un porcentaje nada desdeñable (28%) son de causa indeterminada53.
Se han identificado algunos factores predisponentes para la HIE, entre los que se encuentran los trastornos de hipermovilidad articular, como la dolicoestenomelia (extremidades desproporcionadamente largas), el síndrome de Ehlers-Danlos y el síndrome de Marfan. Sin embargo, la mayoría de los pacientes no presentan estigmas evidentes de laxitud del tejido conectivo y los estudios genéticos que buscan mutaciones en este aspecto han sido negativos, por lo que se necesitan más estudios para demostrar su papel en la predisposición al desarrollo de HIE54.
Manifestaciones clínicasLos signos y síntomas de la HIE pueden variar en función de la gravedad y tiempo de evolución. La manifestación clínica más frecuente es la cefalea ortostática, como consecuencia de una mayor disminución de la presión intracraneal con la bipedestación y suele aparecer a los 15 minutos de adoptar esta posición55. Puede ser difusa o localizada en la región frontal, temporal o, más comúnmente, en la región occipital/suboccipital. La intensidad es variable, y puede empeorar con la tos o las maniobras de Valsalva. La naturaleza ortostática de la cefalea es menos evidente o incluso puede desaparecer en casos evolucionados. Otras presentaciones menos típicas incluyen cefalea no ortostática, cefalea en trueno (15% de los casos) y cefalea precipitada por el esfuerzo56,57.
Los nervios craneales pueden verse afectados, lo que puede producir también diplopía. La oftalmoplejia más común es la del nervio motor ocular externo debido a su largo trayecto intracraneal, que lo hace susceptible a la tracción. La paresia aislada del III y IV par es menos frecuente. Se pueden presentar signos y síntomas relacionados con la tracción de cualquier nervio craneal, que incluyen parálisis facial, disgeusia e hipo56.
Las manifestaciones cocleovestibulares (hipoacusia unilateral, mareo, tinnitus y vértigo) pueden estar relacionadas con la tracción del VIII par craneal. Sin embargo, también se han atribuido a una alteración de la presión a nivel del líquido perilinfático/endolinfático del oído interno. Estos síntomas se han reportado con más frecuencia en mayores de 45 años49.
Se han descrito casos de dolor cervical (hasta en el 71% de los pacientes) y dolor lumbar54. Estos síntomas pueden aparecer al mismo tiempo que la cefalea ortostática, o presentarse días o semanas antes del resto de manifestaciones clásicas. De igual forma, la radiculopatía de extremidades superiores (generalmente de las raíces nerviosas cervicales), se describe hasta en el 6% de los pacientes. Se produce en el sitio de la fuga y generalmente es causado por el efecto de masa de la colección extradural de LCR56.
Una forma de presentación inusual es el estado epiléptico no convulsivo y las crisis epilépticas aisladas en estadios avanzados de HIE. Este diagnóstico debe considerarse en pacientes con crisis epilépticas de etiología no aclarada, con anomalías epileptiformes en el electroencefalograma y ausencia de respuesta al tratamiento anticrisis54.
La somnolencia y las alteraciones del nivel de consciencia pueden aparecer en etapas avanzadas de la HIE. El desplazamiento de las estructuras craneales puede provocar herniación cerebral con progresión cefálica-caudal de signos y síntomas que incluyen parálisis de nervios craneales bajos, fallo respiratorio y coma.
Existen otras manifestaciones clínicas de la HIE menos frecuentes, que incluyen la galactorrea, la diabetes insípida, la hemosiderosis superficial o los trastornos del movimiento como parkinsonismo, ataxia, temblor postural y corea58.
En aquellos pacientes con HIE en los que exista un cambio en el patrón de la cefalea, deben descartarse posibles complicaciones como trombosis venosa cerebral, hemorragia cerebelosa o hematoma subdural. Es importante tener en cuenta las manifestaciones clínicas que provocan estas complicaciones, ya que son similares a las causadas por la propia HIE.
DiagnósticoCriterios diagnósticos de la cefalea por HIEComo se comentó, el aspecto más característico de la cefalea atribuida a HIE es su componente ortostático. No obstante, los criterios diagnósticos de la ICHD-III1 no exigen la presencia de dicho patrón. Ello es debido a que no siempre es evidente el ortostatismo, especialmente en los cuadros más crónicos o en las fístulas de bajo flujo. Tampoco es imprescindible para su diagnóstico la realización de PL, ya que en ocasiones pueden mostrar valores en el límite bajo de la normalidad sin llegar a ser patológicos y su realización puede empeorar la situación clínica del paciente. En las tablas 8 y 9 se describen los criterios diagnósticos de la ICHD-III1.
Criterios diagnósticos de 7.2 de la ICHD3 de cefalea atribuida a hipopresión de LCR1
| 7.2. Cefalea atribuida a hipopresión de líquido cefalorraquídeo | |
|---|---|
| A | Cualquier cefalea que cumpla el criterio C |
| B | Alguno o ambos de los siguientesa. Presión de LCR inferior a 60mm H2Ob. Evidencia de fuga de LCR en neuroimagen |
| C | La cefalea se ha desarrollado en relación temporal con el descenso de presión de LCR o la fístula de LCR o ha motivado su descubrimiento |
| D | No mejor explicación por otro diagnóstico de la ICHD-III |
Criterios diagnósticos de 7.2.3 cefalea atribuida a HIE1
| 7.2.3 Cefalea atribuida a HIE | |
|---|---|
| A | Cefalea que cumpla los criterios 7.2 Cefalea atribuido a hipopresión de LCR y el criterio C |
| B | Ausencia de procedimiento o traumatismo conocido capaz de producir una fístula o fuga de LCR |
| C | La cefalea se ha desarrollado en relación con la hipopresión de LCR o la fuga de LCR o ha motivado su descubrimiento |
| D | No mejor explicación por otro diagnóstico de la ICHD-III |
LCR: líquido cefalorraquídeo.
El diagnóstico diferencial de la cefalea por HIE debe realizarse con aquellas cefaleas que puedan presentar empeoramiento con el paso del decúbito a la bipedestación o que mejoren con el decúbito, entre las que se incluyen: la migraña, la cefalea atribuida a malformación de Chiari, la hipotensión arterial y el síndrome de taquicardia ortostática postural.
Algunas cefaleas presentan empeoramiento con el movimiento cefálico, independientemente de la dirección de este, como las que aparecen en el contexto de una sinusitis, meningitis, la cefalea por ejercicio físico, la cefalea atribuida a consumo de alcohol o la propia migraña. Debe incluirse también en el diagnóstico diferencial de la cefalea en trueno52.
Exploraciones complementariasEl diagnóstico se basa en la presencia de signos radiológicos indirectos ante una clínica compatible y la detección de la causa del cuadro. La mayoría de los casos de HIE son debidos a fugas espinales57,59. Sensu stricto el diagnóstico requiere la presencia de una presión baja o la visualización de la fuga. Algunas de las técnicas diagnósticas y terapéuticas que se recomiendan en este documento no están disponibles en muchos centros, incluso de tercer de nivel, o bien no se cuenta con la experiencia suficiente para su realización e interpretación. Posiblemente influye la prevalencia relativamente baja de pacientes que llegan a precisarlas y el reducido nivel de certeza con el que cuentan dada la ausencia de ensayos controlados, lo que hace que su aplicación sea fundamentalmente empírica.
- -
Examen de LCR: para el diagnóstico de HIE no es imprescindible la realización de PL, la cual, de hecho, puede empeorar la situación clínica del paciente. En caso de que se realice, es obligatoria la determinación de la presión de apertura. El examen bioquímico y citológico del LCR, así como su cultivo, deben ser normales.
- -
TC craneal: suele ser normal, aunque se han descrito senos venosos ingurgitados, ventrículos pequeños, colecciones de fluidos subdurales (fig. 4), obliteración de la cisterna prepontina e imágenes de pseudohemorragia subaracnoidea (hiperdensidad del tentorio y en la cisura de Silvio)49.
- -
RM cerebral con gadolinio (Gd+) iv: es la exploración de neuroimagen de elección para confirmar la sospecha clínica de HIE, siendo diagnóstica en un 80%49. Se han comunicado sus resultados en más de 2.000 pacientes con HIE y los signos informados aparecen en la tabla 1048,49. La captación paquimeníngea de Gd+, difusa y homogénea, es el signo radiológico más frecuente (fig. 2). No obstante, la valoración de estos signos radiológicos requiere entrenamiento para evitar arbitrariedad. Por ello, se han desarrollados escalas como la de Bern (tabla 11)59,60. Los hallazgos en la RM dependen del tiempo de evolución de la enfermedad61.
Tabla 10.Signos radiológicos de HIE en RM craneal
■ Captación paquimeníngea difusa de Gd+ (73-80%) que en la mayoría de los casos se puede apreciar también en secuencia FLAIR sin Gd+. (fig. 2) ■ Colecciones de fluidos extra-axiales (35-50%), siendo el 60% higromas y el 40% hematomas (fig. 4) ■ Descenso cerebral desproporcionado al tamaño de las colecciones de fluidos (43%). Pueden aparecer los siguientes signos: ■ Colapso ventricular ■ Angulación del quiasma óptico ■ Aplanamiento de la protuberancia contra el clivus con obliteración de la cisterna pontina, ■ Descenso del cuerpo calloso ■ Descenso amigdalar ■ Ingurgitación venosa (57%) ■ Aumento del tamaño hipofisario (38%) ■ Pneumoencéfalo intraventricular (fig. 5) en casos de HIE yatrogénico ■ Disminución del diámetro y grosor del nervio óptico en secuencia coronal T2, también detectable con ecografía transorbitaria Tabla 11.Escala de Bern. Signos de HIE en RM craneal
Criterios mayores Puntuación ■ Ingurgitación de senos venosos 2 ■ Captación paquimeníngea 2 ■ Cisterna suprasellar ≤4 mm 2 Criterios menores ■ Colecciones extraaxiales de fluidos 1 ■ Cisterna prepontina ≤5 mm 1 ■ Distancia mamilopontina ≤6,5 mm 1 Bajo riesgo de HIE: ≤2 puntos.
Riesgo intermedio de HIE: 3-4 puntos.
Riesgo alto de HIE: ≥5 puntos.
HIE: hipotensión intracraneal espontánea
- -
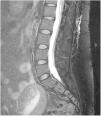
RM espinal con Gd+ iv (mielo-RM): se recomienda que incluya una secuencia T2 de supresión grasa. Puede observar captación de contraste paquimeníngeo, vainas de las raíces nerviosas dilatadas, ingurgitación de senos venosos epidurales y divertículos meníngeos50,62. La mielo-RM no solo sirve para observar signos indirectos de HIE, sino que también puede localizar la fuga de LCR, objetivando colecciones de fluidos en los tejidos blandos epidurales (fig. 3, no compresivas habitualmente, en un 60% de casos59. Por ello, se recomienda solicitar siempre mielo-RM, simultánea a la RM craneal, ante la sospecha clínica de HIE59.
- -
Ecografía transorbitaria (fig. 4), medición del grosor de la vaina del nervio óptico en decúbito y sedestación. Es patológico si la anchura disminuye más del 5% al incorporarse61.
- -
Otras exploraciones complementarias para localizar la fuga de LCR a partir de la detección espinal extraaracnoidea de líquido. En los casos iatrogénicos (punciones accidentales de duramadre en anestesia espinal o poscirugía de columna) no están inicialmente indicadas, ya que se conoce el nivel de la fuga. Todas ellas precisan la realización de una PL, que deberá ser lo más atraumática posible para no agravar el cuadro de HIE. Como contrapeso a esta desventaja, en el mismo acto permiten la determinación de la presión de LCR. Los metaanálisis muestran una sensibilidad para detectar fugas con estas técnicas de neuroimagen del 48-76%50,59. Las fugas se han clasificado en 4 categorías (tabla 12)59,60 y sus localizaciones espinales más frecuentes son: torácica (41%), cérvico-torácica (25%), cervical (14%) y lumbar (12%). Cabe destacar que en un 24% de casos las fugas son múltiples49.
Tabla 12.Clasificación radiológica de Farb de las fugas de LCR
■ Tipo 1 (48-60%). Fuga por desgarro ventral de la duramadre asociado a degeneración discal y, ocasionalmente, a espícula ósea. Se acompaña de CEF ■ Tipo 2 (13-20%). Fuga por perforación proximal y lateral en la vaina dural de una raíz nerviosa. No se acompaña de degeneración discal pero sí, habitualmente, de CEF ■ Tipo 3. Fístula vena-LCR (20%). Divertículo meníngeo asociado (en realidad es un pseudomeningocele embrionario). No se acompaña de CEF ■ Tipo 4. Fuga distal en la vaina de la raíz. No se acompaña de CEF. Es la más infrecuente CEF: colección extraaxial de fluidos; LCR: líquido cefalorraquídeo.
- -
Cisternografía isotópica. Consiste en una inyección intratecal de un radioisótopo, habitualmente indio111. Se realizan TC seriados tras la inyección, a las 24 horas e incluso a las 48 horas50. Además de objetivar la fuga de LCR, la aparición de captación renal/vesical antes de 6 horas es un indicador muy específico de HIE, así como la ausencia de captación en las convexidades cerebrales a las 24 horas. Tiene la ventaja de que también puede detectar fugas craneales, observando captación en las torundas de algodón colocadas en las coanas nasales del paciente en fugas nasales. Su resolución espacial es limitada por lo que progresivamente está siendo sustituida por técnicas de mielografía.
- -
Mielografía.
- ∘
Mielografía convencional con contraste con sustracción digital. Presenta una sensibilidad cercana al 100% en la detección de fugas de LCR49. Los estudios publicados solo han incluido 133 pacientes. Puede objetivar colecciones extraaracnoideas, divertículos meníngeos y fístulas vena-LCR. Permite la realización en decúbito lateral, detectando mejor las fugas de LCR tipo 2.
- ∘
Mielo-TC con contraste intratecal. Tiene las mismas indicaciones y resolución que la mielografía convencional y es más fácil de realizar, por lo que es la primera opción de estudio de fugas de LCR, cuando la mielo-RM con Gd+ es normal. La mielo-TC dinámica es un nuevo método de estudio de fugas que parece ser el mejor para las fugas de flujo rápido, obviadas habitualmente con otras técnicas50,51.
- ∘
Mielo-RM con Gd+ intratecal. Tiene una sensibilidad del 75% en la detección de fugas de LCR49. En la literatura solo se ha informado la realización de esta exploración en 87 pacientes. Cabe destacar que el Gd+ no tiene indicación de administración intratecal y que a altas dosis puede ser neurotóxico. Además, un reciente metaanálisis62, que ha incluido 643 pacientes, no ha mostrado diferencias entre el rendimiento diagnóstico de la mielo-RM con Gd+ iv (86%) y la mielo-RM con Gd+ intratecal (83%).
No disponemos de datos de ensayos clínicos aleatorizados en el tratamiento de la HIE, por lo que la evidencia proviene principalmente de estudios observacionales (la mayoría en casos de hipotensión pospunción dural) y opinión de expertos.
Tanto en los casos espontáneos como pospunción dural, se recomienda el manejo conservador inicial que incluye reposo, hidratación o el uso de faja abdominal (NE IV, GR C).
Desde el punto de vista farmacológico, la mayoría de los guías recomiendan el uso de analgésicos, corticoides o cafeína. Existen múltiples casos publicados de respuesta a antiinflamatorios no esteroideos y corticoides, pero su efectividad no se ha demostrado en ensayos clínicos aleatorizados49 (NE IV, GR C). El uso de cafeína y otras xantinas (teofilina, aminofilina) se ha correlacionado con una reducción de la intensidad de la cefalea pospunción dural, que suele ser transitorio64,65 (NE IV, GR C). Aunque su uso es extendido, la evidencia sobre la eficacia de la cafeína es pobre y debemos tener en cuenta que su consumo regular y prolongado es un factor de riesgo de cronificación de la cefalea, por lo que se recomiendan pautas cortas. El bloqueo bilateral del nervio occipital mayor puede ser útil66 (NE IV, GR C) aunque probablemente el efecto también sea transitorio.
Solo un 15-30% de los casos de HIE se resuelven tras tratamiento conservador49. Dada la falta de evidencia, la gravedad de los síntomas y discapacidad asociada, además de las potenciales complicaciones graves, los expertos recomiendan no demorar la realización del tratamiento con parche hemático, después de la confirmación diagnóstica mediante pruebas de neuroimagen54 que debe realizarse de forma urgente o preferente (Grado IV, nivel de recomendación GECSEN).
Parche hemático epidural autólogoEl tratamiento de la HIE es esencialmente etiológico, ya que persigue el cierre del punto de salida del LCR. Su eficacia está netamente demostrada de forma empírica (NE III, GR B). Se dispone además de numerosas revisiones y un metaanálisis reciente que intentan ofrecer una visión lo más objetiva posible para la práctica clínica48,67–71 y para futuras investigaciones, que han servido de base para este texto.
El parche hemático epidural autólogo (PHEA) inicial se realiza mayoritariamente a nivel lumbar sin conocer el punto de localización de la fuga («inyección ciega»). Sus indicaciones aparecen en la tabla 13. Sus contraindicaciones son análogas a las de cualquier técnica de punción en general y de la lumbar en particular. Tiene un doble efecto: de forma inmediata, la sangre inyectada se distribuye por el espacio epidural tanto caudal como, sobre todo, cefálicamente (prácticamente el doble). Se provoca así un aumento de volumen en el espacio epidural que genera una compresión del saco, contrapuesta a la fuga de líquido desde el espacio intradural. Este mecanismo suele producir un alivio muy rápido de los síntomas, a menudo inmediato. En las 24-48 horas siguientes, tiempo en el que la mayoría de la sangre es reabsorbida, la formación de coágulos de fibrina y cierto grado de reacción inflamatoria dural facilitarán la reparación y cierre del desgarro, lo que en conjunto puede llevar hasta tres semanas.
Indicaciones del PHEA a iniciar en la HIE
| - Paciente con síntomas durante más de dos semanas en el momento de presentación (en especial si ha guardado reposo en domicilio)- Síntomas que persisten después de 1-2 semanas de tratamiento conservador* en:. Pacientes que se presentaron en fase aguda. Pacientes de más tiempo de evolución que prefirieron probar inicialmente dichotratamiento conservador*Eficacia poco probable más allá de 7-10 días si transcurrido ese tiempo elpaciente no ha experimentado ya una mejoría significativa- Cefalea de gran intensidad, otros síntomas incapacitantes o complicaciones graves, sea cual sea la duración del cuadro- Trauma mayor (p. ej., caída o choque grave) como potencial desencadenante, en comparación con trauma menor (p. ej., rotación o estiramiento del tronco o maniobra de Valsalva)- Antecedente de conectivopatía o hiperlaxitud ligamentosa |
PHEA: parche hemático epidural autólogo.
El volumen de sangre a inyectar, extraída «in situ» de vena antecubital con el paciente ya posicionado y en general sin ningún procesamiento posterior, debería ser suficiente para llenar el espacio epidural de aquel según su constitución. A mayor volumen, mayor probabilidad de éxito (77% si> 20ml, 66% si menor), pero también mayor riesgo de efectos adversos. La inyección debe ser lenta, a razón de 5ml/min. Lo más aceptado es inyectar entre 10 y 25ml72, aunque autores con una gran experiencia llegan a inyectar hasta 50ml, en algunos casos, considerando la talla y peso del paciente y la longitud de su columna49, aun cuando no está claro que estos sean determinantes68. En la práctica, el volumen final administrado suele depender sobre todo de la tolerancia del paciente, marcada por la aparición de dolor de espalda, que puede irradiarse y asociarse a parestesias en cuello, espalda o extremidades. La aparición de dolor o parestesias intensas obliga a detener la administración durante unos 30 segundos. Si el dolor remite se seguirá inyectando. Si reaparece, se parará definitivamente.
Tras el procedimiento el paciente debe guardar reposo en decúbito, entre 2 y 24 horas según distintas fuentes. En el caso de esta indicación (HIE) es probable que se precisen tiempos más prolongados (8-24 horas), y que al menos un tercio de ese tiempo el paciente esté en posición de Trendelenburg49,70–72. Al alta se indicarán ciertas medidas que reducen el riesgo de recurrencia (tabla 14)70–72. La tasa de éxito de un primer PHEA (respuesta completa, sin recurrencia en los 6 meses siguientes, con desaparición paulatina de los signos radiológicos) oscila entre un 43 y un 64%70–73, aunque esta última proporción podría estar sobreestimada48. Debe tenerse en cuenta que en la HIE por fístulas LCR-venosas la eficacia del PHEA es mínima, por lo que no estaría indicado en esos casos74–77. Un PHEA se considera ineficaz si los síntomas no remiten en las siguientes 48 horas. De ser así, cabe iniciar en ese momento una búsqueda más activa del punto de salida del líquido (no antes), al tiempo que se programa una segunda inyección. Algunos autores supeditan las exploraciones de segundo nivel para estudio de localización al resultado de este segundo PHEA49, que de todas formas no debe demorarse, aunque no se conozca la etiología.
Recomendaciones al alta tras el PHEA
| Evitar en los 7 días siguientes:- Ejercicio físico- Maniobras de Valsalva- Retorcerse y agacharse- Desplazamientos largos en vehículos u otros medios de transporte (un aumento brusco de la PIC, movimientos o vibraciones en sedestación pueden desalojar un coágulo estable ya formado)- Mantener la espalda recta durante la sedestación- Estreñimiento (usar laxantes si es preciso, evitando los estimulantes o irritantes –p.ej., senósidos–) |
PHEA: parche hemático epidural autólogo.
Aparte del riesgo de infección, por lo que debe realizarse con total asepsia, el PHEA, generalmente, es seguro, aunque puede tener complicaciones, que excepcionalmente pueden ser graves. La más común es la lumbalgia, que puede durar varias semanas. A veces el dolor se irradia a las extremidades inferiores, donde puede haber parestesias y disestesias, atribuidas al efecto irritativo de la sangre. Si estos síntomas se prolongan más de dos semanas deben considerarse otras posibilidades. También puede producirse punción transdural de forma accidental, lo que agravaría la HIE. La inyección de sangre en el espacio subaracnoideo entraña un riesgo, aunque bajo, de aracnoiditis, meningitis o ventriculitis. Otro efecto relativamente frecuente es una hipertensión intracraneal de rebote tras el procedimiento (7-27% considerando tanto el PHEA como tratamientos percutáneos o quirúrgicos) la cual suele responder a acetazolamida o topiramato46. En la tabla 15 se recogen todas las complicaciones descritas74–77.
Posibles complicaciones del PHEA
| Frecuentes (suelen ser leves y transitorias):- Dolor de espaldaMenos frecuentes (ídem):- Durante el procedimiento (recomendable monitorización): 1. Bradicardia y/ohipotensión2. Palpitaciones3. Mareo- Dolor cervical- Dolor radicular- Parestesias, hipoestesia- Reacción pirética leve- Tinnitus- Punción dural- Hipertensión intracranealExcepcionales (< 1%):- Paresia del VI par, parálisis facial- Síndrome de cauda equina- Compresión medular- Aracnoiditis, meningitis, ventriculitis (asépticas, químicas, infecciosas)- Aracnoiditis adhesiva crónica- Hematoma subdural, sangrado subaracnoideo, hematoma espinal- Neumoencéfalo- Trombosis de senos venosos- Siderosis superficial |
PHEA: parche hemático epidural autólogo.
En los casos en los que la primera inyección no da resultado (40-50%), se puede repetir pasados al menos 7 días. Si en ese momento se conoce el punto de fuga, esta segunda inyección puede ser ya dirigida, en cuyo caso se practica con control fluoroscópico y con contraste yodado (1-5ml) mezclado con la sangre, en algunos centros se realiza TC helicoidal posterior (a los 15-20min) para comprobación. Las inyecciones dirigidas requieren un abordaje interlaminar o transforaminal. En el primer caso se recomienda un volumen de sangre máximo de 20ml y tan solo de 5ml para el transforaminal. Se han publicado tasas de éxito de hasta un 88% para estas inyecciones dirigidas49.
Si el punto de fuga sigue sin localizarse, esta segunda inyección será también «ciega» y puede repetirse a nivel lumbar. No obstante, teniendo en cuenta que a priori la mayoría de las fugas se producen a nivel cérvico-dorsal, esta inyección ciega puede hacerse a un nivel más alto, normalmente torácico, con control radiológico para minimizar el riesgo de daño medular. En todo caso, de no ser el resultado favorable puede plantearse una tercera inyección, con idénticas consideraciones.
Un factor del que puede depender en gran medida la tasa de éxito puede ser la posición. Se ha demostrado que colocar al paciente en Trendelenburg antes, durante y después del procedimiento mejora la tasa de éxito en más de la mitad de los casos71. Otras posibles causas de fallo se muestran en la tabla 1667,68. Como ya se ha comentado, serían necesarios ensayos clínicos aleatorizados para comparar las diferencias según la posición, inyecciones ciegas o dirigidas y PHEA grandes frente a los de menor volumen.
Posibles causas de fallo del PHEA en el tratamiento de la HIE
| - Postura inadecuada del paciente- Volumen de sangre insuficiente (< 22,5 ml).- Uso de esteroides (podrían retrasar la cicatrización dural)- Colección de LCR de gran volumen a nivel epidural anterior- Deformidad diencéfalo-mesencefálica significativa por el descenso del encéfalo |
LCR: líquido cefalorraquídeo; PHEA: parche hemático epidural autólogo.
El uso de sangre alogénica se ha propuesto en casos de pacientes con neoplasias hematológicas, fiebre, infección por VIH o COVID-19. En tales casos se utilizará sangre cruzada y analizada69.
La inyección epidural de solución salina o dextrano no se recomienda actualmente, ya que no facilita la cicatrización del desgarro dural67. Los adhesivos de fibrina pueden ser una alternativa, aunque su empleo es bajo76 y pueden considerarse para el cierre dirigido de roturas identificadas si ha fallado al menos un PHEA también dirigido. Recientemente surgen como alternativa eficaz para el cierre de fístulas LCR-venosas78. Estos adhesivos tienen cierto riesgo de anafilaxia, sobre todo los que contienen aprotinina bovina, mayor en pacientes con exposición previa, dado su uso como hemostático o reparador en ciertas cirugías69.
En pacientes con HIE grave con alteración del nivel de conciencia y déficit neurológicos debidos a un marcado descenso del encéfalo, debe intentarse la inyección precoz del PHEA, también si se produce trombosis de senos venosos como complicación, antes de un tratamiento anticoagulante67. Como medida de urgencia temporal para aumentar la presión intracraneal se ha propuesto la infusión de suero fisiológico intratecal o epidural, pero solo existe información de pocos casos69,79. También puede plantearse cirugía si está identificado el punto a tratar. La evacuación de hematomas subdurales grandes no se recomienda sin haber manejado antes la fuga, ya que el riesgo supera al dudoso beneficio, y solo debería plantearse si a posteriori se produjera una inversión de la presión intracraneal como complicación67.
Tratamiento quirúrgico. Tratamiento endovascularLa cirugía se indica cuando está claramente identificado el punto de salida del LCR y han sido inefectivos como mínimo tres PHEA, al menos uno de ellos dirigido (GR GECSEN). En la tabla 17 aparecen las distintas técnicas disponibles, combinables en algunos casos67,69. Si se considera indicada, la cirugía no debería demorarse en exceso.
Procedimientos quirúrgicos en el tratamiento de la HIE
| - Requiere monitorización neurofisiológica intraoperatoria- Procedimientos:. Reparación directa del desgarro de la duramadre (cierre mediante sutura). Duroplastia («parche» de sustituto dural biológico o sintético, o de músculo,para reforzamiento del cierre, o si los bordes de este no pueden ser afrontados). Alternativa a la duroplastia: adhesivo de fibrina. Resección de osteofitos causales en roturas anteriores. Ligadura quirúrgica de fístulas LCR-venosas. Alternativa en fístulas LCR-venosas: adhesivo de fibrina. Ligadura quirúrgica o clipaje de divertículos meníngeos o, más raro, quistes. Cirugía de reducción de la duramadre: propuesta por Schievink en 2009, no practicada en ninguno de los artículos seleccionados en el metanálisis de D́Antona et al.48. |
| Notas:- Con las técnicas microquirúrgicas actuales, tanto los desgarros ventrales como los laterales (p.ej., en el seno de divertículos) y las fístulas LCR-venosas (generalmente también laterales), pueden ser tratados con mínima invasión mediante abordaje dorsal a través de hemilaminectomía o fenestración interlaminar.- Los desgarros de la duramadre ventral requieren un abordaje transdural con separación de los ligamentos denticulados, de modo que la médula espinal pueda movilizarse fuera del campo quirúrgico.- En los casos en que las opciones quirúrgicas o endovasculares no son posibles o resultan inefectivas, se puede intentar repetir PHEA dirigido |
LCR: líquido cefalorraquídeo; PHEA: parche hemático epidural autólogo.
En casos de HIE debidos a fístulas LCR-venosas, es posible realizar una embolización de venas paraespinales de drenaje de la fístula, provocando su cierre. Sobre este novedoso tratamiento ha sido publicada recientemente la primera serie de pacientes79.
Otros tratamientosEn la cefalea tras punción dural puede ser de ayuda como terapia sintomática el bloqueo bilateral del nervio occipital mayor, su beneficio se explicaría por su efecto sobre un núcleo caudal trigeminal anormalmente estimulado por la tracción, lo que contribuiría al dolor generado, en la HIE se cuenta solo con experiencia en casos aislados80. Existe algún caso reportado de respuesta de la cefalea por HIE a la toxina botulínica según protocolo PREEMPT81. Este efecto beneficioso se debería a la modulación del sistema nociceptivo, de forma similar a lo descrito en la migraña y otras cefaleas primarias (fig. 5).
Ecografía transorbitaria. Adaptada de Fichtner et al.63.
Como conclusión, en las figuras 6 y 7 se propone un algoritmo de tratamiento, que dada la gran variabilidad de las fugas espontáneas de LCR y sus diferentes aspectos, debería basarse al menos en estudios observacionales prospectivos y ensayos comparativos entre distintas técnicas radiológicas y terapéuticas, actualmente no disponibles.
PronósticoEn algunos casos hay evidencia de la resolución espontánea del HIE en un periodo de 2 semanas82 y, en el otro extremo, puede haber pacientes que continúen teniendo síntomas incluso después de la resolución de la fuga de LCR83. En ocasiones el cuadro puede prolongarse varios meses o incluso años. Si las fugas son intermitentes y se producen en intervalos de semanas o meses, pueden ocasionar episodios de cefalea episódica sin otros síntomas entre ellos. En casi el 10% de los pacientes afectados por una fuga de LCR espontánea, el cuadro recurrirá a pesar de un correcto tratamiento84.
Complicaciones de la fuga de LCRAparte de la clínica más frecuente que caracteriza al HIE, si el proceso es larvado o grave, los pacientes pueden sufrir diversas complicaciones secundarias al descenso encefálico y tracción de estructuras cerebrales. Se ha descrito la afectación del campo visual o visión borrosa por congestión o compresión de los nervios ópticos, síntomas a nivel de los miembros superiores por tracción o irritación de las raíces cervicales, alteraciones cognitivas por descenso encefálico o compresión de lóbulos frontales o temporales, hiperprolactinemia por distorsión del tallo hipofisario, alteración de la marcha por compresión medular, corea por presión de los ganglios basales o sus conexiones, clínica bulbar, parkinsonismo o ataxia por compresión de estructuras de la fosa posterior y los casos más graves pueden presentar síntomas de encefalopatía, disminución de nivel de conciencia o coma por compresión diencefálica85.
Es por ello fundamental realizar un diagnóstico correcto y llevar a cabo las medidas terapéuticas más adecuadas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.