El déficit de arginasa 1 (ARG1-D) o argininemia es el trastorno del ciclo de la urea menos frecuente, con una incidencia de 1/950.000 nacimientos. Es una enfermedad hereditaria autosómica recesiva causada por mutaciones en el gen ARG1, que provoca la elevación de arginina en sangre y cursa con un deterioro neurológico progresivo caracterizado por paraparesia espástica, deterioro cognitivo y crisis epilépticas, con inicio en la infancia, habitualmente entre los 1 y 3 años de edad1-3, aunque se han descrito algunos casos con inicio más tardío, hasta la adolescencia4-6. Presentamos un caso de ARG1-D excepcional por su inicio clínico en la cuarta década de la vida.
Se trata de una mujer caucásica de 35 años, nacida en España, casada, sin antecedentes de interés, que consultó en 2009 por un trastorno de la marcha progresivo de 2años de evolución. No refería antecedentes familiares de enfermedades neurológicas, sus padres no eran consanguíneos y tenía un hermano sano. El desarrollo psicomotor en la infancia y juventud fue normal y no había presentado ningún síntoma neurológico hasta los 33 años. Comenzó entonces con rigidez y torpeza progresiva en miembros inferiores que le impedían caminar normalmente. No presentaba síntomas motores en miembros superiores, tampoco síntomas cognitivos, sensitivos ni esfinterianos. En la exploración destacaba la espasticidad simétrica de miembros inferiores, con hiperreflexia y signo de Babinski bilateral. La exploración era normal en miembros superiores y no había alteraciones sensitivas ni ataxia.
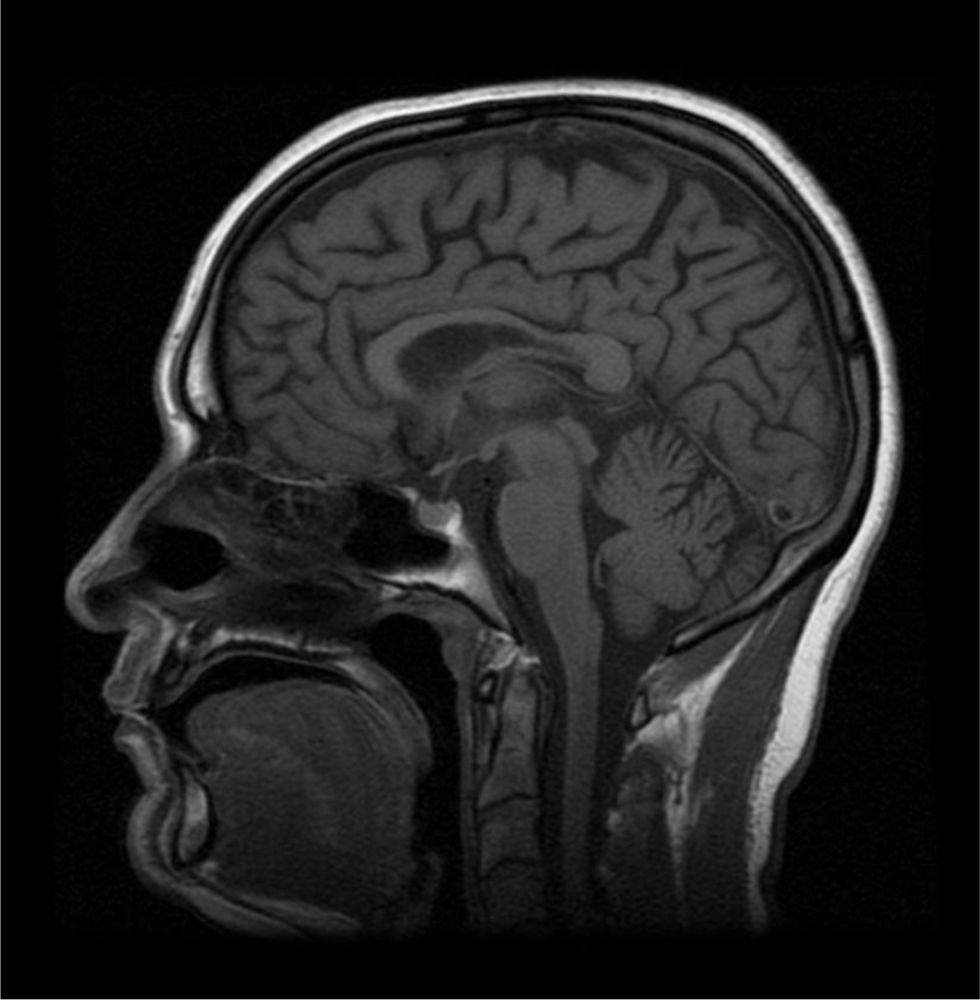
El estudio analítico en sangre y líquido cefalorraquídeo fue normal. La resonancia magnética (RM) craneal y medular mostró atrofia cortical cerebral, cerebelosa y del cuerpo calloso, sin lesiones en la sustancia blanca (fig. 1). El electromiograma fue normal. El estudio genético no identificó ninguna mutación asociada a paraparesia espástica hereditaria (PEH).
El trastorno de la marcha siguió progresando en los años siguientes y en la actualidad precisa apoyo bilateral, con espasticidad muy acusada y escasa respuesta a tratamiento con baclofeno y toxina botulínica. A los 37 años dio a luz una niña por cesárea, sin complicaciones y sin modificación del curso de su enfermedad. Con 48 años comenzó con urgencia miccional.
En 2022 se realizó un nuevo estudio genético, mediante un panel ampliado de NGS de genes relacionados con PEH, incluyendo el gen ARG1, en el que se identificó la presencia en homocigosis de la variante patogénica NM_000045.4:c.404C>Tp.(Thr135Ile). Se determinaron los niveles de arginina en sangre, con un valor de 719μMol/l (rango normal: 15-140) y una actividad de arginasa en eritrocitos de 49μMol urea/h× g Hb (3.741-7.805), lo que confirmó el diagnóstico de argininemia. El amonio en plasma era de 20μMol/l (11-51). Una nueva RM craneal no mostró cambios respecto al estudio inicial de 2009. El electroencefalograma fue normal. La evaluación neuropsicológica fue compatible con un leve déficit frontosubcortical caracterizado por bradipsiquia, déficit en atención sostenida y disfunción ejecutiva, si bien la paciente no refería síntomas cognitivos subjetivos.
Tras el diagnóstico, se inició dieta de restricción proteica (cantidad de proteína estimada en 30g), con suplementación de aminoácidos esenciales libres de arginina (0,3g/kg de peso), con benzoato de sodio asociado (16g) para favorecer la eliminación renal de nitrógeno vía ácido hipúrico7,8, con lo que se consiguió reducir los niveles de arginina hasta 444μMol/l. Dos años después la paciente refiere mejoría subjetiva en el trastorno de la marcha y estabilidad en el control de esfínteres. En la exploración no se aprecian cambios, salvo un ligero aumento de la velocidad de la marcha en la prueba de los 25 pies en el primer año de tratamiento, con posterior estabilización. En marzo de 2025 se inició tratamiento enzimático con pegzilarginasa.
La paraparesia espástica es el síntoma inicial más frecuente en el ARG1-D4-6,9. Las crisis hiperamoniémicas son menos frecuentes y, en general, más leves que en otros trastornos del ciclo de la urea y las manifestaciones extraneurológicas son excepcionales10. La RM cerebral puede mostrar atrofia cerebral y cerebelosa, atrofia del cuerpo calloso y lesiones de sustancia blanca cerebral inespecíficas4,11,12. En los casos con un inicio más tardío, la paraparesia espástica es el síntoma dominante y el cuadro puede ser clínica y radiológicamente indistinguible de una PEH pura/no complicada4,5. Por tanto, el ARG1-D debería incluirse en el diagnóstico diferencial de esa entidad en pacientes jóvenes y adultos. La determinación de aminoácidos en sangre es una prueba accesible que permite un rápido diagnóstico, que debe confirmarse con el estudio genético. Esto es aún más importante al ser una enfermedad tratable, especialmente desde la aprobación del uso de la pegzilarginasa, una enzima recombinante humana que ha demostrado una mejoría clínica y analítica en el 79% de los pacientes13, que debe combinarse con el tratamiento dietético y las otras medidas farmacológicas descritas anteriormente14.
FinanciaciónSin fuentes de financiación.
Conflicto de interesesNinguno.