La neuromielitis óptica (NMO) es una enfermedad predominantemente humoral mediada por anticuerpos IgG-NMO/AQP-4. Sin embargo, no se conoce bien la contribución de las diferentes subpoblaciones de células B y T en su patogenia o en la respuesta a los tratamientos.
ObjetivosDescribir los cambios clínicos e inmunológicos asociados al tratamiento con inmunoglobulinas intravenosas (Ig-IV) y rituximab (RTX) en una paciente con un brote grave de NMO y síntesis intratecal de IgG-NMO/AQP-4 que no había respondido a metilprednisolona y recambio plasmático.
MétodosSe analizaron, de forma secuencial en el LCR y en la sangre periférica (SP), las subpoblaciones linfocitarias mediante citometría de flujo multiparamétrica y los IgG-NMO/AQP-4, antes y después del tratamiento con Ig-IV y RTX.
ResultadosEn el LCR antes del tratamiento, y comparado con la SP, predominaban las células T CD4+ y estaban menos representadas las T CD8+ y las B CD19+. Tras el tratamiento, el porcentaje de células T CD4+ se mantuvo alto, el de T CD8+ aumentó y el de B CD19+ disminuyó, aunque menos que en la SP. Al comparar los LCR se vio que tras la terapia el porcentaje de células T CD8+ memoria efectoras y efectoras había aumentado, y el de células B memoria IgM y el de células B con cambio de isotipos, disminuido. Los cambios observados fueron paralelos a la negativización de los IgG-NMO/AQP-4 y a la mejoría clínica.
ConclusionesNuestros hallazgos confirman que, además de una respuesta inmunitaria humoral intratecal durante el brote de NMO, subpoblaciones específicas de células B y T participan en la modulación de la inflamación dentro y fuera del sistema nervioso central.
There is increasing evidence supporting that neuromyelitis optica (NMO) is an inflammatory humoral mediated disorder associated with NMO-IgG/AQP-4 antibodies. However, little is known about the subsets of B cells and T cells that contribute to the pathogenesis or therapy response.
ObjectivesTo describe the clinical and immunological changes associated with intravenous immunoglobulins (IV-Igs) plus rituximab (RTX) in a patient with a severe acute attack of NMO and intrathecal synthesis of NMO-IgG/AQP-4, who previously did not respond to intravenous methylprednisolone and plasma exchange.
MethodsWe sequentially analysed the levels of NMO-IgG/AQP-4 by immunohistochemistry, and B and T cells subsets by multiparametric flow-cytometry, in the CSF and peripheral blood (PB), before and alter IV-Igs plus RTX therapy.
ResultsIn the CSF before treatment, and compared with PB, there was a higher percentage of CD4+ T cells and a lower percentage of CD8+ T cells and CD19+ B cells. After therapy, the percentage of CD4+ T cells remained high, and that of CD8+ T cells increased. The observed decrease in the percentage of CD19+ B cells was lower than in the PB. When the CSF was compared, it was found that the percentage of effector-memory and effector CD8+ T cells had increased after therapy, and that of IgM memory B cells and switched-memory B cells decreased. The observed changes paralleled the decrease of NMO-IgG/AQP-4 results to negative and the clinical improvement.
ConclusionsOur findings confirm that, besides intrathecal humoral immune response against AQP4, B and T cell subsets are involved in the modulation of inflammation within and outside the central nervous system.
La neuromielitis óptica (NMO) es una enfermedad inflamatoria desmielinizante del SNC que afecta de forma predominante al nervio óptico y a la médula. El curso de la enfermedad es habitualmente recidivante, con acumulación rápida de discapacidad relacionada con los brotes y una alta tasa de mortalidad temprana1,2. La mayoría de los pacientes presentan autoanticuerpos, IgG-NMO/AQP-4, dirigidos contra un canal acuoso, la acuaporina-4 (AQP-4), que se expresa principalmente en los podocitos de los astrocitos1-5. Diferentes hallazgos apoyan el papel patogénico de los IgG-NMO/AQP-4, tales como la pérdida selectiva de AQP-4 en las lesiones del SNC6, la correlación de los títulos de anticuerpos con la actividad de la enfermedad7,8, y el que se pueda reproducir lesiones de tipo NMO mediante la transferencia pasiva de anticuerpos de pacientes con NMO en modelos animales1. El papel predominante de las células B y de la respuesta inmunitaria humoral también se apoya en el hecho de que citocinas que promueven la activación de las células B y la producción de anticuerpos, como BAFF y la interleucina-6, están incrementadas en el líquido cefalorraquídeo (LCR) y en el suero de los pacientes con NMO9,10. Este hecho es importante pues, al igual que en los pacientes con esclerosis múltiple (EM), las células B de memoria, tras cruzar la barrera hematoencefálica, son reestimuladas dentro del SNC por su afinidad frente al antígeno, maduran, se expanden clonalmente y se diferencian en células plasmáticas secretoras de anticuerpos11.
No se conoce bien cuál debe de ser la actitud terapéutica ante pacientes con brotes graves de NMO que no responden a la terapia convencional, incluyendo los ciclos de metilprednisolona intravenosa (MPIV) y el recambio plasmático (RP). En este trabajo presentamos a una paciente con un brote grave de NMO y síntesis intratecal de IgG-NMO/AQP-4, que no respondió al tratamiento con MPIV y RP. Sin embargo, la paciente presentó una buena respuesta al tratamiento con inmunoglobulinas por vía intravenosa (Ig-IV) y rituximab (RTX). Describimos los cambios que se produjeron en la distribución de las subpoblaciones de células B y T, y de los títulos de IgG-NMO/AQP-4 en el LCR y en la sangre periférica (SP) tras el tratamiento.
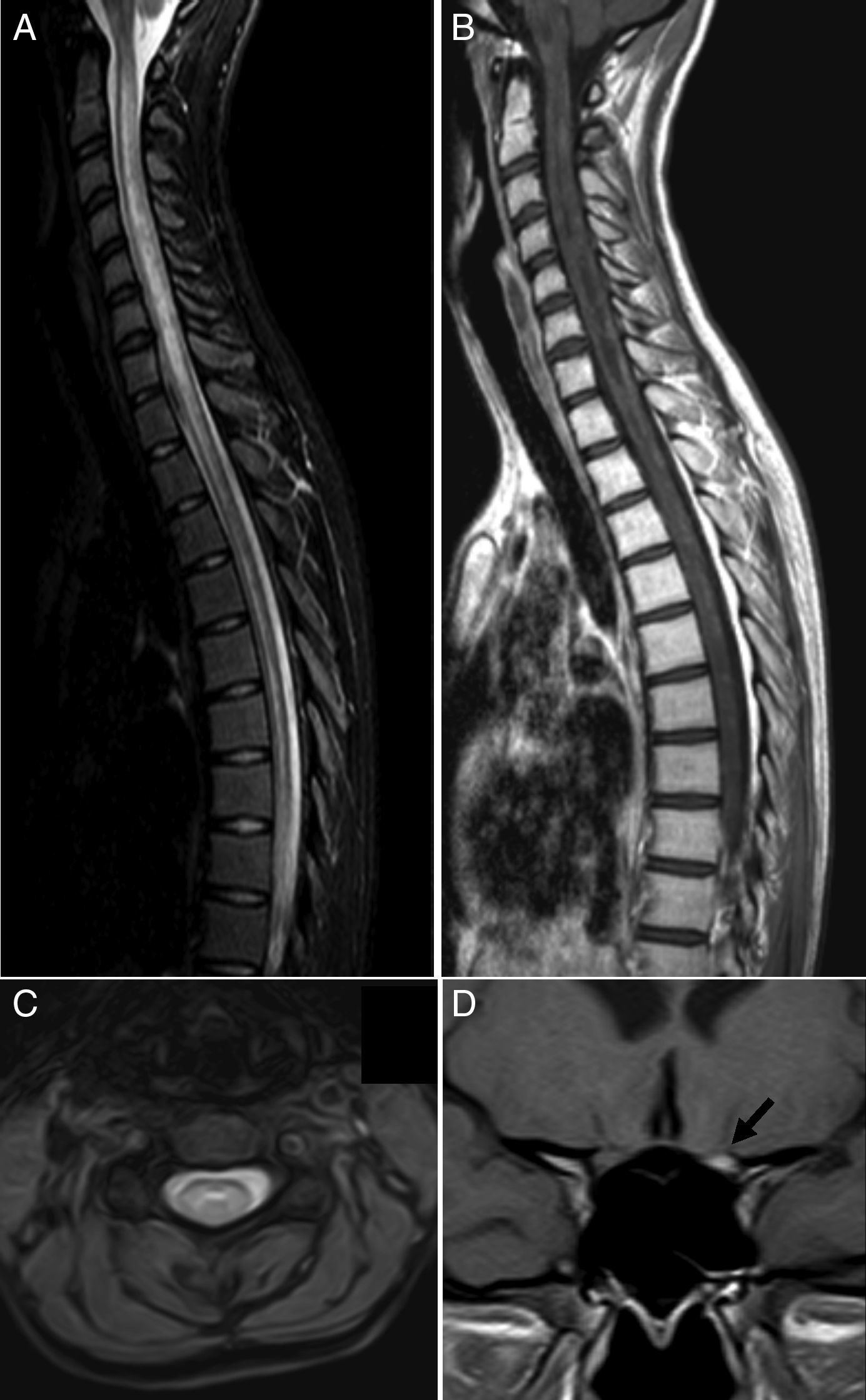
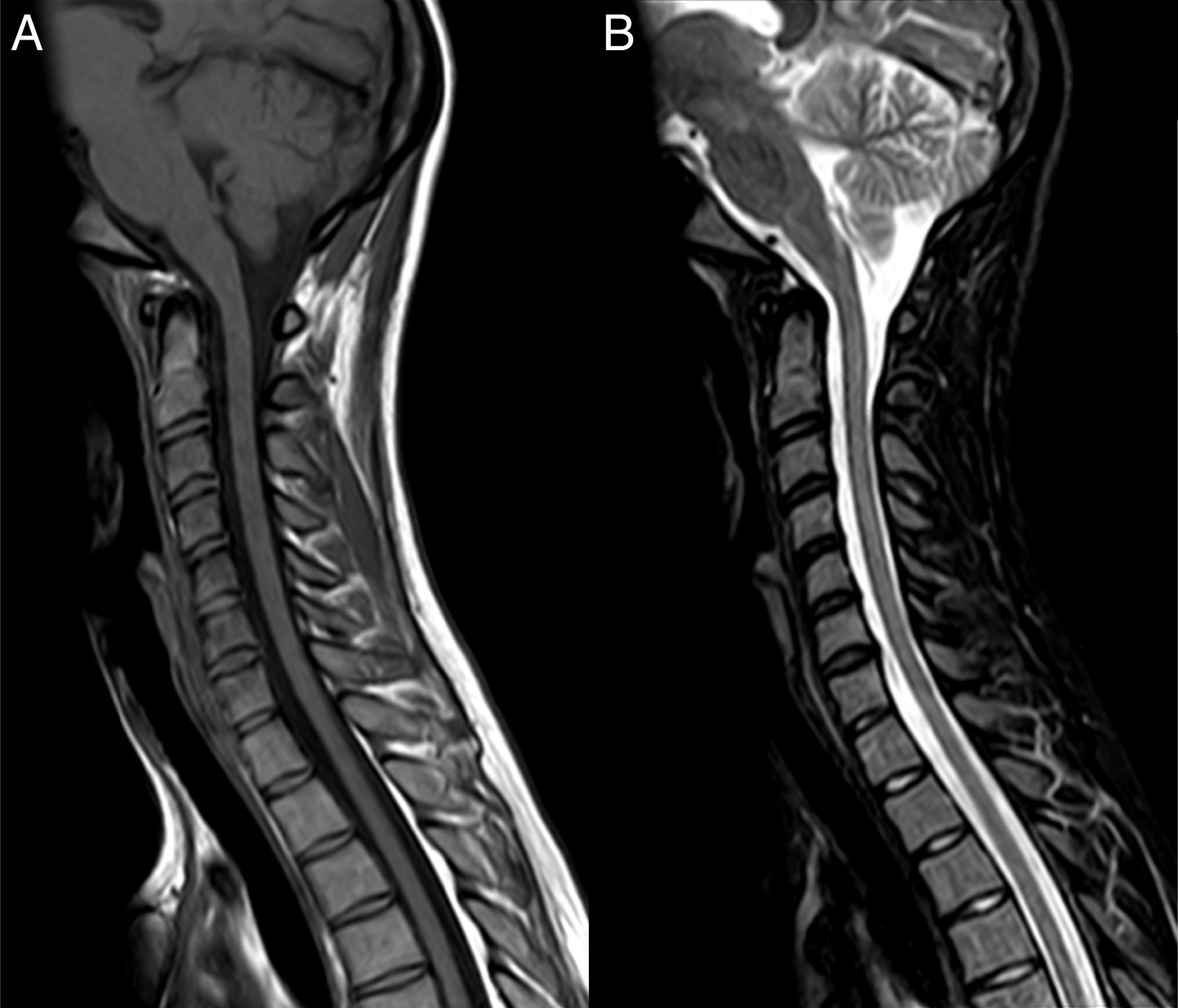
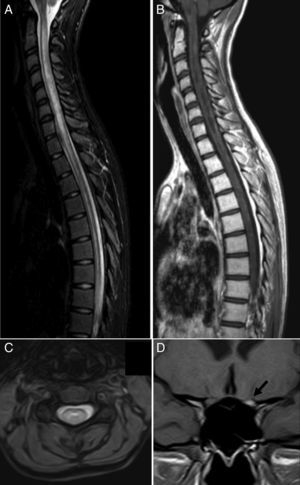
Caso clínicoUna mujer de 17 años fue valorada en otro centro, el 28 de septiembre del 2009, por pérdida de visión subaguda en el ojo derecho que le llevó hasta la ceguera completa. Una resonancia magnética (RM) cerebral y medular fueron normales. Se excluyeron causas autoinmunes e infecciones responsables del cuadro. Tras tratamiento con MPIV 1g/día/7 días, seguido de prednisona por vía oral descendente, la paciente recuperó la agudeza visual en 3 semanas. Un mes después, presentó vómitos y disestesias dolorosas en los pies, que se siguieron de síntomas progresivos de mielitis transversa con cuadriplejía y nivel sensitivo C2, y visión dolorosa en el ojo izquierdo. La paciente tuvo que ser ingresada el 27 de noviembre del 2009 en la UCI por dificultad respiratoria, voz hipotónica y discapacidad en la escala ampliada de Kurtzke (EDSS)12 de 9,0. El hemograma, las pruebas de función hepática, los electrolitos, el nitrógeno ureico en sangre, la creatinina, las serologías de hepatitis, los anticuerpos para enfermedades autoinmunes, los marcadores tumorales, la prueba de la tuberculina, el electrocardiograma, el ecocardiograma y las pruebas microbiológicas se encontraban dentro de los rangos normales. La RM cerebral fue normal excepto por captación de gadolinio (Gd) en el nervio óptico izquierdo y la medular mostró una lesión extensa edematosa continua desde C1 a D10 captante de Gd (fig. 1). El LCR mostró 53 linfocitos/mm3, 62mg/dl de proteínas e índice de IgG de 0,84 (normal, < 0,70). Se detectó mediante inmunohistoquímica13,14 IgG-NMO/AQP-4 en el suero (título de 1:2.000) y en el LCR (título 1:128), y una síntesis intratecal específica de IgG-NMO/AQP-4. La paciente fue tratada con MPIV 1g/día/5 días sin mejoría, seguida de 500mg/d 5 días y de RP durante 5 días consecutivos. Dos días después de la última sesión de RP, la paciente había mejorado levemente de la capacidad respiratoria y solo era capaz de realizar leves desplazamientos con los dedos de la mano izquierda. Un nuevo LCR (9 de diciembre del 2009) reveló 43 linfocitos/mm3, 28mg/dl de proteínas y el índice de IgG era de 1,48. Los IgG-NMO/AQP-4 continuaban siendo positivos en el LCR (título de 1:2), pero negativos en suero. Dado el efecto beneficioso de las Ig-IV en algunos casos de NMO15, la hipogammaglobulinemia sérica que presentaba la paciente (probablemente relacionada con el tratamiento previo de RP) y el alto riesgo que amenazaba su vida, se le propuso tratar con Ig-IV y RTX. Se empezó el 11 de diciembre del 2009 a la dosis de 400mg/kg durante 5 días consecutivos y a las 72 h de la última dosis se añadió RTX, 375mg por m2/semanal, durante 2 semanas. Un nuevo LCR (29 de diciembre del 2009) mostró 15 linfocitos/mm3, 31mg/dl de proteínas, y un índice de IgG de 0,48. Los IgG-NMO/AQP-4 eran negativos tanto en el suero como en el LCR. Una RM cerebral, incluyendo estudio de nervios ópticos, fue normal y la medular mostró un aspecto de adelgazamiento continuo desde C1 a D10 sin captación de Gd. La paciente había mejorado y era capaz de caminar con 2 ayudas distancias cortas (EDSS 6,5). La mejoría clínica posterior fue notable y progresiva en los siguientes 2 meses, de forma que 4 meses más tarde la exploración neurológica era normal. Una RM medular de control mostró la desaparición de la hiperintensidad en secuencias de supresión grasa (STIR) y que el adelgazamiento del cordón medular era más evidente (fig. 2). Desde entonces, la paciente ha recibido 2 ciclos anuales de RTX para la prevención de los brotes, no ha vuelto a presentar nuevos episodios, la exploración neurológica continúa siendo normal y los IgG-NMO/AQP-4 son positivas en suero aunque a título bajo (agosto del 2013).
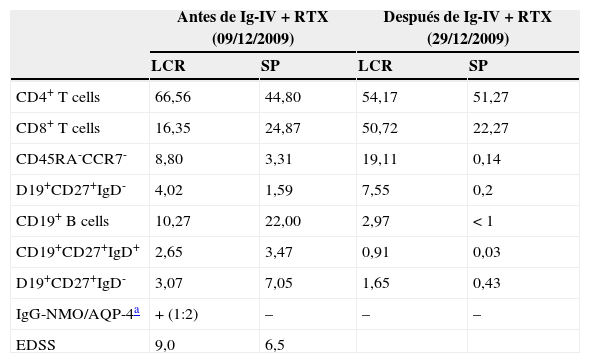
Resonancia magnética al ingreso. A) Sección sagital en secuencia de supresión grasa (STIR): se observa un aumento de señal difusa que se extiende longitudinalmente a lo largo de la médula. B) Secuencia potenciada en T1: captación de contraste parcheada a lo largo de la médula e hipointensidades centrales sugestivas de lesiones necróticas. C) Sección axial potenciada en T2: se observa la localización central de la lesión. D) Sección coronal en secuencia potenciada en T1: se observa la marcada captación de gadolinio en el nervio óptico izquierdo (flecha).
Se obtuvieron simultáneamente muestras de LCR y SP, y se analizaron las subpoblaciones de linfocitos B y T mediante citometría de flujo multiparamétrica, tal como hemos descrito previamente16-18 y los títulos de NMO-IgG/AQP4 por inmunohistoquímica.
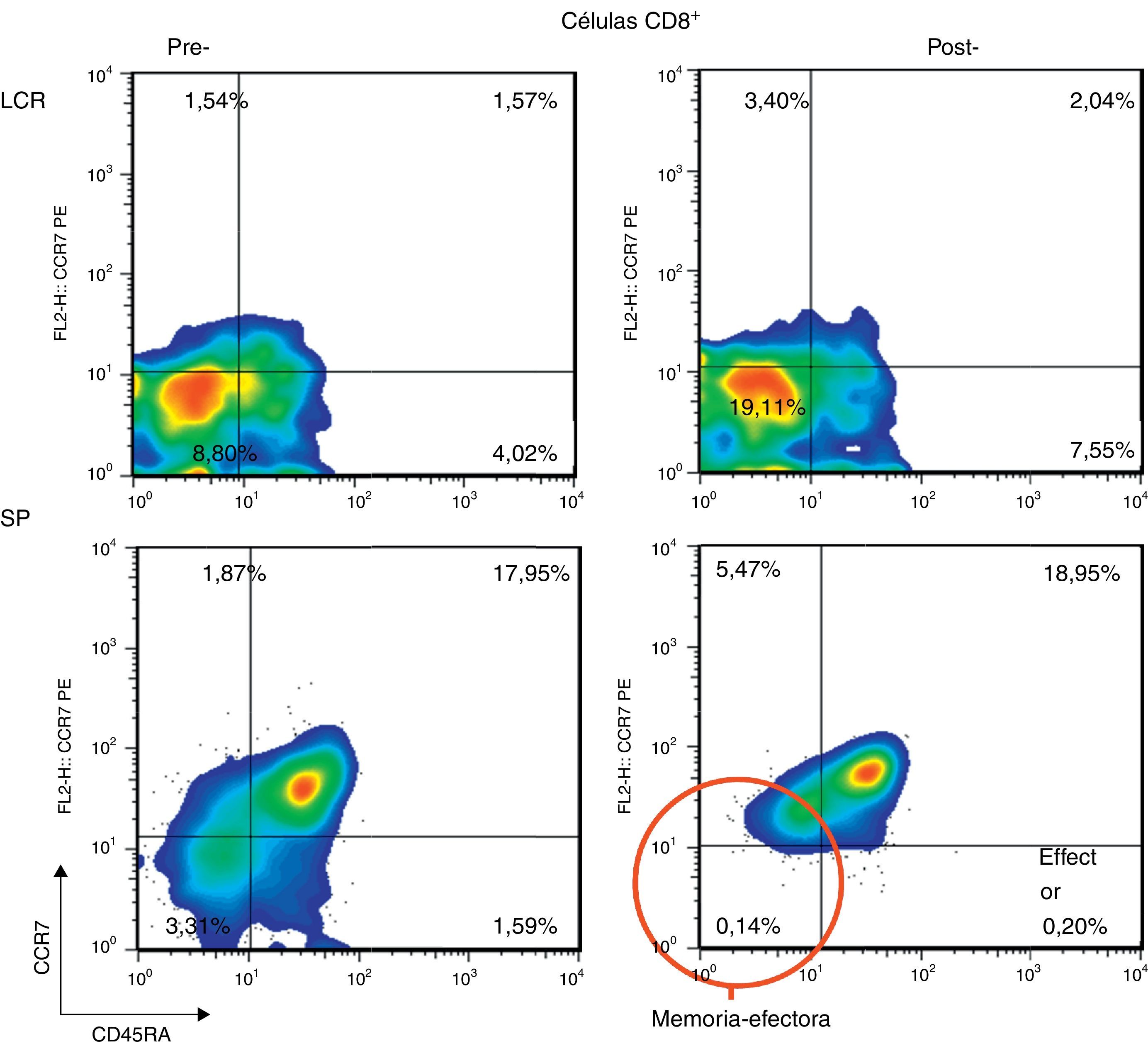
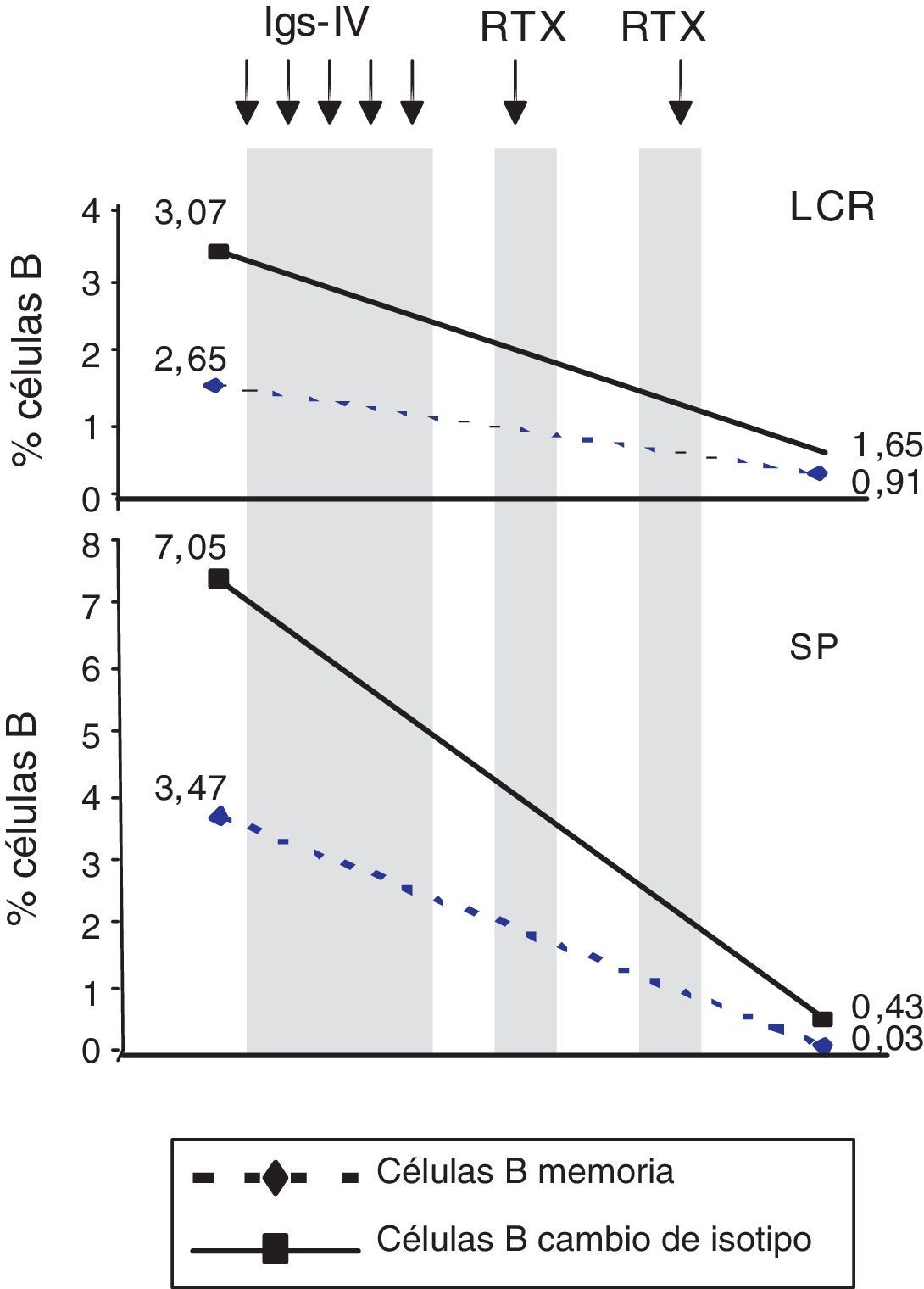
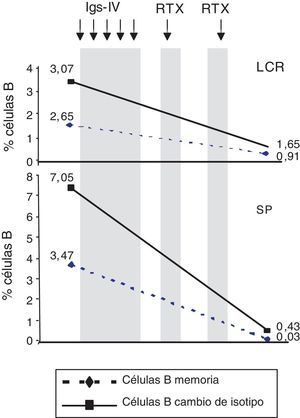
ResultadosPorcentaje de las subpoblaciones de células B y TAntes del tratamiento con Ig-IV y RTX: en el LCR, y comparado con la SP, predominaban las células T CD4+ (66,56% vs. 44,80%), mientras que las T CD8+ y las células B CD19+ estaban menos representadas (16,35% vs. 24,87% y 10,27% vs. 22,00%, respectivamente). También era inferior el porcentaje de células B memoria (CD19+, CD27+, IgD+) (2,65% vs. 3,47%) y el de células B con cambios de isotipo («class-switched») (CD19+, CD27+, IgD−) (3,07% vs. 7,05%). Por el contrario, el porcentaje de células T CD8+ memoria efectoras (CD45RA−, CCR7 −) (8,80% vs. 3,3%) y el de efectoras (CD45RA+, CCR7−) era mayor (tabla 1). También estaban más representadas las células T CD4+ reguladoras (CD4+, CD25hi+ y CD4+, CD25+, Foxp3+ (2,25% vs. 0,40% y 3,25% vs. 0,12%, respectivamente) y las T CD8+ reguladores/supresores (CD8+, CD25+, CD28−) (5,56% vs. 2,40%). Los anticuerpos NMO-IgG eran positivos en el LCR (título 1:2) y negativos en el suero (tabla 1).
Cambios en los porcentajes de células T y B en el líquido cefalorraquídeo (LCR) y en sangre periférica (SP) y en el título de IgG-NMO/AQP-4 antes y después del tratamiento con inmunoglobulinas intravenosas (Ig-IV) y rituximab (RTX)
| Antes de Ig-IV+RTX (09/12/2009) | Después de Ig-IV+RTX (29/12/2009) | |||
|---|---|---|---|---|
| LCR | SP | LCR | SP | |
| CD4+ T cells | 66,56 | 44,80 | 54,17 | 51,27 |
| CD8+ T cells | 16,35 | 24,87 | 50,72 | 22,27 |
| CD45RA-CCR7- | 8,80 | 3,31 | 19,11 | 0,14 |
| D19+CD27+IgD- | 4,02 | 1,59 | 7,55 | 0,2 |
| CD19+ B cells | 10,27 | 22,00 | 2,97 | < 1 |
| CD19+CD27+IgD+ | 2,65 | 3,47 | 0,91 | 0,03 |
| D19+CD27+IgD- | 3,07 | 7,05 | 1,65 | 0,43 |
| IgG-NMO/AQP-4a | + (1:2) | – | – | – |
| EDSS | 9,0 | 6,5 | ||
Los números están expresados en porcentajes del total de linfocitos.
EDSS: Expanded disability Status Scale; Ig-IV: inmunoglobulinas por vía intravenosa; LCR: líquido cefalorraquídeo; SP: sangre periférica; RTX: rituximab.
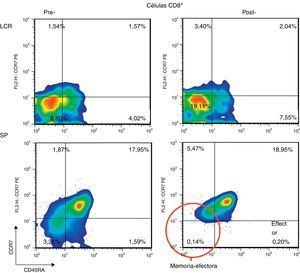
Después del tratamiento con Ig-IV y RTX: en el LCR, y comparado con la SP, las células T CD4+ persistían más altas (54,17% vs. 51,27%), las T CD8+ habían aumentado (50,72% vs. 22,27%) y las células B CD19+ habían disminuido (2,97% vs. < 1%) (tabla 1). Cuando se comparó el LCR con el de pretratamiento, se observó que había disminuido el porcentaje de células B de memoria (98% de IgM) (del 2,65 al 0,91%) y el de células B con cambios de isotipo (del 3,07% al 1,65%) y que había aumentado el de células T CD8+ de memoria efectoras (CD45RA−, CCR7−) (del 8,80 al 19,11%) y el de las efectoras (CD45RA+, CCR7−) (del 4,02 al 7,55%) (tabla 1 y figs. 3 y 4). Cuando se comparó en SP respecto a antes de la terapia, también habían disminuido las células B de memoria (del 3,47 al 0,03%) y las B con cambios de isotipo (del 7,05 al 0,43%) y, a diferencia del LCR, habían disminuido las células T CD8+ de memoria efectoras (CD45RA−, CCR7−) (del 3,31 al 0,14%) y las efectoras (CD45RA+, CCR7−) (del 1,59 al 0,20%) (tabla 1 y figs. 3 y 4). Los IgG-NMO/AQP-4 eran negativos, tanto en el suero como en el LCR (tabla 1).
El tratamiento estándar de los brotes de NMO suele ser MPIV a dosis altas y cuando la respuesta no es adecuada, hasta un 50%-75% de los pacientes se pueden beneficiar del RP1,19-21. Sin embargo, no hay ensayos controlados y aleatorizados que hayan evaluado terapias encaminadas a la prevención de las recidivas de NMO y las opciones de tratamiento se basan en pequeños estudios observacionales en los que se han utilizado inmunosupresores como la azatioprina, la mitoxantrona, el micofenolato mofetilo y más recientemente el rituximab1.
En este trabajo, describimos a una paciente con un segundo episodio grave de NMO, poco después de su comienzo, y con síntesis intratecal de IgG-NMO/AQP-4, que no respondió al tratamiento con MPIV y el RP. La escasa mejoría clínica y la persistencia de IgG-NMO/AQP-4 en el LCR, a pesar del RP, nos llevó a decidir tratarla con Ig-IV y RTX. Las Ig-IV inhiben la presentación antigénica mediada por células B y la proliferación de células T22. El RTX es un anticuerpo monoclonal que se dirige contra el marcador CD20 e induce una depleción de células B CD20+, incluyendo las células pre-B, naïve y memoria9. Ambos fármacos se han mostrado eficaces en la prevención de brotes de NMO1,9,15,23.
Antes del tratamiento con Ig-IV y RTX, observamos que en el LCR había un alto porcentaje de células B y el reclutamiento de células B de memoria, predominantemente IgM, y con cambio de isotipos. Este hecho, asociado a la síntesis intratecal de IgG-NMO/AQP-4, corroboraría el papel predominante de la inmunidad humoral en la NMO1,24. Se sabe que durante la neuroinflamación el acúmulo de células B de memoria en el LCR se debe de forma mayoritaria a su reclutamiento por parte de las células B con cambio de isotipos25. Además, las células B de memoria pueden diferenciarse rápidamente en células secretoras de anticuerpos tras el reconocimiento antigénico y la colaboración de células T26. Un hallazgo no descrito previamente fue la detección de un mayor porcentaje de células CD8+ memoria efectoras y efectoras en el LCR que en la SP. La razón de este reclutamiento no está clara. Podría deberse a la secreción de quimiocinas por parte de las células B NMO-específicas dentro del SNC, lo que llevaría a su reclutamiento desde la periferia, y a su activación y proliferación. O bien podría tratarse de células T CD8+ reguladoras/supresoras que podrían contribuir a la resolución del proceso inflamatorio25-27. En cualquier caso, su presencia es un dato indicativo de que las células T participan en la patogenia de la NMO28.
Tras el tratamiento con Ig-IV y RTX, y como era de esperar, observamos una importante depleción de las células B CD19+, así como de los subtipos de células memoria y las de cambios de isotipo, aunque todavía persistían más altas en el LCR que en la periferia. Hay que tener en cuenta que el análisis se hizo tras 2 dosis de RTX y la depleción completa se suele observar tras 4 dosis29,30. El incremento en el porcentaje de células CD8+ en el LCR es sorprendente, pues en la EM se ha descrito su descenso31, aunque incrementos transitorios también se han observado en otras enfermedades autoinmunes32. El que no analizáramos si estas células CD8+ de memoria efectoras y efectoras se correspondían con células citotóxicas o reguladoras no nos permite dilucidar su posible papel en este contexto. Aunque se ha visto en algunos estudios que el título de IgG-NMO/AQP-4 puede disminuir tras RTX9,33, y se ha indicado que la depleción de células B de memoria afecta al reaprovisionamiento a partir de las células plasmáticas de corta duración, la completa desaparición de los anticuerpos en nuestra paciente cuando todavía persistían células B de memoria nos habla de la compleja interrelación entre las diferentes subpoblaciones de células B y T. De hecho, se ha sugerido la reaparición de las células B CD19+ o de memoria CD27+ en la SP (que suele ocurrir a los 6-9 meses) como marcadores para readministrar un nuevo ciclo de RTX9,33. En cualquier caso, en nuestra paciente los cambios inmunológicos fueron paralelos a la observación de una rápida y notable mejoría clínica, aunque es difícil determinar si en la magnitud del efecto también contribuyó el tratamiento previo con MPIV y RP.
En conclusión, nuestros hallazgos confirman que durante el brote de NMO hay una respuesta inmunitaria humoral contra la AQP-4 e indican que la respuesta inmunitaria es compartimental, inducida por el antígeno y dependiente de células B y T. Un mejor conocimiento de la fisiopatología de la NMO puede ser de utilidad a la hora de desarrollar estrategias terapéuticas que sean más precisas y específicas para la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.