La fibrosis hepática y su etapa final, la cirrosis, representan un enorme problema de salud mundial. La encefalopatía hepática (EH) o encefalopatía portosistémica es una afección clínica de la cirrosis a largo plazo. En esta revisión se destacan las bases moleculares de la EH, así como el papel del estrés oxidativo en el desarrollo de esta enfermedad.
FuentesDiversos estudios señalan que la EH es de origen multifactorial, las alteraciones en la barrera hematoencefálica, sustancias como el amonio y el manganeso, así como alteraciones en la neurotransmisión de dopamina, glutamato y GABA, se han implicado en la patogenia de esta enfermedad.
DesarrolloLa EH es una complicación severa de la insuficiencia hepática tanto aguda como crónica. Neuropatológicamente, se caracteriza por cambios astrocitarios conocidos como astrocitosis Alzheimer tipo II y por la expresión alterada de proteínas específicas de astrocito, como la proteína acídica fibrilar glial, la glutamina sintetasa, los inhibidores de la monoaminooxidasa y los receptores periféricos tipo benzodiacepina.
ConclusionesLa EH es un síndrome neuropsiquiátrico complejo asociado a una falla hepática. Estas alteraciones son producto de un incremento de estrés oxidativo en el cerebro como consecuencia de la acción de neurotoxinas. La principal estrategia para el tratamiento de la EH se dirige a la reducción del amonio, ya sea por la disminución de su absorción/producción o promoviendo su eliminación.
Liver fibrosis and its end stage, cirrhosis, is an enormous worldwide health problem. Hepatic encephalopathy (HE) or portal-systemic encephalopathy continues to be a major clinical problem of long-term cirrhosis. In this review we emphasise the molecular basis of HE and the involvement of oxidative stress in the development of this disease.
BackgroundSeveral studies suggest that the pathogenesis of HE could be multifactorial and have implicated different factors, such as alterations in blood brain barrier, substances; such as ammonia and manganese, neurotransmission disorders such as dopamine, glutamate and GABA.
DevelopmentHE is a severe complication of both acute and chronic liver failure. Neuropathologically, it is characterized by astrocyte changes known as Alzheimer type II astrocytosis. In addition, astrocytes manifest altered expression of astrocyte-specific proteins, such as, glial fibrillary acidic protein, glutamine synthetase, monoamine oxidase and peripheral type benzodiazepine receptors.
ConclusionsHE is a complex neuropsychiatric syndrome associated with liver failure. These alterations are products of increases in oxidative stress in brain due to neurotoxin activity. The main strategy for HE treatment is directed at ammonia reduction, which can be achieved either by decreasing its absorption/production or increasing its removal.
La fibrosis hepática y su etapa final, la cirrosis, representan un enorme problema de salud en todo el mundo. En México es la segunda causa de muerte en la población en edad productiva1. Esta enfermedad es consecuencia de una respuesta de cicatrización a una lesión hepática crónica por una variedad de causas, como las infecciones por los virus de la hepatitis B (VHB) y la hepatitis C (VHC), el abuso crónico de alcohol o la colestasis inducida por la obstrucción biliar prolongada2,3. La fisiopatología molecular de la cirrosis hepática se caracteriza por el aumento y la deposición alterada de proteínas de la matriz extracelular, principalmente colágeno tipo I, III y IV. La deposición excesiva de este tejido fibroso en el espacio subendotelial o espacio de Disse da como resultado una disminución en el intercambio de flujo sanguíneo entre los hepatocitos y la sangre sinusoidal (fig. 1). Los efectos de esta deposición de tejido fibroso en el hígado, no sólo origina las características metabólicas de la enfermedad hepática avanzada, sino también el impacto en órganos distantes, incluido el cerebro4–6. Estas condiciones inducen diversas complicaciones, como las varices esofágicas, esplenomegalia, ascitis, colestasis, hipertensión portal y encefalopatía hepática (EH)5–10. La EH o encefalopatía portosistémica es un problema clínico grave de la cirrosis a largo plazo. Una de las principales características observadas en esta enfermedad es el déficit motor, que incluye rigidez, asterixis y una coordinación muscular deficiente11. En la práctica clínica, la EH se clasifica en cuatro categorías, con un deterioro cada vez más avanzado del estado mental de cada categoría (tabla 1) y se clasifica en tres tipos principales en función de su origen o causa; el primero, tipo A, se asocia con una lesión hepática aguda, el tipo B, está relacionado con derivación portosistémica, y el tipo C, que se relaciona con la cirrosis y la hipertensión portal con derivación portosistémica12. Adicionalmente, se ha descrito una etapa subclínica de EH, cuya prevalencia se estima que varía del 14%, en pacientes con cirrosis Child-Pugh A, al 45%, en los pacientes con cirrosis Child-Pugh B/C según clasificación de Child-Pugh13–15. El objetivo de esta revisión es analizar la información que ha llevado al esclarecimiento de la fisiopatología de la encefalopatía hepática, con un especial énfasis en los aspectos moleculares involucrados en el desarrollo de esta enfermedad.
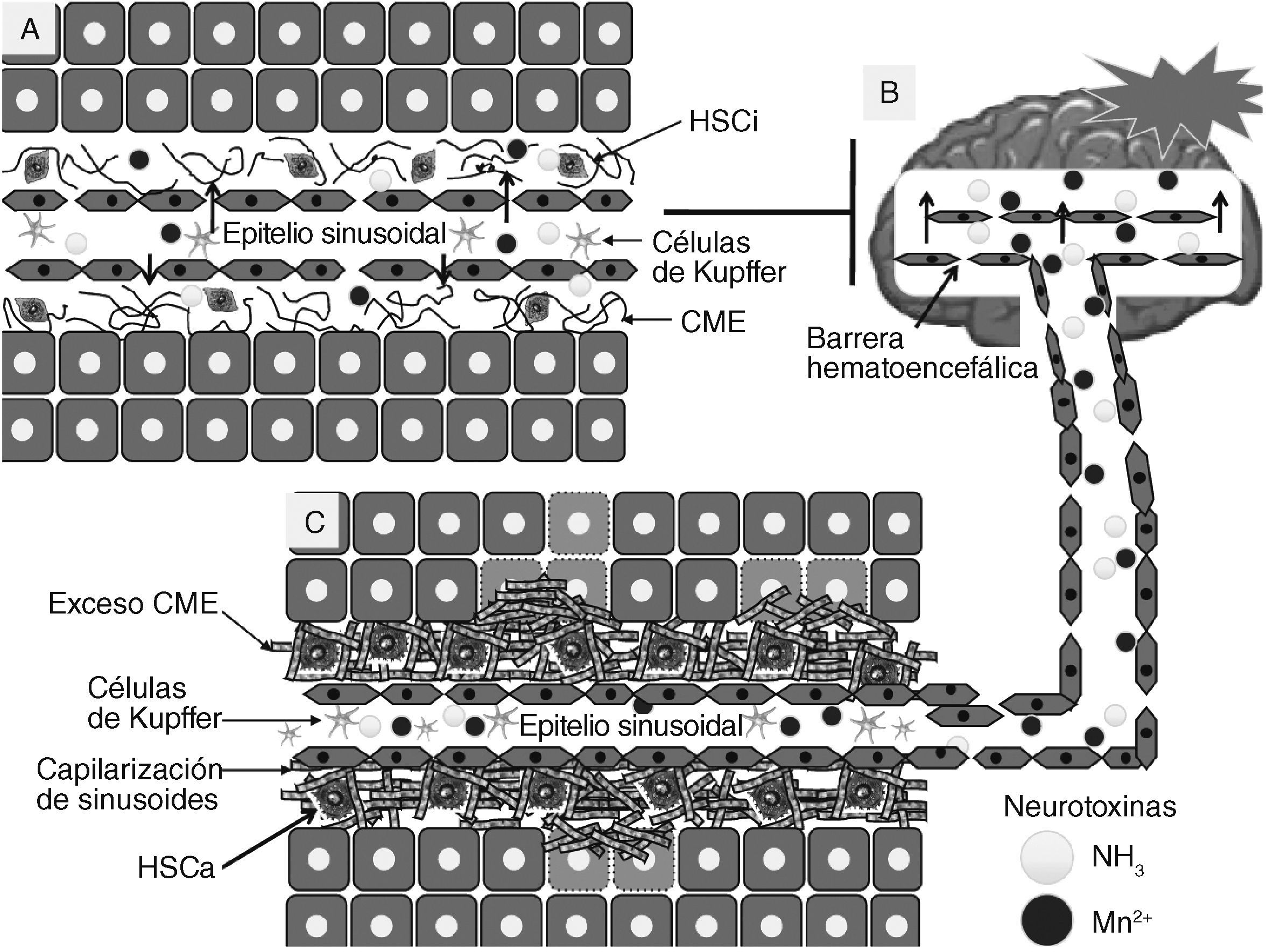
Fisiopatología molecular de la fibrosis hepática. A: en la imagen se observa la representación gráfica de la arquitectura del espacio Disse en un hígado normal donde se puede llevar a cabo la remoción de sustancias (neurotoxinas) que podrían dañar las células cerebrales. B: los cambios en la arquitectura hepática comienzan con una lesión de los hepatocitos que da como resultado el reclutamiento y estimulación de las células inflamatorias en el hígado, como las células de Kupffer. Los factores liberados por estas células inflamatorias conllevan la transformación de las células estelares hepáticas (HSC por sus siglas en inglés) a un fenotipo tipo miofibroblasto. Las HSC activadas proliferan y secretan grandes cantidades de proteínas de matriz extracelular. Posteriormente las células endoteliales sinusoidales pierden sus fenestraciones, y con ello producen un aumento de la resistencia al flujo sanguíneo en los sinusoides hepáticos. C: la pérdida de la arquitectura del tejido normal contribuye al deterioro de la función de órganos que culminan con penetración de neurotoxinas (amonio y manganeso) al cerebro y producen estrés oxidativo y muerte celular. CME: componentes de la matriz extracelular; HSCa: células estelares hepáticas activadas; HSCi: células estelares hepáticas inactivas.
Grados clínicos de encefalopatía hepática.
| Grado I | Falta de conciencia, euforia o ansiedad y tiempo reducido de atención |
| Grado II | Letargo, apatía, desorientación mínima del tiempo y el espacio, cambios de personalidad y comportamiento inapropiado |
| Grado III | Somnolencia, confusión y desorientación |
| Grado IV | Coma |
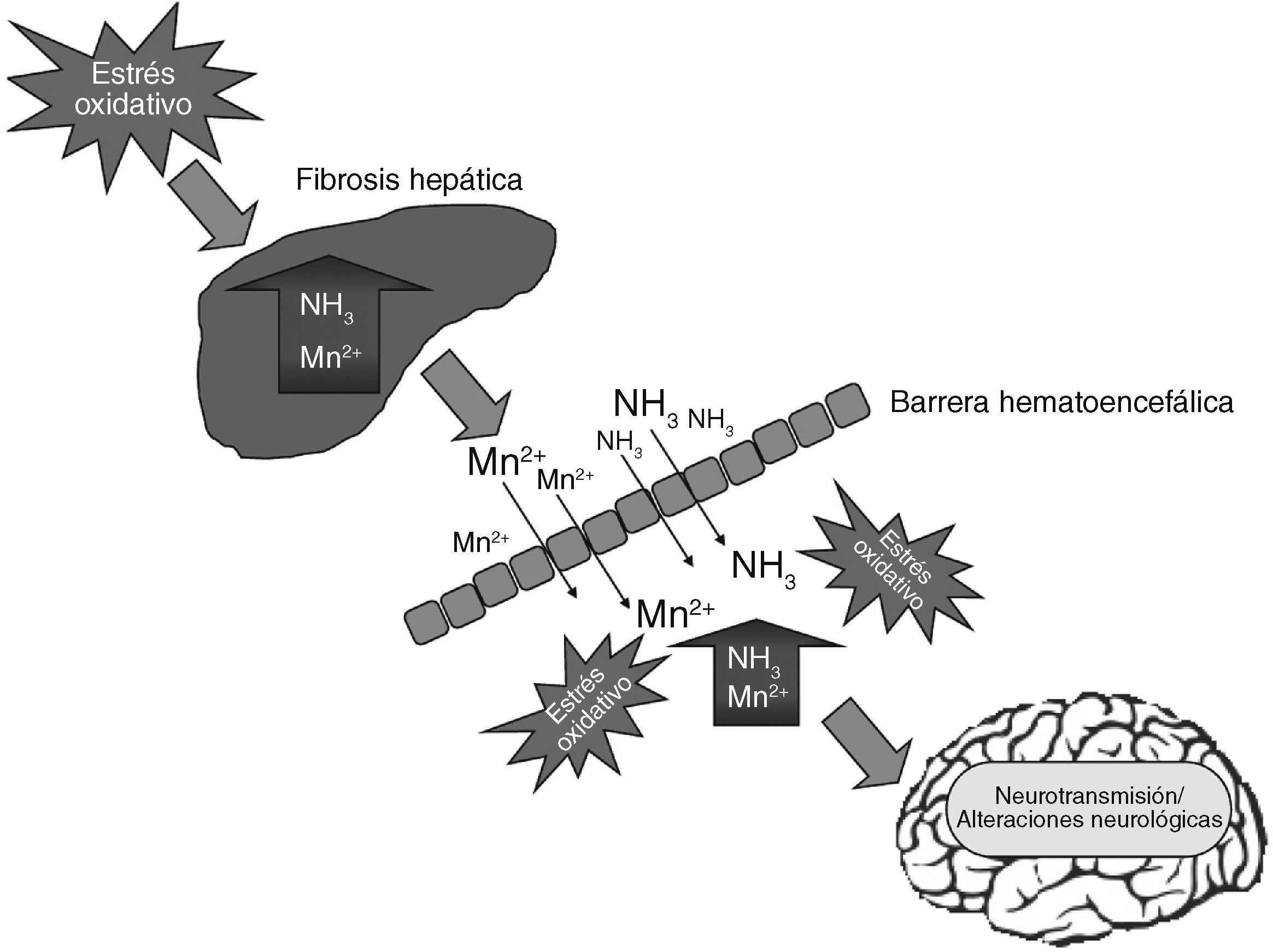
La patogenia de la EH involucra la acción de las neurotoxinas como el amonio y el manganeso, además de diversos fenómenos que incluyen alteraciones en la neurotransmisión, la permeabilidad de la barrera hematoencefálica o en el metabolismo energético (fig. 2). Aunque la patogenia de la EH es complicada y aún no se comprende en su totalidad, se han utilizado numerosos modelos animales para el estudio del desarrollo de esta enfermedad. Adicionalmente, el advenimiento de técnicas modernas de biología celular y molecular, así como el uso de técnicas de imagenología en neurofisiología, ha permitido avances considerables en la comprensión de la patogenia de la EH16.
Alteraciones en el desarrollo de la encefalopatía hepática. El funcionamiento cerebral normal depende en varios aspectos del funcionamiento normal del hígado. Aunque el cerebro se encuentra protegido de sustancias neurotóxicas por la barrera hematoencefálica (característica de los vasos sanguíneos en el cerebro que impide el paso de muchos compuestos de la sangre hacia el tejido cerebral), algunas neurotoxinas pueden penetrar esta barrera después de una lesión al hígado como la cirrosis. Esta enfermedad hepática induce un incremento de sustancias neurotóxicas como el amonio y el manganeso que a su vez inducen estrés oxidativo al atravesar la barrera hematoencefálica, y producen daños en la neurotransmisión, el fracaso en la síntesis de energía y finalmente la muerte celular.
Los astrocitos ocupan cerca de un tercio del volumen de la corteza cerebral y forman una barrera de segregación para las neuronas del ambiente externo. Participan en diversos procesos esenciales para el funcionamiento del cerebro, mantienen y regulan el medio extracelular, participan en la captación de radicales libres, la retención de metales, la modulación de la respuesta inmunitaria y la inflamación, e influyen en la excitabilidad neuronal y la neurotransmisión11,17,18. Estas células presentan diferentes cambios morfológicos, durante la cirrosis hepática se presenta astrocitosis Alzheimer tipo II y en insuficiencia hepática aguda, los astrocitos adquieren una apariencia de células hinchadas51. Se ha documentado que en la EH los astrocitos presentan una expresión alterada de proteínas específicas de astrocito, como la proteína acídica fibrilar glial (GFAP), enzimas como la glutamina sintetasa (GS), inhibidores de la monoaminooxidasa (MAO) y receptores periféricos tipo benzodiacepínicos (PBR)19.
Papel de los astrocitosEntre los diferentes tipos de células en el sistema nervioso central (SNC), los astrocitos son una fuente importante de proteínas extracelulares y moléculas de adhesión. Éstos desempeñan un papel central en la formación de cicatriz glial posterior a numerosas formas de lesión para preservar la integridad del tejido y delimitar la zona de lesión, en un proceso llamado astrogliosis reactiva. La cicatriz glial que se sitúa alrededor de la lesión intenta rescatar al tejido sano del SNC de lesiones secundarias; sin embargo, al mismo tiempo, inhibe la posible regeneración axonal después de la lesión20.
Papel de las neuronasEn contraste con las alteraciones morfológicas descritas en los astrocitos, las neuronas no presentan cambios en su arquitectura celular durante la EH. En estudios histopatológicos del cerebro de pacientes con daño hepático crónico, las neuronas se observan en condiciones y cantidades normales, además de que algunos marcadores de integridad neuronal como la N-acetilaspartato no modifican en estos pacientes. Los estudios en modelos animales de EH proporcionan pruebas convincentes de que los mecanismos de muerte neuronal son similares a los observados en la isquemia. Estos mecanismos incluyen la excitotoxicidad mediada por receptores NMDA, el estrés oxidativo/nitrosativo, la acidosis láctica y la presencia de citocinas proinflamatorias21.
NeurotoxinasAmonio. El amonio (NH3) es la neurotoxina clave implicada en la patogenia la EH. En los últimos años se han realizado progresos importantes para definir su participación en la génesis del edema cerebral durante la insuficiencia hepática fulminante13,22,23. El uso de infusiones de amonio en ratas ha demostrado que el edema cerebral y la hipertensión intracraneal pueden ser inducidos de manera experimental y que este fenómeno puede inhibirse con la administración de sulfato de metoximina, un inhibidor de la GS. Esto ha llevado al concepto de que la glutamina que deriva del SNC participa en la desintoxicación de amonio al producir un gradiente osmótico a través de la barrera hematoencefálica, que da lugar al edema cerebral y la hinchazón de astrocitos11,22. Los cambios estructurales y neuroquímicos en el cerebro, como resultado de la exposición al amonio, han sido objeto de intensas investigaciones. El amonio induce cambios astrogliales que contribuyen a la hinchazón de la célula mediante el aumento de la glutamina intracelular, lo que produce alteraciones en la barrera hematoencefálica que influyen en la neurotransmisión glutamatérgica y aumentan la expresión de la óxido nítrico sintetasa neuronal22.
Manganeso. El manganeso (Mn2+) es un metal neurotóxico, cuya exposición crónica produce alteraciones neurológicas como la rigidez, el temblor y alteraciones de la marcha5. Tanto la deficiencia como el exceso de Mn pueden dar como resultado efectos profundos en el SNC. La exposición industrial o experimental a Mn2+ se ha asociado con trastornos afectivos y psiquiátricos24. En los ganglios basales de pacientes cirróticos se ha encontrado un mayor contenido de Mn2+ que en los no cirróticos, y se ha correlacionado con los síntomas extrapiramidales. Estudios in vitro indican que Mn2+ inhibe la fosforilación mitocondrial oxidativa, mientras que la administración intracerebral de Mn2+ aumenta el lactato y disminuye las concentraciones de ATP. En la actualidad, no se ha comprendido del todo la compartimentación celular de la acumulación de Mn2+, algunos investigadores han comunicado que las células gliales poseen un mecanismo de transporte de alta afinidad por el Mn2+, con capacidad de acumulación de este metal de hasta 200 veces la concentración extracelular y concentraciones intracelulares de 50-75μmol. Estudios adicionales han revelado que el 60-70% del Mn2+ acumulado es capturado en la mitocondria, mientras que el resto se localiza en el citoplasma18,25. El manganeso es un elemento de transición que puede tener diferentes estados de oxidación (incluidos Mn2+, Mn3+ y Mn7+). La transición de Mn2+ a Mn3+ trivalente conduce a un aumento de la capacidad oxidante del metal que puede ocasionar una producción de especies reactivas de oxígeno (ERO), lipoperoxidación y/o daño a la membrana celular25. El mecanismo de neurotoxicidad de Mn2+ no se ha comprendido del todo, aunque se ha propuesto que una disfunción dopaminérgica en los ganglios basales sería una posible causa5,22. Finalmente, se ha descrito que el Mn2+ estimula la autooxidación de dopamina (DA) en las neuronas dopaminérgicas, un proceso que se acompaña de un aumento en la formación de quinonas y proteínas unidas: cisteína-DA y cisteína-ácido dihidroxifenilacético (DOPAC)26,27.
Estrés oxidativoSi bien es cierto que hasta la fecha hay poca evidencia de la participación directa del estrés oxidativo en pacientes con EH, diversas investigaciones indican que el estrés oxidativo tiene un papel clave en la patogenia de la EH. Aunque se ha documentado que los factores involucrados en la patogenia de la EH son capaces de generar radicales libres y disminuir la capacidad antioxidante en el SNC, la participación exacta de las ERO generadas por neurotoxinas como el amonio no es del todo clara. Recientemente Kosenko et al28, así como Hilgier et al29, han demostrado que la infusión de amonio en el cuerpo estriado de ratas da lugar a la producción de radicales hidroxilo. Adicionalmente, Kosenko et al30,31 reportaron una dismnución significativa en la actividad de enzimas antioxidantes como la glutatión peroxidasa, el manganeso-superóxido dismutasa (SOD-Mn) y la catalasa, así como un aumento de la peroxidación lipídica y disminución del glutation (GSH). Por su parte Warskulat et al32 observaron que la expresión de hemoxigenasa-1 (HO-1) disminuía en ratas tratadas con amonio, un fenómeno común en condiciones de estrés oxidativo. Se han observado efectos positivos en el tratamiento de EH experimental con antioxidantes (ascorbato, alfatocoferol, deferoxamina, butilhidroxianisol, dimetilsulfóxido y dimetilurea)33,34. Negru et al35 identificaron valores elevados de radicales libres, en relación con la capacidad antioxidante disminuida por la enfermedad hepática alcohólica, en pacientes con EH. La mayor evidencia de la implicación del estrés oxidativo en la neurotoxicidad por amoníaco se ha derivado de estudios con cultivos celulares. Los astrocitos cultivados han demostrado ser muy sensibles al estrés oxidativo, con afección particularmente de las mitocondrias. Aunque se conoce que la oxidación de los lípidos, proteínas y ácidos nucleicos afecta a la estructura y la función celular, las consecuencias precisas del estrés oxidativo en HE/hiperamonemia no se conocen del todo. Sin embargo, se sabe que el estrés oxidativo está asociado con la hinchazón de astrocitos, un componente importante del edema cerebral en la insuficiencia hepática fulminante (IHF), así como con la inducción de la transición de permeabilidad mitocondrial (TPM), un fenómeno en relación con la falta de energía mitocondrial. Por lo que es probable que otras alteraciones en un estado de hiperamonemia tengan relación con el estrés oxidativo. La TMP puede resultar tanto del estrés oxidativo como del estrés nitrosativo. Es importante señalar que estudios recientes demuestran la inducción de la TPM por Mn2+ en cultivo de astrocitos, de forma dependiente de la concentración, y que tanto el SOD como la vitamina E ofrecen una protección parcial en este fenómeno, lo que indica un posible papel del estrés oxidativo en la TPM inducido por Mn2+. La vulnerabilidad selectiva de los astrocitos al Mn2+ no es clara36, aunque, como se señaló anteriormente, la presencia de transportadores de alta afinidad para Mn2+ en los astrocitos, así como la alta capacidad de acumular Mn2++, puede explicar la predisposición de los astrocitos a la toxicidad del Mn2+.
Disfunción de la neurotransmisiónDopaminérgicaEl mecanismo de la disminución de la DA en la EH se ha considerado causa de la acumulación de falsos neurotransmisores. El aumento de conversión de DA en pacientes con encefalopatía aumenta la concentración de los aminoácidos aromáticos fenilalanina y tirosina en el cerebro, ambos precursores del neurotransmisor DA. Adicionalmente, se ha descrito que el Mn2+ altera la transmisión dopaminérgica mediante un aumento en la conversión de DA5.
GlutamatérgicaEl glutamato es un aminoácido y uno de los neurotransmisores aminoacídicos en el cerebro con efecto excitatorio. Básicamente, se compone de un átomo de carbono central unido a un grupo carboxilo (COOH) y un grupo amino (NH3). El glutamato cerebral se deriva únicamente de las fuentes endógenas; principalmente de cetoglutarato, un producto del ciclo de Krebs37. El glutamato neuronal actúa como un neurotransmisor durante la comunicación entre las neuronas. Estas neuronas pueden ser excitatorias o inhibitorias. La acción excitadora del glutamato en el cerebro y en la médula espinal de los mamíferos se conoce desde la década los cincuenta37, pero no fue hasta finales de los setenta que se reconoció que el glutamato es el principal transmisor de excitación en el sistema nervioso en los vertebrados38.
GabaérgicaEl ácido gamma-aminobutírico (GABA) es el neurotransmisor inhibidor predominante en el SNC de los mamíferos. La alteración de la neurotransmisión gabaérgica está implicada en la fisiopatología de varias enfermedades neurológicas y neuropsiquiátricas como epilepsia, esquizofrenia, enfermedades neurodegenerativas, trastornos del sueño y encefalopatía hepática. La neurotransmisión gabaérgica es mediada por el GABA, que activa el complejo postsináptico GABAA receptor (GRC), un ligando específico de canales iónicos selectivos para el cloruro, después de la activación, el canal se abre y permite que el cloruro entre para inhibir a la neurona postsináptica. La alteración de la neurotransmisión gabaérgica en la EH se propuso hace más de dos décadas39.
Tratamiento de la encefalopatía hepáticaLos avances recientes en el tratamiento de la EH se han centrado en la modificación de los desequilibrios metabólicos. La estrategia principal para el tratamiento de la EH se dirige a la reducción de amonio, que se puede lograr al disminur su producción/absorción o aumentar su eliminación. Tradicionalmente, se conoce que la cavidad gástrica es el principal sitio de producción de amonio, por lo que las estrategias actuales se dirigen a los métodos de reducción de la producción/absorción del amonio en el intestino. La prioridad del tratamiento se ha centrado en la restricción proteínica en la dieta (tabla 2). En la práctica, los agentes más utilizados son los disacáridos no absorbibles, como lactulosa y lacitol, que actúan promoviendo el movimiento del intestino, que afecta al metabolismo bacteriano, incluidas la producción y la absorción de amonio11,22,23. Los antibióticos como neomicina, tetraciclina, metronidazol y vancomicina se utilizan con el fin de reducir la flora bacteriana y la amoniogénesis consecuencia de la degradación de la urea y otras proteínas. Nuevos agentes, como benzoato de sodio y L-ornitina L-aspartato (LOLA), están destinados a la eliminación metabólica del amonio. Por más de 25 años, los disacáridos no absorbibles han sido los principales tratamiento empleados. Sin embargo, estos disacáridos no absorbibles se han usado como tratamiento sin la base de pruebas adecuadas. En una revisión sistemática de 22 estudios aleatorizados del uso de lactulosa/lacitol para la encefalopatía hepática, Bodils Als-Nielsen et al40 concluyeron que no hay pruebas suficientes para recomendar o rechazar su uso.
Fármacos utilizados para el tratamiento de la encefalopatía hepática.
| N-acetilcisteína | Restaura los almacenes de glutatión |
| Benzoato de sodio | Potencia la excreción de amonio |
| Indometacina | Normaliza la presión intracraneal |
| Carnitina | Mejora la función mitocondrial y disminuye la producción de radicales libres por la mitocondria |
| Lactulosa | Disminuye la absorción de amoníaco, luego del cambio de pH intestinal (catárticos osmóticos) |
| Neomicina | Inhibe el crecimiento de bacterias productoras de ureasa y disminye la cantidad de amoníaco producido en el tracto gastrointestinal |
| Rifaximina | Antibióticos orales no absorbibles que disminuyen la concentración de amoníaco sérico |
En un modelo adecuado para el estudio de la EH los animales de experimentación deben exhibir los síntomas típicos de la enfermedad hepática además de presentar los cambios neurológicos como la presencia de astrocitos Alzheimer tipo II. A continuación se describen algunos de los modelos más utilizados para el estudio de la EH.
Modelos quirúrgicosEstos modelos no se ajustan plenamente a los criterios señalados anteriormente para un modelo animal de EH. en uno de los modelos quirúrgicos, la sangre se deriva de la vena porta directamente a la vena cava caudal, sin pasar por el hígado. Esto tiene como principales desventajas el hecho de que solo puede ser revertida por el trasplante, el tipo de coma es diferente al observado en los pacientes. Un modelo quirúrgico más apropiado es el que se utiliza la desvascularización completa del hígado por un puente porto-cava permanente en la arteria hepática. Este procedimiento es irreversible, de modo que la ligadura temporal de la arteria hepática es el modelo quirúrgico más apropiado para el estudio de la EH41.
Modelos de hepatotoxicidadSe ha comunicado que hay correlación entre las concentraciones cerebrales de aminoácidos aromáticos y la encefalopatía hepática experimental inducida por tetracloruro de carbono (CCl4, 1ml/kg 3 veces por semana durante 10 semanas). Las concentraciones cerebrales de los aminoácidos aromáticos, especialmente la tirosina (Tyr) y la fenilalanina (Phe), en ratas con encefalopatía hepática se incrementaron respecto a los controles correspondientes. El aumento de Tyr y Phe en el cerebro, producido por la hiperamonemia, así como los valores elevados de Phe y Tyr en sangre, puede ser un acontecimiento fundamental para el desarrollo de la encefalopatía hepática42. El modelo de daño hepático inducido por el tratamiento con tioacetamida (TAA) presenta inflamación y cambios astrocíticos similares a los observados en los cerebros de pacientes con EH43. Sin embargo, aunque la EH inducida con TAA afecta al sistema glutamatérgico cerebral, las diferencias en el diseño experimental, como el número de administraciones o la dosis del fármaco, han dado resultados diferentes44.
Combinación química y quirúrgicaLa combinación de modelos quirúrgicos y químicos se ha utilizado con resultados satisfactorios en cada uno de los tres tipos de EH clasificados. Los modelos propuestos para EH del tipo A (asociada a la insuficiencia hepática aguda) incluyen el tratamiento con fármacos hepatotóxicos, la desvascularización total o parcial y la hepatectomía parcial o total. A la fecha no hay un buen modelo para el estudio de la EH crónica, tal vez el más eficaz y más utilizado es el de la derivación porto-cava, pero esto es sólo un buen modelo para EH de tipo B. Otros modelos de tipo B realizan ligadura parcial de la vena porta para simular la derivación porto-sistémica. Por último, los modelos propuestos para la EH crónica tipo C (en relación con cirrosis e hipertensión portal) requieren el uso de hepatotoxinas, como la intoxicación por CCl4 o TAA o, en su defecto, la obstrucción del conducto biliar. Si bien es cierto que la ligadura de las vías biliares puede inducir por sí misma la EH, la exposición a neurotoxinas, como el Mn2+, junto con el daño hepático (por hepatotóxicos o métodos quirúrgicos), es el que simula en mayor medida la patogenia de la HE45.
Inyección intravenosa de clorhidrato de galactosaminaAunque en este modelo los animales presentan efectos similares a la encefalopatía hepática aguda grave; existen muchas objeciones para utilizarlo, debido a que se han comunicado diferentes tipos de respuestas entre las especies animales empleadas, además del alto costo del fármaco y las dificultades en la generación de la encefalopatía hepática46.
Exposición crónica y sistémica a endotoxinasSe ha descrito que las concentraciones plasmáticas de endotoxinas derivadas del intestino (lipopolisacáridos) a menudo se encuentran elevadas en pacientes con cirrosis y se cree que contribuyen en el establecimiento de la EH. Este tipo de modelo experimental fue desarrollado para imitar el síndrome del “intestino permeable”, es decir la translocación de endotoxinas de la circulación sanguínea en los pacientes cirróticos47.
Nuevas estrategias terapéuticas en EHLa EH es una causa significativa de morbilidad y mortalidad en pacientes con enfermedad hepática crónica avanzada. Los tratamientos actuales conllevan efectos secundarios, además del alto costo y una eficacia incompleta. La terapia más útil en la EH debe incluir la curación de la insuficiencia hepática debido a que los signos de edema cerebral desaparecen rápidamente cuando hay una mejoría hepática en pacientes con insuficiencia hepática aguda y EH48. Aunque se han utilizado diferentes procedimientos terapéuticos para la EH, muchos de ellos son complementarios e incluyen la manipulación de la producción intestinal de aminoácidos para modificar las bacterias del colon mediante la administración de altas dosis de ureasa en bacterias (Lactobacillus acidophilus), así como la utilización de fármacos que actúan sobre el ciclo de la urea para mejorar la EH de una forma similar a la administración de lactulosa y algunas dietas enriquecidas con aminoácidos de cadena ramificada. El trasplante hepático es, obviamente, el tratamiento más radical para la mejora de las manifestaciones de insuficiencia hepática pero, en algunos casos crónicos no se produce una mejoría en los signos neurológicos o la recuperación puede ser parcial48. Por otra parte, aunque la administración crónica de antibióticos ha demostrado ser eficaz en el tratamiento de la EH, se han reportado efectos adversos graves con la utilización de neomicina o metronidazol. Algunos investigadores han examinado el uso de rifaximina, un derivado no absorbible de rifamicina con un amplio espectro de actividad contra bacterias grampositivas aeróbicas y anaeróbicas y gramnegativas para el tratamiento de EH. La rifaximina parece ofrecer mayores beneficios en cuanto a seguridad, eficacia y perfil de tolerabilidad que lactulosa y, posiblemente, neomicina49. Adicionalmente, se ha propuesto un compuesto cuaternario de amonio L-acil-carnitina como un potente tratamiento alternativo de bajo costo y seguro para pacientes con cirrosis y EH50. En un estudio realizado por Gálvez-Gastélum et al, se evaluó los efectos de la terapia génica con vectores de adenovirales que contienen ADNc humano del activador del plasminógeno tipo urocinasa y de metaloproteasa 8 (Ad-huPA y Ad-MMP8, respectivamente) en la fibrosis hepática y los síntomas como consecuencia de la EH (acumulación de Mn2+ y metabolismo de DA). En ese trabajo, se utilizaron ratas de la cepa Wistar que, después de una ligadura del conducto biliar (BDL), recibieron 1 mg/ml de MnCI2 en el agua de beber (BDL/Mn2). Posteriormente los animales cirróticos y encefalopáticos fueron tratados con los vectores terapéuticos. Como resultado se encontró que los animales con BDL/Mn2 mostraron alteraciones motrices, como temblores, rigidez muscular y alteraciones de la marcha, síntomas que disminuyeron notablemente después de la terapia génica con Ad-huPA y Ad-MMP8. Además, se encontró que la fibrosis hepática disminuyó después del tratamiento, así como mayores concentraciones de dopamina en el cerebro (cuerpo estriado) en comparación con las ratas con encefalopatía sin terapia. Los animales cirróticos sin tratamiento presentaron una morfología anormal de los elementos celulares (gliosis) del estriado y la sustancia nigra, donde se ha incrementado la expresión de la proteína acídica fibrilar glial (GFAP) y ha disminuido la de tirosinhidroxilasa (TH). Estas anomalías disminuyeron con Ad-huPA y Ad-MMP8, por lo que el tratamiento fue eficaz en revertir la fibrosis experimental y la encefalopatía hepática (datos no publicados).
ConclusionesLa EH es un síndrome neuropsiquiátrico complejo que se relaciona con insuficiencia hepática fulminante, enfermedad hepática crónica del parénquima o derivación portosistémica. Los síntomas de EH varían, desde cambios sutiles en la mentalidad y déficit motor, como la rigidez, asterixis (batido, temblor) y coordinación muscular deficiente, así como alteraciones del ritmo circadiano fisiológico y la pérdida completa de la conciencia (coma hepático). Aunque la patogenia de la EH es complicada y aún no se comprende por completo, se han desarrollado numerosos modelos animales para el estudio de la EH. Los resultados de estudios previos indican que la patogenia de la EH podría ser multifactorial y están implicados diversos factores, como alteraciones en la barrera hematoencefálica, sustancias como amoníaco y manganeso, y neurotransmisión de dopamina, glutamato y GABA. Estas alteraciones son producto del estrés oxidativo en el cerebro como consecuencia de la acción de neurotoxinas. Las terapias para el tratamiento de EH se han centrado en la modificación de las perturbaciones metabólicas en la EH (neurotransmisión), ya que se refieren a la hipótesis de amoníaco. La estrategia principal para el tratamiento de la EH se dirige a la reducción de amonio, ya sea por disminución de su absorción o aumento de su eliminación. Tradicionalmente, se ha pensado que el intestino es el principal sitio de producción de amoníaco por lo que las estrategias actuales se dirigen a los métodos de reducción de la absorción/producción de amoníaco en el intestino.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.