Recientemente se ha caracterizado un grupo de pacientes jóvenes que desarrollaron angiopatía amiloide cerebral (AAC) 2-3 décadas después de intervenciones neuroquirúrgicas1,2. Estos casos han sido descritos como una forma iatrógena de AAC (AACi), y compartían factores como el uso de duramadre liofilizada de cadáver, material de embolización, hormona de crecimiento o instrumental neuroquirúrgico contaminado con proteína beta-amiloide (βA)3,4. En general, no cumple el criterio de edad esencial para el diagnóstico5 de AAC no iatrogénica, por lo que podría tratarse de una entidad infradiagnosticada. Adicionalmente, deben descartarse otros tipos de AAC, como la variante genética o la relacionada con la inflamación6.
La principal hipótesis patológica plantea la transmisión de βA por contacto directo a partir de dicho material neuroquirúrgico contaminado mediante un mecanismo de tipo priónico, como han confirmado trabajos posteriores3,7,8.
Basado en una modificación de los criterios de Boston 2.0, se han propuesto unos criterios diagnósticos para AACi2:
- •
Edad<55 años.
- •
Historia de potencial exposición a βA (tratamiento con restos cadavéricos de tejidos del SNC, o bien antecedentes relevantes de procedimiento neuroquirúrgico).
- •
Al menos un rasgo clínico (hemorragias intracerebrales/convexidad, amyloid spells, crisis focales o deterioro cognitivo no atribuibles a otra causa) y otro rasgo radiológico (hemorragias lobulares, HSA de convexidad, siderosis cortical, signos de hemorragia micro-macroscópica evidenciados en secuencias T2*/SWI de RM).
- •
Evidencia de acúmulo de βA en el SNC, bien por PET, LCR o biopsia cerebral.
- •
Exclusión de causas genéticas.
Presentamos el caso de un varón de 45 años en seguimiento por Neurología desde 2014 por episodios de trastorno sensitivo-motor recurrente y autolimitado de extremidades izquierdas y cefalea intensa. Como antecedentes destaca consumo de cocaína y cirugía neonatal de craneosinostosis con fístula de LCR, reparada con plastia de duramadre de cadáver liofilizada. En una primera RM apreciamos pequeños focos de microsangrado corticosubcorticales y siderosis.
En 2017 acudió por un episodio de hemorragia intraparenquimatosa parietal izquierda y HSA de convexidad, apreciando progresión de los microsangrados en la RM (fig. 1 A y C). En la arteriografía cerebral, apreciamos cambios de calibre sutiles en las ramas arteriales distales de circulación anterior y posterior, compatibles con vasculitis de mediano-pequeño vaso. Estos hallazgos fueron atribuidos inicialmente al consumo de tóxicos, cesando el mismo. El resto de los estudios (EEG, ecocardiograma) fueron negativos.
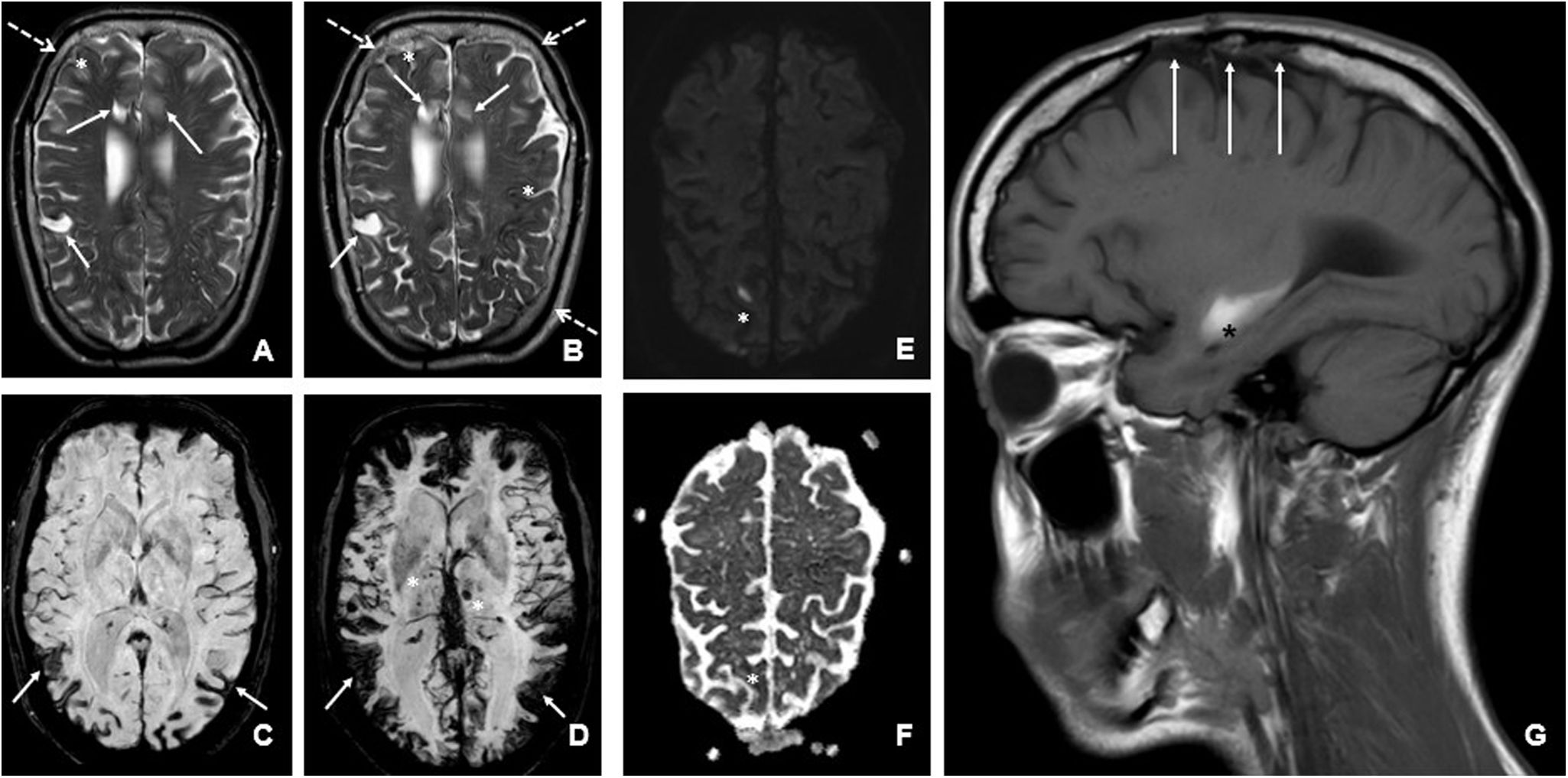
A y B: imágenes de RM con secuencia axial T2 de 2017 (A) y 2023 (B), en las que se observa progresión de la atrofia cortical, con secuelas malácicas de hemorragias territoriales parietal y periventricular derechas (señaladas con flechas), junto con signos de siderosis superficial (asteriscos) que ha progresado. Así mismo, objetivamos también engrosamiento marcado de la calota (flechas gruesas discontinuas). C y D: imágenes de RM con secuencia axial SWI comparando estudios de 2017 (C) y de 2023 (D), apreciándose marcada progresión de la afectación amiloidea con aumento fundamentalmente del componente de siderosis superficial (flechas), pero asociando también aumento del número de lesiones hemorrágicas lacunares y territoriales (asteriscos). E y F: secuencia de difusión (E) y mapa ADC (F), que muestran un foco de restricción de la difusión cortical parietal posterior parasagital derecha (asteriscos). G: imagen de RM en secuencia T1 sagital correspondiente al último estudio del año 2023, en la que se aprecia una hemorragia aguda temporal izquierda (asterisco). También podemos apreciar en esta imagen secuelas de la cirugía previa de craneosinostosis (flechas).
En 2021 reingresa por cefalea pulsátil y parestesias en hemicuerpo derecho. El estudio analítico (hemograma, bioquímica, coagulación, serologías, autoinmunidad) resultó normal. Se practicó punción lumbar, obteniéndose LCR claro con leve proteinorraquia (0,54g/dL). La nueva RM cerebral evidenció pequeños focos restrictivos de la difusión subcorticales biparietales (fig. 1 E y F) y múltiples hemorragias en diferentes estadios. El paciente es dado de alta con tratamiento de prednisona 60mg en pauta descendente, azatioprina 50mg y eslicarbazepina 800mg al día. Con el tratamiento se resolvió la cefalea crónica y el déficit sensitivo.
En 2023 acude por cefalea de instauración abrupta, bradipsiquia e inestabilidad. Una nueva RM mostró hematoma subagudo (fig. 1 G) y progresión de los cambios hemorrágicos ya conocidos (fig. 1 B y D). Una nueva arteriografía mostró estabilidad de los cambios arteríticos descritos (fig. 2 A). El estudio genético (paneles de microangiopatía y amiloidosis familiar, APP, PSEN1, PSEN2) no evidenció mutaciones patológicas.
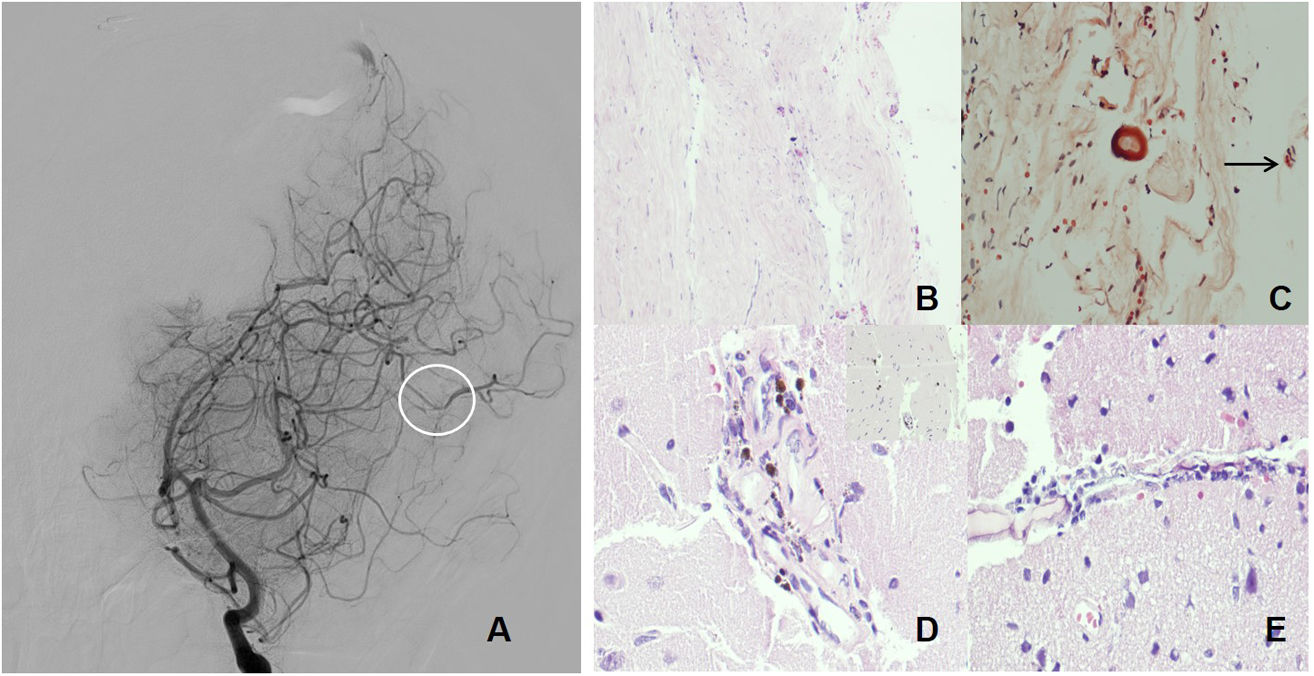
A: imagen de arteriografía que muestra cambios de calibre, observando estenosis de la arteria parietooccipital (círculo). B-E: imágenes anatomopatológicas. B: tinción de hematoxilina-eosina (HE, ×20). Fragmento de duramadre ligeramente fibrosa, con cambios llamativos con algunas células inflamatorias. No se aprecian cambios significativos vasculares. C: tinción de rojo Congo (×40) en imagen de campo claro. Positividad en vaso de duramadre (flecha). D: HE, ×40. El tejido cerebral presenta astrocitosis reactiva y edema del neuropilo. Las paredes vasculares muestran hemosiderófagos, linfocitos y células plasmáticas. E: HE, ×40. Detalle de células linfocitarias, plasmáticas y algunos macrófagos en la pared vascular.
Tras revisar el caso, con estudio etiológico extenso negativo y ante el antecedente de procedimiento quirúrgico con duramadre de cadáver, se plantea el diagnóstico de AACi, realizándose una biopsia cerebral frontal derecha de tejido cortico-subcortical y duramadre, que en el estudio histológico (fig. 2 B-E) muestra signos de microhemorragia antigua (hemosiderófagos) en la periferia de vasos y tinción de rojo Congo positiva, en relación con acumulación de βA. Asocia edema perivascular y acúmulos linfocitarios que afectan la pared.
Estos hallazgos demuestran un estado inflamatorio crónico coadyuvante provocado por la propia presencia de βA que podría incrementar los daños. Recordemos que la amiloidosis secundaria se caracteriza por presentar depósitos de proteína sérica fibrilar amiloide A, con carácter de reactante de fase aguda ante estímulos inflamatorios persistentes o necrosis tisular9. El uso concomitante de cocaína añade estrés oxidativo e inflamación en la glía, pudiendo dañar los mecanismos de autofagia en el pericito10, lo que podría contribuir a un mayor deterioro de los mecanismos de degradación de las fibras de βA en la unidad neurovascular11.
No existe un tratamiento específico disponible para esta entidad. En nuestro caso, los datos inflamatorios apreciados en la angiografía y la biopsia, así como la mejoría clínica, alentaron a mantener el tratamiento inmunosupresor.
En conclusión, la AACi debe considerarse en pacientes jóvenes con hemorragias cerebrales recurrentes y antecedentes neuroquirúrgicos compatibles. El cuadro clínico podría agravarse por la existencia de inflamación vascular asociada a la presencia de βA y la alteración de sus mecanismos degradatorios.