Se han diseñado diferentes modelos animales de la enfermedad de Alzheimer (EA) para apoyar la hipótesis de que la neurodegeneración (pérdida de neuronas, sinapsis y gliosis reactiva) asociada al depósito de Aβ y tau en estos animales es similar a la del cerebro humano. Estas alteraciones producen cambios funcionales que se inician con el deterioro en la habilidad para realizar actividades de la vida cotidiana, pérdida de la memoria y, en general, trastorno neuropsiquiátrico. La alteración neuronal desempeña un papel importante en las etapas tempranas de la enfermedad, especialmente en el área CA1 del hipocampo de animales y humanos.
MétodosSe utilizaron ratones WT y 3xTg-AD hembras de 11 meses de edad, para el análisis conductual (construcción del nido) e histológico en la región CA1 del hipocampo dorsal.
ResultadosLos ratones 3xTg-AD mostraron deficiencia del 50% en la calidad de construcción del nido asociado a un aumento del 26±6% (p<0,05) de neuronas dañadas en comparación con el grupo WT.
ConclusionesEl deterioro de la capacidad para llevar a cabo las actividades de la vida diaria (en el hombre) y la construcción del nido (en el ratón 3xTg-AD) están relacionados con las alteraciones en los circuitos nerviosos observados en la EA. Estas alteraciones son controladas por el hipocampo que en el análisis post mortem (en el humano), así como en la región CA1 (en el modelo de ratón 3xTg-AD) se han relacionado con alteraciones en el depósito de las proteínas Aß y tau que comienzan a acumularse al inicio de la EA.
Different animal models for Alzheimer disease (AD) have been designed to support the hypothesis that the neurodegeneration (loss of neurons and synapses with reactive gliosis) associated with Aβ and tau deposition in these models is similar to that in the human brain. These alterations produce functional changes beginning with decreased ability to carry out daily and social life activities, memory loss, and neuropsychiatric disorders in general. Neuronal alteration plays an important role in early stages of the disease, especially in the CA1 area of hippocampus in both human and animal models.
MethodsTwo groups (WT and 3xTg-AD) of 11-month-old female mice were used in a behavioural analysis (nest building) and a morphometric analysis of the CA1 region of the dorsal hippocampus.
ResultsThe 3xTg-AD mice showed a 50% reduction in nest quality associated with a significant increase in damaged neurons in the CA1 hippocampal area (26%±6%, P<.05) compared to the WT group.
ConclusionsThe decreased ability to carry out activities of daily living (humans) or nest building (3xTg-AD mice) is related to the neuronal alterations observed in AD. These alterations are controlled by the hippocampus. Post-mortem analyses of the human hippocampus, and the CA1 region in 3xTg-AD mice, show that these areas are associated with alterations in the deposition of Aβ and tau proteins, which start accumulating in the early stages of AD.
A finales del siglo xix se iniciaron los estudios de las alteraciones neuronales en diferentes enfermedades neurodegenerativas1. A mediados de los años cincuenta se inicia el estudio topográfico post mortem de estas alteraciones en la enfermedad de Alzheimer (EA)2, que se caracterizan por la atrofia cerebral difusa, la dilatación de los ventrículos y el aumento en la profundidad de los surcos, así como disminución del peso y volumen cerebral asociados con la disminución neuronal3–5. La atrofia de las neuronas afecta principalmente a las cortezas entorrinal, temporal y frontal, así como a la región CA1 del hipocampo6–8. En estas áreas se inicia la formación de las placas neuríticas (PN) por la beta amiloide (Aß, por sus siglas en inglés) y de las marañas neurofibrilares (MNF) que probablemente conllevan a la alteración neuronal, por lo que se ha elegido determinar y correlacionar la muerte neuronal con la evolución cronológica de la demencia9. Los estudios de la relación entre memoria y Aß en ratones transgénicos que expresan la proteína precursora de amiloide (APP) y sus variantes sugieren que el envejecimiento promueve la formación de mediadores solubles de Aß, que es un péptido heterogéneo con residuos carboxilo terminales (Val40 [Aβx-40], Ala42 [Aβx-42], o Thr43 [Aβx-43]], siendo el depósito de Aβx-42 y Aβx-43 el que ocurre tempranamente en el desarrollo de la afección y con efectos negativos sobre la memoria10. En el humano, en las últimas décadas se ha requerido de una mejor calidad para el diagnóstico temprano porque, además de las deficiencias en la memoria, hay un deterioro neuropsiquiátrico que incluye alteraciones en la vida social relacionadas con alteraciones en la actividad sináptica11 y con la habilidad para llevar a cabo actividades de la vida cotidiana. Según Deacon12, en los animales de laboratorio se puede hacer la analogía con esta enfermedad, considerando sus hábitos naturales como el amadrigamiento y la construcción del nido, ambas conductas reguladas por el hipocampo, área en donde se inicia la alteración neuronal en la EA. Esto permite que los modelos animales sean una ayuda para una mejor aproximación en el conocimiento del desarrollo de la enfermedad y por ello se han elaborado diversos modelos transgénicos en el ratón13. Así, su manipulación genética es una estrategia para investigar la función de las proteínas humanas mutadas, como la precursora amiloide o APP, la presenilina (PSEN), la apolipoproteína E y la proteína tau, que se sobreexpresan en estos ratones y que forman las PN y las MNF14,15.
El modelo del ratón triple transgénico (3xTg-AD) se generó en el laboratorio de LaFerla, por Oddo en 2003, microinyectando simultáneamente 2 genes (APP y tau) en una sola celda a embriones de ratón PS1M146v (transgénico que sobreexpresa APP humana o tipo «wild-type» [WT], a su vez generado de un híbrido de 129/C57BL6). Así, el 3xTg-AD expresa la APPSWE, MAPT301L y es Knock-in para PSEN1 M146L (PSEN1-KI)16–18. Estos ratones muestran depósitos de Aβ dependiente de la edad en regiones cerebrales específicas, así como déficit cognitivo relacionado con Aβ intraneuronal, por lo que es un modelo que permite investigar el desarrollo y el tratamiento de la neurodegeneración en la EA13. Además, permite hacer conclusiones sobre el depósito de Aβ en el cerebro y cómo este precede a la enfermedad en que la proteína tau está involucrada (en el modelo animal). Se ha demostrado también que el acúmulo intraneuronal de Aβx-42 se asocia a la deficiencia sináptica temprana en el ratón APPP/PS1Ki19, en las áreas cerebrales relacionadas con la memoria como son la corteza de asociación, el sistema límbico y de manera importante el hipocampo, se encuentran niveles elevados del mARN del APP de 13-16 meses de edad y los niveles de Aβ se elevan desde la edad de 6 meses. Actualmente, no hay reportes sobre el análisis de una conducta innata y el análisis morfológico en la región del hipocampo dorsal en este modelo de ratón triple transgénico (3xTg-AD) de la EA, por lo que el presente trabajo consistió en establecer una relación entre la conducta de nidación (natural en el roedor) y la alteración anatomofuncional del hipocampo para con ello contribuir al conocimiento más amplio de algunos procesos de daño y muerte neuronal observados en esta enfermedad.
MetodologíaSujetosEl protocolo diseñado para este trabajo se realizó conforme a las normas internacionales para el manejo y uso de animales de experimentación establecidas por los National Institutes of Health (NIH) y la National Academy of Science, y fue presentado y aprobado por el Comité de Bioética del Instituto de Neurobiología (INB) de la Universidad Nacional Autónoma de México. Los ratones que se utilizaron como control fueron híbridos de la cepa 129/C57BL/6 y el ratón 3xTg-AD de la misma cepa; ambos se mantuvieron en el bioterio del INB en cajas de policarbonato (12×12×25cm) conectadas a racks de aire lavado y en cuartos con condiciones controladas de temperatura (22°C) y humedad ambiental relativa del 50%,con un ciclo de luz/oscuridad de 12/12h, iniciándose a las 8:00 a.m., con agua y alimento ad libitum con una dieta para ratón del laboratorio Purina Chow (Formula 5001).
Para el estudio se utilizaron solo ratones hembra de 11 meses de edad, obtenidos de las cruzas de las unidades reproductivas originales, destetados a los 30 días de edad, y los 3xTg-AD, que son homocigotos para la EA, poseen los 3 genes (APPSwe y tauP301L y PS1M146Vknock-in) comparados con los ratones no transgénicos (129C57BL/6) o WT, alojados 3 por caja desde el destete hasta el momento del experimento.
Genotipificación del ratón 3xTg-ADSe realizó la extracción de ADN del segmento más caudal de la cola (aproximadamente 0,3cm de largo) del ratón 3xTg-AD, que fue colocado en tubos eppendorf de 1,5ml con 500μl de 0,05M NaOH; los fragmentos se incubaron a 95°C por 15 min; después se añadieron 50μl de solución stock (1M Tris, 10mM EDTA, pH 8); se realizó una reacción en la cadena de la polimerasa (PCR) para comprobar la presencia de los genes de la PPA (PPβA) y de la proteína tau, así como del gen de la presenilina 1 (PS1PSEN1). La genotipificación se llevó a cabo en 2 reacciones; primero se amplificaron 2 productos de PCR con oligoespecíficos para PPβA y tau, de 500 pb y 350 pb, respectivamente, y se visualizaron en un gel de agarosa al 1%, y en una segunda reacción, se amplificó un producto de PCR de 530 pb y se llevó a cabo una digestión 2 h a 37°C de este producto con la enzima BstEII y que generó 2 fragmentos de 180 pb y 350 pb.
Estudio conductualSe midió la prueba conductual de construcción del nido en 10 ratones hembra WT y 10 transgénicos (3xTg-AD), de 11 meses de edad. La prueba se ejecutó desde el final de la tarde hasta la mañana siguiente (8:00 a.m.) y consistió en colocar un cuadro de algodón prensado de 5cm de lado en la caja habitación, una hora antes del ciclo de luz (7:00 p.m.) o de reposo. Se tomaron imágenes 15min antes de la fase de actividad, en las que se evaluó la construcción del nido y el criterio utilizado fue de solo 3 categorías de las 5 descritas por Deacon20: a) si el algodón permaneció en gran parte intacto (> 90% desmenuzado); b) si la mayoría del algodón fue desmenuzada (< 90%) con o sin nidación identificable (si hay nidación, esta es plana); y c) si el nido estaba hecho casi perfecto: > 90% del algodón desmenuzado, en forma de un cráter y con las paredes superiores a la altura corporal del ratón (acurrucado) en más de un 50% de la circunferencia (fig. 1).
Ejemplos de la construcción del nido por ratones hembra de 11 meses de edad en los 2 grupos estudiados wild type (WT) y transgénicos (3xTg-AD). Se observa que los WT tuvieron mejor calidad en la construcción del nido en relación con los 3xTg-AD. En cada panel, se indica el número de animales que realizaron cada nivel de la prueba.
Seis hembras WT y 6 3xTg-AD, aleatoriamente escogidas de los 20 animales empleados para el estudio conductual, fueron anestesiadas i.p. con una dosis de pentobarbital (300μg/kg de peso corporal) y con perfusión intracardiaca de paraformaldehído al 4% en solución amortiguadora de fosfatos (PBS, pH 7,4, 0,1M) y 1.000 U de heparina y procaína al 0,1%. Los cerebros fueron extraídos del cráneo y posfijados por 24h en paraformaldehído al 4% en PBS a temperatura ambiente. Se realizaron cortes sagitales seriados de 50μm de espesor en un vibrátomo (sistema de seccionado de tejidos modelo 3000; Pelco International). Ambos hemisferios fueron utilizados para los estudios morfológicos y teñidos con la técnica convencional de Klüver-Barrera para visualizar la morfología neuronal y las fibras mielinizadas en la región CA1 del hipocampo, Bregma 1,92–2,28mm lateral21.
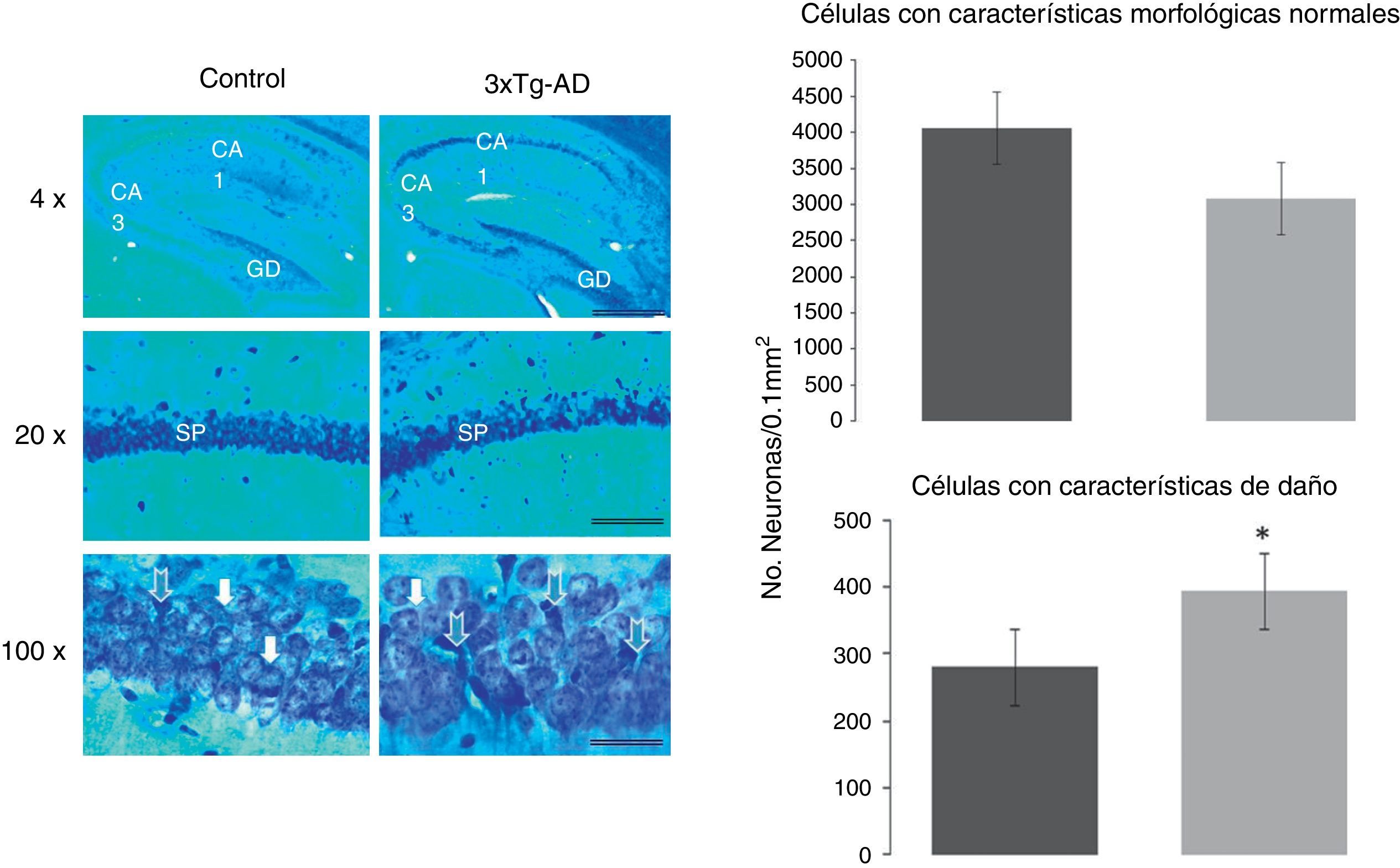
Para el análisis morfométrico se contaron las neuronas del área CA1 del hipocampo en su totalidad, que correspondió a un área de 262,5×125μm, con el empleo de un microscopio óptico NIKON modelo Eclipse 50i equipado con una cámara DS-U2 S. Para la cuantificación tanto de células con características normales como con características de daño neuronal fue empleado el programa Q-Win y se utilizó un sofware ImageJ (NIH, EE. UU.).
Se contaron las neuronas en estas imágenes y se expresaron como número de neuronas por área determinada (μm). Las neuronas fueron cuantificadas de aspecto normal y las identificadas con aspecto de daño (hipercromatismo citoplasmático, encogimiento celular y fragmentación nuclear).
ResultadosAnálisis cualitativo de la conducta de construcción del nidoLas hembras control o WT de 11 meses de edad, 6 de las 10, construyeron el nido según el criterio 3, lo que representó el 60% de la capacidad para construir un nido de buena calidad y solo una hembra lo construyó de pobre calidad (10%); en los animales 3xTg-AD, fueron 5 las que lo construyeron de pobre calidad (etapa 2), lo que representó el 50%, y solo 2 (20%) lo hicieron bien, o sea la etapa 3. En ambos grupos experimentales, 3 hembras no construyeron nido, lo que representa el 30% (fig. 1). De estos 20 animales, se escogieron de manera aleatoria, 12 que fueron los que se consideraron para el estudio morfométrico comparativo del área CA1 del hipocampo dorsal.
Análisis morfológico de las neuronas piramidales de la región CA1 del hipocampoPara determinar la proporción de células normales y con características de daño en la región CA1 del hipocampo, fueron cuantificadas el número de neuronas de ambas características en el grupo experimental (3xTg-AD) y en el grupo WT. Se encontró un mayor número de neuronas con características de daño en el ratón 3xTg-AD. Utilizando ANOVA de una vía se encontró una diferencia significativa (F1,430=56,074, p<0,0001), con un aumento de 26±6% en células anormales en el grupo 3xTg-AD en comparación con el grupo WT, como se muestra en la figura 2.
Cortes sagitales representativos del área CA1 del hipocampo teñido con la técnica de Klüver Barrera de hembras de 11 meses de edad. Las barras en cada figura representan 1.000, 100 y 25μm en fotomicrografías tomadas con los objetivos de 4, 20 y 100X, respectivamente. Las flechas azules indican neuronas con características de daño en el stratum pyramidale (sp) del área CA1 del hipocampo; giro dentado (GD) y del área CA3. Las gráficas muestran un incremento significativo en la densidad de las células anormales en el ratón 3xTg-AD. Las flechas blancas muestran neuronas piramidales normales en ambos grupos. Las gráficas expresan el número de neuronas con aspecto normal (gráfica superior) y neuronas con características de daño (gráfica inferior), calculadas en un área de 0,01 mm2 en ambos grupos de ratones estudiados (WT y 3XTg-AD). Las cifras corresponden al promedio ± EEM. * p<0,0001.
Los resultados indican una relación entre la deficiencia de la conducta natural de construir nido (regulada por el hipocampo) asociada a la alteración neuronal del campo CA1 en el hipocampo dorsal de las hembras 3xTg-AD de 11 meses de edad con la afección desarrollada. Esta relación es importante ya que el proceso de daño y muerte neuronal tiene su origen en esta importante área que regula la memoria de tipo espacial. Asimismo, se podría hacer una analogía de la conducta alterada en el humano para llevar al cabo los eventos de la vida cotidiana al inicio de la enfermedad.
Es interesante que una conducta tan sencilla y natural en los murinos en general pueda dar información tan específica del daño tisular que se inicia en el hipocampo y en el primer relevo que es la corteza subicular, en donde se observa a esta edad el depósito de Aβ en forma de placas y de la tau. Se hizo el ajuste a 3 de los 5 criterios de Deacon20 para la evaluación de la construcción del nido y se encontró que solo 3 animales (30%) en ambos grupos (WT y 3xTg-AD) no construyeron de manera adecuada el nido; sin embargo, la diferencia se encontró en la calidad de construcción, que fue del 60% en los WT, lo que indica que su hipocampo se encuentra sin alteración tisular, ya que es una buena prueba para la evaluación del bienestar animal. Por el contrario, en el animal transgénico, solo el 20% de los animales construyó bien el nido y el 50% lo hizo mal, indicando que existe desconexión y pérdida neuronal asociadas a la aparición de estas proteínas, e incluso la formación de las placas entre el CA1 y el subiculum, y conforme avanza la enfermedad, esta región cerebral es una de las más afectadas22.
En el estudio no encontramos cambios significativos en el número de células normales, lo que coincide con datos reportados en otras afecciones, como la enfermedad de Huntington23. Por el contrario, en el área CA1 del este ratón (3xTg-AD) encontramos que no solo se aumentó la densidad de células anormales, sino, además, observamos diversos estadios degenerativos neuronales como fueron signos claros de picnosis, condensación y acúmulo intracelular de Aβ y tau en esta edad (resultados en proceso). Esas alteraciones se han comunicado también en esta región CA1 del hipocampo post mortem del humano en etapas avanzadas de la EA6,7,24,25. Las características específicas de la EA se asocian a la presencia de PN y MNF, que se encuentran de manera predominante en esta región cerebral23. Además, nuestros resultados son consistentes con lo encontrado en el modelo de ratón transgénico PSAPP, en donde se observó disfunción de neuronas en la región CA1 del hipocampo26 y un 14% de disminución neuronal fue reportado en el modelo APP23, asociado con la presencia de placas neuríticas de Aβ26,27.
Esta disfunción neuronal y la muerte celular desempeñan un papel importante en las etapas tempranas e intermedias de la enfermedad27. El depósito de Aβ intraneuronal es el origen de la cascada de eventos patológicos que dejan la neurodegeneración en la EA, con síntomas clínicos clásicos, como la pérdida de la memoria y los cambios en la personalidad28,29. Se ha reportado que este depósito de Aβ precede a la formación de las marañas neurofibrilares con la pérdida de neuronas hipocampales y corticales que provoca las alteraciones neuropatológicas, que se han descrito en el cerebro de los pacientes con la EA, lo que resulta en una disminución del peso y el volumen cerebral5. Esta pérdida neuronal tiene su origen en la alteración sináptica11 y se correlaciona con la disfunción cognitiva progresiva, lo que se asocia a que el número de neuronas reducido determina la capacidad funcional de estructuras cerebrales como el hipocampo29.
En un estudio realizado por Spires et al., en el 20064, muestran una disminución neuronal en esta área hipocampal en un modelo de ratón para taupatía, lo que ha permitido una correlación del daño neuronal que se inicia intracelularmente y continúa de manera progresiva con estas características específicas de la EA24. Se ha comunicado en otros trabajos que ocurre una pérdida neuronal del 25 al 70% en diferentes áreas del hipocampo por la EA30,31, pero de forma especial en el área CA1 con una disminución neuronal significativa en cerebros de pacientes con esta afección en comparación con cerebros normales21,30–33.
Así, en este modelo de ratón 3xTg AD, hemos encontrado que las hembras con la enfermedad tienen un deterioro en la manifestación conductual de construcción del nido, asociada a la alteración neuronal del hipocampo, estructura que regula la memoria de tipo espacial y que es, además, una conducta natural, comparado con el animal WT que no presenta esta alteración. Además, hay una relación con la formación intracelular de Aβ y tau anormal en el hipocampo dorsal que se encuentra desde los 7 meses de edad en este modelo. Será necesario diseñar experimentos en donde se pueda prevenir el depósito de estas proteínas en el hipocampo, entre otras medidas, con el empleo de antioxidantes o de estrógenos que protejan a las hembras de la pérdida de neuronas en esta área cerebral.
FinanciaciónEste trabajo fue financiado parcialmente por el CONACYT (Beca No. 295523; proyecto No. CB-2012/178841) y la UNAM-DGAPA (IN201613).
Conflicto de interesesLos autores declaran que no existe ningún conflicto de interés.
Los autores desean agradecer a la Unidad de Proteogenómica del INB y a los técnicos académicos A. Aguilar Vázquez y M. Servín García por su ayuda con el cuidado de los animales.