La cirugía estereotáxica permite el implante de electrodos o cánulas para estudiar el funcionamiento de diversas estructuras cerebrales a nivel preclínico. El hipocampo ha sido ampliamente estudiado con esta metodología, debido a su participación en desórdenes neurológicos, cognitivos, emocionales y afectivos. Sin embargo, el efecto per se de esta metodología sobre la coordinación y la actividad motora, para identificar o descartar alteraciones neurológicas que pudieran influir en los resultados de protocolos que la utilizan, requiere ser explorado.
MétodosSe evaluó el efecto de la cirugía estereotáxica y el implante de cánula en el hipocampo de ratas hembra Wistar en las pruebas de actividad locomotora, nado y Rota-rod. El análisis estadístico consideró la fase del ciclo estral de las ratas.
ResultadosNinguna de las variables evaluadas en las pruebas de actividad locomotora (cuadros cruzados, tiempo de acicalamiento y conducta vertical), nado (giros, nado lateral, latencia a la primera inmovilidad y tiempo de inmovilidad) o Rota-rod (latencia a la caída), fueron modificadas por la manipulación quirúrgica, en relación con ratas intactas. Independientemente de la manipulación quirúrgica, las ratas en metaestro-diestro cruzaron más cuadros y tuvieron mayor tiempo de inmovilidad, que las ratas en proestro-estro.
ConclusiónLa cirugía estereotáxica y el implante de cánula en el hipocampo dorsal carecen de efectos sobre la coordinación y la actividad locomotora de la rata, por lo que se descarta algún daño neurológico que pudiera interferir en la interpretación de resultados en protocolos que incluyen esta manipulación experimental.
Stereotactic surgery is used to place electrodes or cannulas in the brain in order to study the function of several brain structures in preclinical research. The hippocampus has been extensively studied with this methodology due to its involvement in a wide range of neurological, cognitive, emotional, and affective disorders. However, the effects of stereotactic surgery on coordination and motor activity should be evaluated in order to determine whether this surgical procedure causes any neurological alterations that may bias the results of studies incorporating this technique.
MethodsWe evaluated the effects of stereotactic surgery and implantation of a cannula into the hippocampus of female Wistar rats on the motor activity, forced swim, and rotarod tests. The stage of the oestrous cycle was included in the statistical analysis.
ResultsStereotactic surgery had no impact on any of the motor activity variables assessed in the open field (squares crossed, time spent in grooming, and rearing), forced swim (turning behaviour, lateral swimming, latency to first immobility, and time spent immobile), and rotarod (latency to fall) tests, compared with intact rats. Regardless of surgical manipulation, rats in the metestrus and diestrus stages crossed a greater number of squares and displayed longer immobility times than those in the proestrus and estrus stages.
ConclusionStereotactic surgery for cannula placement in the dorsal hippocampus does not affect coordination and motor activity in rats. We can therefore conclude that this procedure has no neurological complications that may interfere in the interpretation of results of studies applying this technique.
La cirugía estereotáxica es una técnica que permite la localización de estructuras cerebrales para implantar electrodos o cánulas con la finalidad de explorar la función cerebral1. Estos procedimientos han permitido identificar circuitos neuroanatómicos y neuroquímicos involucrados en el funcionamiento del cerebro, así como en alteraciones neurológicas (epilepsia, trastornos del movimiento y enfermedades neurodegenerativas)2-5, problemas de aprendizaje y memoria6,7, alteraciones emocionales8,9 y afectivas10. Además, han permitido explorar el potencial efecto terapéutico y los mecanismos de acción de sustancias susceptibles de ser utilizadas en el ser humano para el tratamiento de los padecimientos antes mencionados9,11-14.
En este sentido, el hipocampo es una de las estructuras cerebrales ampliamente estudiadas por estar involucrada en la neurobiología de diversos desórdenes neurológicos, cognitivos, emocionales y afectivos. Mediante el implante de cánulas en el hipocampo se han microinyectado sustancias como el ácido kaínico o la pilocarpina3,4 para reproducir experimentalmente estados semejantes a la epilepsia del lóbulo temporal, lo cual se acompaña de la reducción del número de neuronas en el área CA1 del hipocampo15. Bajo estas condiciones experimentales, después del estatus epiléptico, hay un déficit en los procesos de aprendizaje y memoria16,17, los cuales pueden ser minimizados al administrar fármacos anticonvulsivantes14.
Por otro lado, se ha explorado la participación del hipocampo en problemas neurológicos asociados al consumo de algunos alimentos. La microinyección intrahipocampal de metilazoximetanol, un neurotóxico presente en las semillas de cícadas (Dioon spinulosum)2, o de linamarina, un neurotóxico contenido en la yuca (Manihot esculenta Crantz)18, promueve incoordinación motora y reducción del número de neuronas en el área CA1 del hipocampo de la rata18. Estas alteraciones al parecer reproducen experimentalmente parte del cuadro neurológico asociado al consumo de semillas de cícada o de yuca, como ocurre en la esclerosis lateral amiotrófica-demencia parkinsonismo, la neuropatía atáxica tropical y el konzo, en el ser humano19-21.
Cabe señalar que los efectos de la microinyección intrahipocampal de sustancias neurotóxicas o potencialmente benéficas como tratamiento de algunos padecimientos neurológicos o psiquiátricos en el ser humano son evaluados en modelos experimentales que involucran la actividad motora de los animales2,11,14,15. Sin embargo, en la mayoría de estos estudios no se ha evaluado el efecto per se de la cirugía estereotáxica sobre la locomoción en pruebas específicas. Por lo tanto, el objetivo del presente estudio fue evaluar el efecto de esta manipulación experimental, sobre la actividad y la coordinación locomotora de la rata hembra, con la finalidad de identificar o descartar alguna alteración neurológica que pudiera interferir en la interpretación de resultados en protocolos que incluyan esta manipulación experimental.
MétodosSujetosSe incluyeron a 56 ratas hembras Wistar de 3 meses de edad, con un peso entre 250-300g al inicio de los experimentos. Se alojaron en cajas de acrílico (4-5 ratas) en un bioterio de estancia con temperatura ambiente (25±1°C) y ciclo de luz oscuridad de 12/12 h (la luz se encendió a las 7:00 am). El acceso al agua y alimento fue ad libitum. Todas las manipulaciones experimentales se realizaron de acuerdo con los estándares éticos internacionales y nacionales basados en la Guide for care and use of laboratory animals22 y las Especificaciones técnicas para la producción, cuidado y uso de animales de laboratorio23, respectivamente.
Frotis vaginalAntes de iniciar las pruebas conductuales, se obtuvieron diariamente frotis vaginales de cada rata. Solo las hembras con 3 ciclos regulares continuos (4-5 días) fueron incluidas en el estudio. Para confirmar la fase del ciclo estral, al terminar las pruebas conductuales, a cada rata se le tomó un frotis vaginal mediante un pequeño hisopo húmedo con solución salina para obtener un exudado vaginal. El frotis fue examinado al microscopio de luz (objetivo 40×). De acuerdo con la citología vaginal de la rata24, se formaron 2 subgrupos correspondientes a las fases de proestro-estro caracterizadas por altos niveles de hormonas ováricas, y metaestro-diestro donde hay bajos niveles de hormonas ováricas25.
Grupos experimentalesEn un primer experimento, se formaron aleatoriamente 2 grupos de ratas: un grupo intacto (n = 14), que estuvo libre de cualquier manipulación quirúrgica, y un grupo (n=14) con cirugía estereotáxica en el hipocampo dorsal y microinyección de un vehículo utilizado en diversos protocolos experimentales (0,3μL, solución de ciclodextrina al 35%). Las ratas de ambos grupos fueron evaluadas en las pruebas de actividad locomotora y nado. En un segundo experimento, se incluyeron otros 2 grupos: intacto (n = 14) y cirugía estereotáxica más microinyección (n = 14), los cuales fueron evaluados en la prueba de Rota-rod.
Al finalizar las pruebas conductuales, a cada una de las ratas se les realizó un frotis vaginal para identificar la fase del ciclo estral en la cual se encontraban, con la finalidad de integrar los resultados en 2 subgrupos de acuerdo con un alto (proestro-estro) o bajo (metaestro-diestro) contenido de hormonas ováricas y evitar alguna interferencia en el análisis de los resultados, debido a esta condición hormonal.
Cirugía estereotáxicaLas ratas fueron anestesiadas26 con pentobarbital sódico (50mg/kg i.p. Anestesal®, Laboratorios Pfizer, Ciudad de México, México), previa administración de 0,05mg/kg (i.p.) de sulfato de atropina (Sigma-Aldrich Co., St. Louis MO, EE. UU.). Una vez que la rata se encontraba bajo anestesia profunda, se fijó su cabeza en un aparato estereotáxico (Stoelting, Wood Dale, Illinois, EE. UU.). Se descubrió el cráneo y de acuerdo con las coordenadas estereotáxicas del atlas de Paxinos y Watson (1998)1 se realizó un trépano en el cráneo con un taladro dental (Saeshin Dental Lab 35000 RPM, Korea del Sur) y se implantó la cánula para la microinyección en el hipocampo dorsal (Ap=–3,8mm y L = –2mm, respecto a la Sutura Bregma; H = –2mm de profundidad, respecto a la corteza cerebral). La cánula de acero inoxidable (8mm de longitud, 0,7mm de diámetro) fue fijada al cráneo con acrílico dental (Arias Distribuidora Dental, Tlalnepantla, México). Al finalizar la cirugía, se colocó lidocaína (Laboratorios PISA, México D.F., México) local alrededor del área del implante. Los 3 primeros días posquirúrgicos se administró un analgésico por vía intraperitoneal (Dipirona 50, Virbac Salud Animal, Guadalajara, Jalisco, México) para minimizar el dolor. Trascurrieron 4 días de recuperación antes de evaluar el efecto de la manipulación experimental en las pruebas conductuales.
MicroinyecciónEl vehículo fue microinyectado mediante la cánula de acero inoxidable (10mm de longitud, 0,7mm de Ø), conectada a una jeringa Hamilton de 10μL mediante un tubo de polietileno. A través de una bomba de microinfusión automatizada (KD Scientific, Holliston, Massachusetts, EE. UU.) se inyectaron 0,3μL del vehículo (velocidad: 0,06μL/min), durante 5min; bajo este procedimiento la rata estuvo en libre movimiento. Al concluir la microinyección se esperaron 5min más para evitar que el vehículo regresara por capilaridad. Pasado este tiempo, las ratas fueron evaluadas en las pruebas conductuales.
Actividad locomotoraLa rata fue colocada durante 5min en una caja de acrílico (44×33cm de base por 20cm altura) cuya base está dividida en cuadros de 11×11cm. Se evaluaron: a) número de cuadros cruzados, que fue cuando la rata pasó al menos 3 cuartas partes de su cuerpo de un cuadro a otro; b) tiempo en segundos empleado en la conducta vertical, es la suma de los periodos en los que la rata adquirió una postura vertical respecto al piso, apoyada en sus extremidades posteriores, y c) el tiempo en segundos empleado en el acicalamiento es la suma de tiempo en los que la rata se autoacicaló, lo cual incluyó la realización de movimientos elípticos con las extremidades anteriores sobre la narina, las orejas, el cuerpo y el área genital, en una dirección céfalo-caudal27.
Prueba de nadoLa rata fue colocada durante 5min en un estanque de vidrio (26×29cm de base por 50cm de altura) con agua a una temperatura de 25°C (± 1) y un nivel de 30cm. En esta prueba se evaluaron: a) latencia a la primera inmovilidad, es el tiempo en segundos trascurrido desde que se colocó a la rata en el estanque hasta que se presentó la primera inmovilidad; b) tiempo total de inmovilidad, es la suma de los periodos en los que la rata permaneció inmóvil. La inmovilidad se define como aquellos episodios en los que la rata realizó mínimos movimientos para mantenerse a flote, sin desplazamiento; c) tiempo en segundos empleado en el nado lateral, es la suma de los periodos en los que la rata nada incoordinadamente sobre uno de sus costados, y d) número de giros, es la suma de las veces que la rata nadó girando sobre su propio eje2,28.
Todas las sesiones de prueba fueron videograbadas. La cuantificación de las variables fue realizada por 2 observadores independientes mediante un software diseñado ex profeso para el registro conductual.
Rota-rodDurante 4 sesiones, una diaria, la rata fue entrenada en el Rota-rod (LE 8300, LSI Letica, Panlab Scientic Instruments, Barcelona, España) a una aceleración de 4 a 20rpm en 5min. Al finalizar este periodo de entrenamiento se realizó la cirugía estereotáxica en el grupo correspondiente. Cuatro días después las ratas fueron colocadas en el Rota-rod, a una velocidad creciente de 4 a 20rpm, durante 5 ensayos con un tiempo de corte de 3min cada uno. La variable evaluada fue la latencia a la caída, es decir, el tiempo que transcurrió desde que la rata fue colocada en el eje rotatorio del Rota-rod hasta que cayó de él. Esta variable permite identificar alteraciones en la coordinación motora y el equilibrio29.
Verificación del sitio de implante de cánula y microinyecciónAl finalizar la prueba conductual y después de haber tomado el frotis vaginal todos los animales fueron eutanizados por sobredosis de pentobarbital (PISA-Agropecuaria, Guadalajara, México). Mediante la cánula implantada se marcó el sitio de microinyección con azul de Evans (Sigma-Aldrich Co. St. Missouri, MO, EE. UU.) y las ratas fueron perfundidas para fijar el cerebro, extraerlo y realizar cortes para verificar el sitio del implante mediante microscopio de luz, tomando como referencia el atlas estereotáxico de Paxinos y Watson (1998)1. Solo las ratas en las que se identificó el correcto implante de las cánulas en el hipocampo dorsal (CA1) fueron incluidas en el análisis estadístico.
Análisis estadísticoLos datos fueron analizados mediante ANOVA de 2 vías para grupos independientes tomando como factores la condición (intactas o con cirugía estereotáxica) y la fase de ciclo estral de las ratas (proestro-estro y metaestro-diestro). Cuando se alcanzó el criterio de significación de p ≤ 0,05 se aplicó la prueba post hoc de Student Newman Keuls. Los resultados son presentados como la media±el error estándar.
ResultadosFase del ciclo estralCon el análisis del frotis vaginal se confirmaron 7 ratas en proestro-estro y 7 en metaestro-diestro en cada una de las condiciones experimentales de las 2 series experimentales.
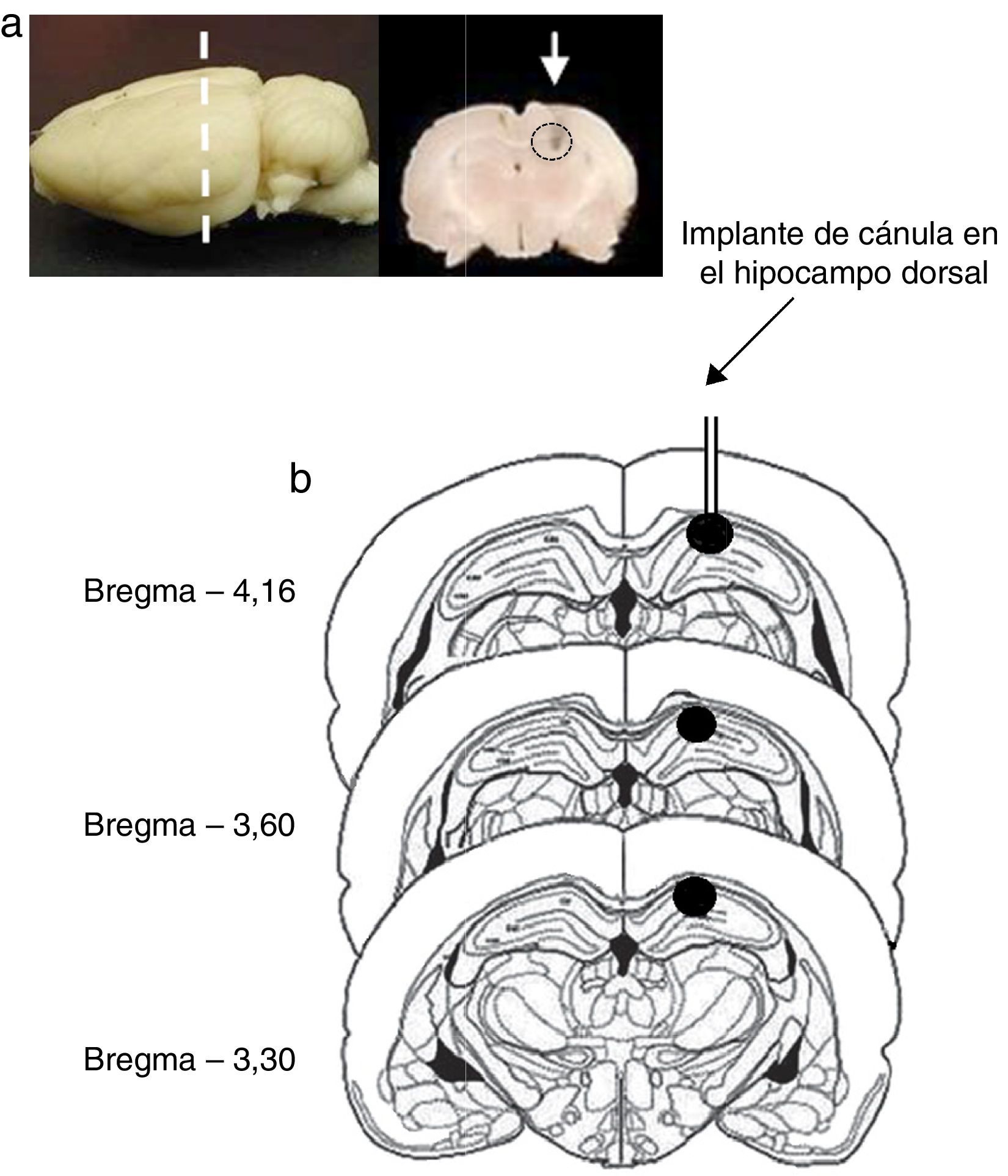
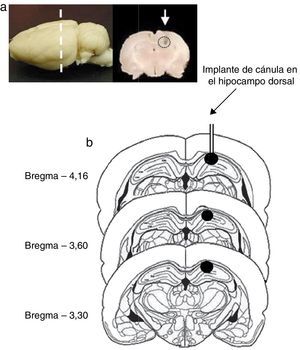
Sitio de implante de cánulaDel total de ratas incluidas en el estudio, 2 de ellas fueron eliminadas del análisis estadístico, una rata del grupo proestro-estro (experimento 1) y otra del grupo metaestro-diestro (experimento 2), debido a que el análisis histológico reveló una zona de edema alrededor del implante, la cual se extendió desde el hipocampo dorsal hasta la corteza cerebral. En el resto de las ratas, la inspección histológica confirmó que el implante de la cánula fue realizado en el área dorsal del hipocampo (CA1) entre las coordenadas Ap = –3,30 y –4,6mm respecto a la sutura Bregma (fig. 1).
a) Se ilustra un cerebro de rata donde se muestra a qué nivel anteroposterior se realizó el implante de cánula (línea punteada) y una sección coronal del cerebro con la marca donde fue localizada la punta de la cánula inyectora (flecha blanca). b) Esquema representativo de cortes coronales del cerebro de rata que ilustra (círculo negro) el sitio del implante de la cánula en el hipocampo dorsal (CA1). Construido a partir del atlas estereotáxico de Paxinos y Watson (1998).
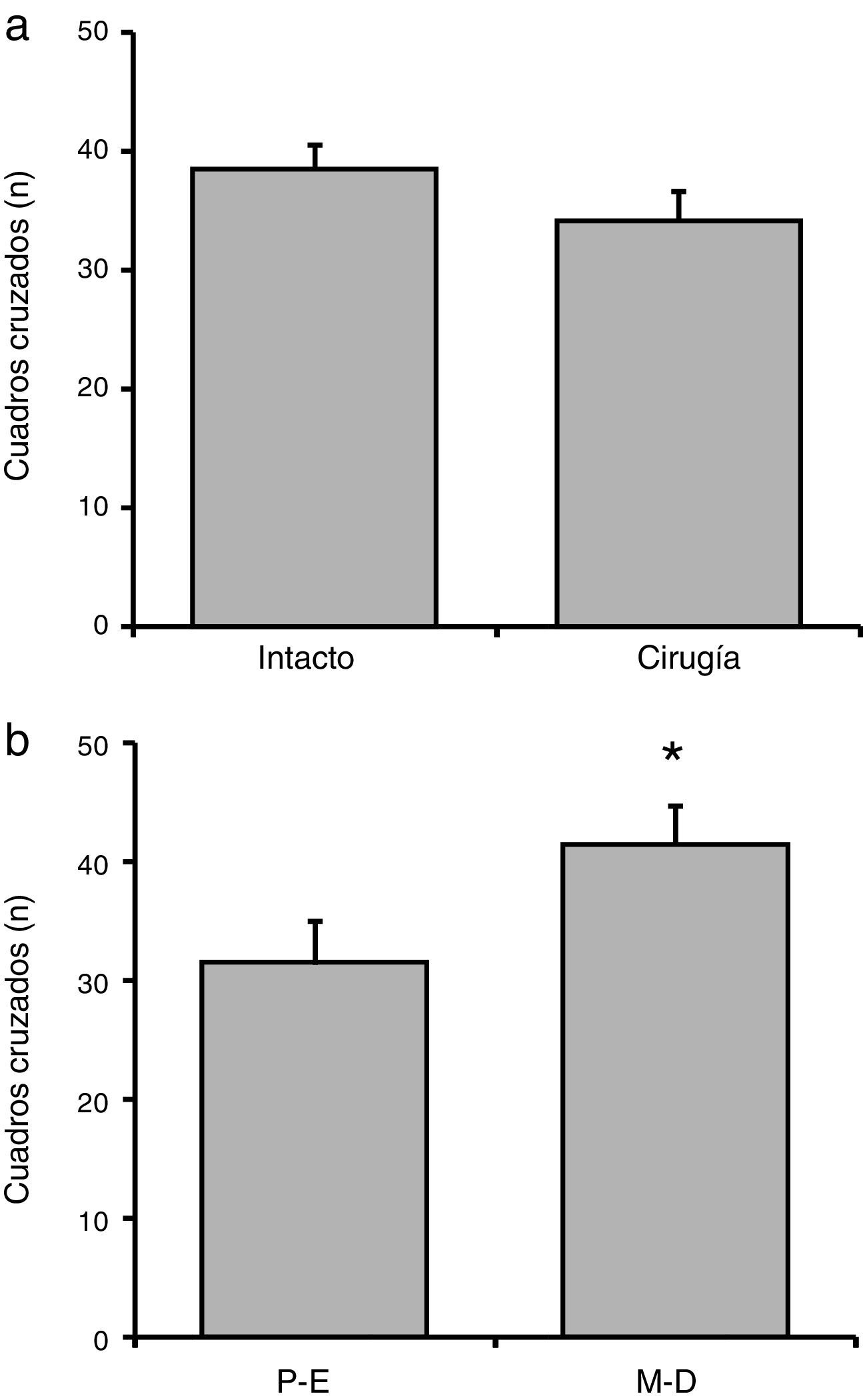
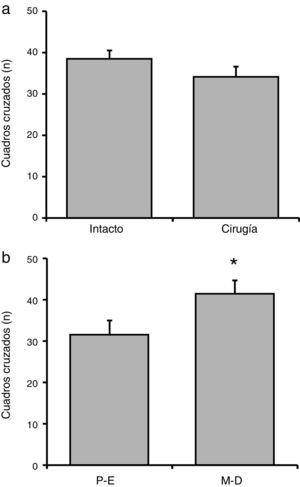
El análisis del número de cuadros cruzados no reveló diferencias significativas (F[1,23] = 1,38; p = 0,25) de acuerdo con la manipulación experimental (fig. 2 a). En tanto que el análisis considerando la fase del ciclo estral reveló diferencias significativas (F[1,23] = 6,58; p < 0,02). La prueba post hoc mostró que las ratas en metaestro-diestro cruzaron un mayor número de cuadros, en relación con las ratas en proestro-estro (fig. 2 b). La interacción de factores no reveló diferencias significativas (F[1,23] = 1,42; p = 0,25]: proestro-estro intacto (n=7): 33,28±2,19; proestro-estro cirugía (n=6): 33,34±3,07; metaestro-diestro intacto (n=7): 43,71±2,23; metaestro-diestro cirugía (n=7): 37,14±3,62.
Número de cuadros cruzados en la prueba de actividad locomotora. a) La manipulación quirúrgica no produjo cambios significativos en esta variable, respecto al grupo de ratas intactas. b) En el grupo metaestro-diestro (M-D) se encontró un mayor número de cuadros cruzados, respecto al grupo proestro-estro (P-E).
* p<0,05 vs. P-E.
El análisis del tiempo empleado en el acicalamiento no reveló diferencias significativas (F[1,23] = 0,63; p = 0,43) de acuerdo con la manipulación experimental (intacto: 40,06±1,47 s, cirugía: 41,51±1,23 s), ni a la fase del ciclo estral (F[1,23] = 2,89; p = 0,10): proestro-estro, 39,23±1,37 s y metaestro-diestro: 42,34±1,24 s. Del mismo modo, la interacción de factores no reveló diferencias significativas (F[1,23]=1,42; p = 0,25): proestro-estro intacto (n=7): 37,17±2,09 s; proestro-estro cirugía (n=6): 41,29±1,35 s; metaestro-diestro intacto (n=7): 42,94±1,51 s; metaestro-diestro cirugía (n=7): 42,74±2,06 s.
Conducta verticalEl análisis del tiempo empleado en la conducta vertical no reveló diferencias significativas (F[1,23] = 1,43; p = 0,24) de acuerdo con la manipulación experimental (intacto: 65,66±1,79 s, cirugía: 68,47±1,49 s), ni a la fase del ciclo estral (F[1,23] = 2,18; p = 0,15): proestro-estro, 65,33±2,07 s y metaestro-diestro, 68,79±1,14 s. La interacción de factores tampoco reveló diferencias significativas (F[1,23] = 0,14; p = 0,70): proestro-estro intacto (n=7): 63,47±3,03 s; proestro-estro cirugía (n=6): 67,17±2,83 s; metaestro-diestro intacto (n=7): 67,84±1,79 s, y metaestro-diestro cirugía (n=7): 69,75±1,43 s.
Prueba de nadoTiempo de nado lateral y número de girosNinguno de los animales intactos o con implante de cánula, desplegó el nado lateral ni la conducta de giro durante la sesión de prueba; todos nadaron de la forma habitual en esta prueba.
Latencia a la primera inmovilidadEl análisis de la latencia a la primera inmovilidad no reveló diferencias significativas (F[1,23] = 0,04; p = 0,83] de acuerdo con la manipulación experimental (intacto: 26,84±2,25 s, cirugía: 27,53±2,42 s), ni a la fase del ciclo estral (F[1,23] = 2,07; p = 0,16]: proestro-estro, 29,54±1,84 s y metaestro-diestro, 24,84±2,52 s. La interacción de factores tampoco reveló diferencias significativas (F[1,23] = 0,39; p = 0,53]: proestro-estro intacto (n=7): 30,22±2,68 s; proestro-estro cirugía (n=6): 28,86±2,73 s; metaestro-diestro intacto (n=7): 23,47±3,32 s; metaestro-diestro cirugía (n=7): 26,21±3,96 s.
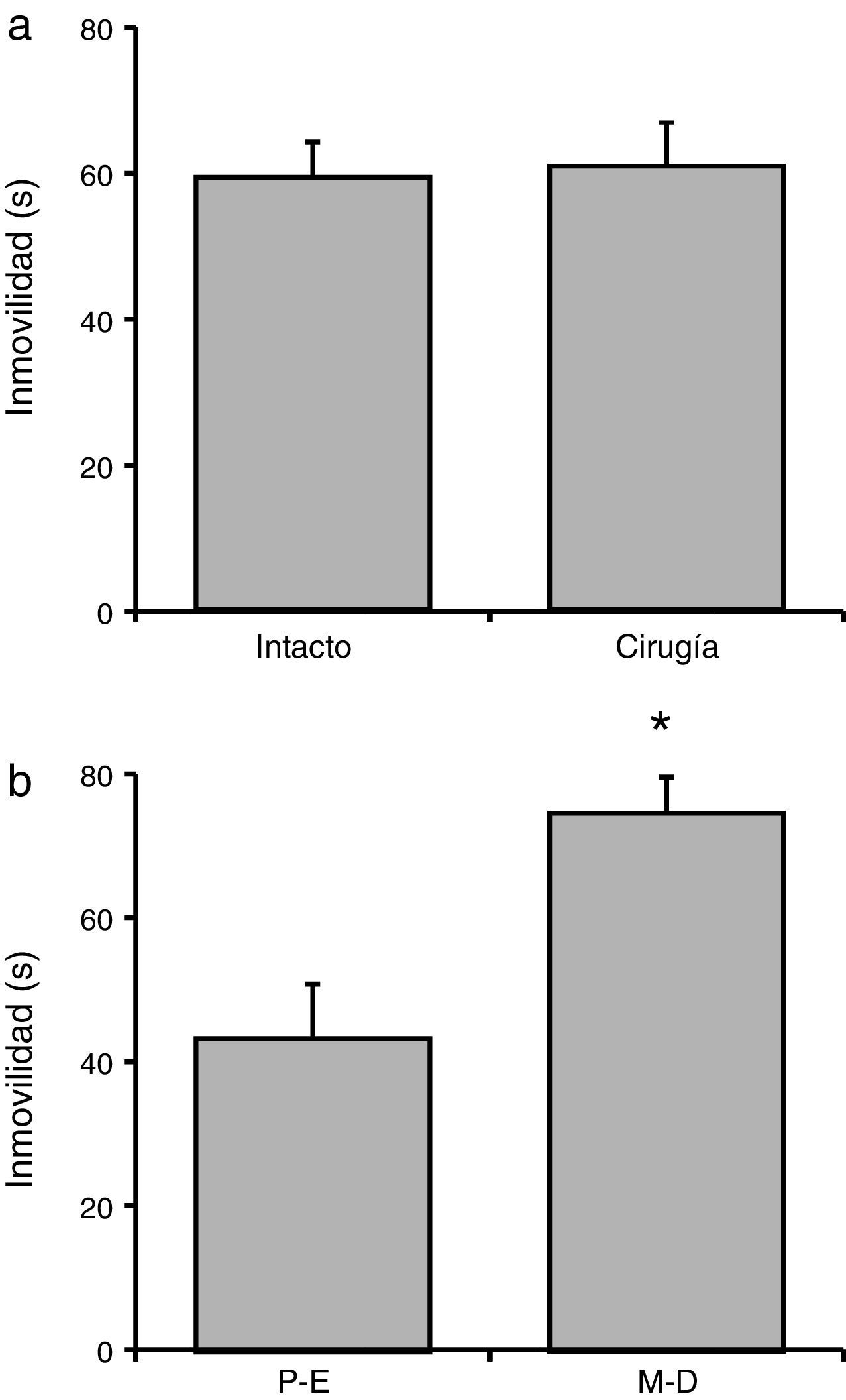
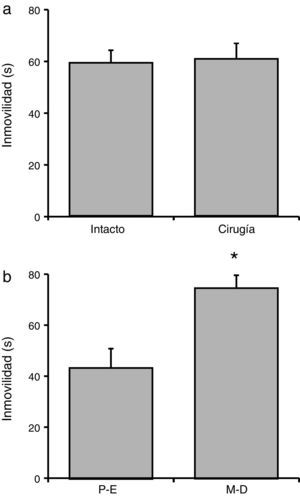
Tiempo total de inmovilidadEl análisis del tiempo total de inmovilidad no reveló diferencias significativas (F[1,23] = 21,06; p = 0,62] de acuerdo con la manipulación experimental (fig. 3a). En tanto que el análisis de acuerdo con la fase del ciclo estral reveló diferencias significativas (F[1,23] = 90,95; p < 0,001]. La prueba post hoc indicó que las ratas en proestro-estro tuvieron un menor tiempo de inmovilidad en relación con las ratas en metaestro-diestro, quienes tuvieron el mayor tiempo de inmovilidad (fig. 3b). No obstante, la interacción de factores no mostró diferencias significativas (F[1,23] = 77,21; p = 0,35): proestro-estro intacto (n=7): 44.00±6.61 s; proestro-estro cirugía (n=6): 42.38±7.75 s; metaestro-diestro intacto (n=7): 74,91±9,07 s; metaestro-diestro cirugía (n=7): 80,07±10,68 s.
Tiempo total de inmovilidad en la prueba de nado. a) La manipulación quirúrgica no produjo cambios significativos en esta variable, respecto al grupo de ratas intactas. b) En el grupo metaestro-diestro (M-D) se encontró un mayor tiempo de inmovilidad, respecto al grupo proestro-estro (P-E).
* p<0,05 vs. P-E.
El análisis de la latencia a la caída no reveló diferencias significativas (F[1,23] = 0,03; p = 0,85) de acuerdo con la manipulación experimental (intacto: 151,47±5,36 s, cirugía: 149,92±6,64 s), ni a la fase del ciclo estral (F[1,23] = 3,40; p = 0,07): proestro-estro, 142,10±2,94 s y metaestro-diestro, 158,29±7,11 s. La interacción de factores tampoco mostró diferencias significativas (F[1,23] = 0,14; p = 0,70): proestro-estro intacto (n=7): 142,32±3,78 s; proestro-estro cirugía (n=7): 143,10±4,96 s; metaestro-diestro intacto (n=7): 160,62±9,08 s; metaestro-diestro cirugía (n=6): 155,29±11,61 s.
DiscusiónEn el presente estudio la cirugía estereotáxica y el implante de cánula más la microinyección de un vehículo en el área CA1 del hipocampo no produjeron efectos negativos sobre la actividad y la coordinación locomotora. Independientemente de la manipulación experimental, se pudieron identificar los patrones conductuales de la rata Wistar propios de cada fase del ciclo estral.
La prueba de actividad locomotora es utilizada frecuentemente para cuantificar variables de desplazamiento, exploración y estado emocional de la rata, bajo diversas condiciones experimentales30,31. En el presente estudio el uso de esta prueba permitió verificar que la cirugía estereotáxica y el implante de cánula, que atraviesa la corteza motora, más la microinyección de un vehículo en el hipocampo dorsal no producen hipoactividad o hiperactividad motora (aumento o disminución del número de cuadros cruzados), ni cambios en la exploración (tiempo empleado en la conducta vertical), ni en la motivación (tiempo dedicado al acicalamiento), por lo que se descarta algún daño neurológico producido por la manipulación quirúrgica o la microinyección. En este sentido, se ha reportado que la lesión del hipocampo dorsal, mediante la administración de neurotóxicos, produce hiperactividad motora11,18, tal como ocurre en el ser humano cuando desarrolla enfermedades neurológicas al consumir grandes cantidades de yuca o semillas de cícadas5,20,21,32. Por lo tanto, los datos del presente estudio sugieren que la cirugía estereotáxica y el implante de cánula más la microinyección no provocan algún daño cerebral que pudiera repercutir en la actividad locomotora de la rata. Cabe señalar que los cambios en la actividad motora aquí descritos solo estuvieron asociados con la fase del ciclo estral, pero no con la manipulación quirúrgica. Las ratas en metaestro-diestro tuvieron un mayor número de cuadros cruzados con respecto a las ratas en proestro-estro. Este incremento en la actividad motora podría estar relacionado con los mayores indicadores de ansiedad que se presentan durante el metaestro-diestro, una fase del ciclo estral caracterizada por la reducción de la concentración de hormonas ováricas, como ha sido reportado en estudios previos25,33.
Por su parte, el acicalamiento es considerado como un indicador del estado motivacional y emocional de la rata. El tiempo empleado en el acicalamiento aumenta en ratas sometidas a estrés leve34,35, mientras que disminuye bajo condiciones de estrés severo36,37, en relación con animales intactos. En este estudio se encontró que el acicalamiento no fue modificado por la manipulación quirúrgica, por lo que se descarta algún efecto de la cirugía estereotáxica y el implante de cánula en el hipocampo dorsal sobre la emocionalidad y la motivación de la rata. Del mismo modo, en este estudio no se encontraron cambios en el tiempo empleado en la conducta vertical asociados a la manipulación quirúrgica o a la fase del ciclo estral. La conducta vertical es considerada como un indicador de exploración38,39, que implica un alto grado de coordinación motora. Esta conducta se incrementa en ratas con daño neuronal en el hipocampo dorsal, al parecer asociado a un estado de hiperactividad e incoordinación motora en la rata18. Estos cambios conductuales no se presentaron bajo las condiciones experimentales del presente estudio, por lo que se descarta algún daño cerebral asociado a la manipulación experimental aquí descrita.
Las ratas con daño neurológico asociado al consumo de algunos alimentos que contienen neurotóxicos18,19 o cuando tienen lesión vestibular40, despliegan la conducta de giro y el nado lateral, debido a alteraciones en la coordinación locomotriz. En el presente estudio ninguna de las ratas (intactas o con la manipulación quirúrgica) desplegaron este tipo de nado, descartándose algún daño neurológico. En la latencia a la primera inmovilidad y en el tiempo total de inmovilidad en la prueba de nado no se encontraron diferencias entre el grupo con cirugía estrereotáxica e implante de cánula y el grupo intacto. Las diferencias que se encontraron en el tiempo total de inmovilidad estuvieron relacionadas solo con la fase del ciclo estral. Las ratas en metaestro-diestro tuvieron un mayor tiempo de inmovilidad en relación con las ratas en la fase de proestro-estro. Estos datos son consistentes con la literatura puesto que las ratas en metaestro-diestro son más vulnerables al efecto del estrés, por lo que en la prueba de nado despliegan un mayor tiempo de inmovilidad, mientras que las ratas en proestro-estro, donde hay altas concentraciones de hormonas ováricas, despliegan un reducido tiempo de inmovilidad; como ocurre cuando se administran hormonas como progesterona o alopregnanolona41,42.
En el Rota-rod se evalúa la coordinación motora y el equilibrio de la rata43. Un animal intacto (sano) permanecerá más tiempo sobre el aparato debido a que mantiene la coordinación y el equilibrio en sus extremidades44; en tanto que un animal con algún daño neurológico o tratado con neurotóxicos o con fármacos sedantes tendrá una corta latencia a la caída del Rota-rod45,46. En el presente estudio, las ratas con cirugía estereotáxica e implante de cánula en el hipocampo dorsal no tuvieron diferencias en la latencia a la caída del Rota-rod en relación con las ratas intactas. Tampoco se detectaron diferencias asociadas con la fase del ciclo estral. Bajo estas observaciones no se produjeron alteraciones neurológicas causadas por la manipulación experimental que pudieran afectar la motricidad y la coordinación motora de la rata.
Finalmente, los resultados obtenidos bajo estas condiciones experimentales señalan que la cirugía estereotáxica y el implante de cánula en el hipocampo dorsal no producen alteraciones de la coordinación o la actividad locomotriz de la rata, descartando daños neurológicos que interfieran en la interpretación de resultados en protocolos que incluyen esta manipulación experimental.
FinanciaciónPrograma de Fortalecimiento Académico del Posgrado de Alta Calidad, claves I010/458/2013, C-703/2013 y I010/152/2014, C-133/2014.
Conflicto de interesesLos autores declaran no tener conflicto de intereses
Al Consejo Nacional de Ciencia y Tecnología (CONACyT), por otorgar becas para estudios de Posgrado en Neuroetología; al primer, tercer y cuarto autor, registros 272294, 297410 y 297560, respectivamente.