Los agonistas dopaminérgicos no ergóticos (AD) son tratamientos útiles en la enfermedad de Parkinson (EP). Revisamos la farmacología, el grado de evidencia en cuanto a eficacia y tolerabilidad de pramipexol, ropinirol y rotigotina, y proponemos algunas recomendaciones para su uso en la práctica clínica.
DesarrolloEn el momento actual se dispone de formas de liberación prolongada (LP) de pramipexol y ropinirol y de administración transdérmica de rotigotina, que contribuyen a una mayor estabilidad plasmática de los valores del fármaco. En la EP inicial los 3 fármacos mejoran de forma significativa las escalas de incapacidad de los pacientes, retrasan la aparición de discinesias y permiten retrasar la introducción de levodopa. En la EP avanzada reducen el tiempo off, mejoran la Unified Parkinson's Disease Rating Scale (UPDRS) en on y en off y permiten reducir la dosis total de levodopa. Además, los 3 han sido capaces de inducir una mejora significativa en las escalas de la calidad de vida relacionada con la salud. Las fórmulas de LP han demostrado la no inferioridad frente a las de liberación inmediata, e incluso una mejor tolerabilidad (ropinirol). A pesar de su buen perfil de seguridad, entre los efectos adversos graves cabe destacar el trastorno de control de impulsos, cuya aparición puede ser precoz, y los accesos de sueño (sleep attacks). Aunque la terapia combinada no ha sido estudiada específicamente, algunas asociaciones (como la de apomorfina y otros AD) pueden ser beneficiosas. El cambio de un AD a otro es factible de un día para otro, aunque en los primeros días puede haber una sumación de efectos adversos dopaminérgicos que debe tenerse en cuenta. La suspensión brusca del tratamiento con AD puede inducir un síndrome de deprivación dopaminérgica. La retirada de cualquier AD, en particular pramipexol, se ha asociado a aparición de apatía que puede ser grave.
ConclusionesLos nuevos AD no ergóticos constituyen una opción válida de tratamiento de la EP tanto inicial como avanzada. A pesar de su buen perfil de tolerabilidad, no están exentos de efectos adversos graves, que pueden tener un efecto patoplástico en la EP y que deben monitorizarse.
Non-ergoline dopamine agonists (DA) are effective treatments for Parkinson's disease (PD). This review presents the pharmacology, evidence of efficacy and safety profile of pramipexole, ropinirole, and rotigotine, and practical recommendations are given regarding their use in clinical practice.
ResultsExtended-release formulations of pramipexole and ropinirole and transdermal continuous delivery rotigotine patches are currently available; these may contribute to stabilising of plasma levels.
In early PD, the three drugs significantly improve disability scales, delay time to dyskinesia and allow a later introduction of levodopa. In late PD they reduced total 'off'-time, improved Unified Parkinson's Disease Rating Scale (UPDRS) in both 'on' and 'off' state and allowed a reduction in total levodopa dosage. A significant improvement in quality of life scales has also been demonstrated. Extended-release formulations have proved to be non-inferior to the immediate release formulations and are better tolerated (ropinirole). Despite a generally good safety profile, serious adverse events, such as impulse control disorder and sleep attacks, need to be routinely monitored. Although combination therapy has not been addressed in scientific literature, certain combinations, such as apomorphine and another DA, may be helpful. Switching from one DA to another is feasible and safe, although in the first days an overlap of dopaminergic side effects may occur. When treatment with DA is stopped abruptly, dopamine withdrawal syndrome may present. Suspending any DA, especially pramipexole, has been linked to onset of apathy, which may be severe.
ConclusionsNew non-ergotine DAs are a valuable option for the treatment of both early and late PD. Despite their good safety profile, serious adverse effects may appear; these effects may have a pathoplastic effect on the course of PD and need to be monitored.
La levodopa continúa siendo el fármaco más eficaz para el tratamiento sintomático de la enfermedad de Parkinson (EP), sin embargo, su relación con la aparición de complicaciones motoras (fluctuaciones y discinesias) limita parcialmente su uso, en particular en pacientes menores de 70 años y con síntomas leves de la enfermedad. Los agonistas dopaminérgicos (AD) ofrecen una alternativa eficaz y segura a levodopa en sujetos jóvenes y su utilización se asocia a una menor incidencia de complicaciones motoras a 5 años. Son útiles tanto en monoterapia en fases iniciales de la enfermedad como asociados a levodopa en pacientes con EP avanzada. Los derivados ergóticos fueron los primeros AD disponibles pero actualmente su utilización está restringida por el riesgo de fibrosis valvular cardiaca1,2 y no deben considerarse nunca fármacos de primera elección.
Los AD no ergóticos pueden administrarse por vía oral (pramipexol y ropinirol), transdérmica (rotigotina) o subcutánea (apomorfina). Recientemente se han introducido presentaciones orales de liberación prolongada que permiten una única administración diaria. Estas formas se han desarrollado con el fin de conseguir unos valores plasmáticos más estables y así minimizar en lo posible las fluctuaciones motoras, derivadas, al menos en parte, de las oscilaciones de los niveles plasmáticos del fármaco2. Con la misma intención se ha diseñado más recientemente otro AD, rotigotina, el primero no ergótico de administración transdérmica, que ha demostrado una efectividad y un perfil de seguridad similar a los otros AD.
Los nuevos AD, aunque no están exentos de efectos adversos graves, entre los que destaca el trastorno de control de impulsos (TCI), han tenido un impacto indiscutible en la calidad de vida de los pacientes con EP y han ampliado notablemente el abanico de estrategias terapéuticas disponibles para los neurólogos. En este artículo de revisión analizamos desde un punto de vista práctico los aspectos farmacológicos, efectos adversos y utilidad clínica de los 3 agonistas dopaminérgicos de mayor utilización en la práctica clínica (pramipexol, ropinirol y rotigotina).
Farmacocinética y farmacodinámicaPramipexolSu nombre químico es (S)-2-amino-4,5,6,7-tetrahidro-6-propilamino-benzotiazol. Se trata de un potente agonista D2 con afinidad máxima por el subtipo D3 (tabla 1)2. La absorción de pramipexol de liberación inmediata (LI) es rápida, alcanzándose una concentración máxima entre 1 y 2h después de su administración y más tardíamente si se administra con los alimentos. Su biodisponibilidad es elevada, en torno al 90%. La farmacocinética es lineal, la unión a proteínas escasa (< 20%) y el volumen de distribución elevado (400 l). Se elimina sin metabolizar en su mayor parte (80%) por la orina (secreción tubular activa). No se debe emplear en pacientes con insuficiencia renal avanzada y la dosis debe ajustarse en caso de insuficiencia renal leve y moderada (véase «Posología»). No se han descrito interacciones significativas con otros fármacos, salvo una posible disminución de su excreción urinaria con el tratamiento concomitante con cimetidina y amantadina3.
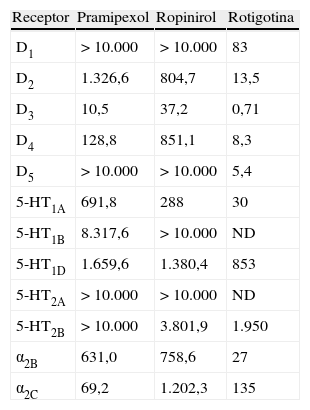
Afinidad de los agonistas dopaminérgicos por los distintos subtipos de receptores dopaminérgicos, serotoninérgicos y alfaadrenérgicos, expresada en constante de inhibición (nmol/l, inversamente proporcional a la afinidad del receptor)
| Receptor | Pramipexol | Ropinirol | Rotigotina |
| D1 | > 10.000 | > 10.000 | 83 |
| D2 | 1.326,6 | 804,7 | 13,5 |
| D3 | 10,5 | 37,2 | 0,71 |
| D4 | 128,8 | 851,1 | 8,3 |
| D5 | > 10.000 | > 10.000 | 5,4 |
| 5-HT1A | 691,8 | 288 | 30 |
| 5-HT1B | 8.317,6 | > 10.000 | ND |
| 5-HT1D | 1.659,6 | 1.380,4 | 853 |
| 5-HT2A | > 10.000 | > 10.000 | ND |
| 5-HT2B | > 10.000 | 3.801,9 | 1.950 |
| α2B | 631,0 | 758,6 | 27 |
| α2C | 69,2 | 1.202,3 | 135 |
Fuente: Chen JJ et al8.
En el caso de pramipexol de liberación prolongada (LP), la formulación se basa en un comprimido matricial con carbómero que favorece una liberación lenta y constante del fármaco por difusión y erosión. La concentración máxima se alcanza a las 6h de su administración y las fluctuaciones de los niveles plasmáticos del fármaco son mínimas, en comparación con la administración tres veces al día de la formulación de LI. Los niveles plasmáticos se estabilizan a los 5 días de tratamiento4,5.
RopinirolEs un derivado indólico, de nombre químico 4-[2-(dipropilamino)etil]-1,3-dihidro-2H-indol-2-clorhidrato], muy lipofílico y con elevado volumen de distribución (6,7 l/kg). Es un potente AD con unión tanto a receptores periféricos como centrales, siendo el subtipo D3 el de máxima afinidad (tabla 1). En la formulación de LI la absorción es rápida (concentración máxima en 1-2h, se retrasa 1-2h si se toma con alimentos) y la biodisponibilidad del 50%. Su unión a proteínas plasmáticas es escasa (10-39%) y sin relevancia clínica. El metabolismo de ropinirol es hepático, a través del citocromo P450, y se elimina por la orina, un 10% en forma activa. En cuanto a interacciones farmacológicas, el ciprofloxacino, fluvoxamina y los estrógenos en dosis altas (como en terapia hormonal sustitutiva) aumentan las concentraciones de ropinirol, mientras que el tabaco puede disminuirlas. Se ha calculado que el aclaramiento de ropinirol es un 15% menor en individuos mayores de 65 años6,7.
La formulación de liberación prolongada (LP) se basa en una matriz recubierta de una barrera de 2 capas (impermeable y semipermeable) que se gelifica en contacto con los jugos intestinales, permitiendo una liberación y absorción lenta y continua del fármaco a lo largo de 24h e independientemente de las comidas. Estudios comparativos han demostrado que con la formulación de LP se obtienen concentraciones plasmáticas del fármaco más estables y con menores oscilaciones que las conseguidas con dosis similares de preparados de LI administradas tres veces al día. La biodisponibilidad de las formas de LP se mantiene en torno al 50%, la farmacocinética es lineal y la latencia a la concentración máxima de 6-10h6,7.
RotigotinaSu nombre químico es (6S)-6{propil[2-(2-tienil)etil]amino}-5,6,7,8-tetrahidro-1-naftalenol. Es de un compuesto de bajo peso molecular y muy lipofílico, circunstancias que favorecen su difusión a través del estrato corneal de la piel. Se dispensa en una matriz autoadhesiva de silicona revestida de una película de poliéster que contiene aluminio. La liberación del fármaco es constante y proporcional a la superficie del parche aplicado. Tiene una afinidad máxima por los receptores D3 (tabla 1), además de un efecto agonista sobre los receptores serotoninérgicos 5HT1A y antagonista de receptores adrenérgicos α2B y α2C8.
Frente a menos del 1% de biodisponibilidad por vía oral, y a pesar de las variaciones inter e intraindividuales, rotigotina muestra una buena absorción transdérmica, con un promedio del 46,1±10,6% del total del contenido del parche. Por este motivo, el parche de 2mg contiene un total de 4,5mg de fármaco; el de 4mg, 9mg; el de 6mg, 13,5mg, y el de 8mg, 18mg. Recientemente se han añadido 2 nuevas presentaciones de 1 y 3mg. El contenido no absorbido se queda en el parche. Con el recambio diario del parche las concentraciones plasmáticas son estables, sin picos ni valles, y las diferencias según el lugar de colocación del parche no son significativas. Los niveles plasmáticos se estabilizan a los 2-3 días de tratamiento. Si el parche se mantuviera más de 24h las concentraciones serían menos estables y podría haber fluctuaciones indeseables. El metabolismo de rotigotina es hepático (citocromo P450 y glucuronidación), sus metabolitos se eliminan por la orina (< 1% en forma activa) y la hemodiálisis no afecta a sus niveles plasmáticos. La tasa de unión a proteínas es mayor del 90%. No se han descrito interacciones farmacológicas relevantes (tampoco con fármacos metabolizados por el citocromo p450) ni modificación de los niveles en caso de hipoalbuminemia o administración de otros fármacos con unión a proteínas plasmáticas8.
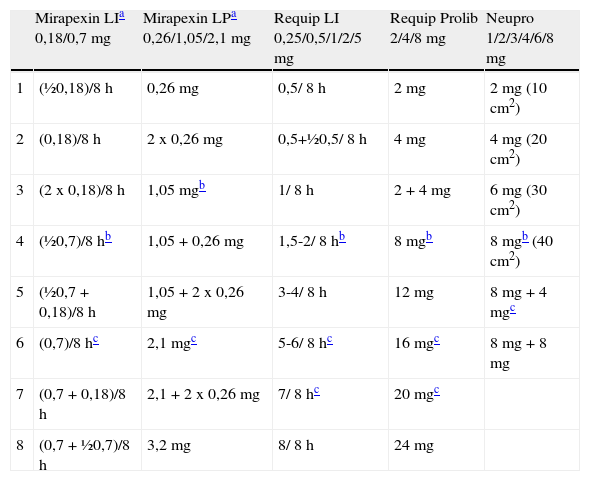
PosologíaEn la tabla 2 se muestran las dosis recomendadas en el escalado terapéutico para cada uno de los AD, que habitualmente se realiza de semana en semana. Es recomendable una evaluación inicial aproximadamente al mes de tratamiento para valorar la tolerabilidad y seguridad del fármaco, en particular desde el reconocimiento de efectos adversos graves cuya aparición puede ser precoz (véanse «Efectos adversos y precauciones especiales») con dosis altas de AD. En la mayoría de los casos será necesario un nuevo aumento posterior para alcanzar la dosis terapéutica habitual. En la actualidad, las formas de LP de pramipexol y ropinirol ofrecen claras ventajas sobre las fórmulas de LI: simplificación de la posología y el escalado de dosis, una mayor comodidad para el paciente y probablemente una mayor adherencia terapéutica (véase «Equivalencia y cambio de uno a otro. Tratamiento combinado»).
Dosis recomendadas para el escalado terapéutico de pramipexol, ropinirol y rotigotina
| Mirapexin LIa 0,18/0,7 mg | Mirapexin LPa 0,26/1,05/2,1 mg | Requip LI 0,25/0,5/1/2/5 mg | Requip Prolib 2/4/8 mg | Neupro 1/2/3/4/6/8 mg | |
| 1 | (½0,18)/8 h | 0,26 mg | 0,5/ 8 h | 2 mg | 2mg (10cm2) |
| 2 | (0,18)/8 h | 2 x 0,26 mg | 0,5+½0,5/ 8 h | 4 mg | 4mg (20cm2) |
| 3 | (2 x 0,18)/8 h | 1,05mgb | 1/ 8 h | 2 + 4 mg | 6mg (30cm2) |
| 4 | (½0,7)/8 hb | 1,05 + 0,26 mg | 1,5-2/ 8 hb | 8mgb | 8mgb (40cm2) |
| 5 | (½0,7 + 0,18)/8 h | 1,05 + 2 x 0,26 mg | 3-4/ 8 h | 12 mg | 8 mg+4mgc |
| 6 | (0,7)/8 hc | 2,1mgc | 5-6/ 8 hc | 16mgc | 8 mg+8 mg |
| 7 | (0,7+0,18)/8 h | 2,1+2 x 0,26 mg | 7/ 8 hc | 20mgc | |
| 8 | (0,7+½0,7)/8 h | 3,2 mg | 8/ 8 h | 24 mg |
LI: liberación inmediata; LP: liberación prolongada.
Fuente: elaboración propia.
Existen comprimidos de 0,18 y 0,7mg de pramipexol LI, que se administran tres veces al día. Pramipexol LP está disponible en 3 presentaciones de 0,26, 1,05 y 2,1mg de liberación prolongada que no se deben fraccionar, de administración única diaria, por la mañana, en ayunas o con alimentos. Se recomienda planificar el escalado de dosis en periodos de 7-10 días según se indica en la tabla 2. En caso de tratamiento previo con pramipexol LI se ha demostrado eficacia y seguridad del cambio de un día para otro a la dosis más aproximada a la dosis total previa (en datos del mismo estudio, 1:1,05 LI:LP). Pramipexol LP no debe emplearse en pacientes con aclaramiento de creatinina por debajo de 30ml/min y la dosis debe ajustarse en pacientes con aclaramiento de creatinina entre 30-50ml/min, comenzando por 0,26mg cada 48h la primera semana, después 0,26mg diarios la segunda semana y aumentando 0,26mg adicionales cada semana hasta una dosis máxima de 1,57mg diarios (1,05+0,26+0,26mg)3–5.
Ropinirol está disponible en comprimidos de 0,25, 0,5, 1, 2 y 5mg en la fórmula de LI y de 2, 4 y 8mg en la fórmula de LP. Al igual que sucede con pramipexol LP, los comprimidos de ropinirol LP no deben fraccionarse y se administran en una única dosis matutina en ayunas o con alimentos. El escalado de dosis es también semanal hasta 8mg diarios el primer mes; en la mayoría de los casos será necesario aumentar la dosis hasta 16-18mg diarios. No se precisa ajuste de dosis en caso de insuficiencia renal leve o moderada, aunque el fármaco no debe emplearse en pacientes con insuficiencia renal y un aclaramiento de creatinina menor de 30ml/min, y tampoco en caso de insuficiencia hepática grave6,7.
Rotigotina está disponible en parches de 1, 2, 3, 4, 6 y 8mg. El parche de rotigotina se aplica en piel seca y limpia (sin lociones ni cremas) de tronco o extremidades, con presión local durante unos 30-60s. El parche se recambia cada 24h, realizando una rotación del lugar de aplicación y evitando aplicar el parche en el mismo lugar al menos en 2 semanas. Puede ser necesario afeitar o cortar el pelo en la zona de aplicación para facilitar una mejor adherencia. Debe conservarse refrigerado (2-8°C). No se recomienda recortarlo, pues aunque no se afecta la liberación del fármaco, sí puede empeorar la adhesividad. Por su contenido en aluminio puede hacer saltar la alarma en los aeropuertos, recalentarse en saunas o al sol y producir quemaduras en un equipo de resonancia magnética o cardioversión eléctrica. La dosis inicial de 2mg se aumenta semanalmente de 2 en 2mg hasta llegar a 8mg en un mes, posteriormente se ajusta según la respuesta clínica, hasta una dosis máxima de 16mg. No precisa ajuste de dosis en caso de insuficiencia hepática moderada o insuficiencia renal avanzada8.
Evidencia de efectividadTodos los AD no ergóticos han demostrado un nivel de evidencia clase I para el tratamiento de la EP precoz en monoterapia (tabla 3) y de la EP avanzada (tabla 4) en asociación con levodopa9,10. Un metaanálisis publicado en 2010 que combinó todos los ensayos controlados realizados con AD (ergóticos y no ergóticos) calculó una reducción media del tiempo off de 1,54h, 116mg de reducción media de levodopa y descenso de 10 puntos en la Unified Parkinson's Disease Rating Scale (UPDRS) total, con una odds ratio (OR) de aparición de discinesias frente a placebo de 2,7011.
Eficacia comparada de los diferentes agonistas dopaminérgicos en la enfermedad de Parkinson precoz
| AD | Cambio en UPDRS | Complicaciones motoras a largo plazo | Periodo de estudio |
| Pramipexol12,13,49 | [LI] -3,4 (-7,3 LD) | [LI] 28% discinesias (51% LD); RR 0,37 discinesias, RR 0,68 wearing off | [LI] 5 años |
| [LP] -8,1 (5,1 PL) | [LP] ND | [LP]18 semanas | |
| Ropinirol7–19 | [LI] -0,8 (-4,8 LD) | [LI] 5% (35% LD); OR 0,3 discinesias, 0,3 wearing off | [LI] 5 años |
| [LP] reducción > 30% en el 77% (66% LI, NS) | [LP] ND | [LP] 20 semanas | |
| Rotigotina24–26 | -7,2 (-2 PL) | ND | 13 semanas |
LD: levodopa; LI: liberación inmediata; LP: liberación prolongada; ND: no disponible; NS: no significativo; OR: odds ratio; PL: placebo; RR: riesgo relativo.
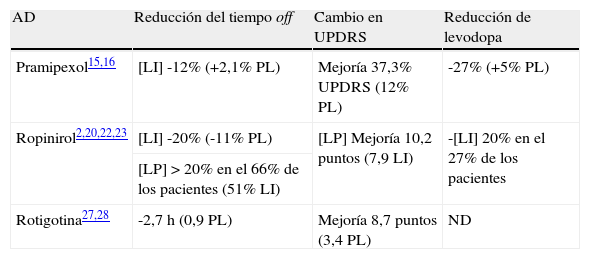
Eficacia comparada de los diferentes agonistas dopaminérgicos en la enfermedad de Parkinson avanzada
| AD | Reducción del tiempo off | Cambio en UPDRS | Reducción de levodopa |
| Pramipexol15,16 | [LI] -12% (+2,1% PL) | Mejoría 37,3% UPDRS (12% PL) | -27% (+5% PL) |
| Ropinirol2,20,22,23 | [LI] -20% (-11% PL) | [LP] Mejoría 10,2 puntos (7,9 LI) | -[LI] 20% en el 27% de los pacientes |
| [LP] > 20% en el 66% de los pacientes (51% LI) | |||
| Rotigotina27,28 | -2,7 h (0,9 PL) | Mejoría 8,7 puntos (3,4 PL) | ND |
LI: liberación inmediata; LP: liberación prolongada; ND: no disponible; PL: placebo.
El estudio CALM-PD (doble ciego aleatorizado) demostró que el inicio del tratamiento de la EP con pramipexol LI reducía de forma significativa la incidencia de discinesias y fluctuaciones motoras con respecto a la levodopa (28 frente a 51%). A pesar de que el control de los síntomas motores fue mejor en el grupo de levodopa (-7,3 puntos en UPDRS frente a -3,4 de pramipexol), el 32% de los pacientes pudo mantener el tratamiento con pramipexol en monoterapia al finalizar el periodo de estudio (5 años)12. Se han publicado los resultados de las 2 fases de prolongación del estudio. En la primera (4 años desde la aleatorización), el tratamiento inicial con pramipexol se asoció con un menor riesgo de aparición de discinesias (riesgo relativo -RR- 0,37) y wearing off (RR 0,68), aunque las discinesias discapacitantes ocurrieron en proporción similar en ambos grupos y la levodopa se asoció a un menor riesgo de freezing (25,3 frente a 37,1%, RR 1,7)13. Este último dato no se confirmó en la segunda fase de prolongación hasta 6 años después de la aleatorización, analizados 108 sujetos en el grupo de pramipexol y 114 del grupo de levodopa: 26,2 frente a 34,7% (p=0,3). Además, la tasa de fluctuaciones (wearing off y on-off) y discinesias continuó siendo inferior en el grupo que inició el tratamiento con pramipexol (50 frente a 68,4%), con valores similares en la UPDRS (subescalas de actividades de la vida diaria y motora) y escalas de calidad de vida14. El grupo tratado con pramipexol presentó una puntuación en las escalas de somnolencia significativamente más elevada (11,3 frente a 8,6 en la Epworth Sleepiness Scale [ESS]) y mayores tasas de edema (27,1 frente a 14,4) que el grupo de levodopa. Los investigadores concluyeron que tanto pramipexol como levodopa son eficaces a largo plazo como tratamientos iniciales para la EP, con un menor riesgo de aparición de complicaciones motoras con el primero y de somnolencia con el segundo.
En la EP avanzada, varios estudios controlados con placebo han demostrado que pramipexol induce una disminución significativa de las puntuaciones de la UPDRS en on y en off (descenso global de un 37,3 frente a 12% de placebo en un estudio de 78 pacientes durante las 11 semanas), disminución del tiempo off (del 12 frente a aumento del 2% con placebo en el mismo estudio)15 y disminución de la dosis de levodopa (en otro estudio de 360 pacientes y 32 semanas de duración, del 27 frente al 5% con placebo)16. Los efectos adversos dopaminérgicos fueron más frecuentes en el grupo de sujetos tratados con pramipexol en ambos estudios, aunque la tasa de abandonos por mala tolerabilidad fue baja (9 y 11,6% frente al 11 y 10,1% de placebo, respectivamente) con una elevada proporción de pacientes aleatorizados que completó el estudio (87 y 80,8%, respectivamente)15,16.
RopinirolEl estudio 056 demostró que la administración de ropinirol LI en monoterapia en la EP precoz, produce una menor tasa de discinesias (5% en monoterapia con ropinirol, 35% con levodopa y 20% con tratamiento combinado de ambos) que el tratamiento con levodopa y una mayor probabilidad de permanecer libre de discinesias (OR 2,82). Al igual que en los estudios de pramipexol, las puntuaciones de la UPDRS II fueron similares en ambos grupos de pacientes, pero los pacientes que recibieron levodopa presentaron una reducción en la puntuación de la subescala motora mayor que el grupo que recibió ropinirol (−0,8±10,1 para ropinirol y −4,8±8,3 para levodopa). Al finalizar el estudio (5 años), la dosis media de ropinirol utilizada fue de fue de 16,5mg, y el 30% de los pacientes asignados a este grupo se mantenían en monoterapia17. La prolongación abierta del ensayo duró 10 años e incluyó 42 pacientes del grupo de ropinirol y 27 de levodopa. Se confirmó un menor riesgo de aparición de discinesias con ropinirol (OR 0,3), así como un mayor tiempo hasta la aparición de discinesias y menor incidencia de aparición de wearing off (OR 0,3)18. La elevada tasa de abandonos constituye una limitación importante de este estudio. Entre los ensayos en enfermedad avanzada, destaca un estudio realizado en 149 pacientes, que demostró un potencial para la reducción de dosis total de levodopa (del 20% en el 27% de los pacientes) y del tiempo off (del 20 frente a 11%) de ropinirol LI frente a placebo a los 6 meses de tratamiento2.
Por otro lado, los ensayos EASE-PD-estudio 168 (ropinirol LI frente a LP, dosis de 8-12mg) y estudio 169 (LP controlado con placebo) demostraron eficacia y seguridad del tratamiento con ropinirol LP en monoterapia en el tratamiento de la EP precoz y en combinación con levodopa en la enfermedad avanzada. En el caso de la EP precoz se consiguió una reducción de más del 30% en la UPDRS basal en un 77% de los pacientes tratados (frente a 66% de ropinirol LI, diferencia no significativa)19. En la EP avanzada (media de 7h de off al inicio del periodo de estudio), ropinirol LP redujo el tiempo off una media de 2,1h frente a 0,3h de placebo (diferencia media de 1,7h), aumentó el tiempo en on y el tiempo on sin discinesias y mejoró las escalas de depresión y calidad de vida de forma significativa frente a placebo20. Asimismo, el estudio PREPARED demostró la no inferioridad y tolerabilidad de ropinirol LP frente a la fórmula de LI en tratamiento combinado con levodopa en EP avanzada. A las 24 semanas de tratamiento y con una dosis media de ropinirol de LP de 18,4mg frente a 10,6mg de ropinirol de LI, se encontró una mayor proporción de pacientes en el grupo de LP que tenía una reducción superior a un 20% del tiempo off (66% LP frente a 51% LI) y disminución media mayor de la puntuación de la UPDRS III (10,2 LP frente a 7,9 LI). Ambas diferencias fueron estadísticamente significativas. La incidencia de efectos adversos fue menor en el grupo tratado con LP, si bien esta diferencia no resultó significativa21. El estudio 228 comparó la adición de ropinirol LP frente al aumento de dosis de levodopa en pacientes tratados con levodopa que no tenían un control adecuado de los síntomas. Los resultados demostraron una menor incidencia de discinesias a las 28 semanas de tratamiento en el grupo que recibió ropinirol LP con respecto al grupo en el que se decidió incrementar la dosis de levodopa (3% con una dosis media de 10mg de ropinirol frente a 17% con una dosis media de levodopa adicional de 284mg). No se objetivaron diferencias significativas en la escala UPDRS entre los 2 grupos de pacientes (-3,7 y -3,4 puntos en subescala motora, respectivamente) ni tampoco en la proporción de pacientes que desarrolló fluctuaciones motoras (54 y 57%). Con respecto a los efectos secundarios hay que señalar que le grupo que recibió ropinirol presentó mayor somnolencia medida en la ESS que el grupo tratado con levodopa (0,9±3,5 frente a -0,2±2,9). Una limitación de este estudio fue la finalización precoz del estudio y un reclutamiento escaso de pacientes22,23.
RotigotinaSe han realizado ensayos aleatorizados de rotigotina controlados con placebo, tanto en monoterapia en EP precoz como en combinación con levodopa en EP avanzada24,25. En EP precoz los estudios en monoterapia han demostrado una reducción de la UPDRS III en torno a 3,5 puntos frente a placebo con dosis bajas de rotigotina entre 2 y 6mg24. En el ensayo SURE-PD (SP513) se comparó la eficacia de rotigotina (8mg) frente a ropinirol LI (hasta 24mg). Ambos tratamientos fueron más eficaces que placebo (descenso de 11 y 7,2 puntos frente a 2 puntos de placebo en la escala UPDRS a las 13 semanas). No pudo demostrarse la no inferioridad de la dosis de 8mg de rotigotina frente a ropinirol, aunque al analizar el subgrupo de pacientes tratados con 12mg de ropinirol LI no hubo diferencias significativas frente a rotigotina en cuanto a eficacia (descenso de 7,2 puntos en la UPDRS para ropinirol frente a 8,4 de rotigotina)26.
En EP avanzada (estudio PREFER, SP650) las dosis de 8 y 12mg de rotigotina consiguieron reducciones significativas de UPDRS III a las 24 semanas de tratamiento de 6,8 y 8,7 puntos, respectivamente (frente a 3,4 puntos de placebo). Además se objetivó una reducción de tiempo en off significativa para la dosis de 8mg (2,7h frente a 2,1 con 12mg y 0,9 con placebo)27. El estudio CLEOPATRA (SP515) estudió la eficacia de rotigotina en la reducción del tiempo en off en pacientes con EP avanzada en tratamiento con levodopa. Se comparó la adición de pramipexol (dosis media 3,1mg), rotigotina (dosis media 12,95mg) o placebo a levodopa. Se demostraron reducciones similares del tiempo off con ambos agonistas (1,94h con pramipexol y 1,58h con rotigotina), así como una tasa similar de respondedores (definido por reducción de UPDRS mayor del 30%, en un 67 y 59,7%, respectivamente)28. Finalmente, el estudio RECOVER analizó el efecto del tratamiento con rotigotina sobre el sueño tanto en pacientes de novo como en pacientes tratados con levodopa. En ambos grupos rotigotina produjo una mejoría significativa de la calidad del sueño (reducción de 5,9 puntos en la PDSS frente a 1,9 de placebo) y la UPDRS III matutina (7 puntos respecto a 3,9 de placebo)29.
NeuroprotecciónSe ha postulado que los AD podrían tener un efecto neuroprotector en función de sus propiedades antioxidantes (pramipexol actúa como scavenger de radicales libres, inhibe la apoptosis y actúa directamente sobre la membrana mitocondrial). Además, todos los AD disminuyen la liberación de dopamina (mediada por autorreceptores presinápticos), y por tanto la formación de radicales libres derivados del metabolismo de la dopamina30. Aunque estudios in vitro y en modelos animales han demostrado un efecto neuroprotector de varios AD ergóticos y no ergóticos, en pacientes con EP no existe ninguna evidencia de que los AD ejerzan un efecto modificador de la enfermedad clínicamente relevante. Los estudios de neuroimagen con PET de fluorodopa (ropinirol) o DAT-scan (pramipexol) indicaban que el tratamiento con AD producía una menor pérdida de terminales nigroestriadas que el tratamiento con levodopa. Sin embargo, estudios posteriores han demostrado que los AD y la levodopa modifican la actividad de la dopadescarboxilasa central y de los trasportadores de dopamina, lo que invalida los resultados obtenidos en los estudios de neuroimagen que sugieren una neuroprotección31.
Utilidad clínica y recomendaciones de usoEn la EP inicial los AD mejoran de forma significativa las escalas de incapacidad de los pacientes, retrasan la aparición de discinesias y permiten retrasar la introducción de levodopa. En la EP avanzada reducen el tiempo off, mejoran la UPDRS en on y en off y permiten reducir la dosis total de levodopa2,9,10. Además, los 3 AD no ergóticos inducen una mejoría significativa frente a placebo en las escalas de la calidad de vida relacionada con la salud (pramipexol en EP avanzada y en EP con depresión, ropinirol en pacientes con fluctuaciones y rotigotina en pacientes con wearing off)32.
En estudios con un número reducido de pacientes, pramipexol demostró una reducción significativa de las escalas o registros de temblor (48-65% en comparación con placebo)33,34. Sin embargo, faltan estudios bien diseñados que determinen una posible superioridad frente a levodopa (cuyo potencial antitremórico se estima en un 30-50%) comparándolos directamente34. La actividad antidepresiva de pramipexol ha sido puesta en evidencia en varios estudios controlados tanto en monoterapia como en asociación a levodopa. Se han obtenido resultados de efectividad superior a placebo (63-64 frente a 43-45%) e incluso comparable a sertralina en el tratamiento de los síntomas depresivos de la EP. Estos resultados son independientes de la mejoría de los síntomas motores, indicando una actividad antidepresiva directa del fármaco. Sin embargo, la mayoría de estos estudios son heterogéneos en cuanto a la población estudiada y los instrumentos de medida, lo que limita la generalización de sus conclusiones35,36. Ropinirol LP tiene un escalado de dosis sencillo y proporciona un beneficio motor con un riesgo bajo de aparición de discinesias. En pacientes tratados con levodopa y mal control motor, en particular si ya presentan discinesias molestas, la asociación de ropinirol LP es una alternativa efectiva al aumento de dosis de levodopa23. Rotigotina podría ser de especial utilidad en pacientes con síntomas nocturnos y matutinos29. Ofrece la ventaja adicional de no necesitar suspensión en caso de cirugía37.
Efectos adversos y precauciones especialesLos efectos adversos dopaminérgicos centrales (alucinaciones, psicosis, discinesias, mareo, somnolencia) y periféricos (náuseas, hipotensión ortostática, edema) se describen con los 3 AD no ergóticos en proporciones variables, y pueden aparecer también en el tratamiento con levodopa (tabla 5)2,31. Todos los ensayos clínicos han mostrado una mayor incidencia de alucinaciones y somnolencia con los AD que con levodopa (number needed to harm global de AD de 15 para alucinaciones y sólo 3 para somnolencia)38.
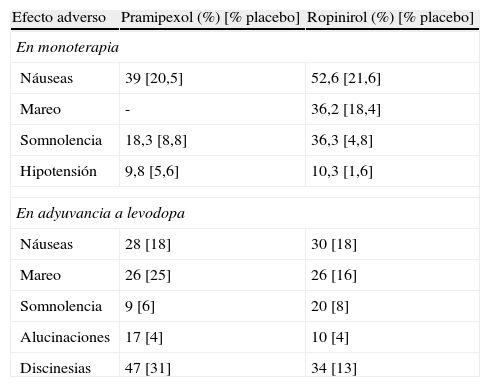
Efectos adversos dopaminérgicos de pramipexol (liberación inmediata) y ropinirol (liberación inmediata) frente a placebo
| Efecto adverso | Pramipexol (%) [% placebo] | Ropinirol (%) [% placebo] |
| En monoterapia | ||
| Náuseas | 39 [20,5] | 52,6 [21,6] |
| Mareo | - | 36,2 [18,4] |
| Somnolencia | 18,3 [8,8] | 36,3 [4,8] |
| Hipotensión | 9,8 [5,6] | 10,3 [1,6] |
| En adyuvancia a levodopa | ||
| Náuseas | 28 [18] | 30 [18] |
| Mareo | 26 [25] | 26 [16] |
| Somnolencia | 9 [6] | 20 [8] |
| Alucinaciones | 17 [4] | 10 [4] |
| Discinesias | 47 [31] | 34 [13] |
Fuente: Lledó A31.
En cuanto a las diferencias entre AD, un metaanálisis reciente comparó los efectos adversos de varios AD ergóticos y no ergóticos. El RR de náuseas fue similar con ropinirol y rotigotina (RR 2,25 y 2,08), pero superior a pramipexol en la comparación indirecta (RR 1,48). El RR de vómitos con rotigotina fue muy superior en la comparación con placebo (5,31), y fue también significativo en el caso de ropinirol (2,84), a diferencia de pramipexol (0,82, no significativo). En la comparación entre ropinirol y pramipexol, los RR de mareo (1,87 frente a 1,20), somnolencia (2,45 frente a 1,68) y discinesias (2,71 frente 2,27) fueron discretamente superiores en el primero. En la comparación entre ropinirol y rotigotina no hubo diferencias significativas en cuanto a somnolencia (RR 1,15 en comparación directa, ropinirol frente a placebo 2,45 y rotigotina frente a placebo 1,35). Todos los AD tuvieron un RR mayor de alucinaciones frente a placebo, mayor con rotigotina (4,02) y pramipexol (3,36) que con ropinirol (2,84). El RR de confusión con pramipexol fue significativamente mayor que con placebo (RR 2,64), sin diferencias significativas en el caso de ropinirol y rotigotina frente a placebo39. En términos generales, la intolerancia a uno de los 3 AD no ergóticos no implica intolerancia cruzada a los demás. Si a pesar de la reducción a la dosis mínima eficaz la intolerancia persiste, sería recomendable probar con uno de los otros dos, con la excepción quizás de la aparición de psicosis o TCI, que obligarían a considerar otras opciones terapéuticas en primer lugar.
Globalmente, la odds ratio de somnolencia en el tratamiento con AD se estima en 2,9 frente a 1,9 de levodopa. Se han identificado como factores de riesgo la dosis del AD, la de levodopa concomitante, la edad, la gravedad clínica de la EP y el sexo masculino38. En un estudio abierto de pacientes tratados con ropinirol IR y trastornos del sueño se observó mejoría significativa en varios parámetros (ESS y Parkinson's disease Sleep Scale, PDSS) en el cambio a ropinirol LP40.
Los ataques de sueño (sleep attacks) son accesos de sueño que ocurren inesperadamente, sin pródromos, y representan un peligro real en situaciones como la conducción de vehículos. Se describieron inicialmente en 1999 en pacientes en tratamiento con AD (pramipexol y ropinirol)41. En un estudio multicéntrico de 6.620 pacientes con EP en tratamiento con AD se estimó una frecuencia de somnolencia diurna excesiva del 42%, con un 10% de estos pacientes experimentando sleep attacks (4% del total). Se han implicado tanto los AD ergóticos como los no ergóticos, aunque en estos últimos la aparición es más precoz33. Rotigotina también se ha asociado con este efecto adverso: en un ensayo comparativo con ropinirol LI, hubo 6 (2,8%) y 4 (1,8%) casos, respectivamente26. La edad por debajo de 70 años y la evolución de la enfermedad menor de 7 años pueden ser factores de riesgo33.
El trastorno de control de impulsos (TCI) asociado a la EP es un fenómeno frecuente (prevalencia en torno al 6-15%), cada vez más reconocido, de origen multifactorial, en el que los AD tienen un papel patogénico indiscutible42. Las manifestaciones más frecuentes son el juego patológico, hipersexualidad, compra compulsiva, ingesta compulsiva y abuso de Internet. Es típico que afecte a varones jóvenes con inicio precoz de la enfermedad, y los antecedentes personales y familiares de TCI o abuso de sustancias, así como la presencia de ciertos rasgos de personalidad premórbida (impulsividad, búsqueda de sensaciones) son un claro factor de riesgo42,43. Se han asociado polimorfismos de los receptores dopaminérgicos con el trastorno por abuso de sustancias y TCI en individuos con EP y sin EP, y se han descrito alteraciones análogas en neuroimagen funcional (mayor liberación de dopamina del estriado ventral, menor densidad de receptores D2/D3, e hipofunción de estructuras dopaminérgicas del sistema de recompensa) en ambos grupos42,44. Si bien estos datos orientan a una probable vulnerabilidad neurobiológica, el elemento clave para la aparición clínica del TCI es el tratamiento con AD. Aunque pramipexol ha sido tradicionalmente el AD más implicado (con el posible sesgo de ser el más prescrito en el grupo de riesgo), ropinirol tiene un potencial de riesgo similar y también se han publicado casos relacionados con rotigotina42,45,46. El aumento absoluto del riesgo se ha calculado en un 13% para el conjunto de los AD38, y un reciente estudio transversal de más de 3.000 pacientes (DOMINION) ha calculado una OR de 2,72 (2,08-3,54) para todos los AD, sin diferencias significativas entre pramipexol (17,7%) y ropinirol (15,5%)47. Las dosis altas de AD y la politerapia se asocian más frecuentemente al desarrollo de TCI, aunque ya se han descrito casos en pacientes tratados por síndrome de piernas inquietas que reciben dosis bajas de AD48. La preocupación por este problema ha llevado a incorporar diversas pruebas de cribado de TCI (modified Minnesota Impulse Disorders Interview [mMIDI], Questionnaire for Impulsive-Compulsive Disorders in Parkinson's Disease [QUIP]) en los ensayos clínicos con AD como medida de seguridad. En los 2 ensayos aleatorizados de pramipexol LP comparados con pramipexol LI y placebo (259 pacientes) y pramipexol LI (156 pacientes) respectivamente, se detectaron 6 casos de TCI (3 con la fórmula de LI y 3 con la de LP), lo que supone aproximadamente un 1% de los pacientes en tratamiento activo, en un periodo de tiempo reducido (18 y 9 semanas, respectivamente)49,50. Por su frecuencia y gravedad, y las posibles repercusiones médico-legales, la aparición de TCI debe ser vigilada estrechamente, informando a paciente y familiares antes de iniciar el tratamiento y vigilando la aparición de cualquier síntoma indicativo de aumento patológico de impulsividad. El tratamiento del TCI es multidisciplinario, con psicoterapia y grupos de apoyo, y pasa en una primera fase por la reducción o suspensión del fármaco AD. Frecuentemente será necesario añadir o aumentar la dosis de levodopa43. El tratamiento con amantadina, aunque controvertido, ha demostrado utilidad en el TCI en ensayos controlados42,51. Otros fármacos han resultado beneficiosos en ensayos abiertos (clozapina, quetiapina, topiramato, bupropión, zonegran, naloxona, valproato)42,43. Los resultados de la cirugía de estimulación profunda no son muy alentadores: en las series publicadas la mitad de los pacientes mejoran y la mitad pueden empeorar o incluso aparecer un TCI de novo52. Globalmente el pronóstico del TCI en la EP es desfavorable: puede persistir a pesar de la retirada del AD, y aparecer apatía o depresión, no siempre reversibles, como consecuencia de la suspensión del fármaco. Las consecuencias en el entorno familiar y social pueden ser difíciles de superar.
El síndrome de la cabeza caída consiste en una anteroflexión cervical exagerada que resulta de la debilidad de los extensores o distonía de los flexores del cuello. Su repercusión en el habla, la deglución y la calidad de vida de los pacientes es notable53. Se considera infrecuente en la EP (< 5%), pero en algunos de estos casos su aparición se ha relacionado con el tratamiento con AD, en particular pramipexol y cabergolina. La aparición es subaguda y típicamente ocurre en las primeras semanas o meses de tratamiento. La reducción o suspensión del AD y la introducción o aumento de dosis de levodopa pueden mejorar los síntomas53,54.
Un efecto adverso característico y frecuente de los parches de rotigotina son las reacciones cutáneas, que afectan hasta al 46% de los pacientes incluidos en ensayos clínicos25. Su carácter es habitualmente leve o moderado y raramente motivan la suspensión del fármaco (menos del 5% de los casos). Estas irritaciones leves deben distinguirse de las reacciones de tipo alérgico, que pueden ocurrir en pacientes con alergia a sulfitos (el parche contiene metabisulfito en su composición) y obligarían a la suspensión del fármaco. Muchos pacientes refieren que el parche se despega con facilidad8. Aunque la presión prolongada durante un minuto o el afeitado de la piel pueden mejorar la adherencia, esta complicación puede suponer un auténtico obstáculo para el cumplimiento terapéutico.
Precauciones especiales en la retiradaTodos los AD pueden precipitar un síndrome de deprivación dopaminérgica en casos de retirada brusca: la suspensión debe ser gradual siempre. En el caso de pramipexol, se recomienda una reducción diaria de 0,52mg (0,26mg x 2) y una vez disminuida a 0,52mg, reducir 0,26mg diarios hasta suspenderlo totalmente. La retirada de ropinirol se podría realizar reduciendo 4mg diarios hasta 8mg y posteriormente 2mg diarios hasta suspender. Para rotigotina, la reducción es de 2mg cada 24 horas hasta su retirada completa3,6,8.
La retirada de los AD, por ejemplo tras la cirugía de estimulación profunda, se ha asociado a la aparición de apatía, en particular en el caso de pramipexol. Esta complicación puede empeorar el pronóstico de la enfermedad y su tratamiento es difícil. Por este motivo, la suspensión del fármaco no debe de ser prioritaria en ausencia de efectos adversos.
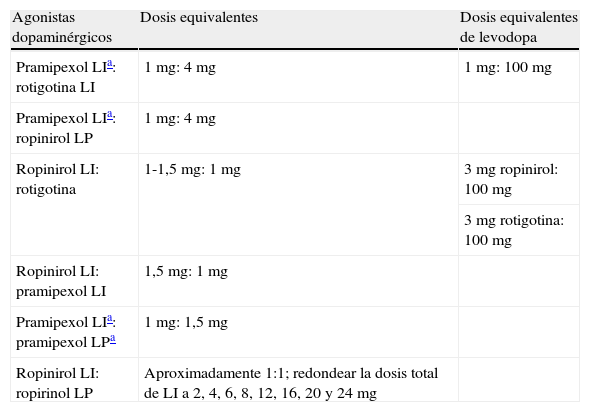
Equivalencia, cambio de uno a otro y tratamiento combinadoEl cambio de un AD a otro es frecuente en la práctica clínica, sea por falta de efectividad o por aparición de efectos adversos. En la tabla 6 se propone una equivalencia de dosis aproximada entre los distintos AD.
Equivalencia aproximada de dosis entre pramipexol, ropinirol y rotigotina
| Agonistas dopaminérgicos | Dosis equivalentes | Dosis equivalentes de levodopa |
| Pramipexol LIa: rotigotina LI | 1 mg: 4 mg | 1 mg: 100 mg |
| Pramipexol LIa: ropinirol LP | 1 mg: 4 mg | |
| Ropinirol LI: rotigotina | 1-1,5 mg: 1 mg | 3mg ropinirol: 100 mg |
| 3mg rotigotina: 100 mg | ||
| Ropinirol LI: pramipexol LI | 1,5 mg: 1 mg | |
| Pramipexol LIa: pramipexol LPa | 1 mg: 1,5 mg | |
| Ropinirol LI: ropirinol LP | Aproximadamente 1:1; redondear la dosis total de LI a 2, 4, 6, 8, 12, 16, 20 y 24 mg |
LI: liberación inmediata; LP: liberación prolongada.
Fuente: elaboración propia. Referencias en el texto: 3-5, 19, 21-22, 40, 49-50, 55-57.
En cuanto a la cronología del cambio, un ensayo clínico demostró una buena tolerabilidad al cambio de ropinirol LI o pramipexol LI a rotigotina de un día para otro55. Se estimó un periodo de superposición de ambos fármacos de 2 y 3 días respectivamente, calculándolo en 5 veces el aclaramiento medio del fármaco (véase tabla 7). Los efectos adversos fueron más frecuentes en este periodo del estudio, por lo que debe advertirse al paciente de esta posibilidad. No se dispone de estudios que contemplen el paso de los preparados de liberación prolongada a rotigotina, aunque es probable que este periodo de superposición sea mayor.
Tiempo de eliminación de pramipexol, ropinirol (ambos de liberación inmediata) y rotigotina desde el momento de suspensión del fármaco
| AD | Tiempo de eliminación del fármaco: vida media terminal plasmática (aclaramiento total) |
| Pramipexol LI | 8-12 h (30 l/h) |
| Ropinirol LI | 5-8 h (47 l/h) |
| Rotigotina | 5-7 h (630 l/h) |
El cambio de pramipexol LI a ropinirol LP se estudió en un ensayo clínico abierto. Los efectos adversos más comunes fueron empeoramiento de los síntomas de EP, somnolencia, náuseas y mareo, que se resolvieron en la mayoría de los casos mediante ajuste de dosis. Trece de 60 pacientes abandonaron el tratamiento con ropinirol LP. Se trataba de pacientes con enfermedad avanzada y dosis de pramipexol en torno a 4mg/día. La conversión de pramipexol LI: ropinirol LR 1:4 se asoció con mayor adherencia y preferencia por ropinirol LP y menor necesidad de ajuste de dosis. El cambio se efectuó de un día para otro en consulta con vigilancia de aparición de hipotensión ortostática (sin encontrarse alteraciones significativas) y contacto telefónico los 5 primeros días como medida de seguridad56.
Un estudio abierto sobre el cambio de AD a pramipexol LI incluyó 34 pacientes con tratamiento previo con ropinirol (dosis media 5,4mg)57. La dosis media de levodopa era de 595mg. La dosis media final fue de 3,4mg/día, sin modificación significativa de la dosis de levodopa, con una estimación de equivalencia de ropinirol LI a pramipexol LI de 1,5:1. En este estudio se observó una mejoría en la escala UPDRS de 8,5 puntos, así como de las fluctuaciones motoras (sin aumento significativo de las discinesias) y las escalas de depresión a las 12 semanas, que deben interpretarse con cautela ante la ausencia de un grupo control.
Finalmente, diversos estudios han demostrado la tolerabilidad y efectividad del cambio de las formulaciones de pramipexol y ropinirol de LI a la fórmula de LP4,5,19,21,22,49,50. La tolerabilidad de pramipexol LP fue similar a la de la a la formulación de LI en estudios realizados en pacientes con enfermedad precoz, tanto en tratamiento de novo como en el cambio de LI a LP. Además, en otro estudio realizado en pacientes con fluctuaciones, la incidencia de efectos adversos de pramipexol LP fue menor que la del placebo y la formulación LI (54,9 frente a 55,6 y 64%)5. Dos estudios realizados en 259 y 539 pacientes con enfermedad precoz y un estudio realizado en 517 pacientes con enfermedad avanzada (en tratamiento con levodopa) demostraron la no inferioridad de pramipexol LP, frente a otro estudio de 156 pacientes con enfermedad precoz que no lo consiguió5. En cuanto a ropinirol, 5 estudios realizados en más de 800 pacientes corroboraron la no inferioridad de la formulación de liberación prolongada22. Además, en el estudio PREPARED, desarrollado en pacientes con enfermedad avanzada y tratamiento con levodopa, fueron significativamente mayores la reducción de la puntuación en la subescala motora de la UPDRS (-10,2 puntos frente a -7,9 con ropinirol de LI) y la proporción de pacientes con reducción mantenida de más del 20% del tiempo off respecto a la basal (66 frente a 51%)21. La tolerabilidad de ropinirol LP a igualdad de dosis parece mejor, en particular en lo que respecta a la somnolencia diurna y calidad del sueño, como se ha señalado anteriormente22. La impresión clínica global es que ropinirol de LP es algo más eficaz y mejor tolerado que la formulación de LI, mientras que las diferencias entre pramipexol LP y LI probablemente son menos apreciables. Por otro lado, aunque la adherencia terapéutica en pacientes con EP se ha considerado por lo general adecuada, esta afirmación ha sido cuestionada por algunos estudios recientes (hasta el 61% de 3.119 pacientes presentaron una mala adherencia)58. En un estudio multicéntrico estadounidense de más de 29.000 pacientes (con un 46,5% de complianza menor del 80%), la adherencia al tratamiento con AD (pramipexol y ropinirol) fue peor que la adherencia a rasagilina y levodopa, aunque las causas del mal cumplimiento no se estudiaron59. Por el contrario, un estudio multicéntrico europeo detectó tasas de mal cumplimiento mucho más bajas (12,5% de 112 pacientes). En este estudio, la adherencia fue significativamente mejor en los tratamientos en dosis bajas (tanto levodopa como agonistas) y si la toma era única diaria60. Aunque la tolerabilidad y el precio (sobre todo en sistemas sanitarios sin cobertura universal) podrían influir en una mala adherencia, parece lógico pensar que una simplificación de la posología puede contribuir a mejorar el cumplimiento terapéutico, aunque no existen ensayos controlados que corroboren este punto.
En cuanto a la cronología del cambio entre AD, se han publicado resultados igualmente favorables en escalado lento, rápido y de un día para otro61. En aras de simplificar el tratamiento el cambio de un día para otro parece la opción más adecuada, advirtiendo al paciente de la posibilidad de efectos adversos dopaminérgicos en el periodo de superposición.
El tratamiento combinado con varios AD ha sido poco estudiado en la literatura científica: sólo un ensayo con limitaciones por su diseño (corto periodo de observación) en pacientes fluctuantes en tratamiento con levodopa y un AD (pramipexol o ropinirol) detectó una mejoría clínica con la asociación de cabergolina sin aumento de los efectos adversos dopaminérgicos61. Por sus propiedades farmacocinéticas y farmacodinámicas diferentes, la asociación de un AD de LP (pramipexol o ropinirol) con rotigotina transdérmica podría ofrecer ventajas frente a la monoterapia en algunos pacientes (por ejemplo, con mal control de síntomas nocturnos o matutinos), aunque serían necesarios ensayos clínicos para confirmarlo.
La combinación de AD está fuera de ficha técnica en Europa. La excepción son los pacientes a quienes se administra apomorfina en inyecciones subcutáneas. En el caso de perfusión continua de apomorfina, aunque se tiende a suprimir el tratamiento con AD, debe vigilarse la aparición de apatía y depresión, tal y como se ha expresado antes para el tratamiento quirúrgico.
ConclusiónEn conclusión, los AD pramipexol, ropinirol y rotigotina contribuyen a ampliar y enriquecer el abanico terapéutico disponible para el tratamiento de la EP en sus diferentes fases. A pesar de su buen perfil de seguridad, la aparición de efectos adversos y el potencial patoplástico de estos fármacos deben tenerse en cuenta a lo largo del tratamiento. La información al paciente y familiares, así como una monitorización clínica estrecha, en particular en las fases iniciales de escalado terapéutico, favorecen la detección precoz de una eventual toxicidad o efectos adversos farmacológicos y pueden mejorar la adherencia al tratamiento.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.